Похожие презентации:
Растворение как физико-химический процесс. Растворимость. Типы растворов
1.
РАСТВОРЕНИЕ КАКФИЗИКО-ХИМИЧЕСКИЙ
ПРОЦЕСС. РАСТВОРИМОСТЬ.
ТИПЫ РАСТВОРОВ
2.
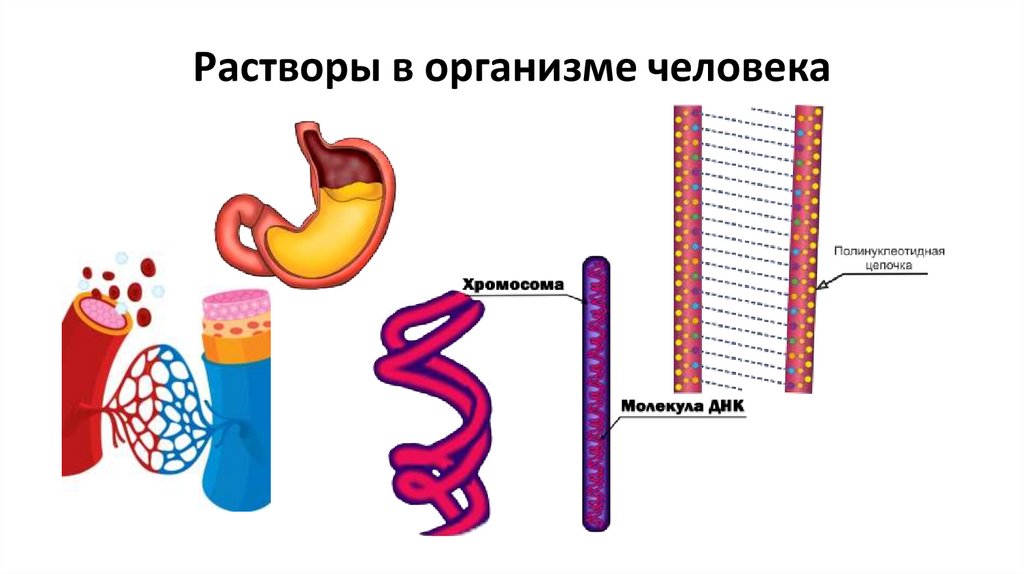
Растворы в организме человека3.
Растворы в промышленностиПочвообразование
Питание растений
Получение бумаги
Получение красок
Получение металлов
Получение удобрений
4.
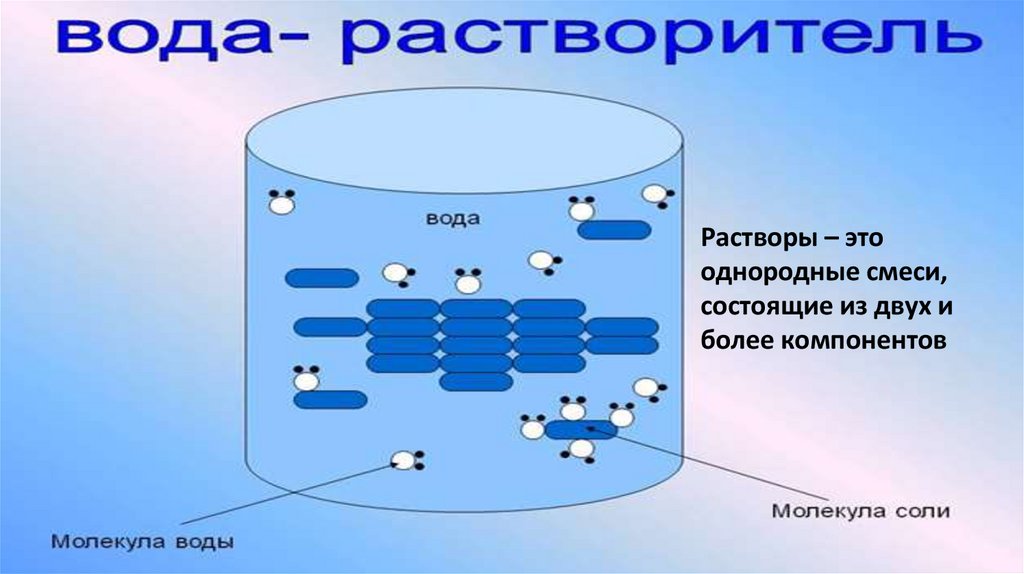
Растворы – этооднородные смеси,
состоящие из двух и
более компонентов
5.
ТвёрдыеСплавы
металлов
Растворы
Жидкие
Раствор
сахара
Газообразные
Воздух
6.
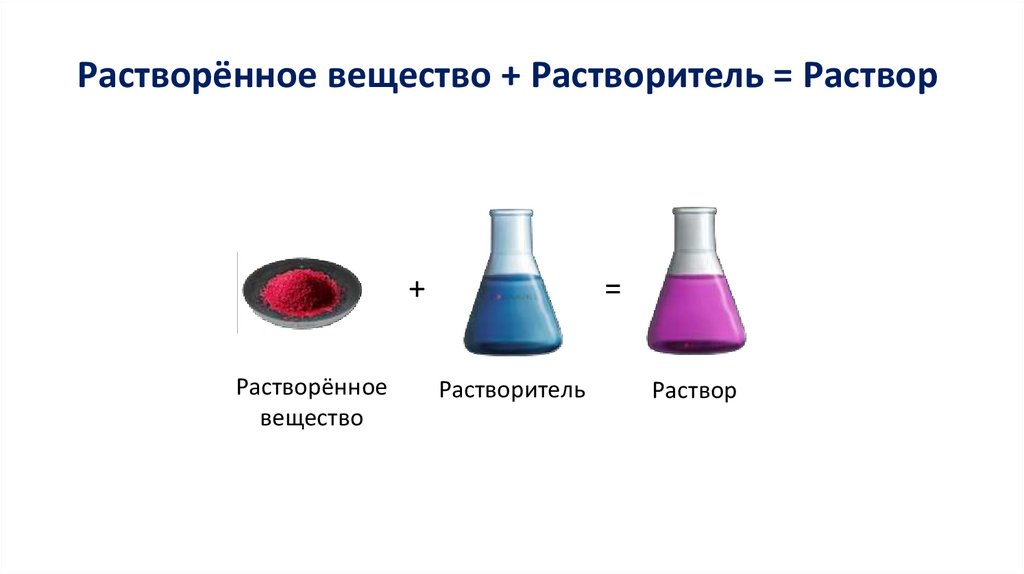
Растворённое вещество + Растворитель = Раствор+
Растворённое
вещество
=
Растворитель
Раствор
7.
Растворители:Вода
Бензин
Эфир
Спирт
8.
Растворение – физико-химический процессФизическая сторона процесса –
равномерное распределение
частиц растворённого вещества
среди молекул растворителя
Химическая сторона процесса –
взаимодействие частиц
растворенного вещества с
молекулами растворителя
9.
Гидраты – продукты взаимодействия воды срастворённым веществом
Теплота выделяется
Теплота поглощается
Растворение серной
кислоты в воде
Растворении нитрата аммония,
хлорида натрия в воде
10.
Кристаллогидраты – кристаллические вещества,содержащие молекулы воды
Медный купорос – CuSO4 · 5H2O
Сульфат меди (II) – CuSO4
11.
34,4 г KCl100 г
Насыщенный раствор – раствор, в
котором при данной температуре
вещество больше не растворяется
Ненасыщенный раствор – раствор, в
котором при данной температуре
вещество ещё может раствориться
Перенасыщенный раствор – раствор,
в котором при данной температуре
находится в растворённом состоянии
больше вещества, чем в его
насыщенном растворе при тех же
условиях
12.
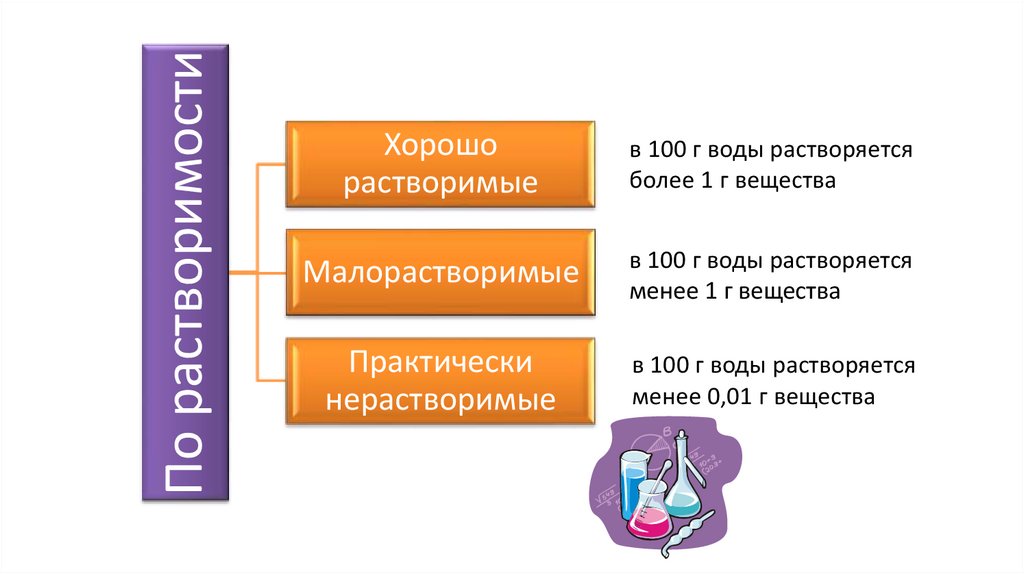
По растворимостиХорошо
растворимые
в 100 г воды растворяется
более 1 г вещества
Малорастворимые
в 100 г воды растворяется
менее 1 г вещества
Практически
нерастворимые
в 100 г воды растворяется
менее 0,01 г вещества








 Химия
Химия