Похожие презентации:
Общая характеристика VIIА-группы – Галогены
1. Общая характеристика VIIА-группы – Галогены
2.
Нахождение в природеИз-за высокой химической активности галогены
в природе в свободном виде не встречаются.
CaF2 плавиковый шпат
Соединения
галогенов
NaCI•KCI сильвинит
NaCI каменная соль
KIO3 , KIO4 в залежах
селитры, в морских
растениях
3.
ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВГалогены – это естественная группа элементов ,
расположенных в главной подгруппе VII группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
Астат получен искусственным путём.
4.
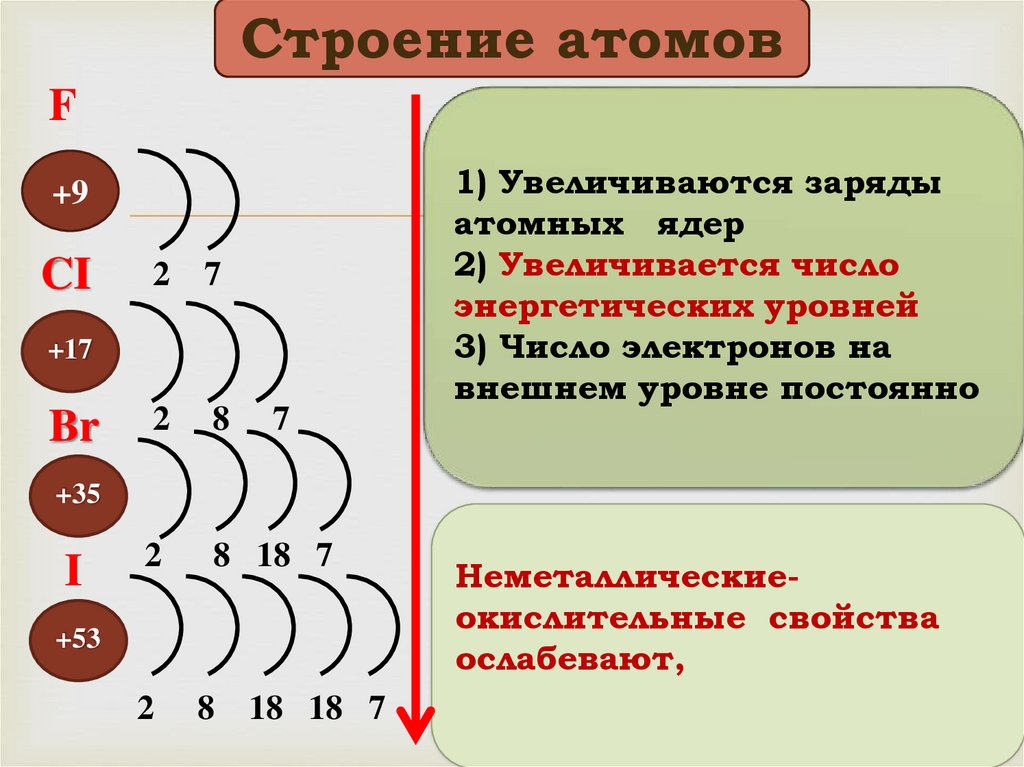
Строение атомовF
CI
2
7
2
8
2
8 18 7
+17
Br
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Число электронов на
внешнем уровне постоянно
+9
7
+35
I
+53
2
8
18 18 7
Неметаллическиеокислительные свойства
ослабевают,
5.
Br2CI2
Простые
вещества
F2
I2
6.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
Ковалентная
неполярная
Кристаллическая
решетка
молекулярная
7.
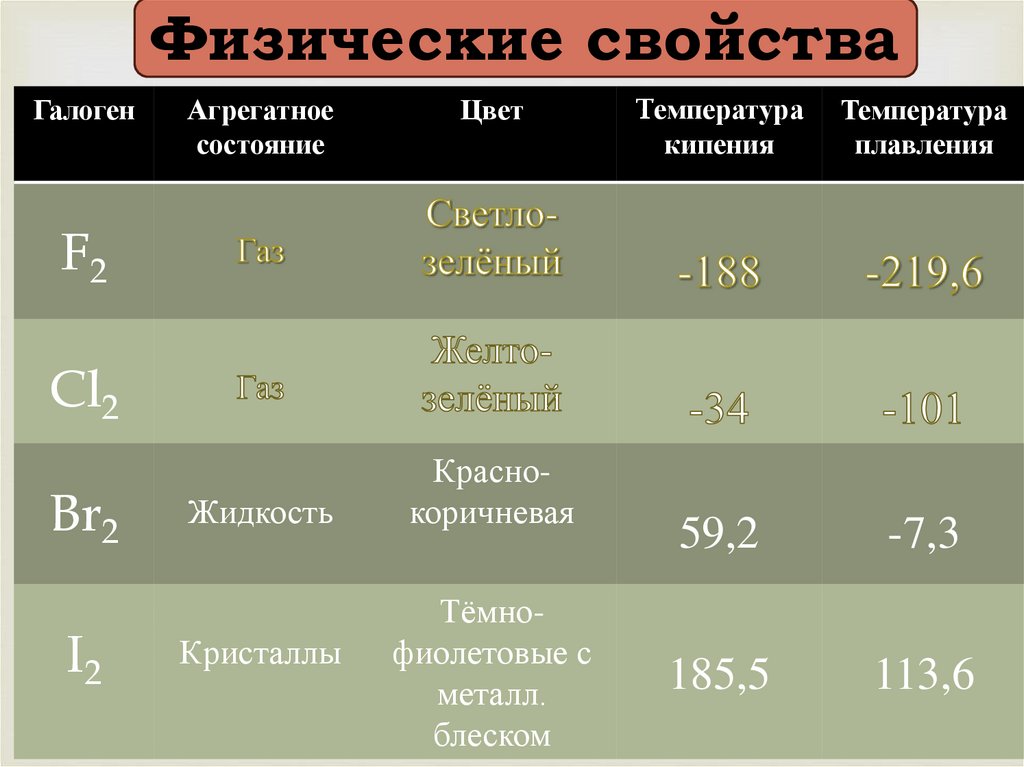
Физические свойстваГалоген
Агрегатное
состояние
Цвет
Tемпература
кипения
Температура
плавления
59,2
-7,3
185,5
113,6
F2
Cl2
Br2
I2
Жидкость
Кристаллы
Краснокоричневая
Тёмнофиолетовые с
металл.
блеском
8.
Химические свойства1.Взаимодействие с металлами= соль
+
2
0
окислитель
-
9.
2.Взаимодействие с водородом =летучие водородные соединения
Н20 + Г20 = 2Н+ Г-
Н20 + F20 = 2НF
Н20 + CI20 = 2НCI
10.
3.Взаимодействие с водой2F2 + 2Н2 О = 4НF + О2
Плавиковая кислота
11.
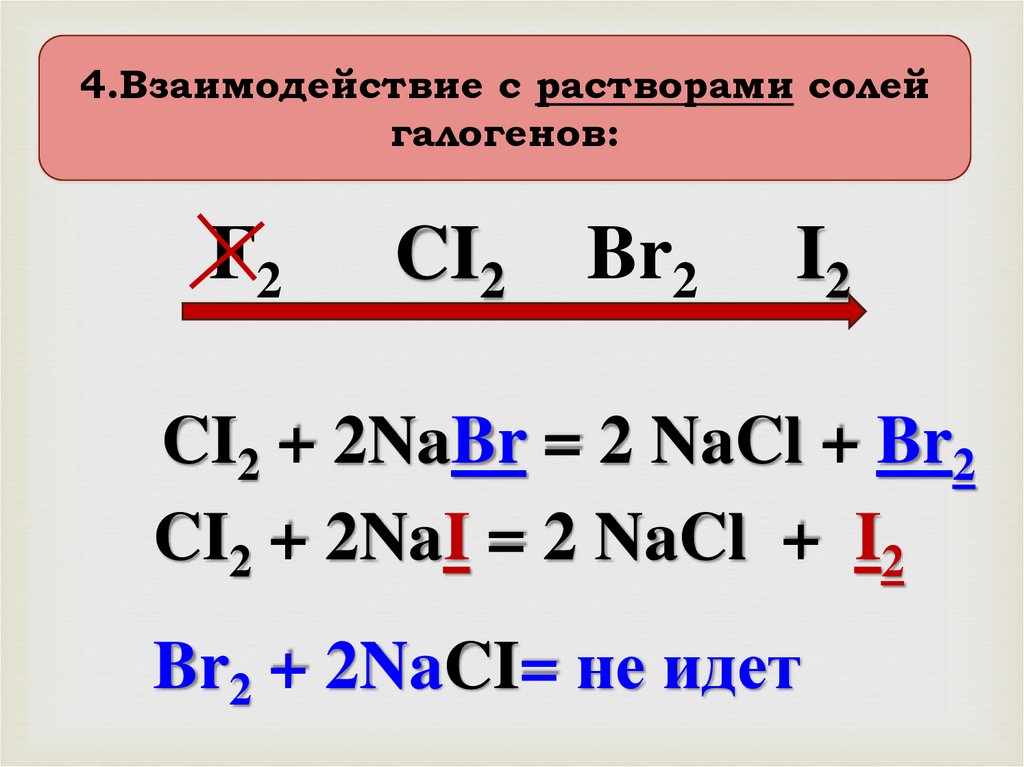
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaCI= не идет









 Химия
Химия








