Похожие презентации:
Хлор
1. Хлор.
11.11.2021Хлор.
9 класс
2. Цель урока:
Закрепить знания о свойствахгалогенов на примере хлора,
рассмотреть применение хлора как
наиболее распространённого галогена.
Основные понятия.
Хлор,
хлорноватистая кислота.
3. Положение хлора в ПСХЭ
• Положение хлора вПСХЭ
CL – хлор
(от греч. χλωρός — «жёлто-зелёный»)
№ 17;
Период -3;
Группа VІІ (A);
Аr (CL) = 35,5
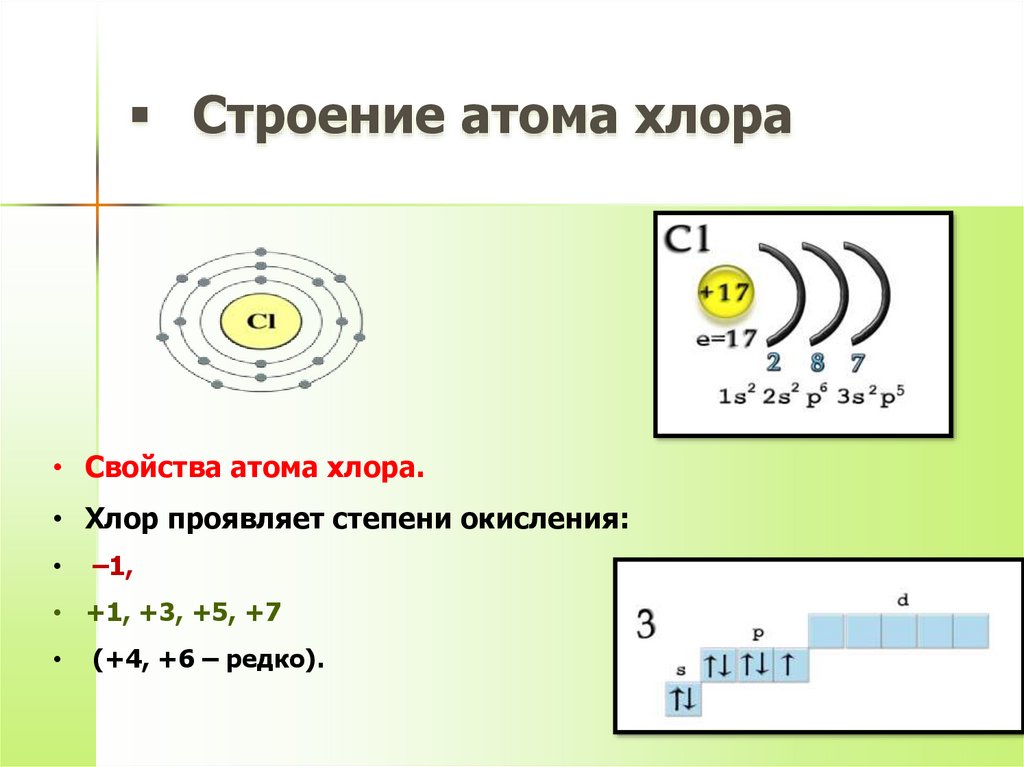
4. Строение атома хлора
• Свойства атома хлора.• Хлор проявляет степени окисления:
–1,
• +1, +3, +5, +7
(+4, +6 – редко).
5. История открытия хлора
• История открытия хлораХлор был получен в 1774 г. шведским
химиком Карлом В. Шееле, при
взаимодействии пиролюзита с соляной
кислотой:
4HCl+MnO →MnCl2+Cl2↑+2H2O.
Шееле отметил запах хлора, схожий с
запахом царской водки,
его способность взаимодействовать
с золотом и киноварью,
а также его отбеливающие свойства
6. Физические свойства хлора
o Физические свойства хлораХлор (CL2) – газ желто-зеленого цвета с
резким запахом. Вызывает удушье.
ЯДОВИТ!!!
Тяжелее воздуха: М (CL2) = 71;
М (возд) =29.
Растворяется в воде:
в 1 V (H2O) : 2,5 V (CL2).
Сжижается под давлением. Хранят в
стальных баллонах, окрашенных
зеленовато-желтый цвет с зелёной
полосой.
7. Химические свойства хлора
• Химические свойства хлораПростые вещества
Металлы:
Cu + Cl2 =CuCl2
- хлорид меди (2)
2Fe + 3Cl2 = 2FeCl3
Неметаллы:
Н2 + Cl2 = 2НCl
- хлороводород
2Р + 5Cl2 = 2РCl5
Сложные вещества
С водой:
Cl2 + Н2О = НCl +НClО –
Хлорноватистая кислота
НClО = НCl + О
Щелочами:
2NaOH +Cl2 = NaCl +NaClO + Н2О
Гипохлорид натрия
Галогенидами:
(вытесняет из солей Бром и Иод:
2KBr+ Cl2 = 2KCl + Br2;
2KI + Cl2 = 2KCL + I2;
Галогенводородами:
2НBr+ Cl2 =2НCl+ Br2;
8. Применение хлора
• Применение хлораРассмотреть схему в § 13, стр. 52,
рис. 11.
На каких свойствах основано
использование хлора в быту и
промышленности?
9.
10.
1.2.
3.
Домашнее задание.
§ 13, составить конспект. упр.
2,4
тестовые задания.
В реакцию с соляной кислотой
вступил оксид марганца, массой
43,5 г. Сколько литров хлора
выделилось в ходе реакции?









 Химия
Химия








