Похожие презентации:
Каталитический крекинг
1.
Лекцияпо теме «Каталитический крекинг»
Лектор: старший преподаватель
Оренбургского государственного университета,
канд. хим. наук
Строганова Елена Алексеевна
2.
В чистом виде цеолиты не могут применяться каккатализаторы, поскольку размер пор очень мал, а крекинг
протекает только на поверхности (не затрагивая внутреннюю
систему
каналов).
Поэтому
применяют
аморфные
алюмосиликаты с добавкой обменных форм цеолитов. Это
повышает количество кислотных центров (от 2 до 100 раз) в
том числе за счет протонированных гидратов подвижных
катионов металлов:
n+
Me . H2O
n+
Me HO
+
H
Дезактивация и регенерация катализаторов крекинга
Примеси в сырье оказывают негативное влияние на
активные свойства катализаторов. Различают 2 типа
примесей:
а) примеси обратимой дезактивации катализатора;
Б) примеси необратимой дезактивации катализатора.
3.
К первой группе относят коксогенные примеси(асфальтены, карбены, смолы) – эти вещества в условиях
высокотемпературных процессов претерпевают дегидрирование
и образуют плотные отложения кокса на поверхности и
частично в порах катализаторов. Регенерация катализаторов в
этом случае возможна – методом выжигания кокса.
Ко второй группе относят металлы и азот. Металлы
(главным образом Ni и V) восстанавливаются в условиях
присутствия коксовых отложений и при высоких температурах,
откладываются в порах катализатора и экранируют активные
центры. А кроме того, адсорбированные металлические
частицы никеля и ванадия катализируют процессы
дегидрирования, что приводит к увеличению в продуктах
крекинга водорода и сухих газов, при этом выход бензина
снижается. Металлические частицы невозможно удалить
методом выжигания, поэтому по мере накопления
металлических отложений катализатор просто перестает
эффективно работать и его утилизируют.
4.
Азот в составе азотистых оснований (анилина, пиридина,холина) нейтрализует кислотные центры катализатора,
связываясь с ними. Обжигом удаление азотистых оснований
невозможно, поэтому отравление «азотом» считается также
необратимым.
Сера сама по себе вредной примесью не является, но она
катализирует процесс коксообразования. А кроме того, в
процессе обжига образуются оксиды серы, поступающие в
продукты крекинга, что обусловливает необходимость
гидроочистки.
В целом перед каталитическим крекингом сырье
нормируется по металлам (допускается не более 2 г/т ), а
также по сере – допускается не более 0,3 %.
5.
Схемы превращения углеводородов в условияхкаталитического крекинга
Кокс
Олефин + Парафин
Парафины
Олефин
Олефин + Н2
Олефин + диены
Олефины
Изопарафины
Полимеры
Парафины+нафтены+арены
Олефин+арены
Олефины
Нафтены
Циклогексан
Арены
Арены
Парафины+алкиларены
Продукты конденсации
Кокс
6.
Механизмы превращений1) Превращения алканов
Механизм карбокатионный: т.е. гетеролиз С-Н связи при
участии протонных центров катализатора.
I Образование карбокатионов
а) протолиз двойной связи
R
CH
CH2
+
+H
+
R
CH
CH3
R
CH2 CH2
б) каталитический гетеролиз С-Н
R
CH2
.
CH2 H
.
+
H
+
+
H2
7.
II Реакции карбокатионова) β-распад
.
+
CH2 C
.
R
T
CH3
R
+
H2C
C
CH3
CH3
CH3
Склонность к β-распаду снижается от первичного иона к
вторичному и далее к третичному.
б) диспропорционирование
R
+
CH2 C
CH3
+
R
+
CH2 C
CH3
R
CH3
+R
CH3
CH3
CH3
CH2 CH
CH
C
CH3
CH3
в) перенос реакционного центра
R
+
CH2 CH
CH3
+
R
CH2 CH
CH3
CH3
R
CH2 CH2 CH3
+
R
+
CH2 C
CH3
CH3
8.
г) изомеризацияH
. .
R
H
. .
+
CH2
CH2 CH
R
CH
+
CH
+
R
CH3
CH
CH2 CH3
Тепло, выделяющееся в результате изомеризации при участии С-Н связи,
затрачивается на образование сигма-комплекса при участии С-С связи с
последующим расщеплением:
R
+
CH
CH2 CH3
R
HC
+
CH3
CH3
CH3
R
CH2
C
. .
+
R
CH2
+
C
CH3
H
III Обрыв цепи при участии катализатора
O
O
R
CH
+
CH
. .
H
CH3
+
O
SiO
O
R
CH
CH
CH3
+
O
-Si
O
H
+
O
9.
Таким образом, в процессе каталитического крекингаобразуются изоалканы, а также преимущественно вторичные и
третичные карбокатионы, образующие при расщеплении
углеводороды С3 и С4 (газы каталитического крекинга).
2) Превращения нафтенов
Скорость каталитического крекинга циклоалканов близка
к скорости крекинга алканов с равным числом атомов углерода
(увеличивается при наличии третичного С).
I Инициация при участии протонных центров
катализатора:
H3C
CH
+
+H
CH2
H3C
+
CH
CH3
H
. .
CH
H2C
CH2
CH2 CH2
+
H3C
+
CH
CH2
CH3
H2C
+
CH
CH2 CH2
+
H3C
CH2 CH3
10.
II Реакции циклических катионов1) С разрывом кольца
. CH2
.
H2C
+
+
CH
H2C
CH2 CH2
CH
CH2
CH2 CH2
Образующийся алкенильный ион легко изомеризуетс я в ион аллильного типа
+
CH2 H
. .
H2C
CH
CH
CH2
H3C
+
CH2
CH
CH2
CH
2) Без разрыва кольца
O
O
CH2
H2C
+
CH
CH2 CH
..
H
CH2
+
O
SiO
O
H2C
CH
CH2 CH
+
O
-Si
O
+
H
O
11.
Непредельные нафтены крекируются быстрее насыщенных, и реакцияидет до образования ароматических углеводородов:
CH
H2C
CH
CH
. .
O
O
+
O
Si-
O
+
CH
H
CH
O
H2C
CH
CH
CH
+
O
-Si
+
O
O
H
3) Превращения аренов
Незамещенные арены в условиях каталитического крекинга
устойчивы.
Метилзамещенные арены реагируют со
скоростью, близкой к алканам, причем основной реакцией
крекинга аренов является деалкилирование:
12.
CHR
C
CH
+
H
CH
R
C
CH
CH
+
+
R
HC
HC
CH
CH
HC
CH
HC
CH
CH
CH
CH
+
H
Скорость процесса растет с увеличением длины R. В случае
метилзамещенных аренов отщепление карбониевого иона
CH3+
энергетически
невыгодно,
поэтому
для
метилзамещенных аренов в основном протекают реакции
диспропорционирования и изомеризации по положению
заместителей:
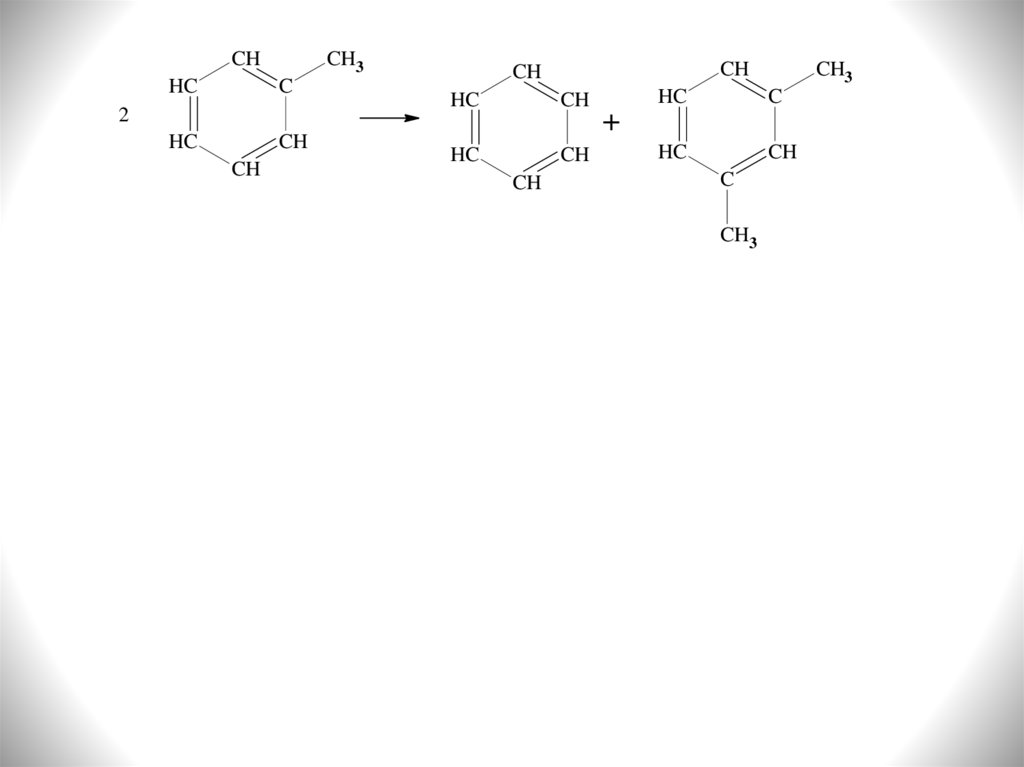
CH
CH3
HC
C
HC
CH
2
CH
CH
CH
HC
CH
HC
CH
CH
CH3
HC
C
HC
CH
+
C
CH3
13.
CHCH3
HC
C
HC
CH
2
CH
CH
CH
HC
CH
HC
CH
CH
CH3
HC
C
HC
CH
+
C
CH3












 Химия
Химия








