Похожие презентации:
Алюминий, соединения алюминия
1.
2. План урока
1. Положение в периодической системе2. Нахождение в природе, способы
получения
3. Химические свойства алюминия
4. Оксид алюминия и его свойства
5. Гидроксид алюминия и его свойства
6. Применение алюминия
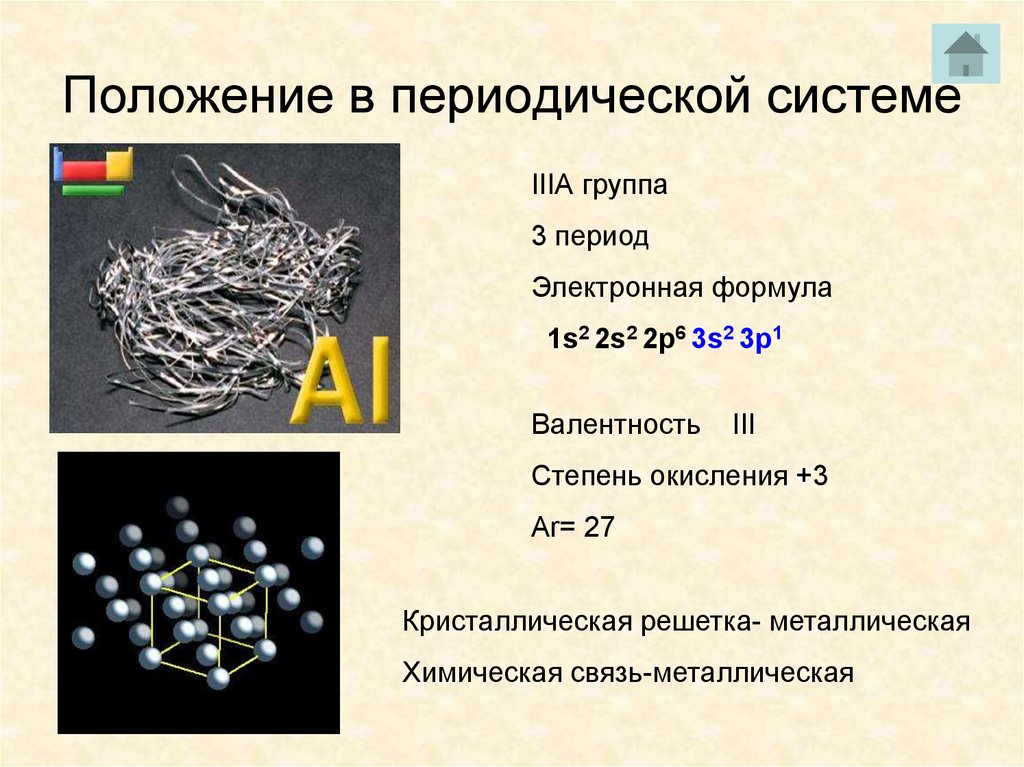
3. Положение в периодической системе
IIIА группа3 период
Электронная формула
1s2 2s2 2p6 3s2 3p1
Валентность
III
Степень окисления +3
Ar= 27
Кристаллическая решетка- металлическая
Химическая связь-металлическая
4.
бериллAl2O3
изумруд
Боксит , горная порода, состоящая из
нескольких минералов – гидроксидов
алюминия; главная алюминиевая руда.
AlO(OH) и гидроксид
Al(OH)3
Крупнейшие производители бокситов –
Австралия, Гвинея, Ямайка, Суринам,
Бразилия, Югославия и Греция, страны
СНГ.
5. Из истории открытия
В период открытия алюминия металл был дороже золота.Англичане хотели почтить
богатым подарком великого
русского химика Д.И Менделеева,
подарили ему химические весы, в
которых одна чашка была
изготовлена из золота, другая из алюминия. Чашка из алюминия
стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только
учёных, но и промышленников и
6. «Серебро из глины»
Немецкий учёный Ф. Велер (1827 г.)получил алюминий при нагревании
хлорида алюминия
со щелочными
металлами калий и натрий.
А.Сент-Клер Девиль.
Впервые получил
алюминий
промышленным
способом (1855г.).
7. Способы получения
Современный способ получения алюминия был открыт в 1886году молодым американским исследователем Чарлзом
Мартином Холлом.
В специальных ваннах при температуре 960–970° С подвергают
электролизу раствор глинозема (технический Al2O3) в
расплавленном криолите Na3AlF6, который частично добывают
в виде минерала, а частично специально синтезируют.
эл.ток
2 Al2O3 → 4 Al + 3 O2
8. Химические свойства алюминия
1.Взаимодействие с простыми веществами2 Al + 3 Br2 → 2 AlBr3
2 Al + 3 I2 → 2 AlI3
9. Взаимодействие с водой
10.
Взаимодействиеалюминия со щелочью
Взаимодействие
алюминия с кислотами
11.
2. Взаимодействие со сложными веществами2Al + 6 HCl → 2 AlCl3 + 3 H2
t
2 Al + 2 NaOH → 2 NaAlO2 + H2
Алюминий проявляет
свойства, так как реагирует и с кислотами и
со щелочами.
12.
Al2O34 Al + 3 O2 →
2 Al2O3
Химические свойства
1.Взаимодействие с кислотами
t
Al2O3+ 6HCl → 2AlCl3 + 3 H2O
2.Взаимодействие со щелочами
t
Al2O3+ 2 NaOH → 2 NaAlO2 + H2O
Оксид алюминия проявляет
свойства
13.
14.
Al(OH)31. Получение
AlCl3
+ 3 NaOH →
Al(OH)3 ↓ + 3 NaCl
2.Химические свойства
2.1. Взаимодействие с кислотами
Al(OH)3 + 3 HCl →
AlCl3 + 3 H2O
2.2.Взаимодействие со щелочами
Al(OH)3 + NaOH → Na AlO2 +2 H2O
Гидроксид алюминия проявляет
свойства
15.
16. Металл будущего
• Вывод: Обладая такими свойствами каклёгкость, прочность,
коррозионноустойчивость, устойчивость
к действию сильных химических
реагентов - алюминий нашёл большое
занимают в авиационном и
космическом транспорте применение во
многих отраслях народного хозяйства.
Особое место алюминий и его сплавы,
электротехнике, а за ними будущее
нашей науки и техники.















 Химия
Химия








