Похожие презентации:
Введение в биохимию. Строение и функции белков
1.
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ
БИОХИМИИ
Лекция по биохимии
Тема:
ВВЕДЕНИЕ в БИОХИМИЮ.
Строение и функции белков
КРАСНОДАР
2015
2. БИОХИМИЯ –
наука, изучающая химический составживых организмов, химические
процессы, которые лежат в основе
жизнедеятельности и обеспечивают
организму сложную морфологическую
целостность и высокую
функциональную активность
3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ –
ПОЗНАНИЕ ХИМИЧЕСКИХОСНОВ ЖИЗНИ, УСЛОВИЙ
И МЕХАНИЗМОВ ЕЁ
ВОЗНИКНОВЕНИЯ И
РАЗВИТИЯ
4. Метаболизм –
совокупность химическихпревращений веществ от
момента поступления их в
клетку до выделения
конечных продуктов
5. Метаболизм
Катаболизм –Анаболизм –
совокупность
поэтапных
ферментативных
процессов
расщепления сложных
молекул до простых.
Идет с
высвобождением
энергии –
экзэргонический
процесс
совокупность
поэтапных
ферментативных
процессов построения
сложных веществ из
более простых
предшественников.
Идет с затратой
энергии,
эндэргонический
процесс
6. БЕЛКИ (протеины) –
ВЫСОКОМОЛЕКУЛЯРНЫЕАЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ, МАЛО
ОТЛИЧАЮЩИЕСЯ ПО
ЭЛЕМЕНТАРНОМУ СОСТАВУ, НО
РЕЗКО ОТЛИЧАЮЩИЕСЯ ПО
ХИМИЧЕСКОМУ СОСТАВУ,
СТРОЕНИЮ, СВОЙСТВАМ,
ФУНКЦИЯМ И СОСТАВЛЯЮЩИЕ
ОСНОВУ ВСЕГО ЖИВОГО
7. Функции белков
• Каталитические(ферменты)
Регуляторные
(гормоны)
Рецепторая (мембранные,
цитозольные и др. рецепторы)
Транспортные (Нb,
трансферрин)
Защитные
(Ig, шапероны)
Сократительные
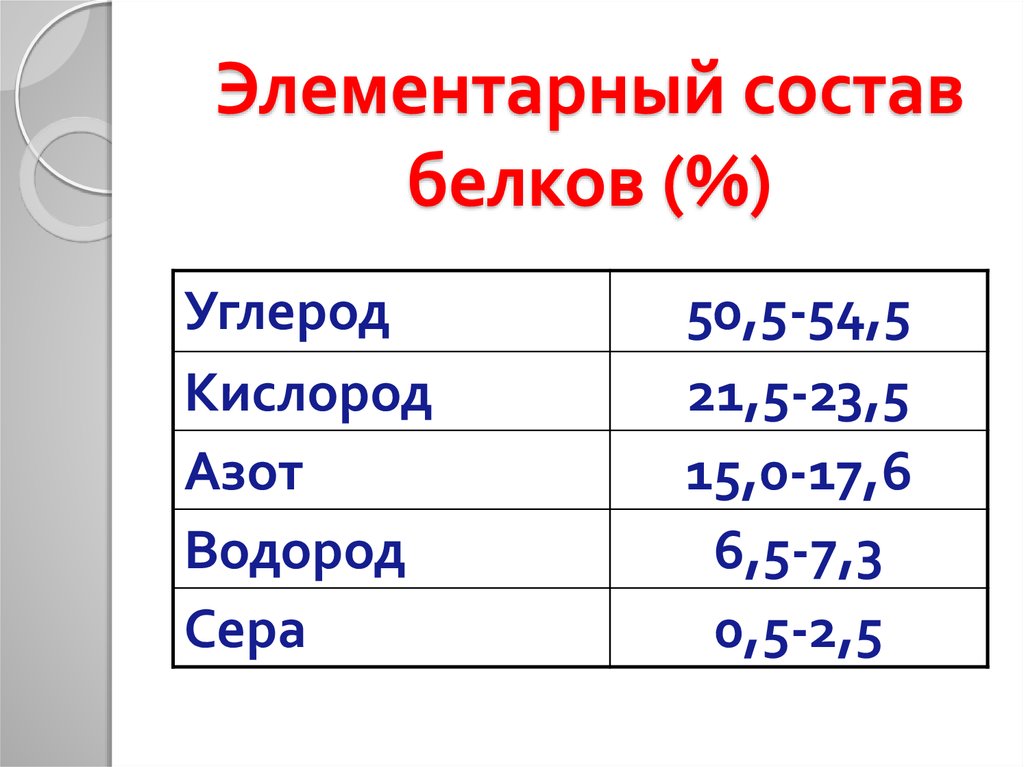
8. Элементарный состав белков (%)
УглеродКислород
Азот
Водород
Сера
50,5-54,5
21,5-23,5
15,0-17,6
6,5-7,3
0,5-2,5
9. БЕЛКИ –
биополимеры, структурнымиединицами которых
(мономерами) являются
α-аминокислоты, соединённые
между собой пептидными
связями. 20 аминокислот, из
которых построены все белки,
называются протеиногенными.
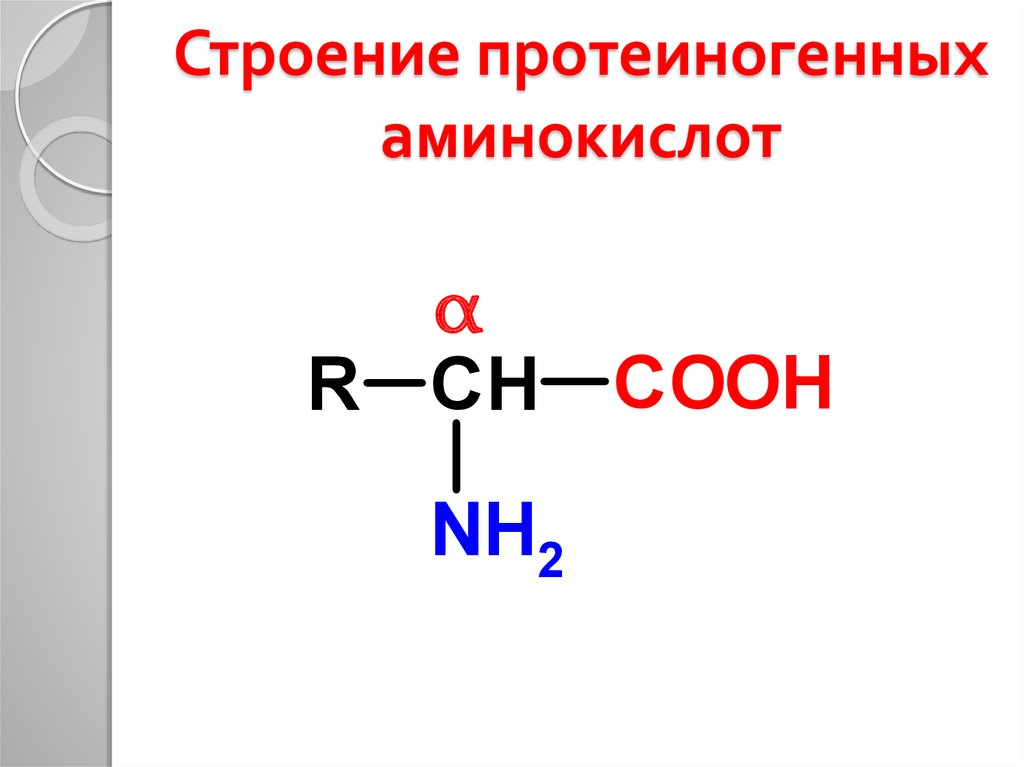
10. Строение протеиногенных аминокислот
αR СН COOH
,
NH
2
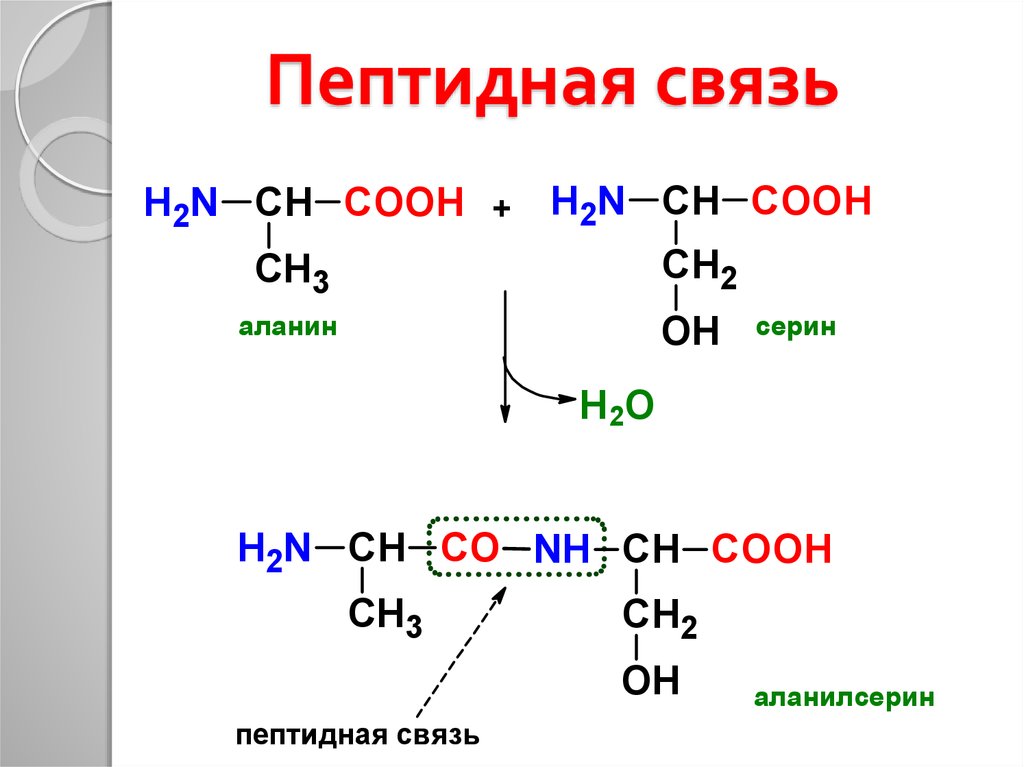
11. Пептидная связь
H2N СН COOH +H2N СН COOH
СН2
CH3
аланин
OH
серин
Н2О
H2N СН CO NH СН COOH
CH3
СН2
OH
пептидная связь
аланилсерин
12. Классификация производных аминокислот
2-10 аминокислотных остатков– пептид,
10-100 ─" ─ полипептид,
> 100
─" ─ белок
Молекулярная масса белков
от 10000 Да до нескольких миллионов Да
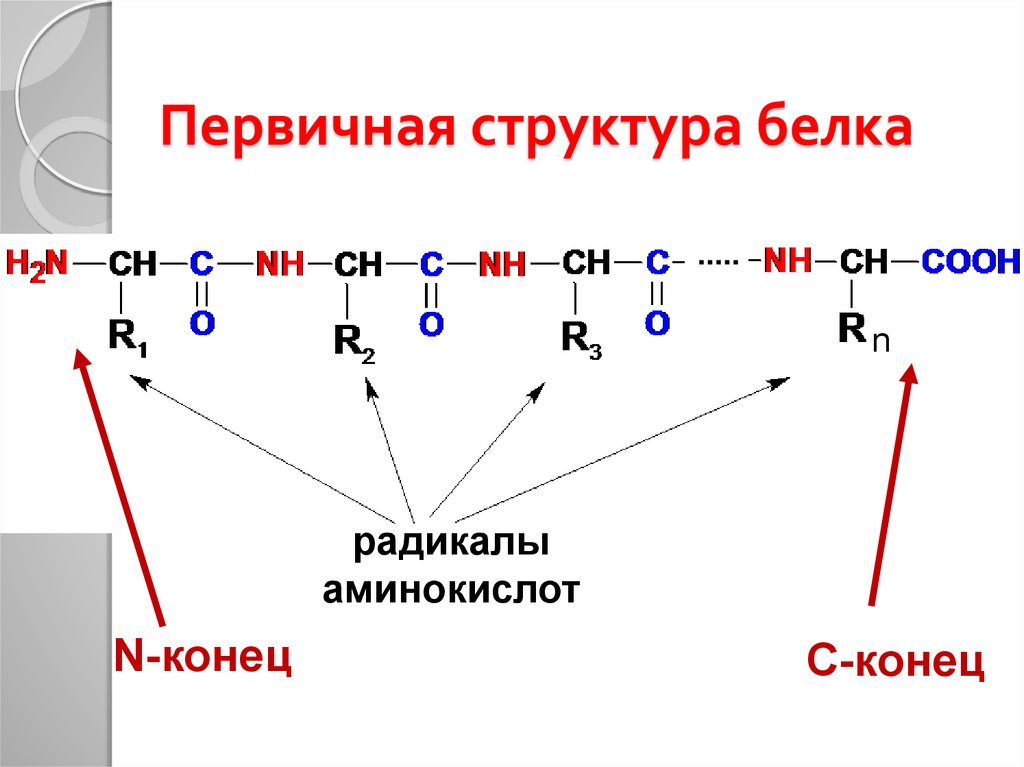
13. Первичная структура белка
nрадикалы
аминокислот
N-конец
С-конец
14. Первичная структура определяет:
Физико-химические свойства (размер,массу, растворимость, заряд и т.д.)
Все последующие уровни структурной
организации белка, а следовательно
Биологическую активность белка
Видовую и тканевую специфичность
белка
15. Закономерности первичной стуктуры
1. Чем важнее роль белка в процессахжизнедеятельности, тем
разнообразнее его аминокислотный
состав (и, наоборот, чем примитивнее
функция белка, тем беднее его
«аминокислотная корзина»)
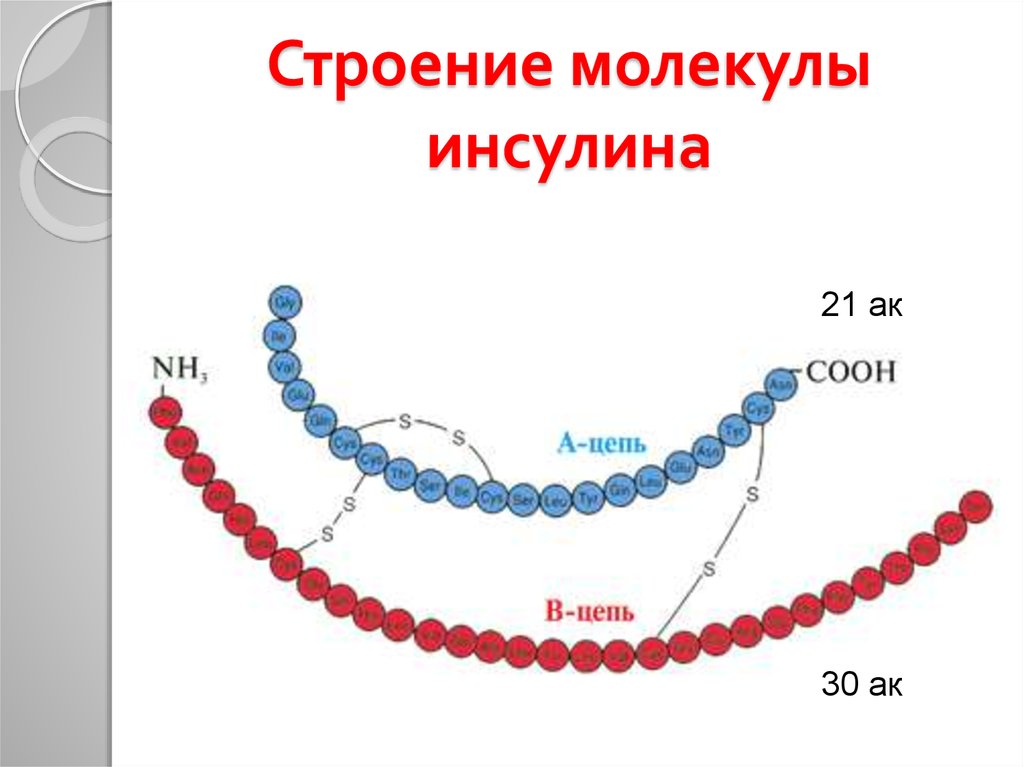
16. Строение молекулы инсулина
SS
21 ак
А-цепь
(21 ак)
S
S
S
S
В-цепь
(30 ак)
30 ак
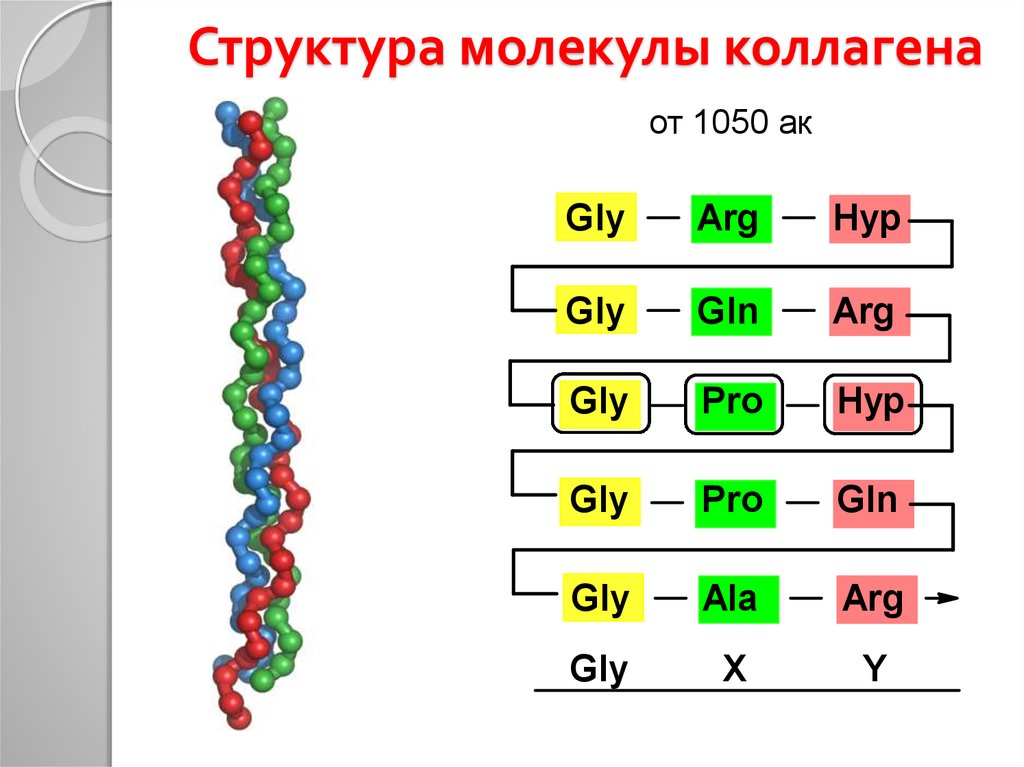
17. Структура молекулы коллагена
от 1050 акGly
Arg
Hyp
Gly
Gln
Arg
Gly
Pro
Hyp
Gly
Pro
Gln
Gly
Ala
Arg
Gly
X
Y
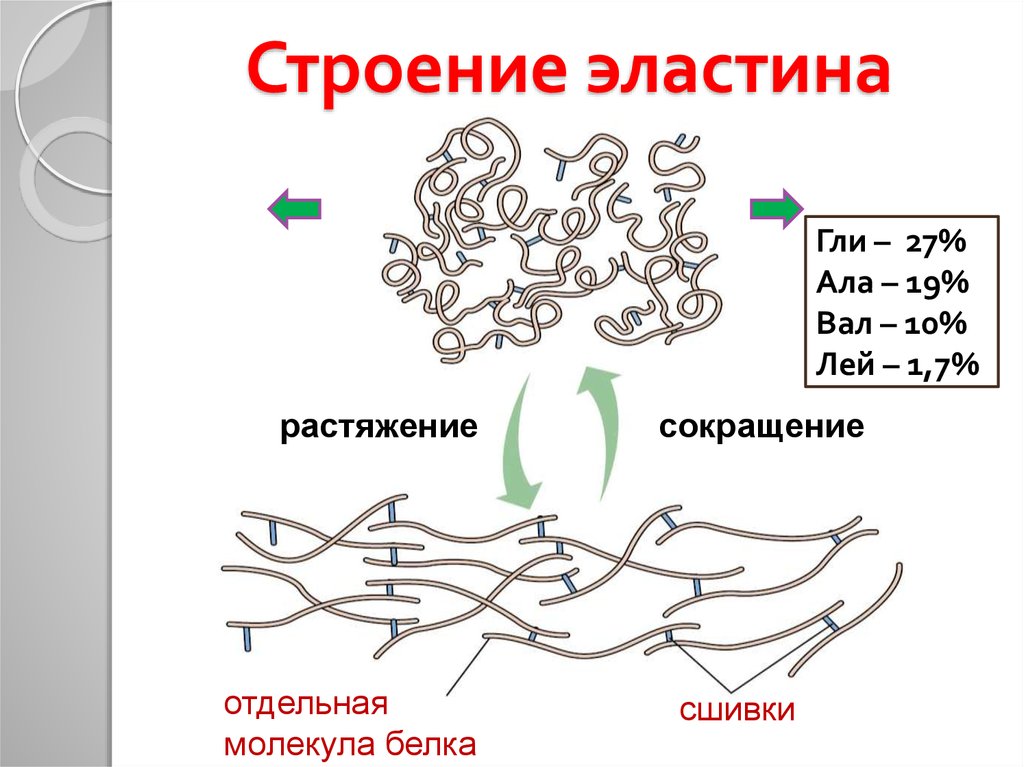
18. Строение эластина
Гли – 27%Ала – 19%
Вал – 10%
Лей – 1,7%
растяжение
отдельная
молекула белка
сокращение
сшивки
19. Закономерности первичной стуктуры
2. Чем важнее роль белка в процессахжизнедеятельности, тем больше
сходство первичных структур
гомологичных белков (гомологичные
белки – белки, выполняющие одну и
ту же функцию у разных видов
животных)
20. Закономерности первичной стуктуры
3. Чем ближе расположены виды наэволюционной лестнице, тем больше
сходство первичных структур
гомологичных белков
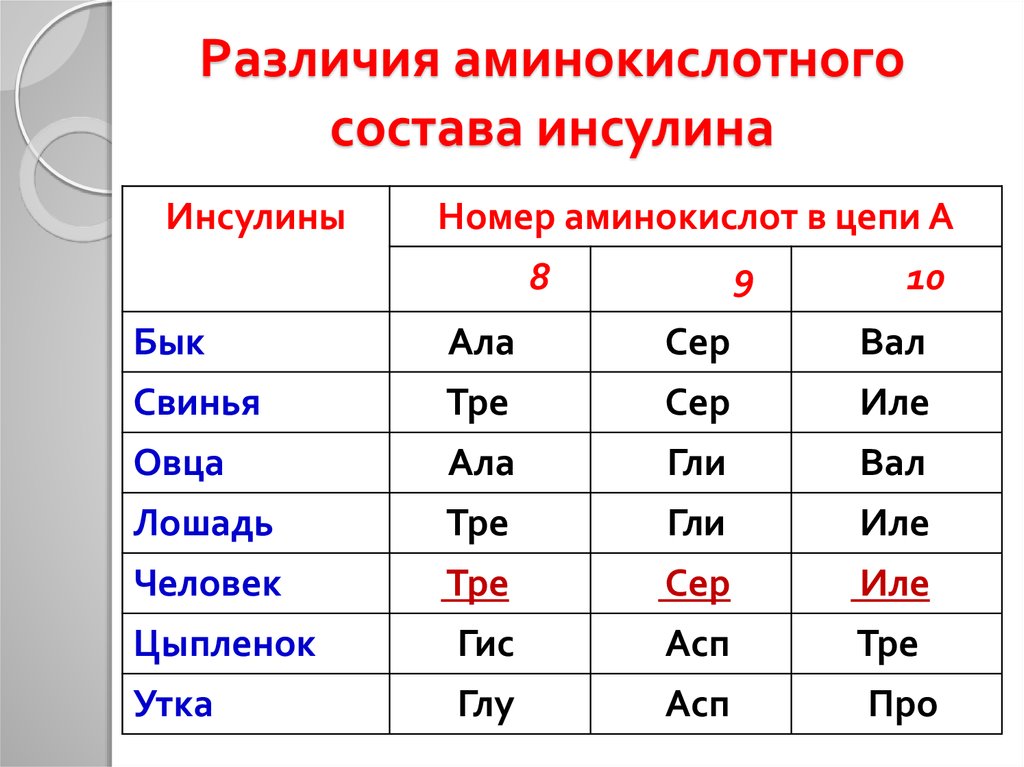
21. Различия аминокислотного состава инсулина
ИнсулиныНомер аминокислот в цепи А
8
9
10
Бык
Ала
Сер
Вал
Свинья
Тре
Сер
Иле
Овца
Ала
Гли
Вал
Лошадь
Тре
Гли
Иле
Человек
Тре
Сер
Иле
Цыпленок
Гис
Асп
Тре
Утка
Глу
Асп
Про
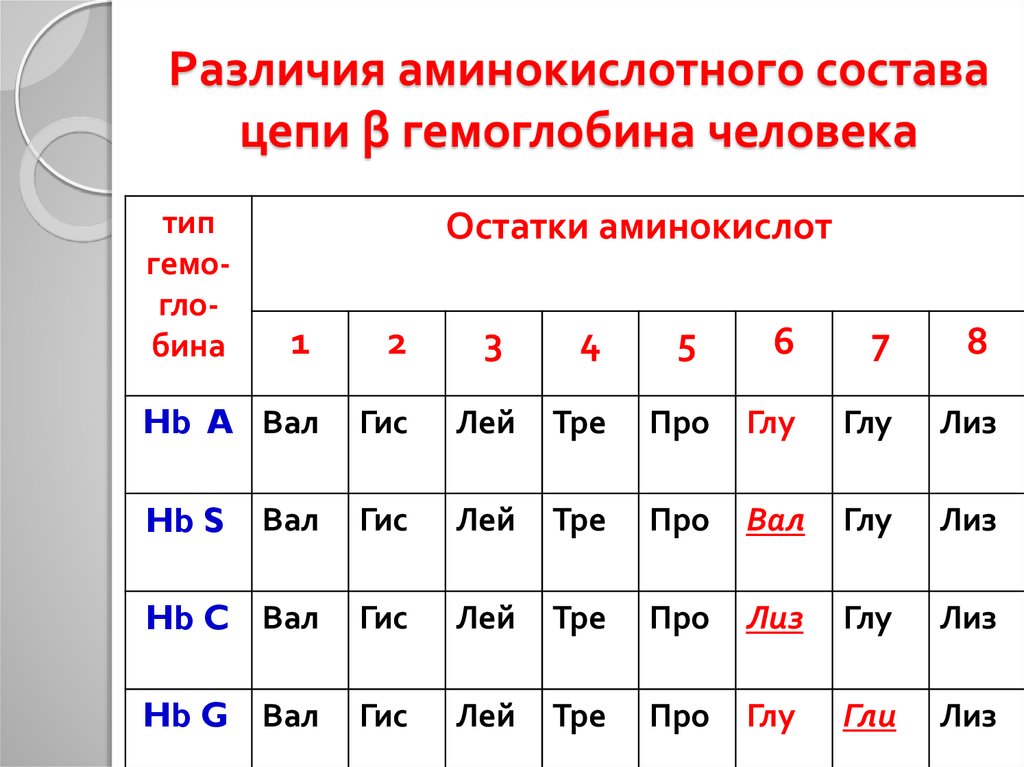
22. Различия аминокислотного состава цепи β гемоглобина человека
типгемоглобина
Остатки аминокислот
1
2
3
4
Hb A Вал
Гис
Лей
Тре
Hb S
Вал
Гис
Лей
Hb C Вал
Гис
Hb G Вал
Гис
5
6
7
8
Про
Глу
Глу
Лиз
Тре
Про
Вал
Глу
Лиз
Лей
Тре
Про
Лиз
Глу
Лиз
Лей
Тре
Про
Глу
Гли
Лиз
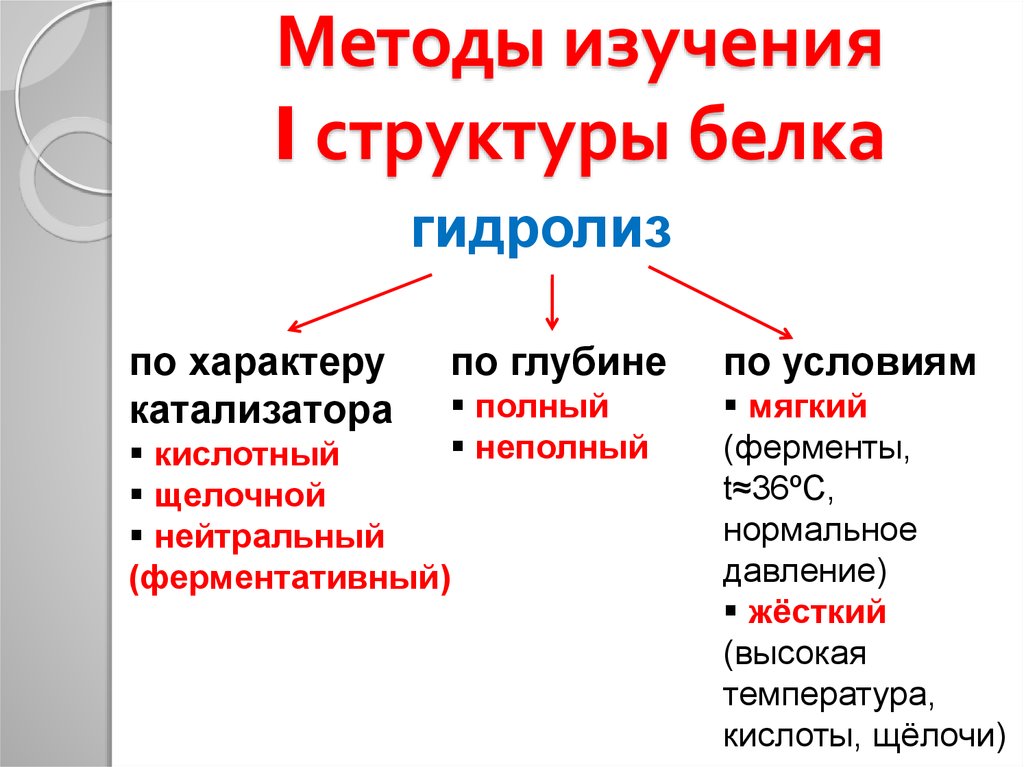
23. Методы изучения I структуры белка
Методы «меток» – определениеконцевых аминокислот (методы
Сэнджера, Эдмана, Акабори,
дансильный)
Гидролиз
Хроматография
Секвенирование
24. Методы изучения I структуры белка
гидролизпо характеру
катализатора
по глубине
по условиям
полный
неполный
мягкий
(ферменты,
t≈36ºC,
нормальное
давление)
жёсткий
(высокая
температура,
кислоты, щёлочи)
кислотный
щелочной
нейтральный
(ферментативный)
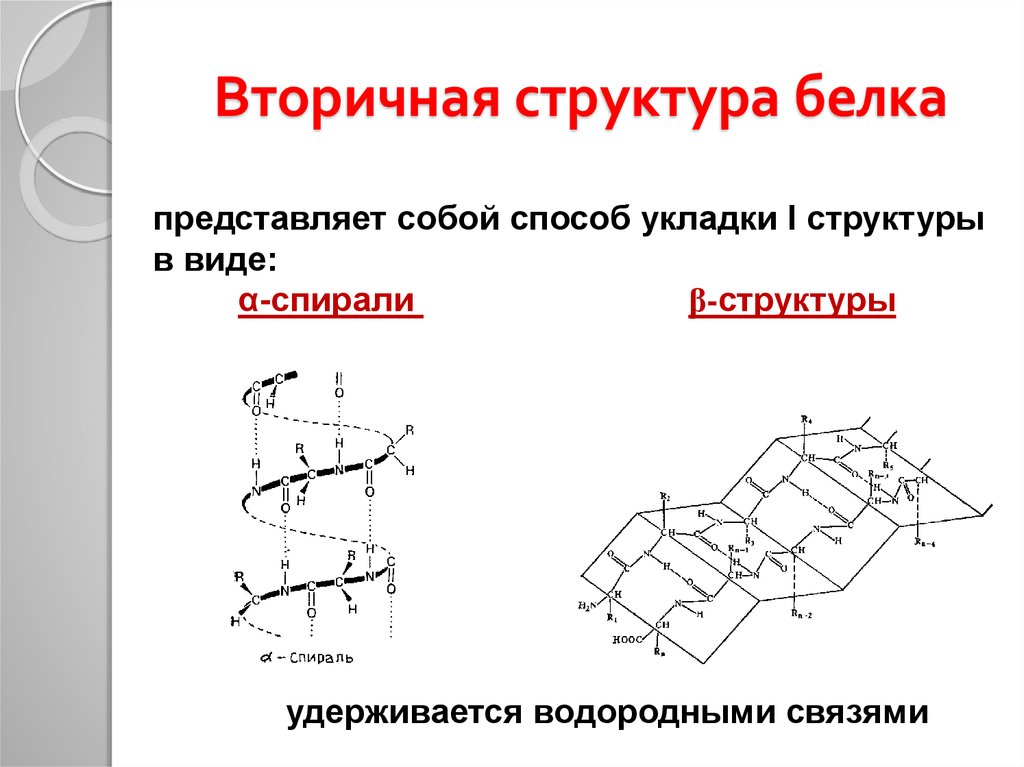
25.
Вторичная структура белкапредставляет собой способ укладки I структуры
в виде:
α-спирали
β-структуры
удерживается водородными связями
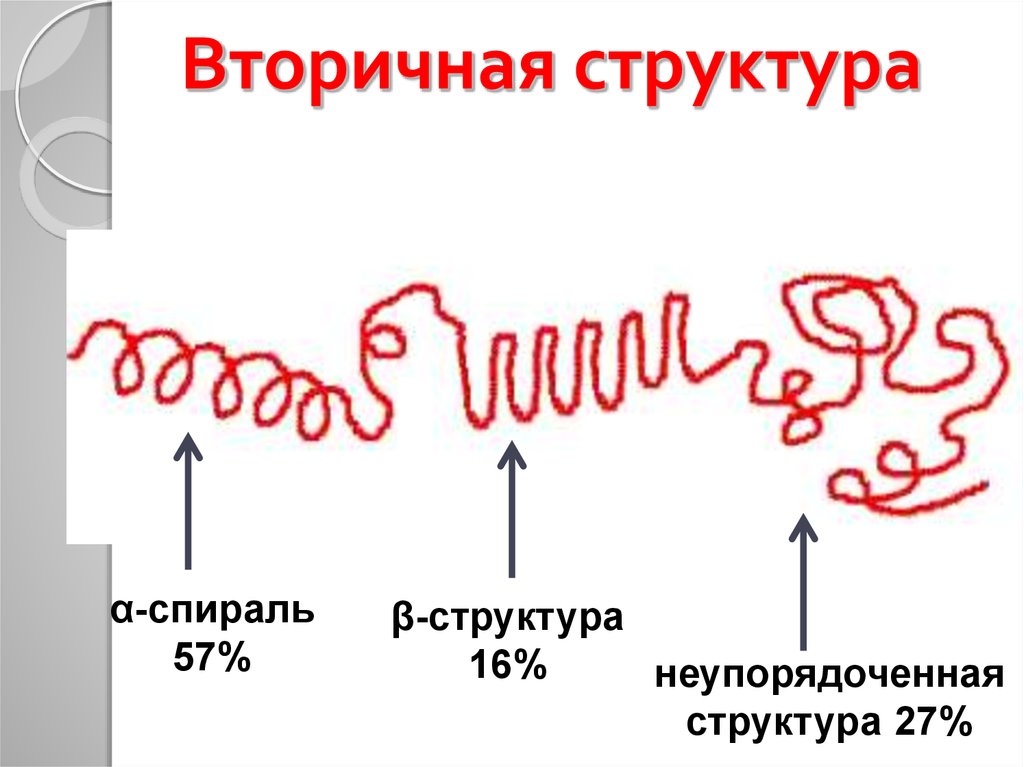
26. Вторичная структура белка
Первичнаяструктура
α-спираль
β-структура
Вторичная структура
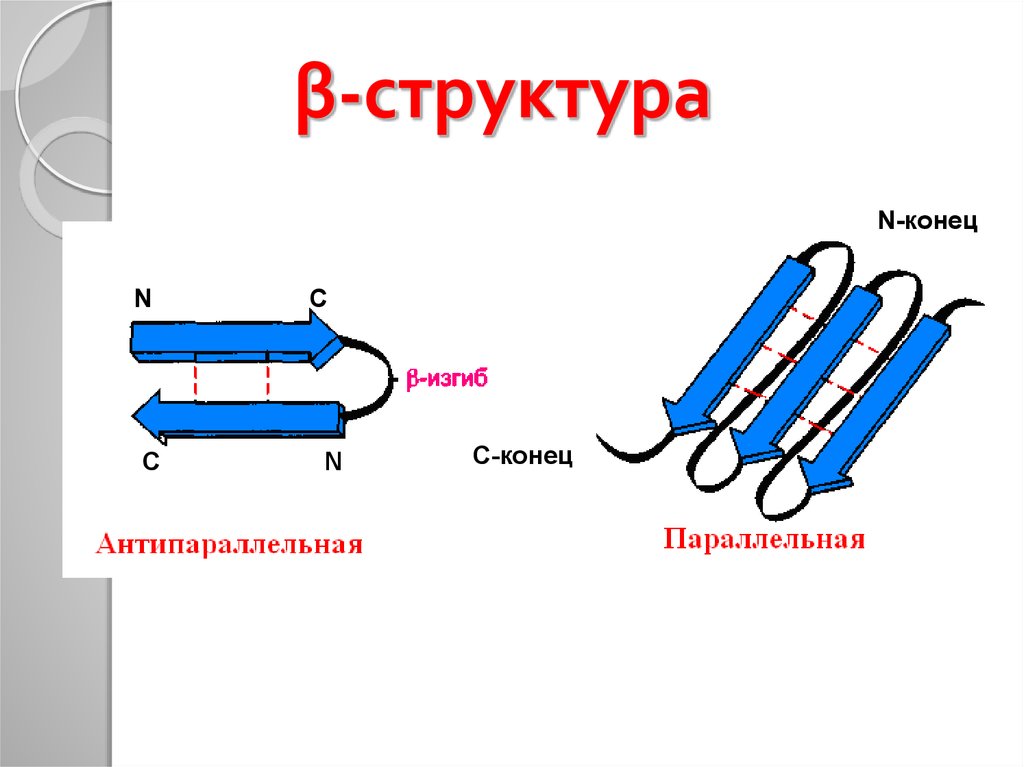
27. β-структура
N-конецN
C
C
N
С-конец
28. Вторичная структура
α-спираль57%
β-структура
16%
неупорядоченная
структура 27%
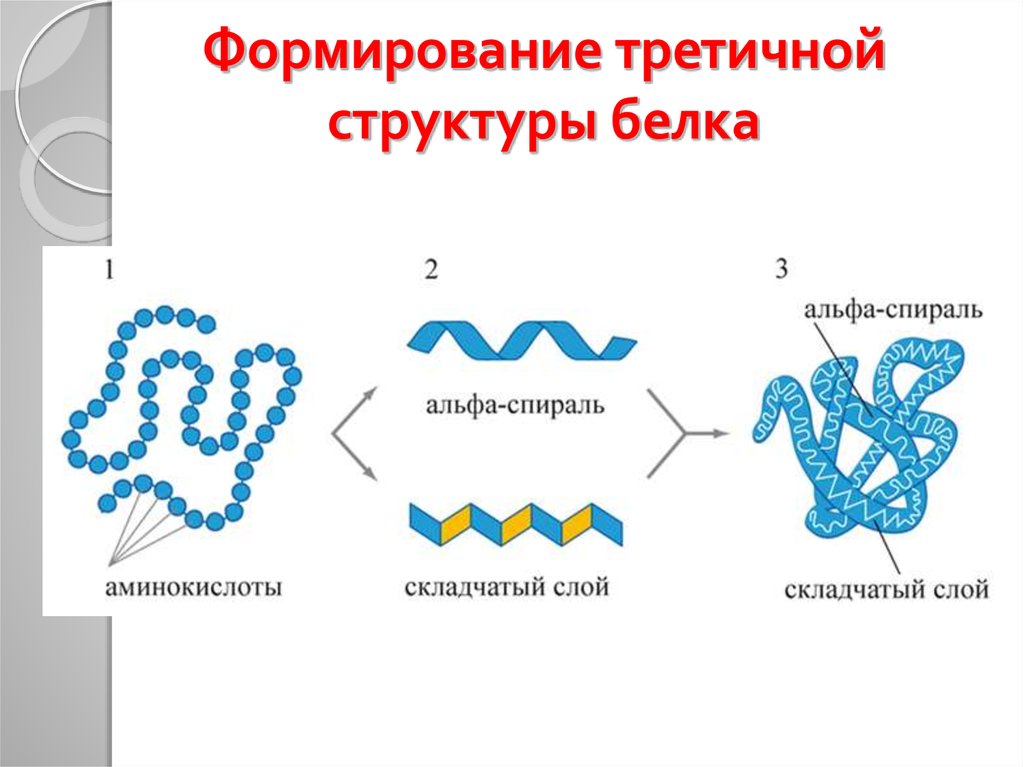
29. Формирование третичной структуры белка
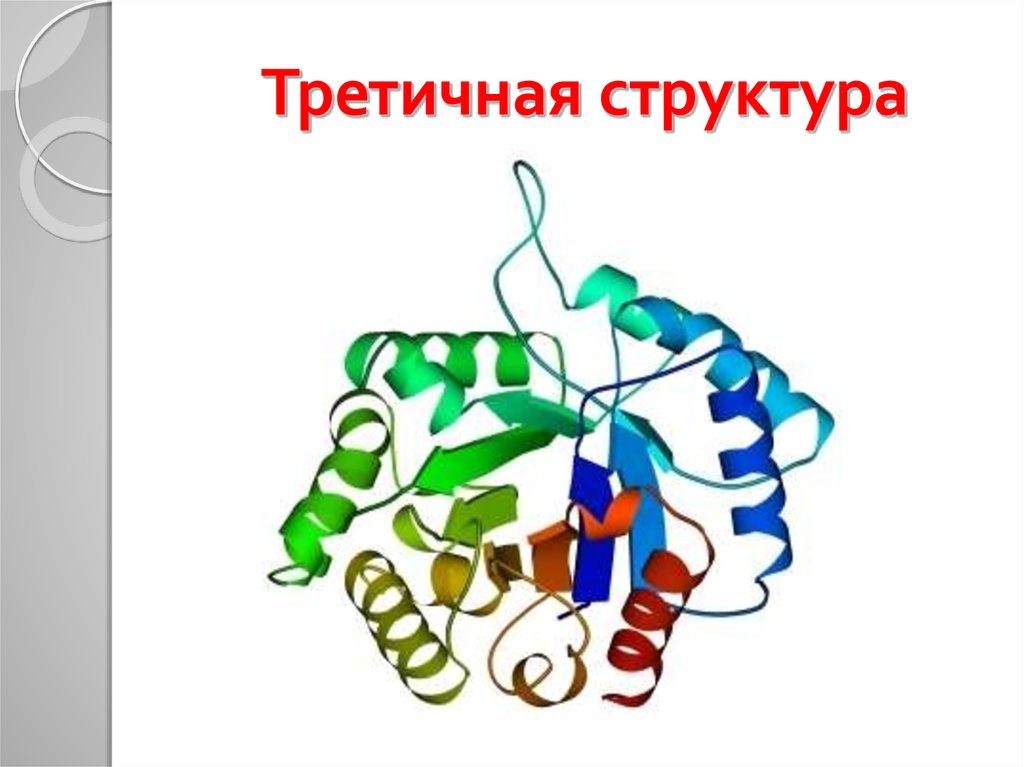
30. Третичная структура
31. Форма белковых молекул
Глобулярные (шарообразные)Фибриллярные (нитевидные)
фибрилла
глобула
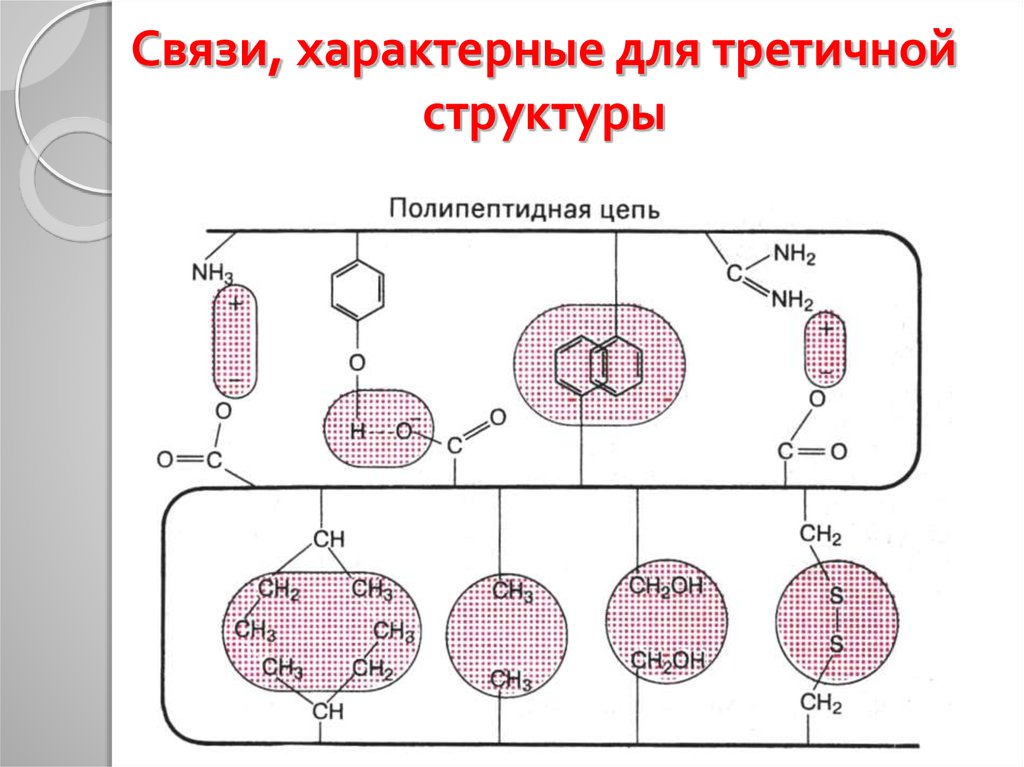
32. Связи, характерные для третичной структуры
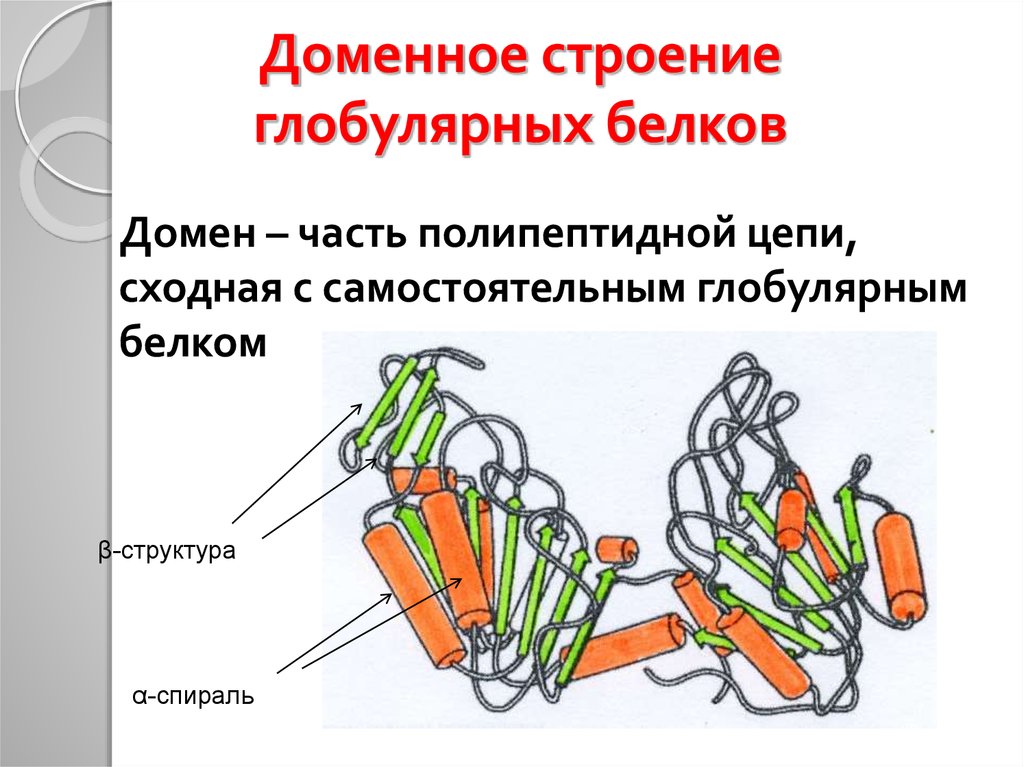
33. Доменное строение глобулярных белков
Домен – часть полипептидной цепи,сходная с самостоятельным глобулярным
белком
β-структура
α-спираль
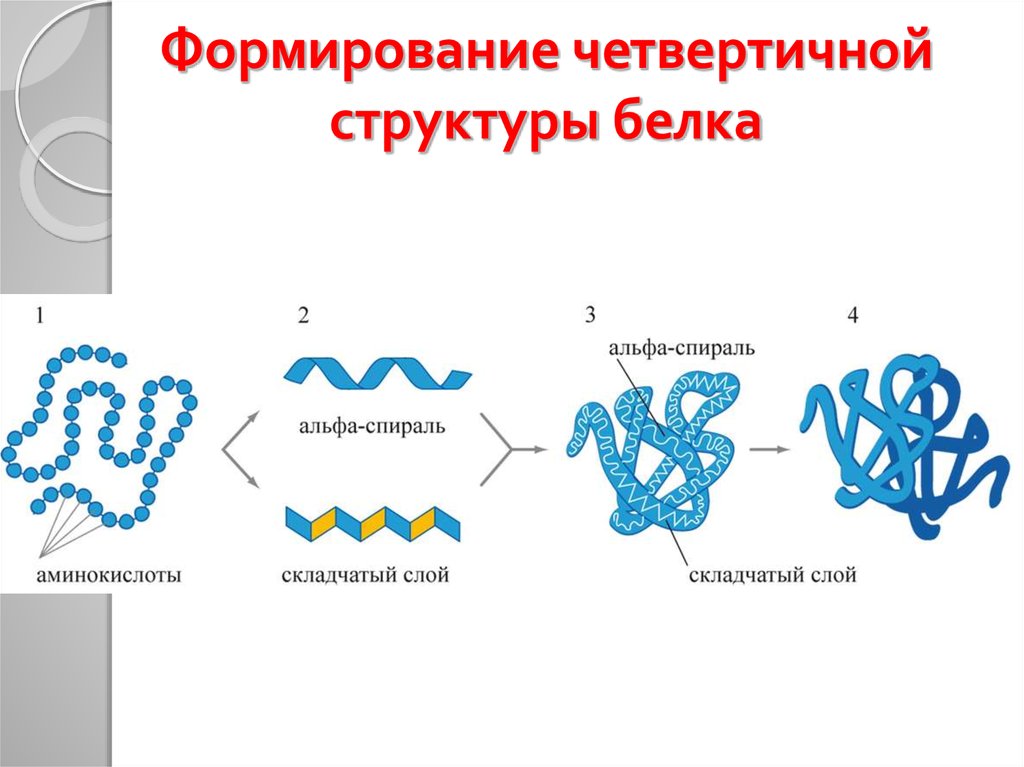
34. Формирование четвертичной структуры белка
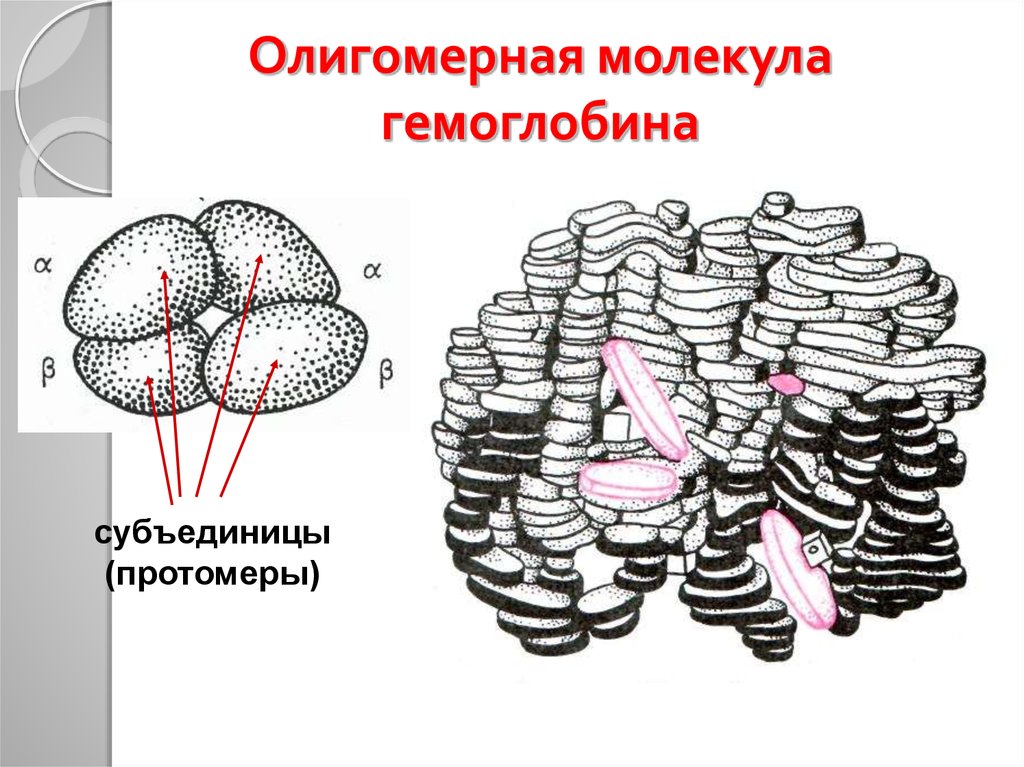
35. Олигомерная молекула гемоглобина
субъединицы(протомеры)
36. Важнейшие свойства белков:
Способность к специфическимвзаимодействиям (образование
белково-лигандных комплексов)
Способность к самосборке
(образование надмолекулярных
структур)
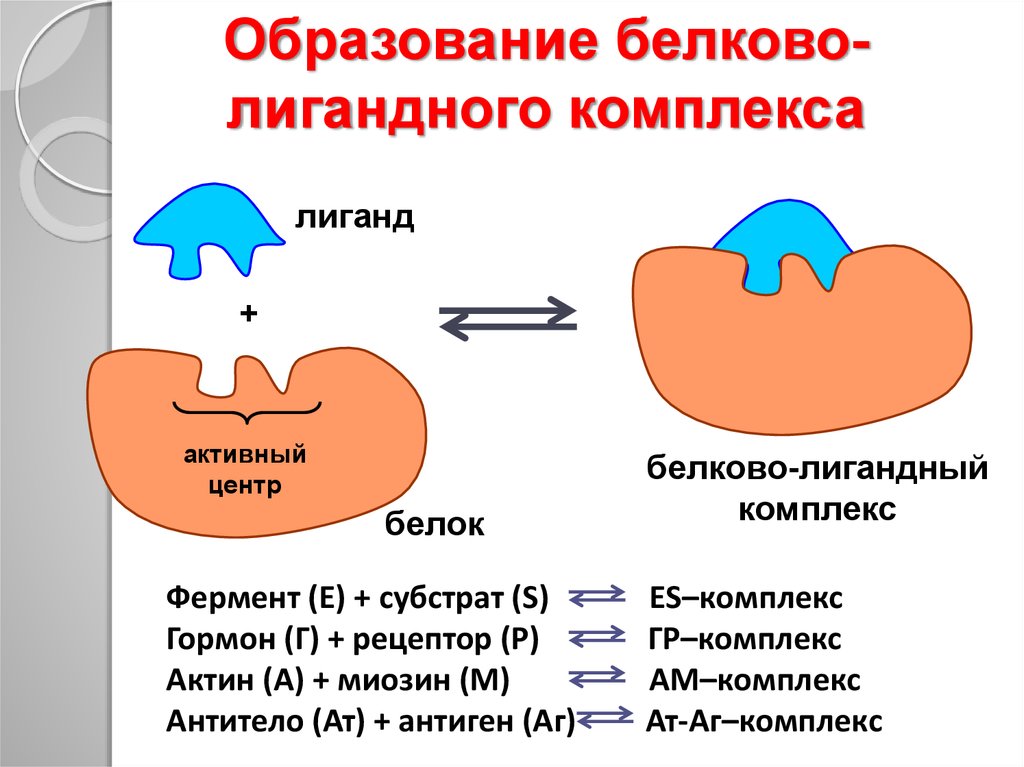
37. Образование белково-лигандного комплекса
Образование белковолигандного комплексаПроисходит только в определённом
месте белка, который называется
центр связывания (или активный
центр)
Взаимодействие высокоизбирательно
Быстрое насыщение
Взаимодействие обратимо
38.
Образование белковолигандного комплексалиганд
+
активный
центр
белок
Фермент (Е) + субстрат (S)
Гормон (Г) + рецептор (Р)
Актин (А) + миозин (М)
Антитело (Ат) + антиген (Аг)
белково-лигандный
комплекс
ЕS–комплекс
ГР–комплекс
АМ–комплекс
Ат-Аг–комплекс
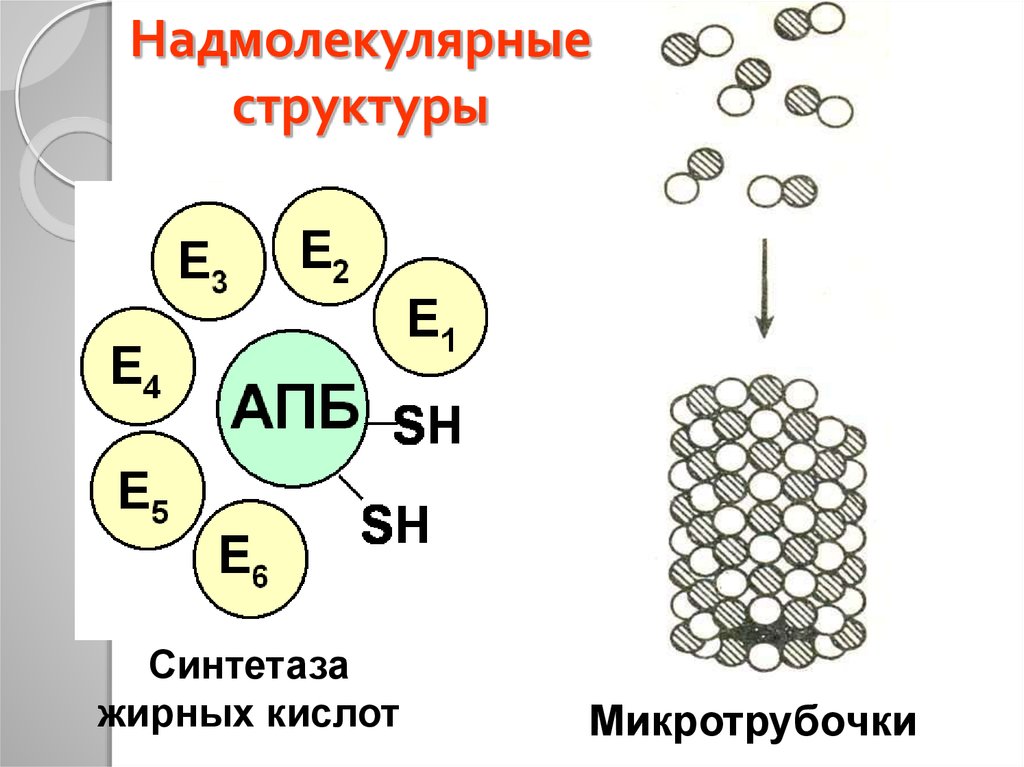
39. Надмолекулярные структуры
Синтетазажирных кислот
Микротрубочки
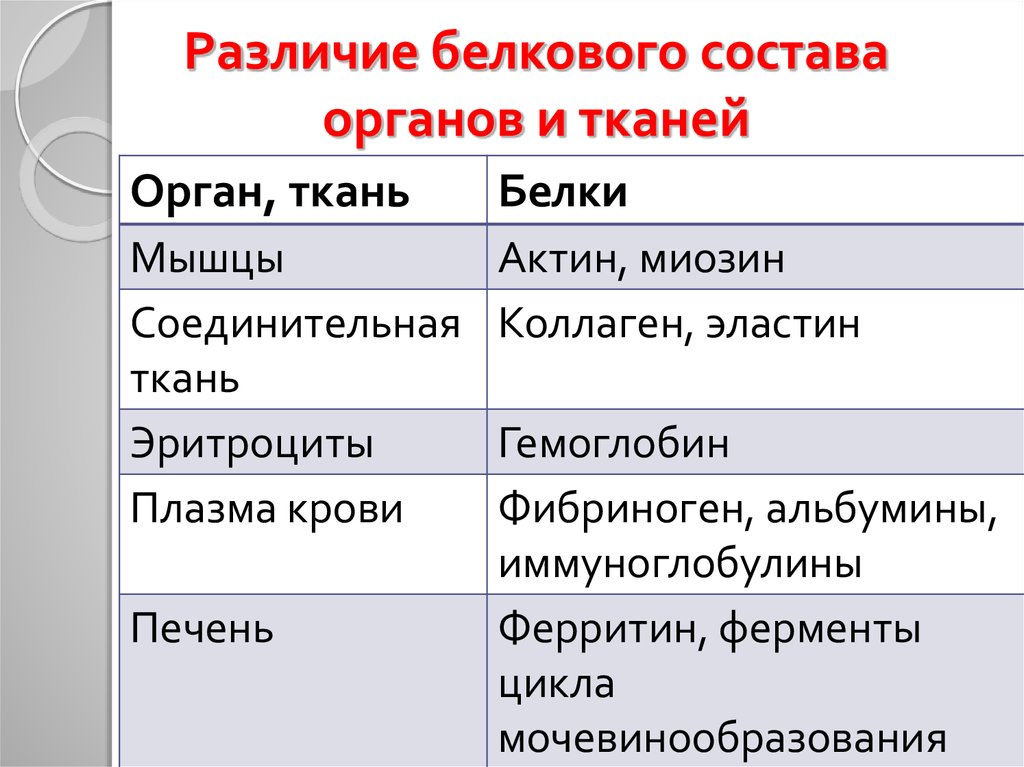
40. Различие белкового состава органов и тканей
Орган, тканьБелки
Мышцы
Соединительная
ткань
Эритроциты
Плазма крови
Актин, миозин
Коллаген, эластин
Печень
Гемоглобин
Фибриноген, альбумины,
иммуноглобулины
Ферритин, ферменты
цикла
мочевинообразования
41. Типы классификации белков
По форме
молекулы.
По физикохимическим
свойствам.
По
происхождению.
По
42. Классификация по функциям
Каталитические
(ферменты)
Регуляторные
(гормоны)
Транспортные (Нb,
трансферрин)
Защитные
(Ig,
шапероны)
Сократительные
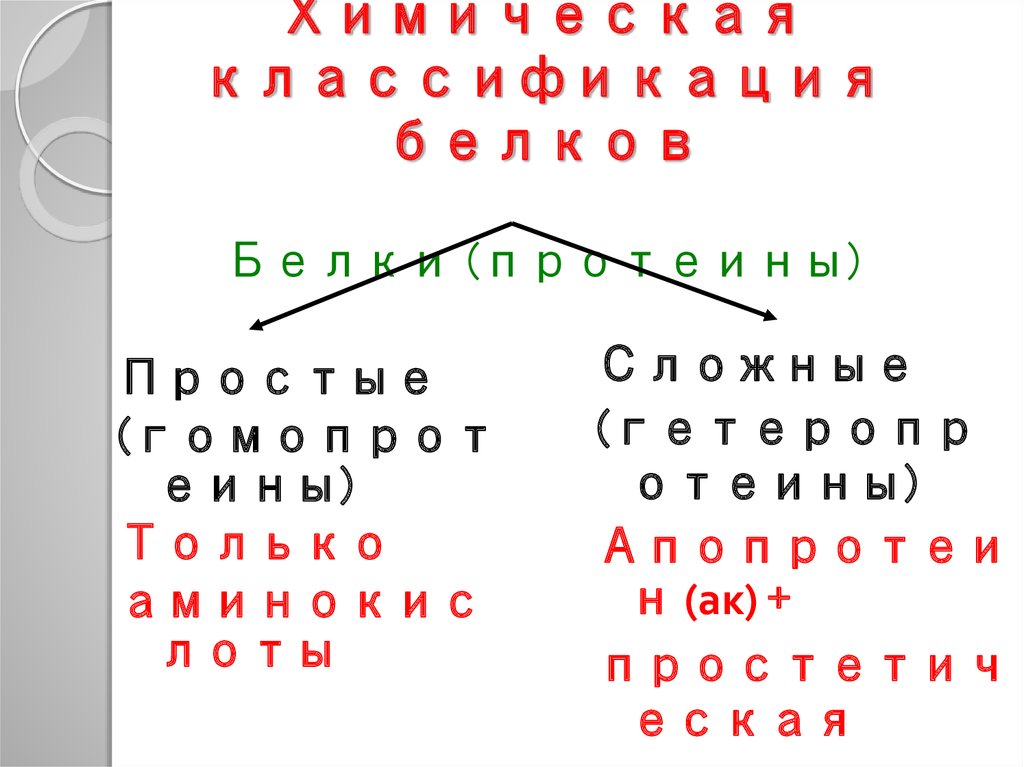
43. Химическая классификация белков п Белки (протеины)
Простые(гомопрот
еины)
Только
аминокис
лоты
Сложные
(гетеропр
отеины)
Апопротеи
н (ак) +
простетич
еская
44.
Химическая классифПростые:
Сложные:
Альбумины;• Нуклеопро
Глобулины; теины;
Проламины;• Хромопрот
Глютелины; еины;
Протамины;• Гликопрот
еины;
Гистоны;
• Фосфопрот
Склеропроте
еины;
ины
• Липопроте
45. Классификация белков по семействам
Сериновыепротеиназы
Шапероны
Иммуноглобулины
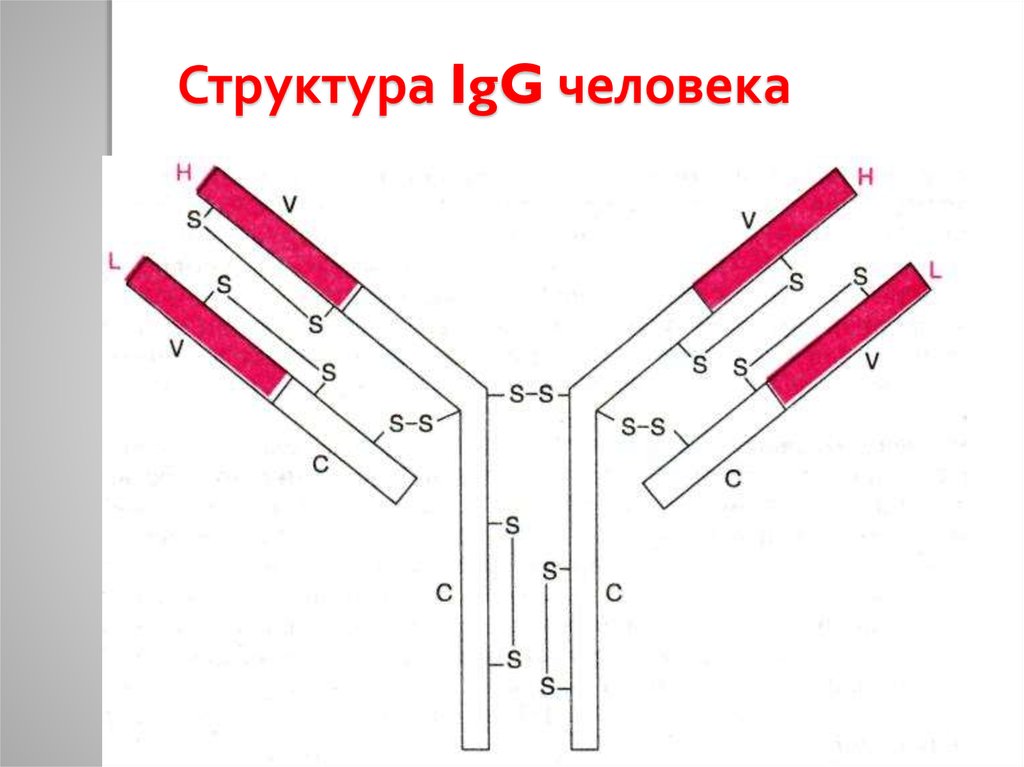
46. Структура IgG человека
47.
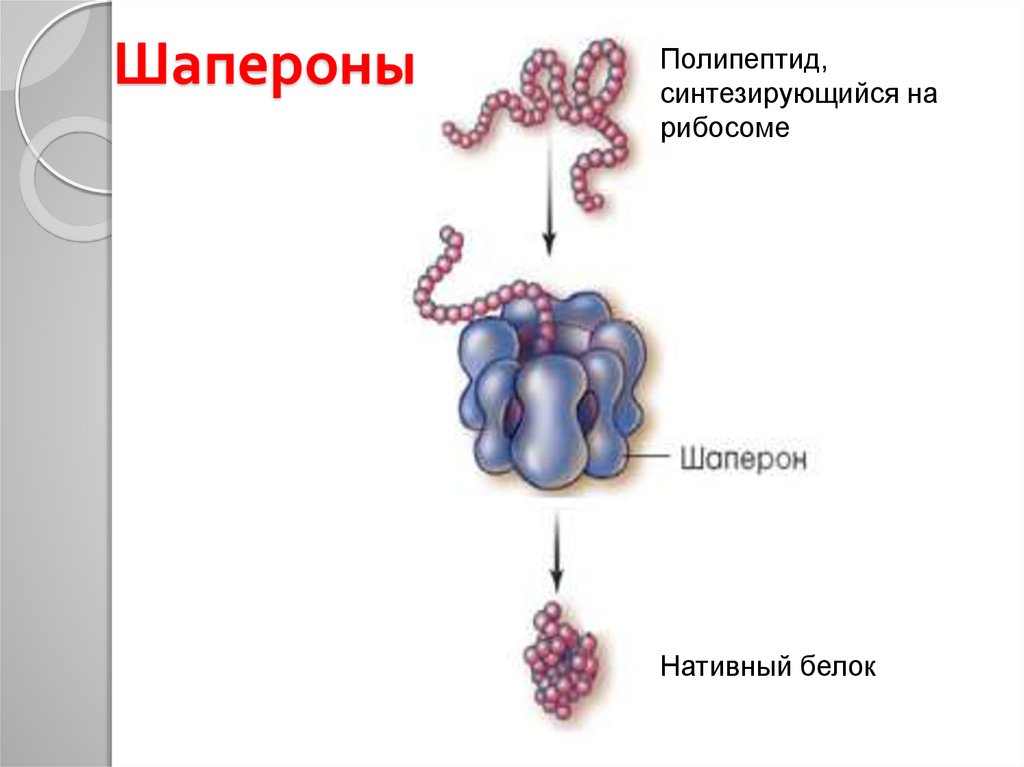
48. Шапероны
Полипептид,синтезирующийся на
рибосоме
Нативный белок
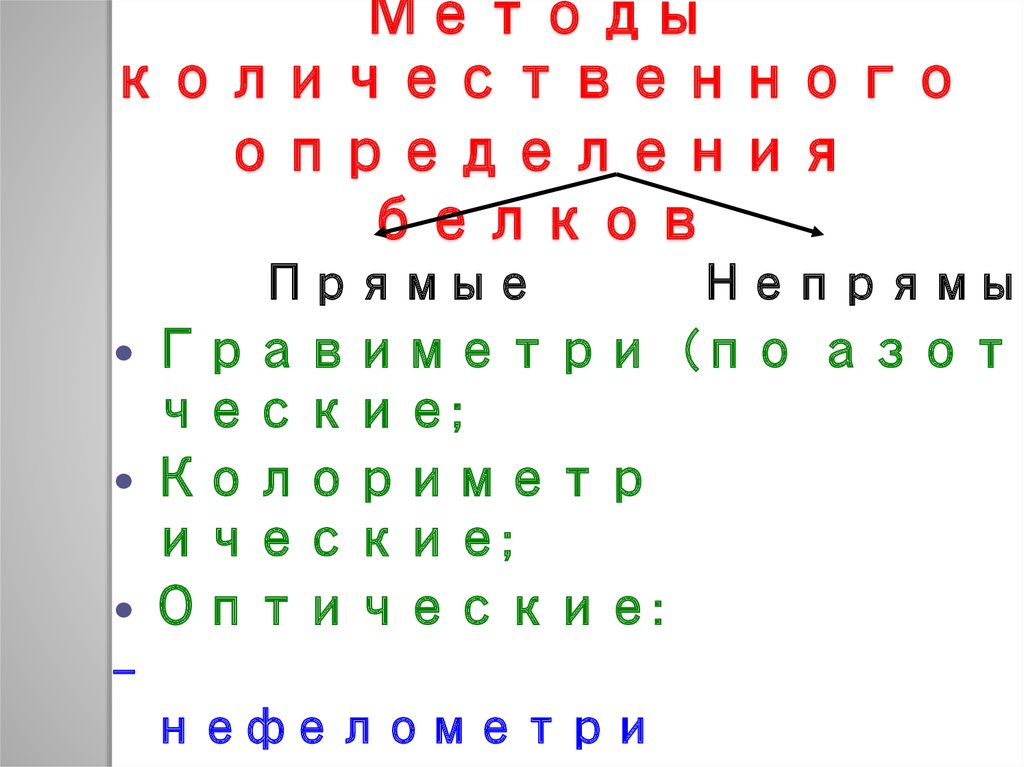
49. Методы количественного определения белков
ПрямыеНепрямые
Гравиметри (по азоту
ческие;
Колориметр
ические;
Оптические:
нефелометри
50. Методы выделения и очистки белков
Гомогенизация;
Экстракция
;
Высаливани
е;
Диализ;
























 Биология
Биология








