Похожие презентации:
Біологічно важливі оксигеновмісні сполуки
1.
2021Лекція № 3
Біологічно важливі
оксигеновмісні сполуки
2.
1. Класифікація оксигеновмісних органічних сполук.2. Спирти, феноли, аміни, їх характеристика.
Застосування в медицині та фізіологічна дія на
організм.
3. Альдегіди та кетони, Будова, властивості. Медикобіологічне значення.
Будова та властивості фенолів та амінів (ПСРС)
3.
Гідроксосполуки –похідні вуглеводнів, у молекулах яких один або декілька атомів Гідрогену
заміщені на групу– ОН. До цієї групи належать спирти і феноли.
Загальна формула гідроксосполук – ROH, для фенолів – ArOH.
Спирти-це органічні речовини, в молекулах яких вуглеводневий
радикал сполучений з однією або кількома функціональними групами -ОН‾.
За кількістю цих груп розрізняють спирти одноатомні – СnН2n+1ОН – загальна формула, двохатомні,
трьохатомні
Гомологічний ряд насичених одноатомних спиртів
СН3ОН - метанол, метиловий (деревний) спирт
С2Н5ОН – етанол, етиловий
С3Н7ОН – пропанол, пропіловий
С4Н9ОН – бутанол, бутиловий
С5Н11ОН – пентанол, аміловий (пентиловий)
СН2ОН- СН2ОН – етиленгліколь, етан-1,2-діол- двохатомний
СН2ОН-СНОН-СН2ОН-гліцерин, гліцерол, пропан-1,2,3-триолтрьохатомний
4.
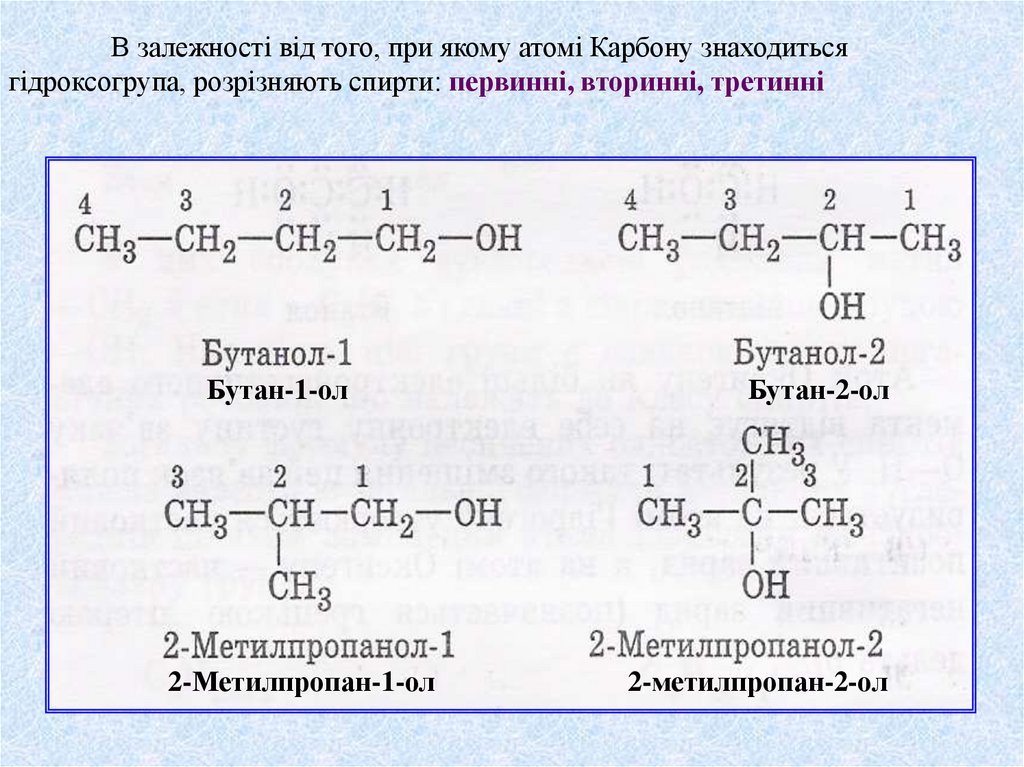
В залежності від того, при якому атомі Карбону знаходитьсягідроксогрупа, розрізняють спирти: первинні, вторинні, третинні
Бутан-1-ол
2-Метилпропан-1-ол
Бутан-2-ол
2-метилпропан-2-ол
5.
1. Ізомерія карбонового ланцюга.2. Ізомерія положення функціональної групи.
1
СН3-СН2 -СН2-ОН - пропіловий спирт, пропан-1-ол
2
СН3-СН(ОН) -СН3 - пропан-2-ол
3. Ізомерія з етерами.
С 2 Н6 О
СН3-О -СН3
Диметиловий етер
СН3-СН2 -ОН
Етиловий спирт
6.
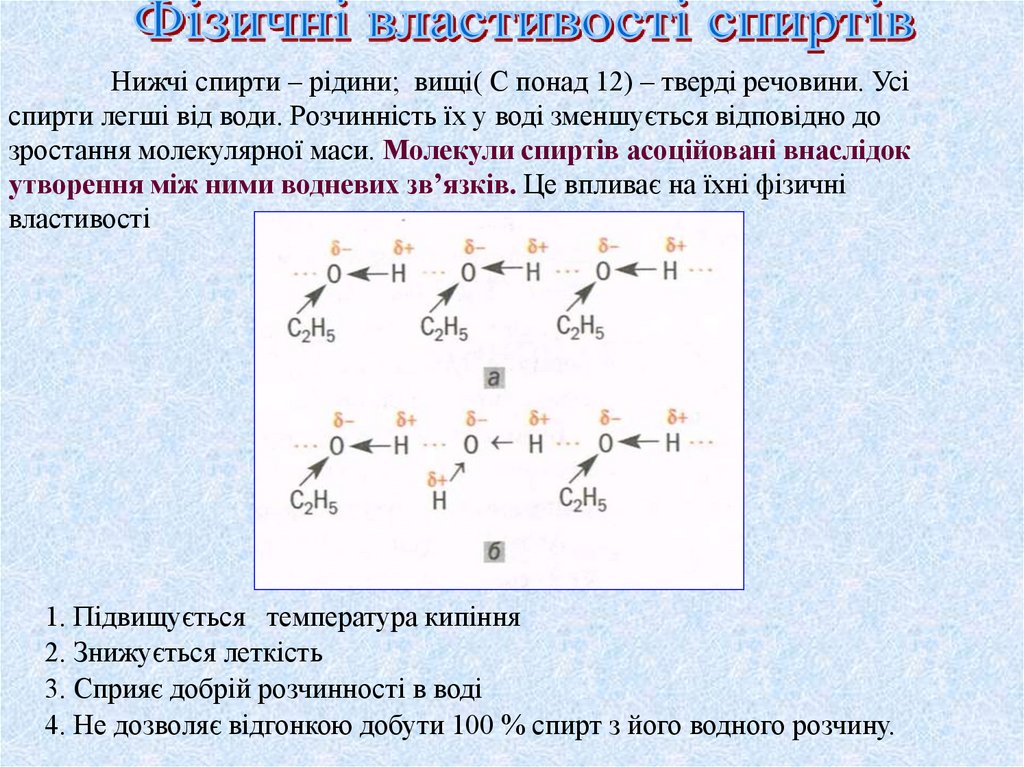
Нижчі спирти – рідини; вищі( С понад 12) – тверді речовини. Усіспирти легші від води. Розчинність їх у воді зменшується відповідно до
зростання молекулярної маси. Молекули спиртів асоційовані внаслідок
утворення між ними водневих зв’язків. Це впливає на їхні фізичні
властивості
1. Підвищується температура кипіння
2. Знижується леткість
3. Сприяє добрій розчинності в воді
4. Не дозволяє відгонкою добути 100 % спирт з його водного розчину.
7.
Хімічні властивості спиртівнатрій етанолят, етилат
8.
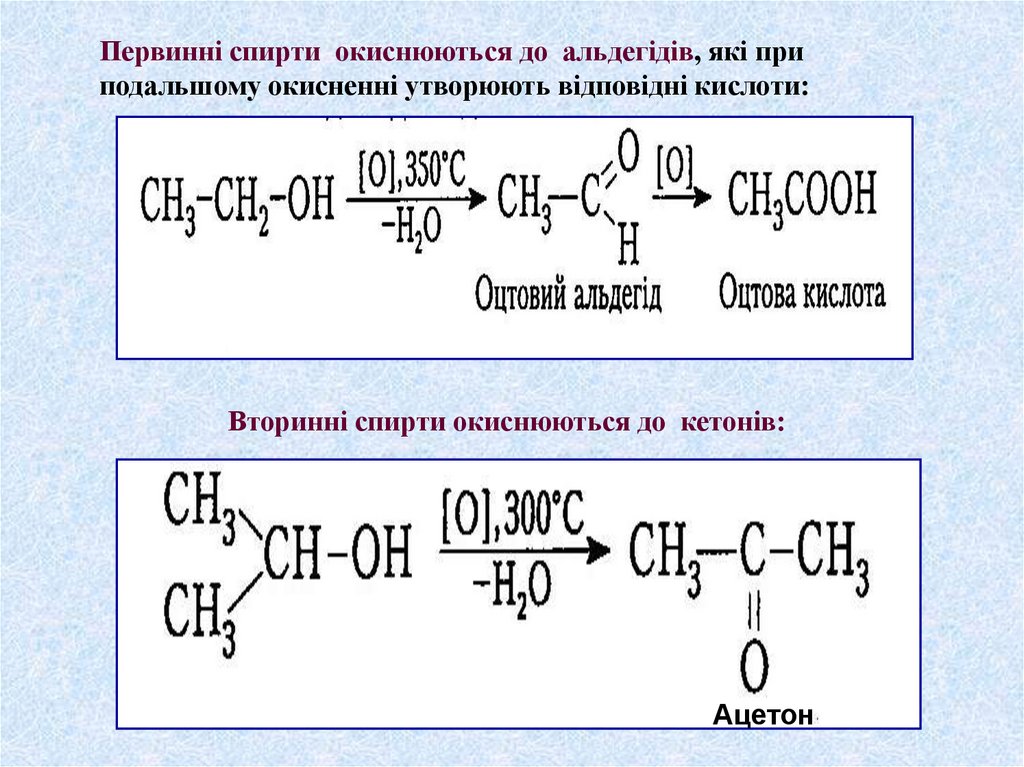
Первинні спирти окиснюються до альдегідів, які приподальшому окисненні утворюють відповідні кислоти:
Вторинні спирти окиснюються до кетонів:
Ацетон
9.
- як зовнішній антисептичний та подразнюючий засіб для обтирань, компресів;- в різних розведеннях для виготовлення настоянок, екстрактів і лікарських
форм
для зовнішнього використання;
- при зовнішньому нанесенні він знезаражує і підсушує, тому його
застосовують
для оброблення рук хірургів й операційного поля та інструментів;
- як фізичний охолоджувач при високій температурі тіла(розтирання);
- є добрим розчинником багатьох сполук;
- виявляє як місцеву, так і загальну – снодійну, знеболювальну, наркозну,
антидотну(при отруєнні пропіленгліколем та метиловим спиртом)дію.
У медицині використовують етанол різної концентрації, зокрема, 96%, 70%.
Найкращі антисептичні властивості має 70% етанол. Спирт високого очищення
в концентрації до 33% використовується для приготування в/в
введень(протишокові рідини).
У людей, які постійно вживають спиртні напої, виникає хронічне
захворювання алкоголізм. Його наслідками є підвищений тиск, ураження
нервової та ССС,
печінки, підшлункової залози. Людина деградує як особистість.
Людина заганяє в рота ворога, який вкрадає її розум, а потім сама з
радістю й веселощами перетворюється на худобу.
Вільям
Шекспір
10.
Метанол-сильна отрута. У малих кількостях (10 мл) спричиняє сліпоту, 25 мл-спричиняє смерть. Tкип. - 650 С. (деревний спирт).
Етанол - Tкип. -78,30 С. За дією на організм є наркотиком.
Зловживання напоями, що містять етанол, викликає захворювання –
алкоголізм. Летальна доза етанолу для людини близько 300г.
Алкогольний синдром плоду.
Ризик народження хворої дитини зростає з кожною наступною вагітністю
11.
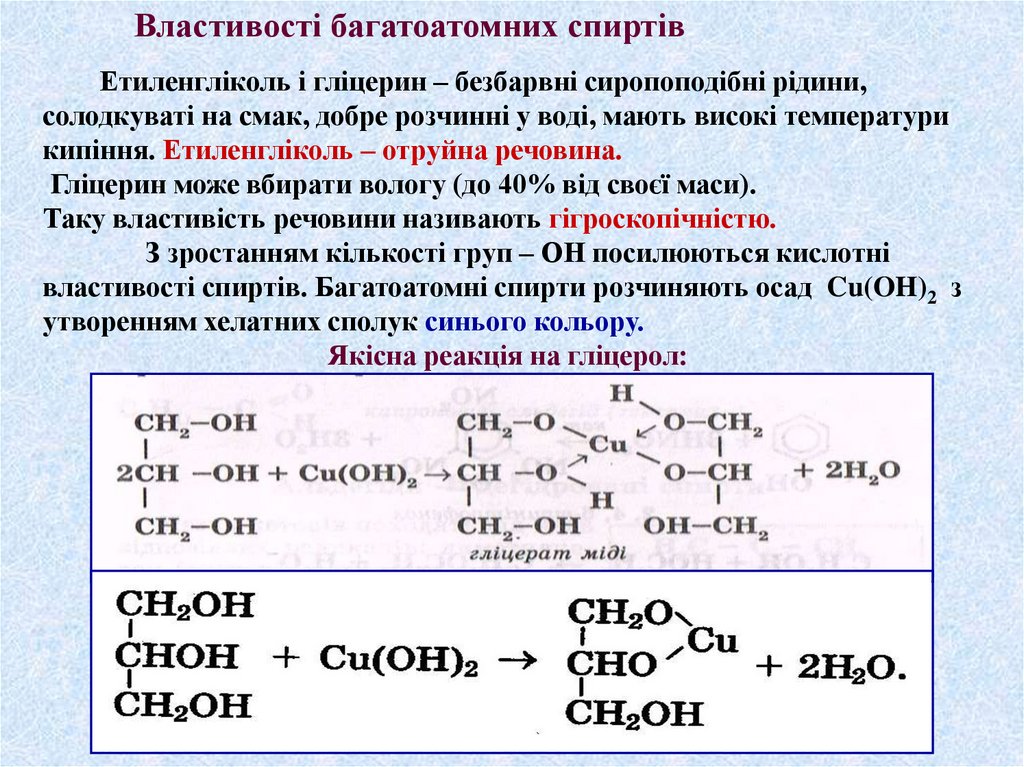
Властивості багатоатомних спиртівЕтиленгліколь і гліцерин – безбарвні сиропоподібні рідини,
солодкуваті на смак, добре розчинні у воді, мають високі температури
кипіння. Етиленгліколь – отруйна речовина.
Гліцерин може вбирати вологу (до 40% від своєї маси).
Таку властивість речовини називають гігроскопічністю.
З зростанням кількості груп – ОН посилюються кислотні
властивості спиртів. Багатоатомні спирти розчиняють осад Cu(OH)2 з
утворенням хелатних сполук синього кольору.
Якісна реакція на гліцерол:
12.
Застосування гліцеринуУ косметичних засобах
У лікарських препаратах
Гліцерин використовують в медицині для виготовлення мазей, які
пом’якшують шкіру. Його використовують для одержання нітрогліцерину і
динаміту. Нітрогліцерин у великих дозах отруйний.
Капсули з розчином
нітрогліцерину;
1% спиртовий р-н судинорозширюючий
засіб .
13.
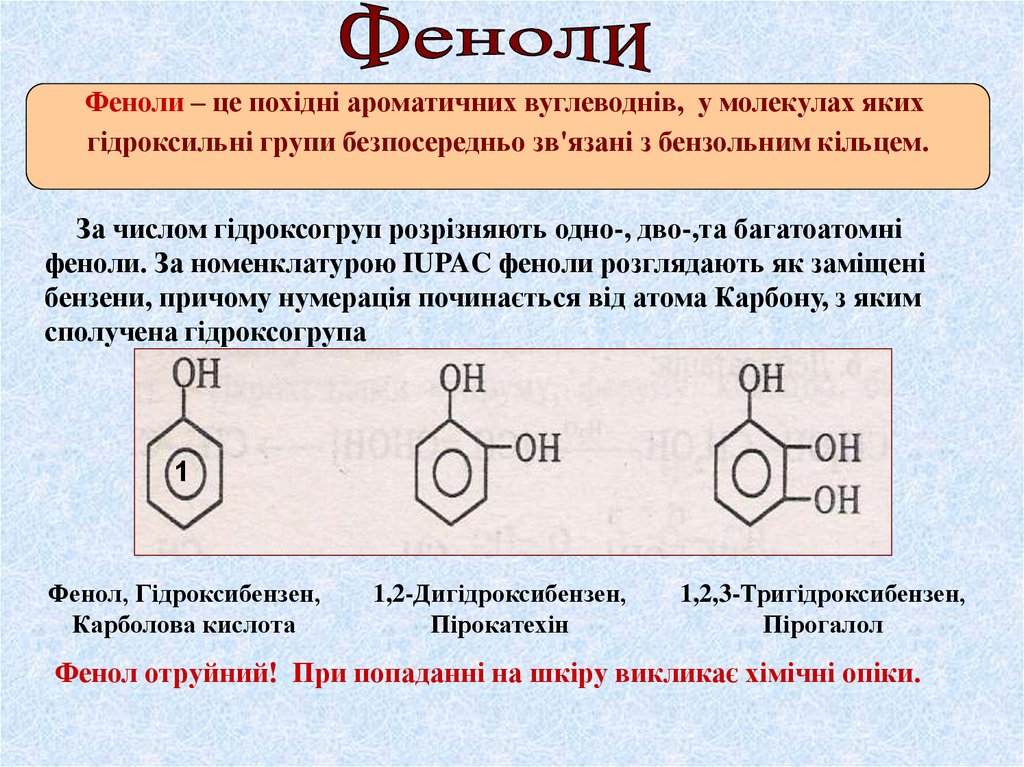
Феноли – це похідні ароматичних вуглеводнів, у молекулах якихгідроксильні групи безпосередньо зв'язані з бензольним кільцем.
За числом гідроксогруп розрізняють одно-, дво-,та багатоатомні
феноли. За номенклатурою IUPAC феноли розглядають як заміщені
бензени, причому нумерація починається від атома Карбону, з яким
сполучена гідроксогрупа
1
Фенол, Гідроксибензен,
Карболова кислота
1,2-Дигідроксибензен,
Пірокатехін
1,2,3-Тригідроксибензен,
Пірогалол
Фенол отруйний! При попаданні на шкіру викликає хімічні опіки.
14.
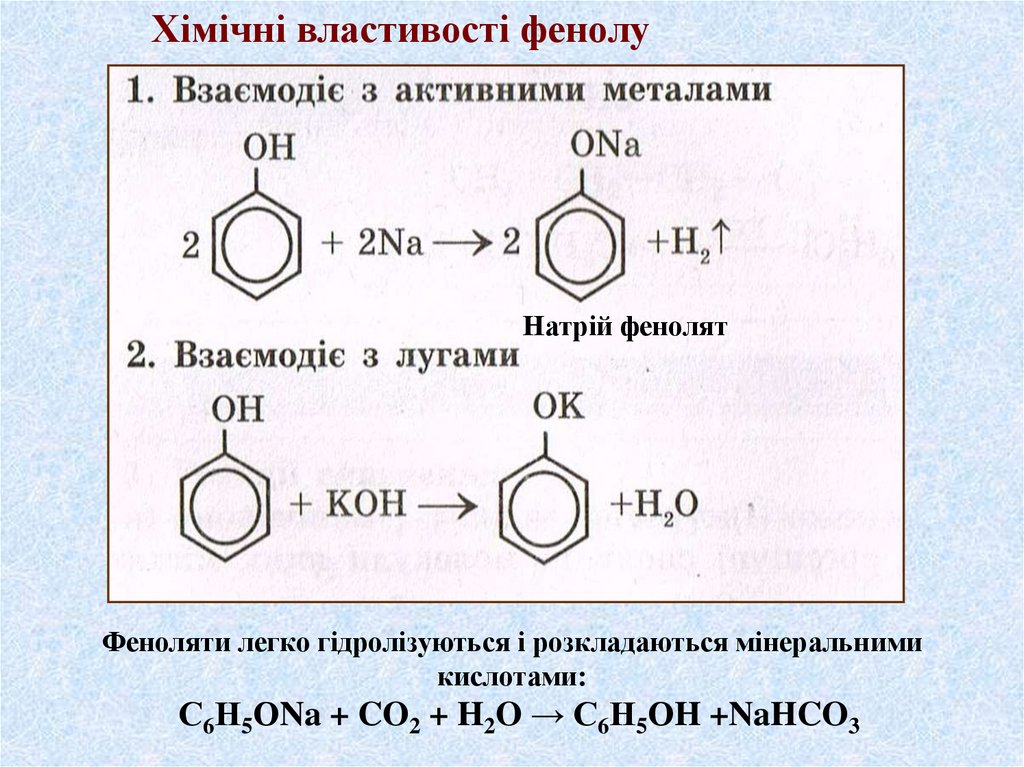
Хімічні властивості фенолуНатрій фенолят
Феноляти легко гідролізуються і розкладаються мінеральними
кислотами:
С6Н5ОNa + CO2 + H2O → С6Н5ОH +NaHCO3
15.
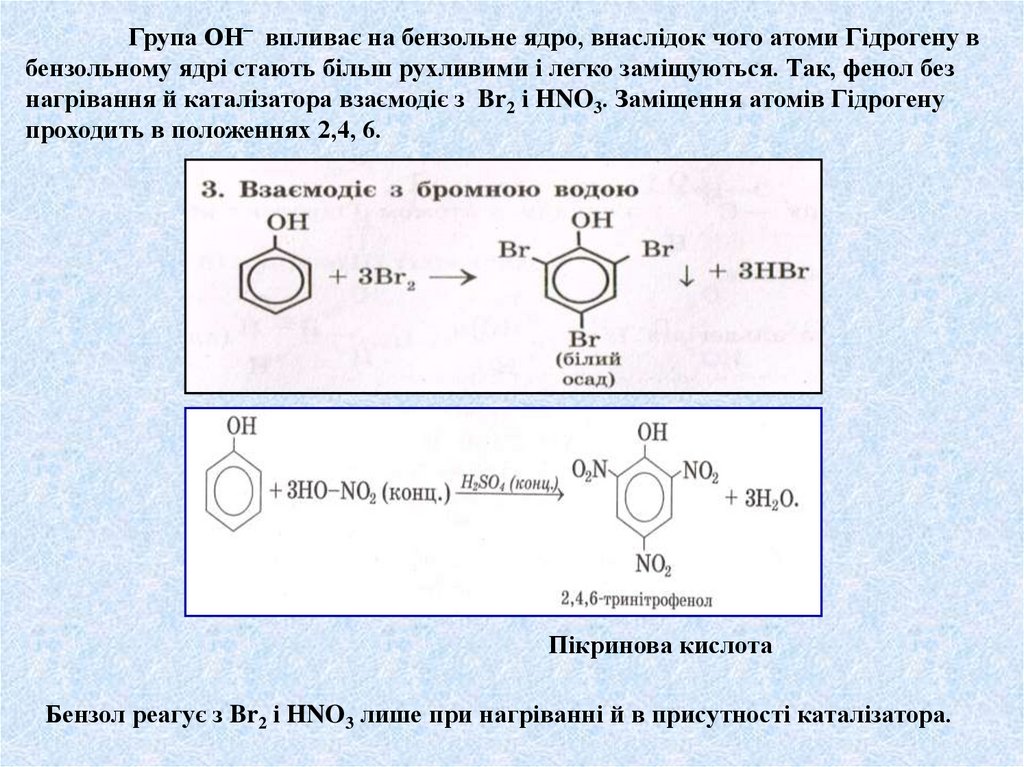
Група ОН‾ впливає на бензольне ядро, внаслідок чого атоми Гідрогену вбензольному ядрі стають більш рухливими і легко заміщуються. Так, фенол без
нагрівання й каталізатора взаємодіє з Br2 і HNO3. Заміщення атомів Гідрогену
проходить в положеннях 2,4, 6.
Пікринова кислота
Бензол реагує з Br2 і HNO3 лише при нагріванні й в присутності каталізатора.
16.
Якісні реакції на феноли:Спрощене рівняння реакції:
3С6Н5ОH +FeCl3 →(C6H5O)3Fe + 3HCl
Ферум(ІІІ)фенолят
При взаємодії з ферум(lll)хлоридом FeCl3 феноли
утворюють комплексні сполуки- феноляти Феруму, які
мають характерне забарвлення синіх, синьо-зелених та
фіалкових відтінків, залежно від конкретного фенолу.
17.
1. Фенол- вихідна речовина для виробництва лікарськихзасобів, барвників, фенол-формальдегідних пластичних мас,
капрону, вибухових речовин.
2. Фенол має антисептичні властивості. 5% р-н фенолу
використовують для знезаражування приміщень,
хірургічних інструментів; його додають до деяких сортів
мила; протравлюють деревину, щоб запобігти її гниттю.
3. Тринітрофенол(пікринова к-та) використовується для
добування вибухових речовин. Його використовують також
при лікуванні опіків.
18.
– це похідні амоніаку (NH3), в молекулі якогоодин, два або три атоми Гідрогену заміщені на
вуглеводневий радикал
За числом заміщених атомів Гідрогену:
первинні CH3 – NH2 метиламін, амінометан
вторинні CH3 – NH – CH3 диметиламін
третинні CH3 – N – CH3
│
CH3 триметиламін
C6H5 – NH2- феніламін, анілін
19.
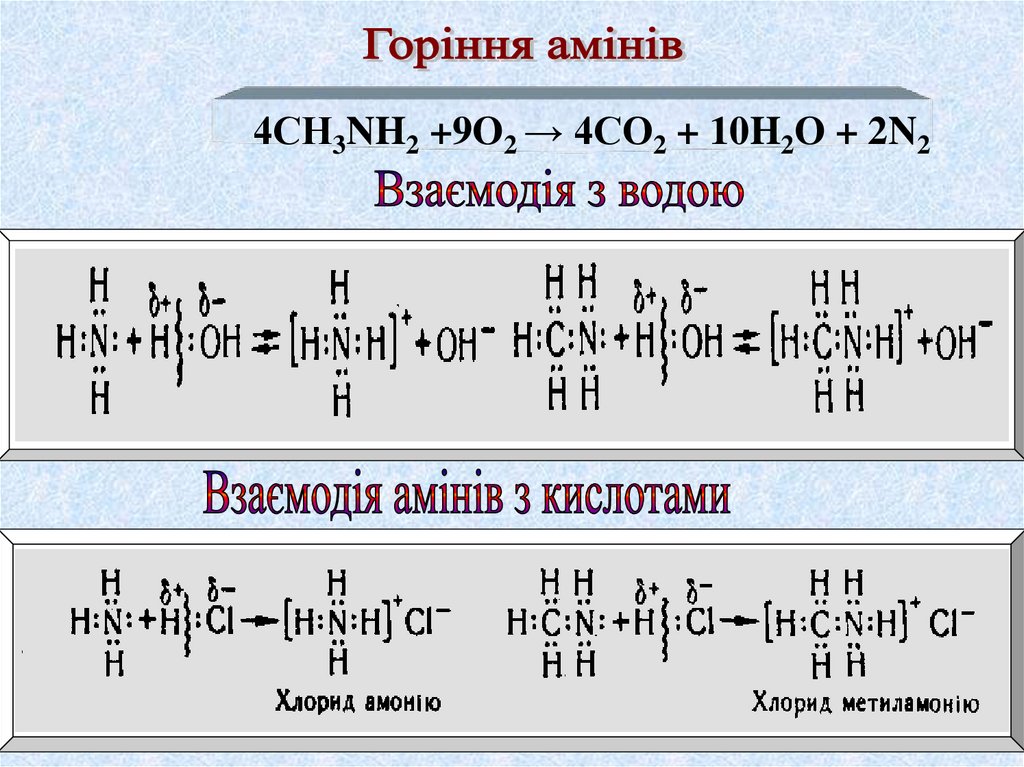
4СН3NH2 +9O2 → 4CO2 + 10H2O + 2N220.
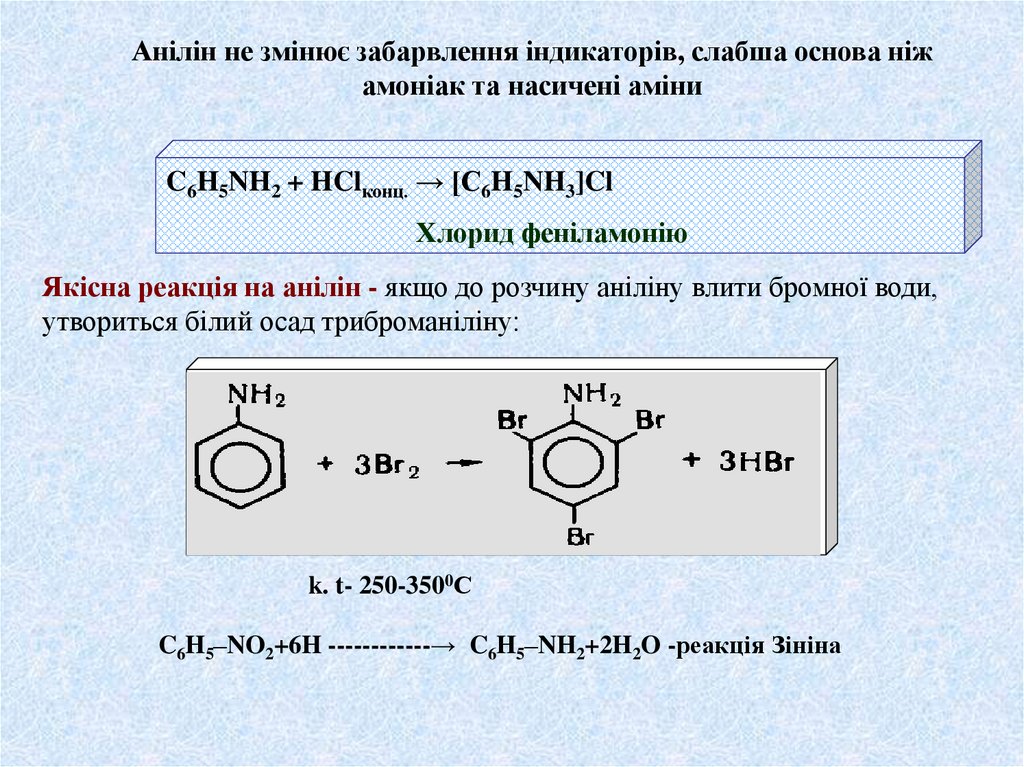
Анілін не змінює забарвлення індикаторів, слабша основа ніжамоніак та насичені аміни
C6H5NH2 + HClконц. → [C6H5NH3]Cl
Хлорид феніламонію
Якісна реакція на анілін - якщо до розчину аніліну влити бромної води,
утвориться білий осад триброманіліну:
k. t- 250-3500С
C6H5–NO2+6H ------------→ C6H5–NH2+2H2O -реакція Зініна
21.
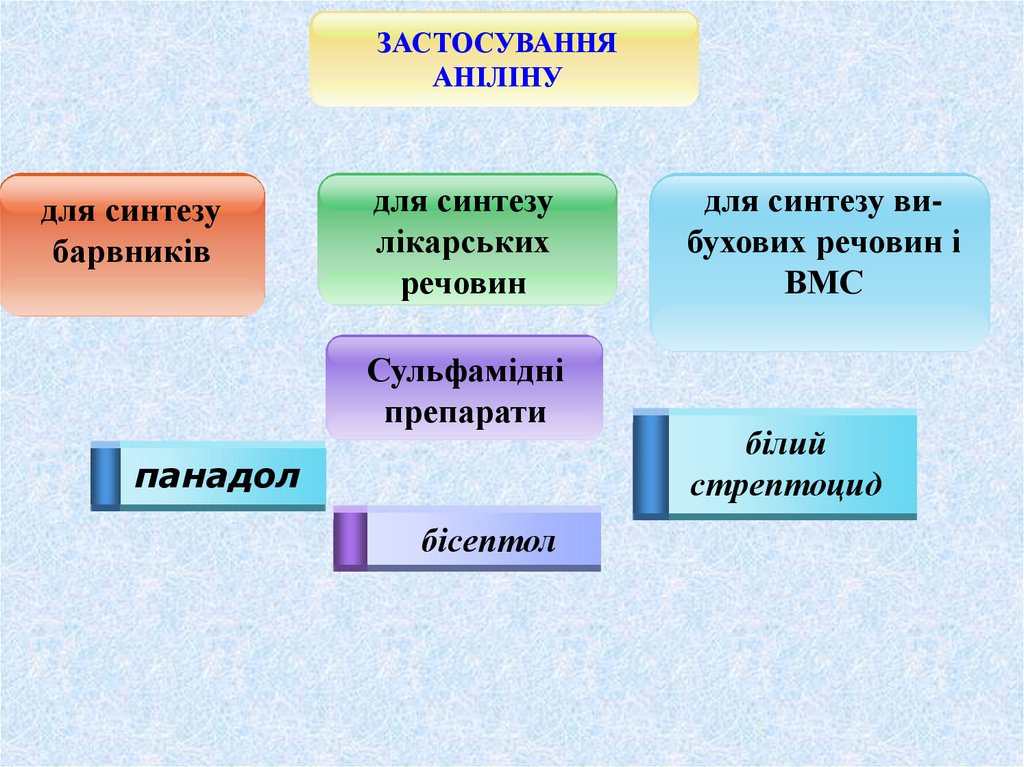
ЗАСТОСУВАННЯАНІЛІНУ
для синтезу
барвників
для синтезу
лікарських
речовин
Сульфамідні
препарати
панадол
бісептол
для синтезу вибухових речовин і
ВМС
білий
стрептоцид
22.
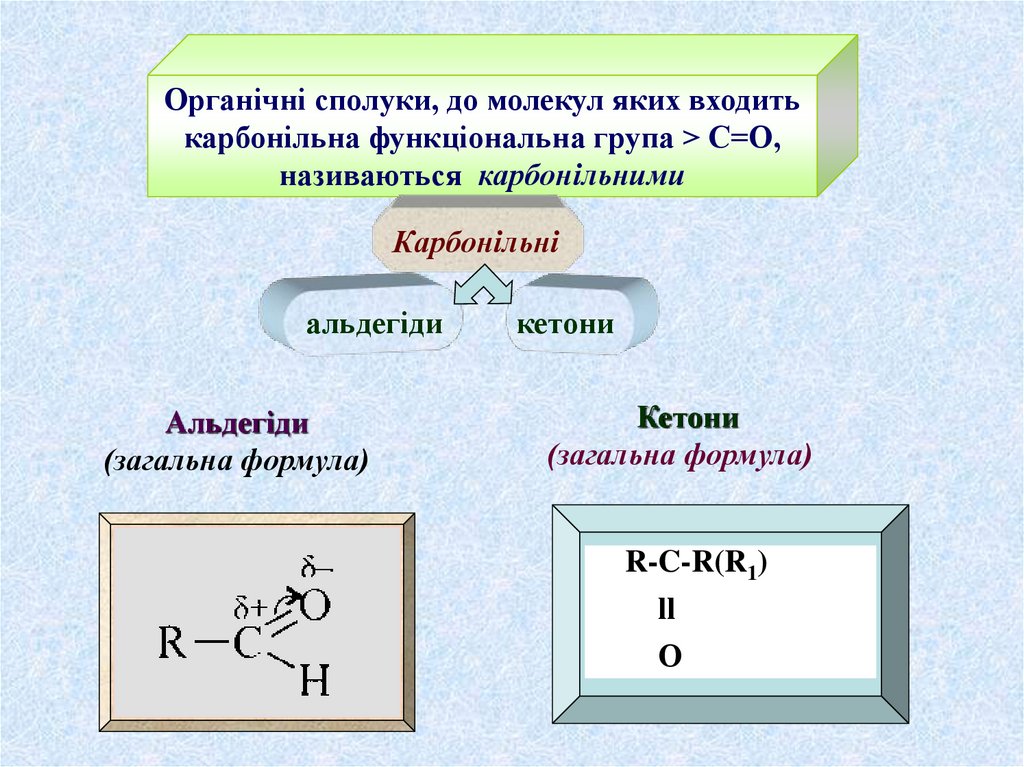
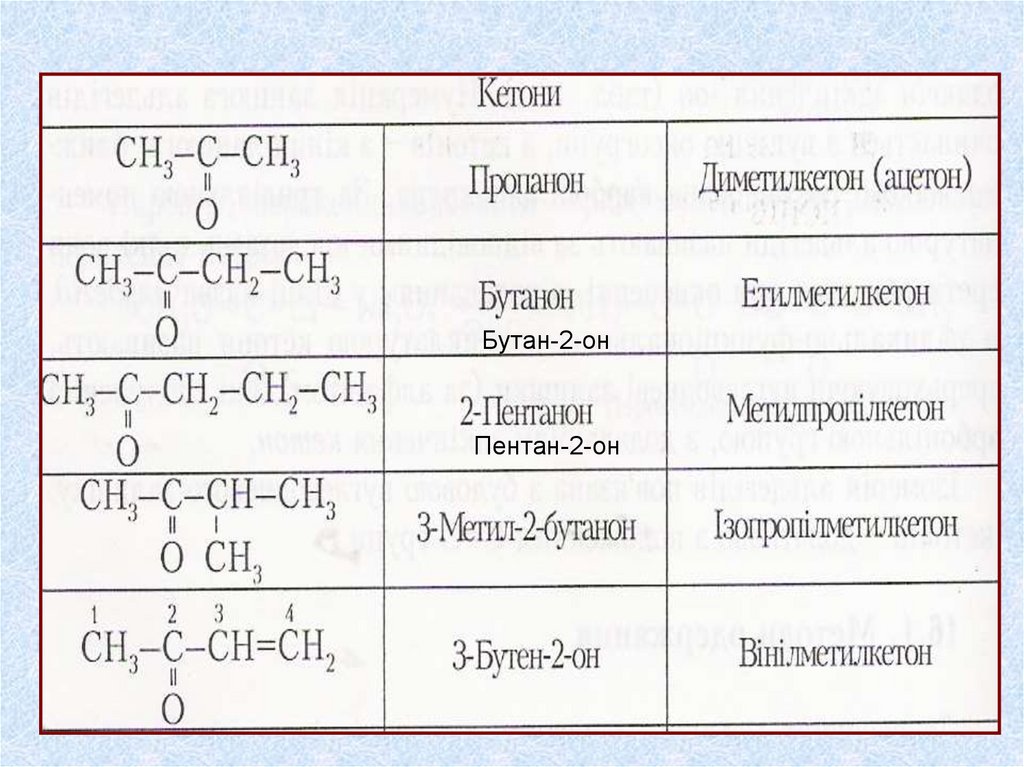
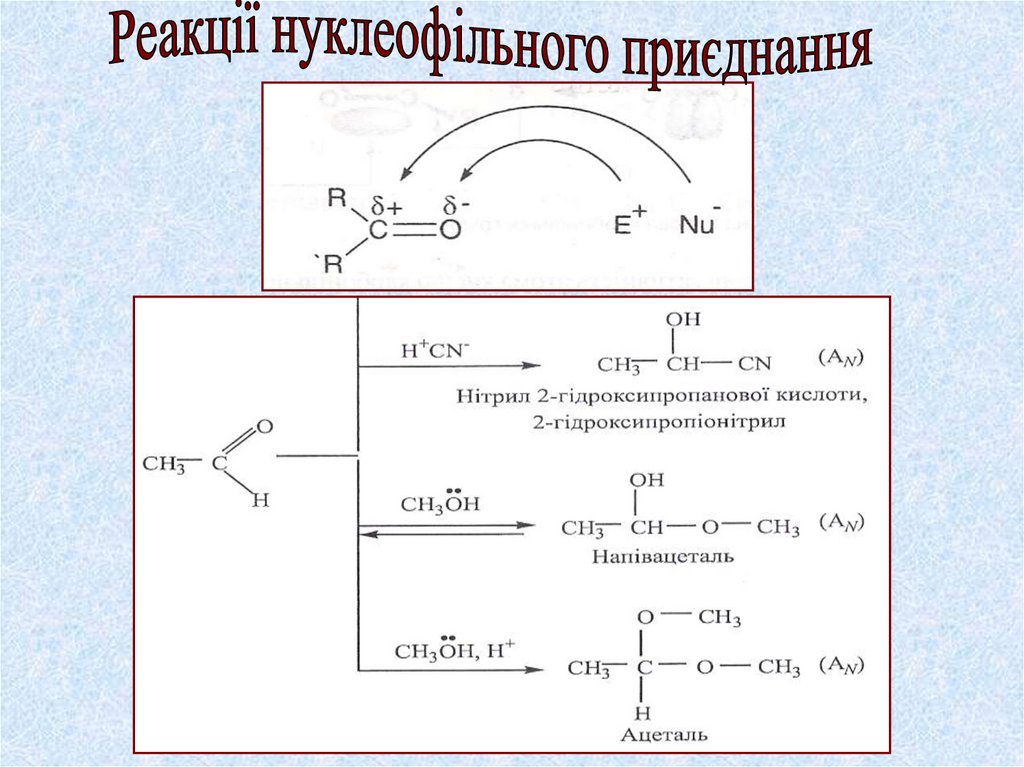
Органічні сполуки, до молекул яких входитькарбонільна функціональна група > С=О,
називаються карбонільними
Карбонільні
альдегіди
Альдегіди
(загальна формула)
кетони
Кетони
(загальна формула)
R-C-R(R1)
ll
О
23.
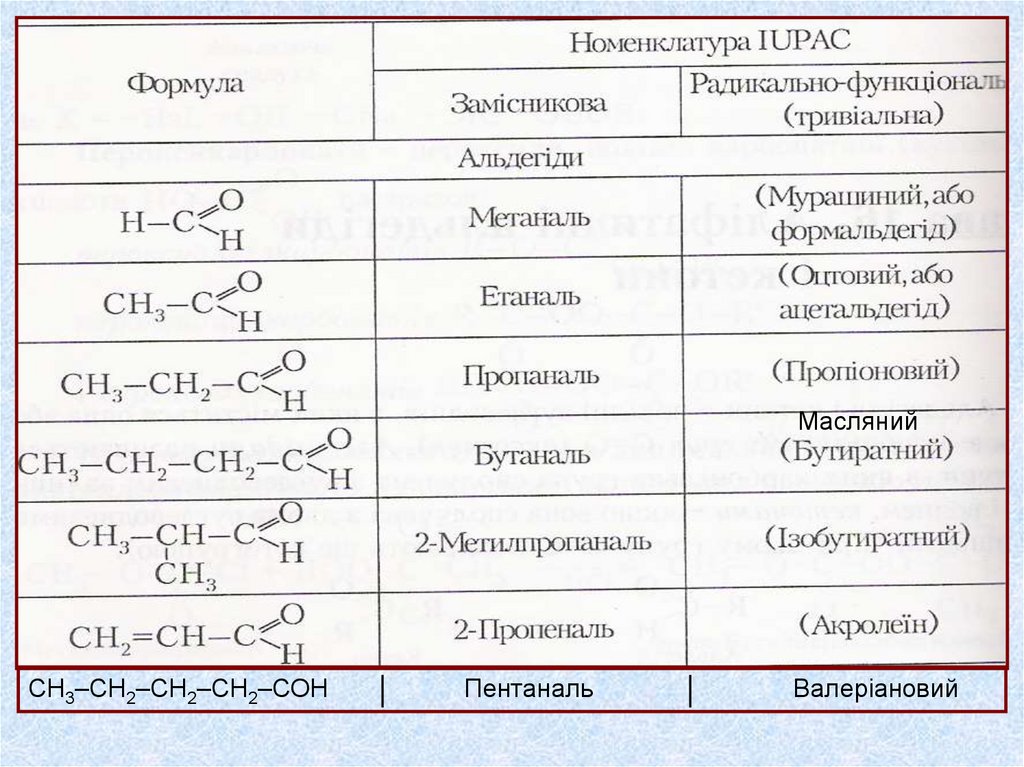
МаслянийСН3–СН2–СН2–СН2–СОН
Пентаналь
Валеріановий
24.
Бутан-2-онПентан-2-он
25.
26.
При відновленні альдегідів утворюються первинні спирти;при відновленні кетонів – вторинні спирти
В біохімічних системах відновлення карбонільних сполук з утворенням
первинних і вторинних спиртів каталізується ферментами дегідрогеназами,
а донорами атомів Карбону є відновлені форми спеціальних коферментів
НАД+ та НАДФ +.
Реакції відбуваються за схемою:
НАД(Ф)Н+Н+ + R-СН=О→ НАД(Ф)+ + R-СН2 -ОН
27.
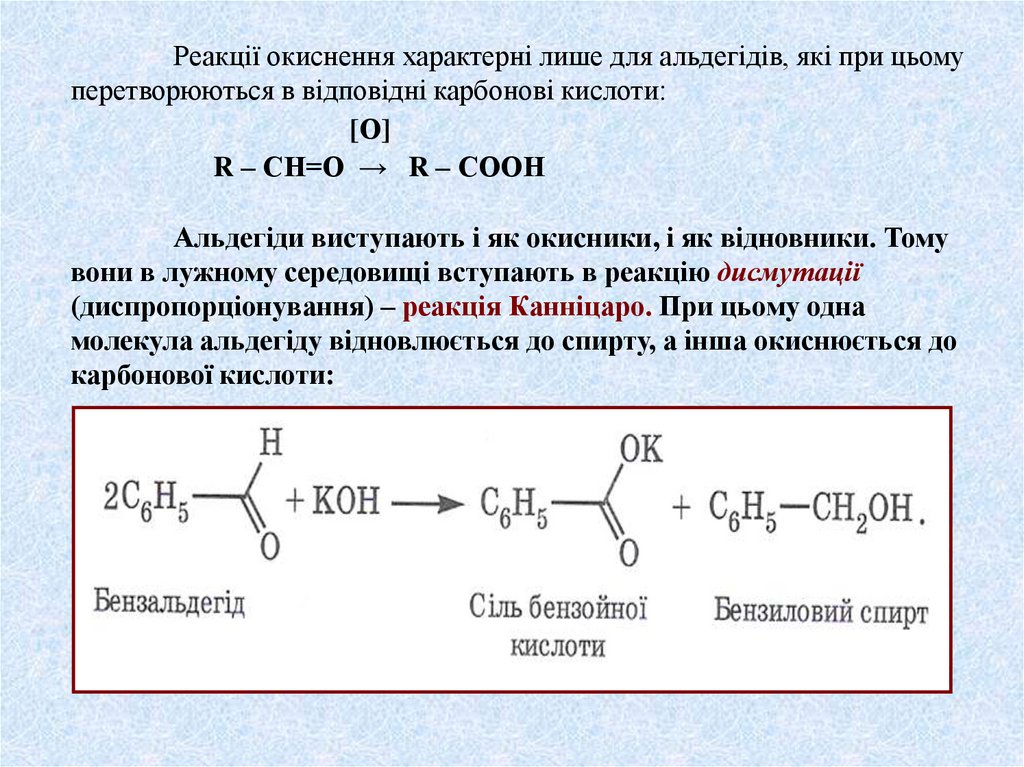
Реакції окиснення характерні лише для альдегідів, які при цьомуперетворюються в відповідні карбонові кислоти:
[О]
R – СН=О → R – СООН
Альдегіди виступають і як окисники, і як відновники. Тому
вони в лужному середовищі вступають в реакцію дисмутації
(диспропорціонування) – реакція Канніцаро. При цьому одна
молекула альдегіду відновлюється до спирту, а інша окиснюється до
карбонової кислоти:
28.
СН3–СОН+2[Ag(NH3)2]OH→СН3СОONН4+2Ag↓+3NH3+H2OСН3СОН+Ag2О→ СН3СООН + 2Ag↓
Реакція Толленса
СН3 –СОН + 2Cu(OH)2→ СН3 – СОOН + 2CuOH + H2O
2CuOH→Cu2O ↓+ H2O
Цегляно-червоний осад
Реакція Троммера
29.
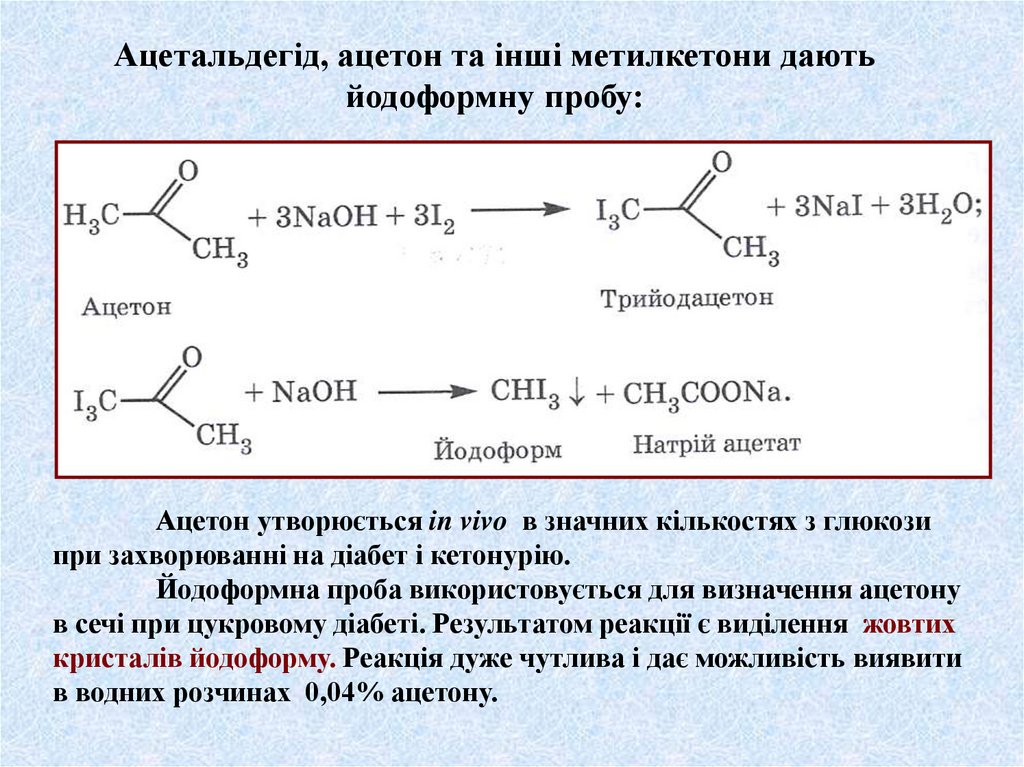
Ацетальдегід, ацетон та інші метилкетони даютьйодоформну пробу:
Ацетон утворюється in vivo в значних кількостях з глюкози
при захворюванні на діабет і кетонурію.
Йодоформна проба використовується для визначення ацетону
в сечі при цукровому діабеті. Результатом реакції є виділення жовтих
кристалів йодоформу. Реакція дуже чутлива і дає можливість виявити
в водних розчинах 0,04% ацетону.
30.
Альдегіди і кетони є важливими продуктамиметаболізму вуглеводів, вищих жирних кислот, АК.
Оксогрупа альдегідного і кетонного характеру є
важливим фрагментом багатьох лікарських засобів.
Формальдегід в невеликих кількостях
утворюється в організмі людини в процесі метаболізму
деяких лікарських засобів. 37- 40% розчин (формалін)
використовують як дезінфекційний засіб для
зберігання анатомічних препаратів.
31.
В.П.Музиченко Медична хімія с. 366-385.Карбонові кислоти та їхні похідні
32.
Скільки різних спиртів зображенотакими формулами:
33.
1. Яка з наведених формул відображає склад молекули фенолу:А СН3 -СО- СН2-СН3
В. СН3СОН
С. С2Н5ОН
D. С6Н5ОН
2. До якого класу органічних сполук належить речовина,
систематична назва якої пропанол?
А. Спирти
В. Альдегіди
С. Феноли
D. Кетони
3. Укажіть ознаку якісної реакції на багатоатомні спирти:
А. Знебарвлення розчину
В. Утворення білого драглистого осаду
С. Поява темно-синього забарвлення розчину
D. Утворення моркв′яно-червоного осаду
34.
4. При нітруванні фенолу розведеною нітратноюкислотою утвориться суміш:
А. м- і п-нітрофенолів
В. м- і о-нітрофенолів
С. о- і п-нітрофенолів
D. Тільки м-нітрофенол
Е. Тільки п-нітрофенол
5. У трьох пробірках міститься етанол, гліцерин
та розчин фенолу в бензолі.
За допомогою яких хімічних реакцій можна
розрізнити ці речовини?
?
35.
Здійснити перетворення:а) етан→етилен→ацетилен→ацетальдегід→ацетатна
кислота
б) метан→хлорометан→пропан→пропен→2-хлоропропан
Задача.
При каталітичному окисненні оцтового альдегіду масою 0,88г було
отримано оцтову кислоту масою 0,9г. Обчисліть та вкажіть масову частку
виходу продукту реакції від теоретично можливого(в відсотках).




















 Химия
Химия








