Похожие презентации:
Соли, их классификация и свойства
1.
Ильина И.В., руководитель РЦДОШ, учитель химии МБОУ «Средняяобщеобразовательная школа № 27 имени А.А. Дейнеки» города Курска
ilina.irina71@mail.ru
2.
Соли, их классификацияи свойства
"Ни один сосуд не вмещает больше своего
объёма,
кроме
сосуда
знаний
он постоянно расширяется"
(Арабская пословица)
3.
Цель и задачи урокаЦель: сформировать основные
номенклатуре, свойствах солей.
понятия
о
составе,
Задачи:
1. Сформировать понятие о солях и их классификации.
2. Изучить характерные химических свойствах солей.
3. Продолжить развивать умения определять валентность по
химическим формулам и составлять химические формулы
по валентности.
4. Закрепить навыки составления уравнений реакций,
характеризующие свойства оксидов, кислот,
оснований и солей.
4.
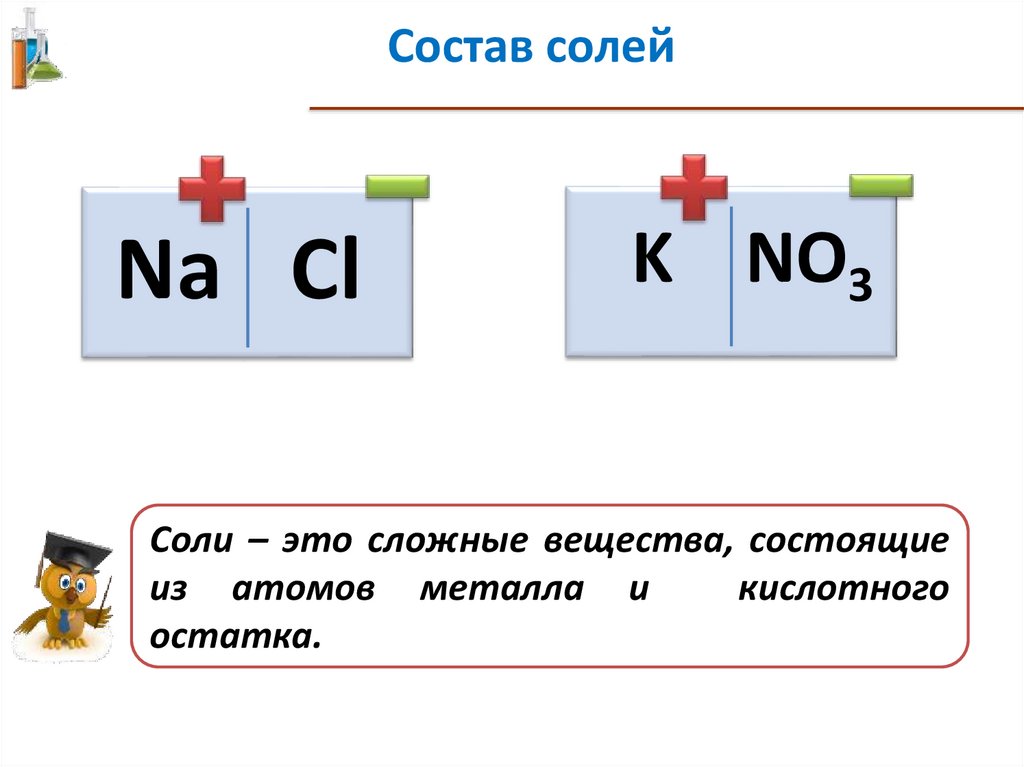
Состав солейNa Cl
K NO3
Соли – это сложные вещества, состоящие
из атомов металла и
кислотного
остатка.
5.
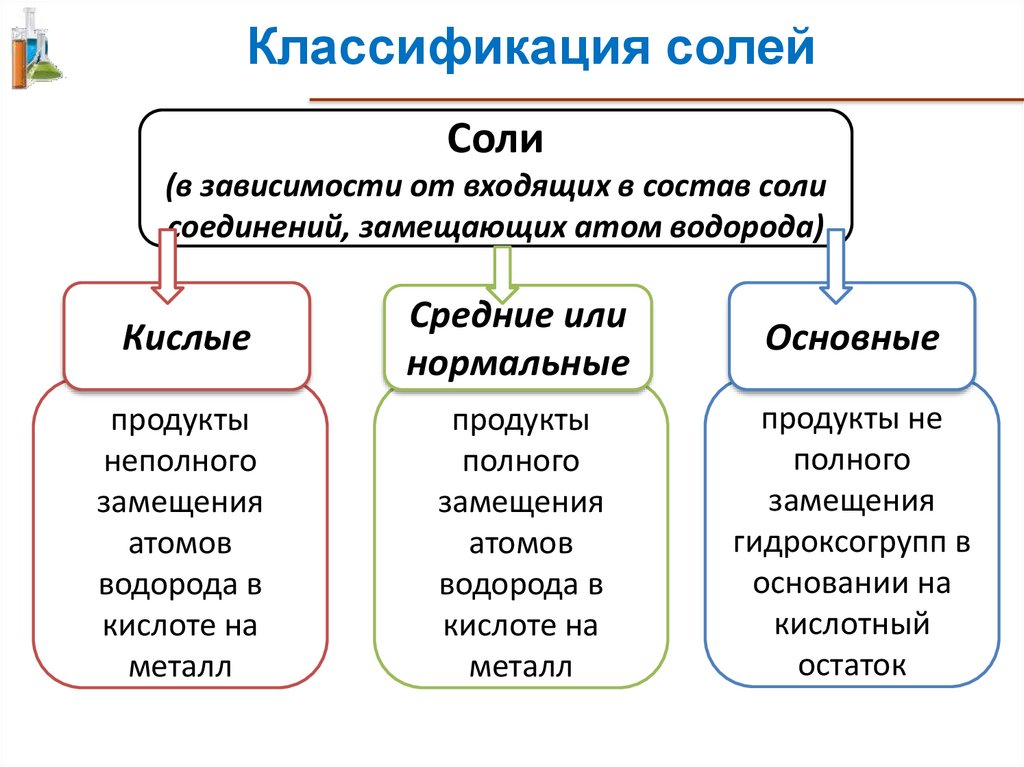
Классификация солейСоли
(в зависимости от входящих в состав соли
соединений, замещающих атом водорода)
Кислые
Средние или
нормальные
Основные
продукты
неполного
замещения
атомов
водорода в
кислоте на
металл
продукты
полного
замещения
атомов
водорода в
кислоте на
металл
продукты не
полного
замещения
гидроксогрупп в
основании на
кислотный
остаток
6.
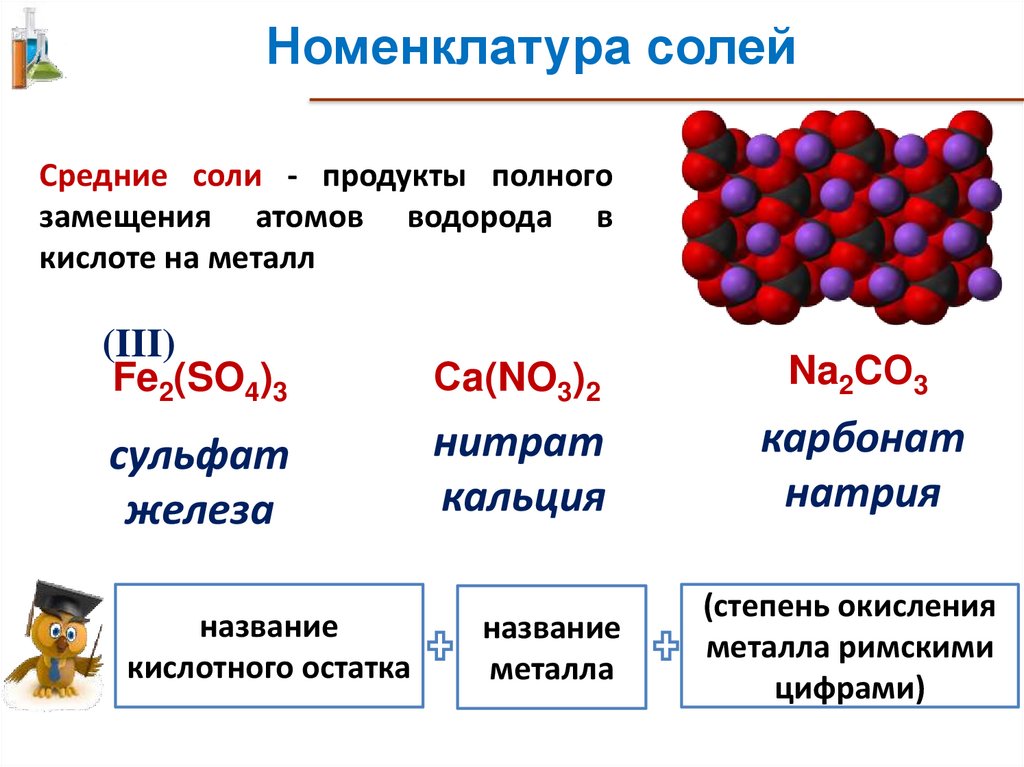
Номенклатура солейСредние соли - продукты полного
замещения атомов водорода в
кислоте на металл
(III)
Fe2(SO4)3
Сa(NO3)2
Na2CО3
сульфат
железа
нитрат
кальция
карбонат
натрия
название
кислотного остатка
название
металла
(степень окисления
металла римскими
цифрами)
7.
Номенклатура кислых солейКислые соли - продукты неполного
замещения атомов водорода в
кислоте на металл
KH2PO4
NaHSO4
К2HPО4
дигидрофосфат гидросульфат гидрофосфат
калия
натрия
калия
гидро
(или
дигидро)
название
кислотного
остатка
название
металла
(степень окисления
металла римскими
цифрами)
8.
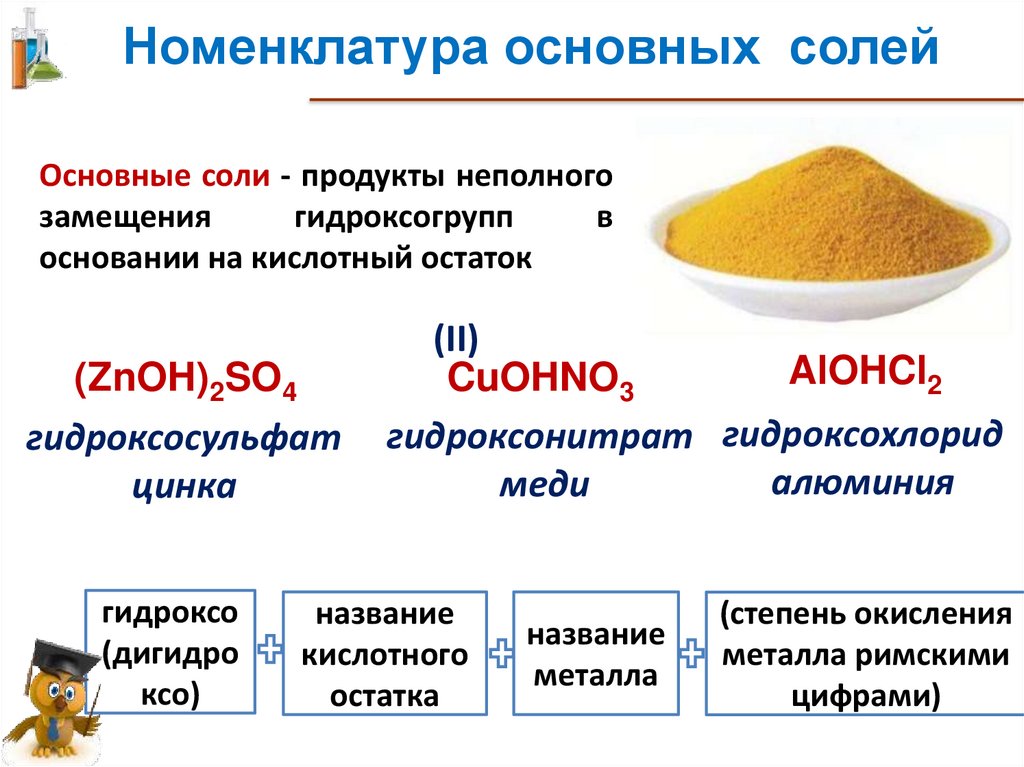
Номенклатура основных солейОсновные соли - продукты неполного
замещения
гидроксогрупп
в
основании на кислотный остаток
(ZnOH)2SO4
гидроксoсульфат
цинка
гидроксо
(дигидро
ксо)
(II)
AlOHCl2
CuOHNO3
гидроксонитрат гидроксохлорид
алюминия
меди
название
кислотного
остатка
название
металла
(степень окисления
металла римскими
цифрами)
9.
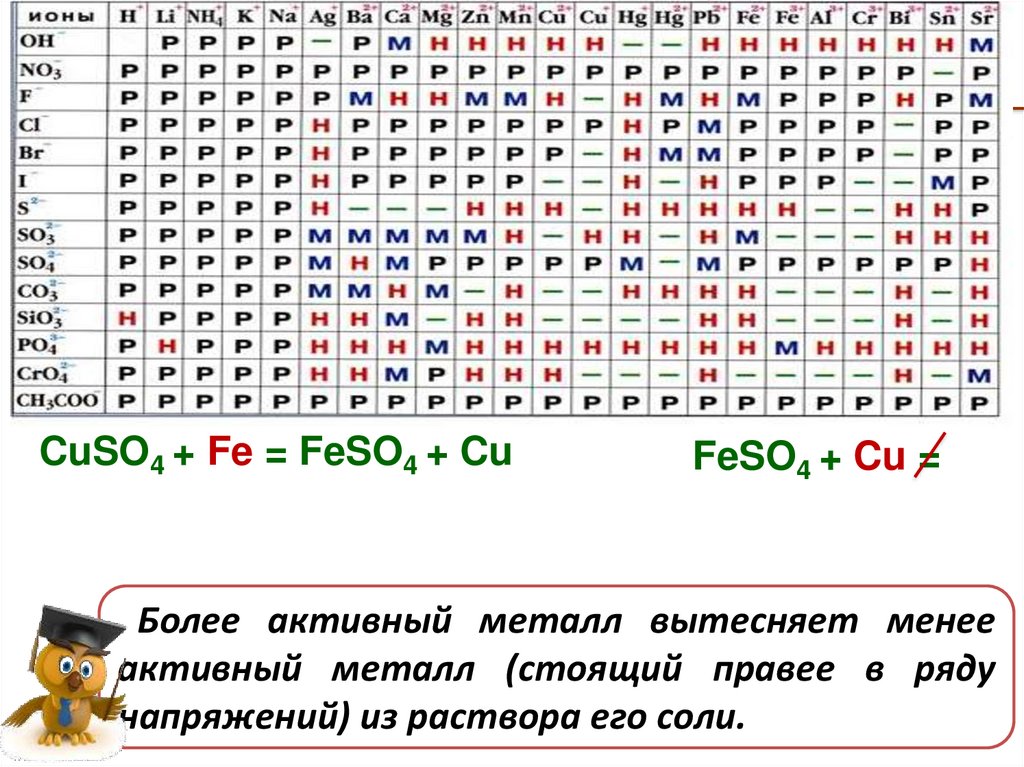
Химические свойства солейCuSО4
CuSO4 + Fe = FeSO4 + Cu
FeSО4
FeSO4 + Cu =
Более активный металл вытесняет менее
активный металл (стоящий правее в ряду
напряжений) из раствора его соли.
10.
Химические свойства солейNa2SO4 + BaCl2 = BaSO4↓+ 2NaCl
Na2SO3 + BaCl2 = BaSO3↓+ 2NaCl
Реакция обмена между солями протекает в
растворе (обе соли должны быть растворимы)
только в том случае, если образуется осадок.
11.
Химические свойства солейCuSO4 + 2NaОН = Cu(OH)2↓+ Na2SO4
Реакция обмена между солью и основанием
протекает в растворе (оба вещества должны
быть растворимы) только в том случае, если
образуется осадок.
12.
Химические свойства солейCaCO3 + 2HCl = CaCl2↓+ H2CO3
H2O CO2
Растворимые соли взаимодействуют с
кислотами, если при этом образуется
нерастворимая в кислотах соль или летучая
кислота.
13.
Химические свойства солейC
О
Л
И
с металлами
CuSO4 + Fe = FeSO4 + Cu
с оксидами
K2CO3 + SiO2 = K2SiO3 + CO2
со щелочами
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
с кислотами
K2CO3 + 2HCl = 2KCl + CO2 + H2O
c солями
2K3PO4+ 3CaCl2 = Ca3(PO4)2 + 6KCl
термическое разложение CaCO3 = CaO + CO2
14.
Разложение нитратовН
И
Т
Р
А
Т
Ы
металлы левее Mg
(кроме лития)
2KNO3 = KNO2 + O2
металлы от Mg до Cu
(включая литий)
2Cu(NO3)2 = 2CuO + 4NO2 + O2
металлы после Cu
2AgNO3 = 2Ag + 2NO2 + O2
15.
Получение солей1. Взаимодействие кислоты с Ме:
Zn + 2HCI → ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным
оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
16.
Упр. №1. Классификация солей• Задание:
Из перечня формул Сa(HSO4)2, (CaOH)2SO4,
Ca(NO3)2,
NaH2PO4,
Na3PO4,
MgOHNO3
выпишите отдельно
1 вариант - формулы средних солей,
2 вариант - формулы кислых солей,
3 вариант - формулы основных солей.
Дайте их название.
• Проверьте друг у друга результаты работы.
17.
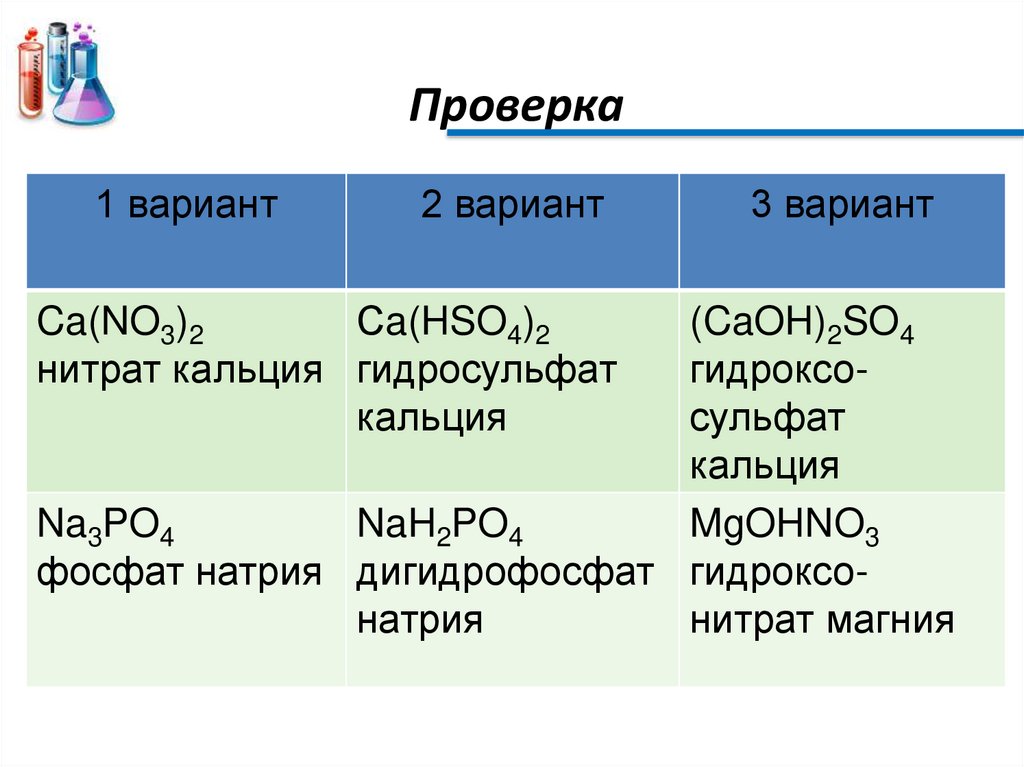
Проверка1 вариант
2 вариант
Ca(NO3)2
Сa(HSO4)2
нитрат кальция гидросульфат
кальция
3 вариант
(CaOH)2SO4
гидроксосульфат
кальция
Na3PO4
NaH2PO4
MgOHNO3
фосфат натрия дигидрофосфат гидроксонатрия
нитрат магния
18.
Упр. 2. В каком случае возможна реакция ипочему? Напишите уравнения реакций.
• CuCl2 + Al →
• AlCl3 + Cu →
• CuSO4 + Pb →
19.
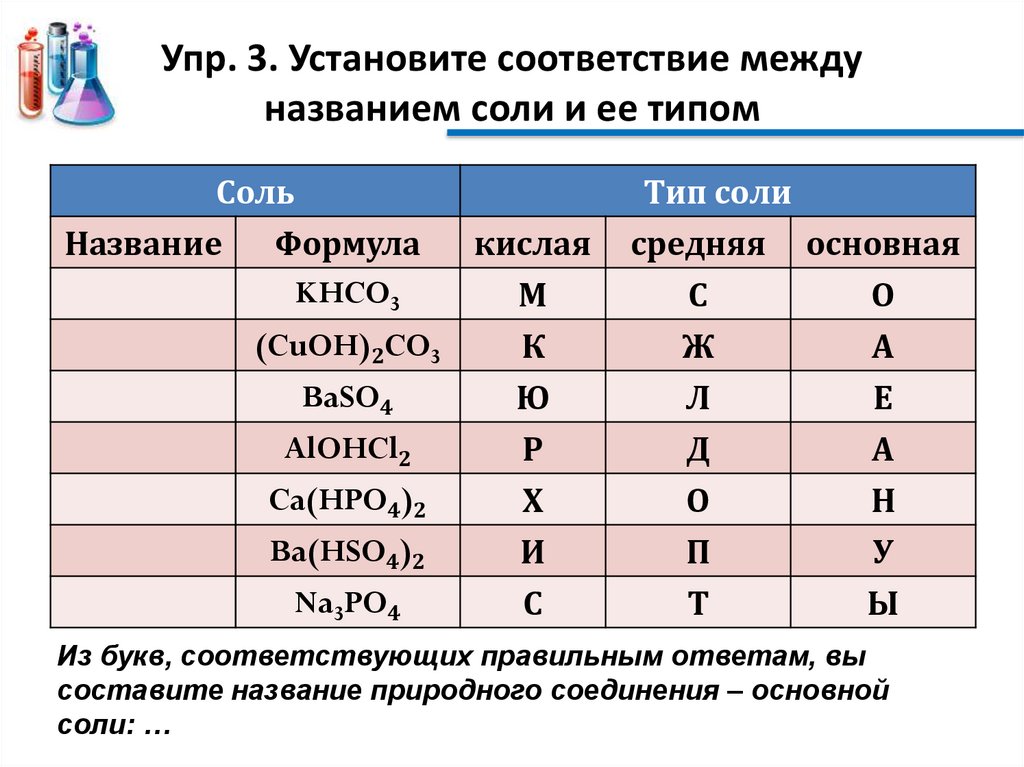
Упр. 3. Установите соответствие междуназванием соли и ее типом
Соль
Название
Формула
KHCO3
кислая
М
Тип соли
средняя основная
С
О
(CuOH)2CO3
BaSO4
AlOHCl2
К
Ю
Р
Ж
Л
Д
А
Е
А
Ca(HPO4)2
Ba(HSO4)2
Na3PO4
Х
И
С
О
П
Т
Н
У
Ы
Из букв, соответствующих правильным ответам, вы
составите название природного соединения – основной
соли: …
20.
Домашнее задание1. Параграф 26, подготовиться к практической
работе №7
2. Упражнения №4 - №6 (из презентации)
Пишите в электронный журнал или на мою почту.
E-mail мой: ilina.irina71@mail.ru
21.
Упр. 4. Составьте уравнения реакцийи укажите их тип:
1. Хлорид цинка + гидроксид натрия →
2. Хлорид железа (II) + кобальт →
3. Оксид лития + вода →
4. Серная кислота + нитрат бария →
5. Сульфид натрия + бромид магния →
22.
Упр. 5. Запишите не менее 5 уравненийхимических реакций, с помощью которых
можно получить:
• Хлорид меди (II)
• Сульфат железа (II)
• Карбонат магния
23.
Упр. 6. Составьте возможные уравненияреакций.
• Fe2(SO4)3 + KOH →
• KNO3 + NaOH →
• (NH4)2SO4 + LiOH →
• Fe(NO3)2 + HCl →
• CaCl2 + H2SO4 →
• K2CO3 + HNO3 →
• BaCl2 + HNO3 →
• Na2SiO3 + HCl →
Составьте из букв, соответствующих правильным
ответам, название металла
К
С
А
Е
Л
И
А
Й
24.
Спасибоза внимание
E-mail: ilina.irina71@mail.ru

















 Химия
Химия








