Похожие презентации:
Алкены. 10 класс
1.
Учитель химииМАОУ «СОШ №16» г. Губкин
Белгородской области
Горбунова Наталья Павловна
http://linda6035.ucoz.ru/
2.
Заполни таблицуОбщая формула
гомологического
ряда, молярная
масса
Виды изомерии
Номенклатура
http://linda6035.ucoz.ru/
CnH_ , n ≥ _ ,
M = ______ г/моль
а) ______, б) _____
в) ______, г) ______
____________
Тривиальные названия
радикалов:
винил:СН2=СНаллил: СН2=СН-СН2пропенил: СН3-СН=СН-
3.
Физические свойства• При н.у. алкены: С2 – С4 _____
С5 – С16 _____
С17 и далее ____
• С ростом молекулярной массы
температура кипения и плавления
_______
http://linda6035.ucoz.ru/
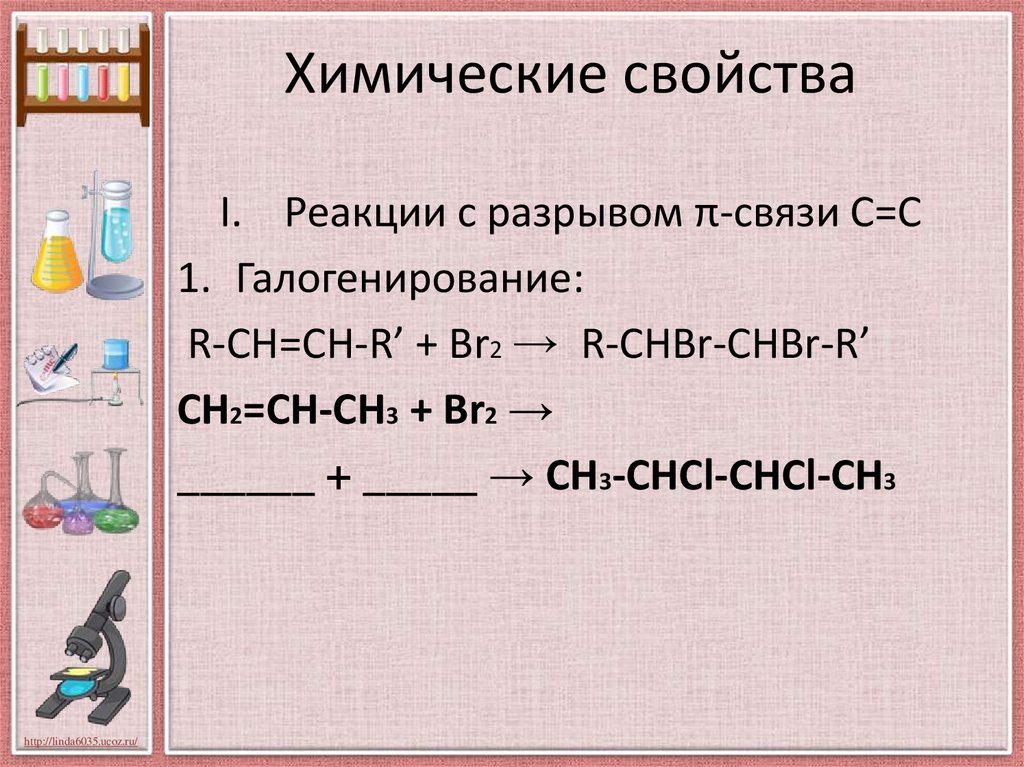
4.
Химические свойстваI. Реакции с разрывом π-связи С=С
1. Галогенирование:
R-CH=CH-R’ + Br2 → R-CHBr-CHBr-R’
СН2=СН-СН3 + Br2 →
______ + _____ → СН3-СНCl-CHCl-СН3
http://linda6035.ucoz.ru/
5.
Химические свойстваI. Реакции с разрывом π-связи С=С
2. Гидрогалогенирование:
CH2 =CH-R’ + HCl → CH3-CH-R’
Cl
Правило Марковникова
Водород присоединяется к наиболее
гидрогенизированному атому углерода, а
галоген – к наименее гидрогенизированному.
http://linda6035.ucoz.ru/
6.
Химические свойстваI. Реакции с разрывом π-связи С=С
3.
Гидратация (в присутствии H2SO4,
H3PO4):
R-CH=CH2+ H-OH → R-CHOH-CH3
СН2=СН-С2Н5 + H2O→
СН2=СН-СН3 + H2O→
http://linda6035.ucoz.ru/
7.
Химические свойстваI. Реакции с разрывом π-связи С=С
4. Гидрирование (в присутствии Pt, Ni,
150°C):
R-CH=CH-R’ + H2 → R-CH2-CH2-R’
+ H2→ СН3-СН2-СН2-CH2-СН3
СН2=СН-СН3 + H2→
http://linda6035.ucoz.ru/
8.
Химические свойстваI. Реакции с разрывом π-связи С=С
5. Полимеризация (kat):
n R-CH=CH-R’ → (-CH-CH-)n
R R’
nСН2=СН2 → (-СН2-СН2 -)n
Полимеризация пропилена:
http://linda6035.ucoz.ru/
9.
Химические свойстваII. Реакции с разрывом связи С-Н
Радикальное галогенирование (t=400-500°C или
при облучении) – двойная связь сохраняется!:
R-CH2-CH=CH2 + Cl2→R-CHCl-CH=CH2 + HCl
450°C
СН2=СН-С2Н5 + Cl2→
500°C
СН3-СН=СН2 + Br2→
hν
СН3-СН=С(CН3)2 + Cl2→
25°C
СН3-СН=СН2 + Cl2→
http://linda6035.ucoz.ru/
10.
Химические свойстваIII. Реакции с разрывом связи С-С, C-H
Окисление :
а)CH2=CH2+ 1/2О2 → CH2-CH2
О
б) Реакция Вагнера:
3R-CH=CH-R’ + 2KMnO4 + 4H2O →
R-CHOH-CHOH-R’ + MnO2 + 2KOH
в) горение
http://linda6035.ucoz.ru/
11.
ПолучениеРеакции элиминирования
Правило Зайцева:
При отщеплении молекул типа H-X (H-Hal, H-OH)
от несимметричного галогеноалкана или
спирта атом водорода приемущественно
отщепляется от того из соседних атомов
углерода, который связан с наименьшим
числом атомов водорода
http://linda6035.ucoz.ru/
12.
ПолучениеВ ПРОМЫШЛЕННОСТИ
1. Крекинг алканов:
2. Дегидрирование алканов(500°С):
В ЛАБОРАТОРИИ
1. Каталитическое
гидрирование
алкинов (Pt, Pd, Ni)
http://linda6035.ucoz.ru/
13.
Получение2.
3.
4.
5.
http://linda6035.ucoz.ru/
В ЛАБОРАТОРИИ
Дегидратация
спиртов
(H2SO4,
t>150°C)
Дегидрогалогенирование
галогеноалканов
(спиртовой
раствор щелочи)
Дегалогенирование
дигалогеналканов с помощью цинка
или магния
Дегидрирование алканов (Cr2O3, Pt,
t)
14.
ПрименениеНазвание процесса
Уравнение процесса
1. Полимеризация
nСН2=СН2 →
этилен→полиэтилен
Производство
полимеров
2. Гидратация
СН2=СН2 + H2O→
→ этиловый спирт
Растворитель, в
медицине, в
производстве
синтетического каучука
3. Галогенирование СН2=СН2 + Cl2 →
гидрогалогени→дихлорэтан
рование
СН2=СН2 + НCl →
→хлорэтан
4. Окисление
раствором KMnO4
http://linda6035.ucoz.ru/
Характер
использования
продуктов
Растворитель, в
оргсинтезе
Раствоитель, местная
анастезия,
обеззараживание
зернохранилищ
СН2=СН2 + KMnO4 + H2O→ Получение
антифризов,
→ этандиол-1,2
тормозных жидкостей,
15.
Литература1. Рудзитис, Г.Е. Химия. Органическая химия. 10
класс [Текст]: учеб. для общеобразоват.
учреждений с прил. на электрон. носителе /
Г.Е. Рудзитис, Ф.Г. Фельдман. – 15-е изд. – М.:
Просвещение, 2012. – 192 с.: ил. – ISBN 978-509-026516-4.
2. Дерябина, Н.Е. Органическая химия. Книга 1.
Углеводороды и многофункциональные
производные [Текст]: учебник - тетрадь/ Н.Е.
Дерябина. – М.: ИПО «У Никитских ворот»,
2012. – 200с. – ISBN 978-5-91366-375-7.
http://linda6035.ucoz.ru/














 Химия
Химия








