Похожие презентации:
Алкены. Углеводороды. 10 класс - базовый уровень
1.
Алкеныуглеводороды
10 класс – базовый уровень
KMS
2.
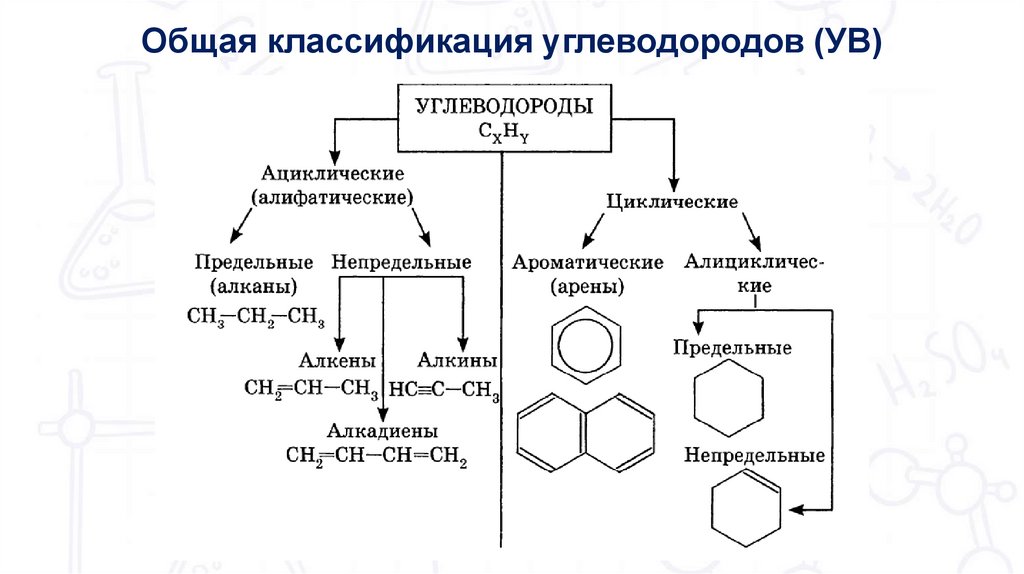
Общая классификация углеводородов (УВ)3.
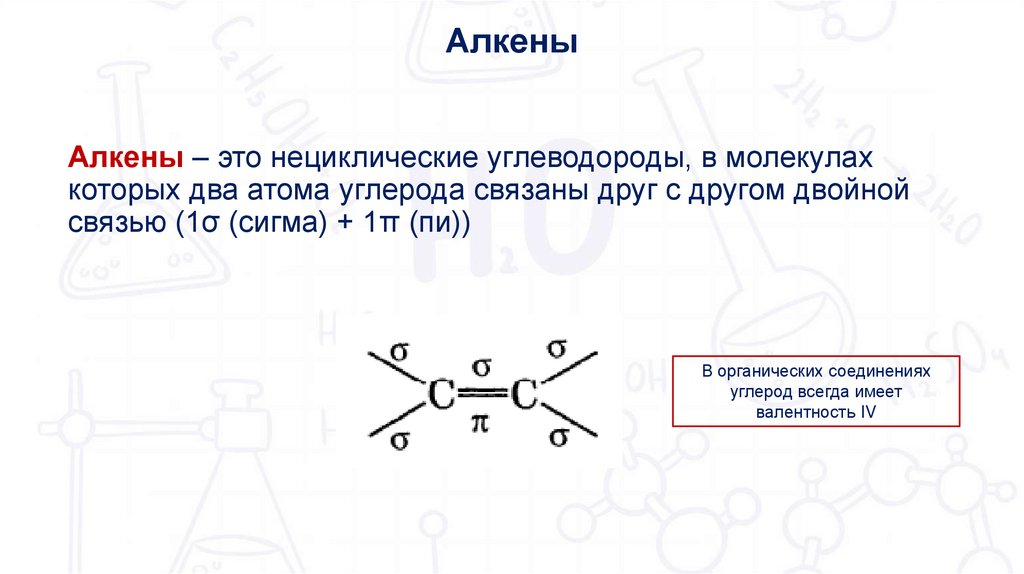
АлкеныАлкены – это нециклические углеводороды, в молекулах
которых два атома углерода связаны друг с другом двойной
связью (1σ (сигма) + 1π (пи))
В органических соединениях
углерод всегда имеет
валентность IV
4.
Гомологический рядОбщая формула для всех алкенов CnH2n, где n ≥ 2
Радикал CH2 = CH - называется винил
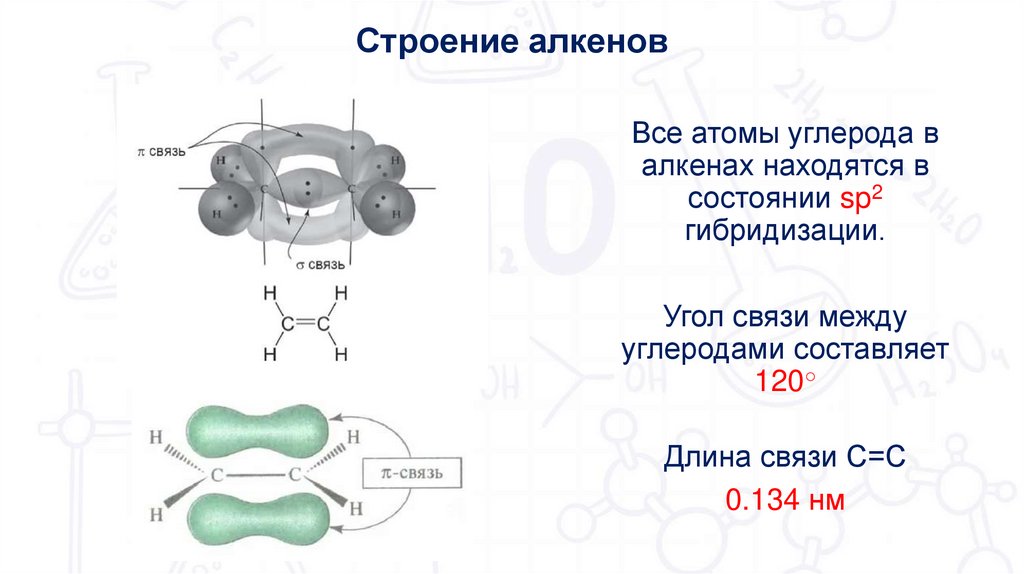
5.
Строение алкеновВсе атомы углерода в
алкенах находятся в
состоянии sp2
гибридизации.
Угол связи между
углеродами составляет
120○
Длина связи С=С
0.134 нм
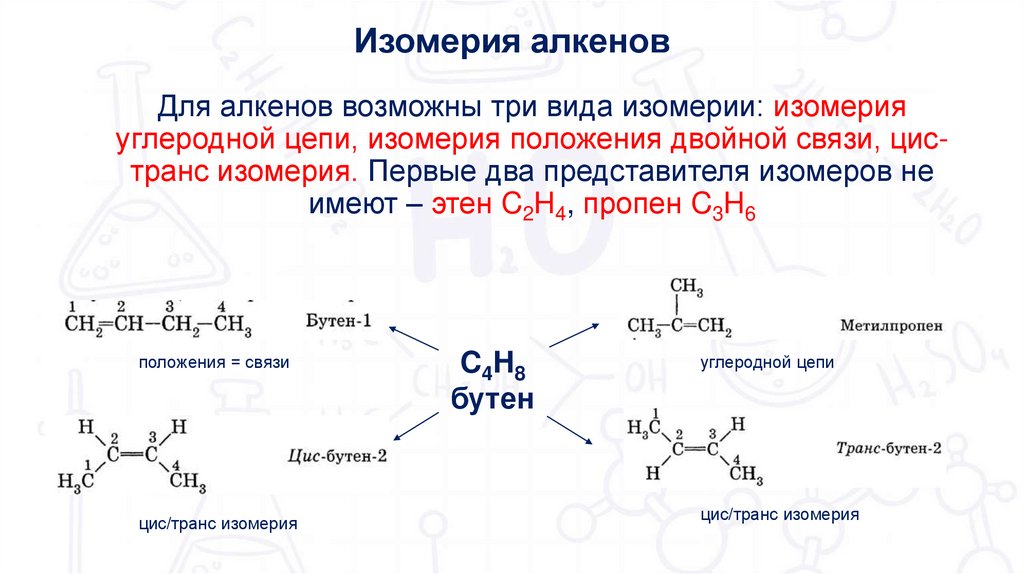
6.
Изомерия алкеновДля алкенов возможны три вида изомерии: изомерия
углеродной цепи, изомерия положения двойной связи, цистранс изомерия. Первые два представителя изомеров не
имеют – этен C2H4, пропен C3H6
положения = связи
цис/транс изомерия
C4H8
бутен
углеродной цепи
цис/транс изомерия
7.
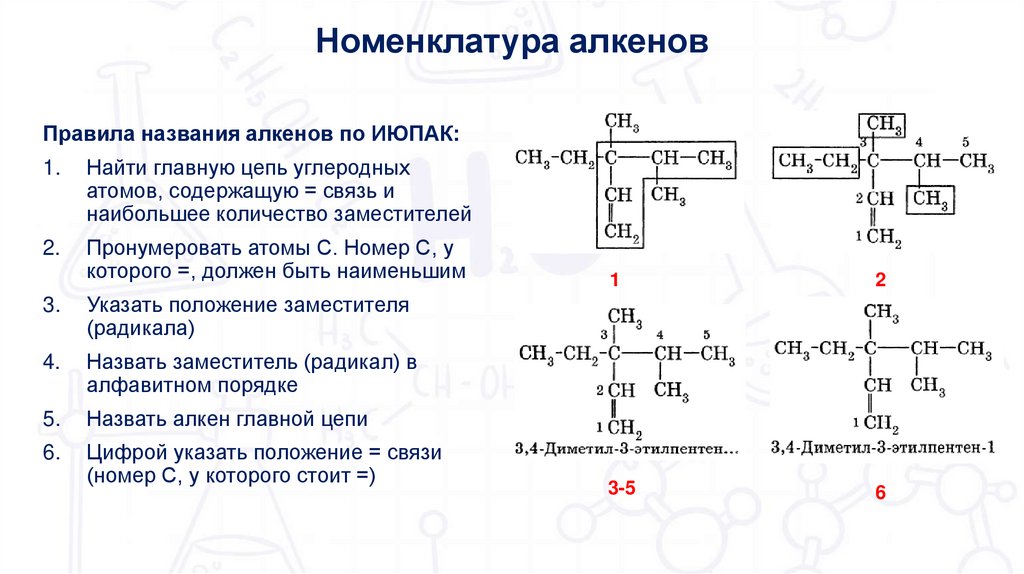
Номенклатура алкеновПравила названия алкенов по ИЮПАК:
1.
Найти главную цепь углеродных
атомов, содержащую = связь и
наибольшее количество заместителей
2.
Пронумеровать атомы С. Номер С, у
которого =, должен быть наименьшим
3.
Указать положение заместителя
(радикала)
4.
Назвать заместитель (радикал) в
алфавитном порядке
5.
Назвать алкен главной цепи
6.
Цифрой указать положение = связи
(номер С, у которого стоит =)
1
2
3-5
6
8.
Физические свойства алкеновАлкены имеют более низкие температуры кипения и плавления по
сравнению с алканами (из-за = связи). Ткип и Тпл растут с
увеличением молекулярной массы.
Редко встречаются в природе. В основном накапливаются у
растений и отвечают за созревание плодов.
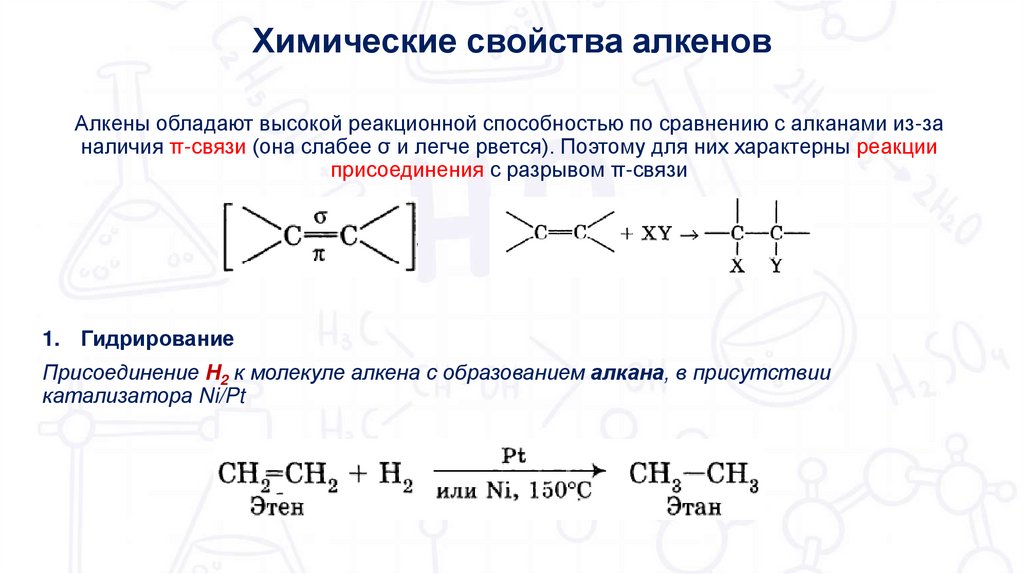
9.
Химические свойства алкеновАлкены обладают высокой реакционной способностью по сравнению с алканами из-за
наличия π-связи (она слабее σ и легче рвется). Поэтому для них характерны реакции
присоединения с разрывом π-связи
1. Гидрирование
Присоединение H2 к молекуле алкена с образованием алкана, в присутствии
катализатора Ni/Pt
10.
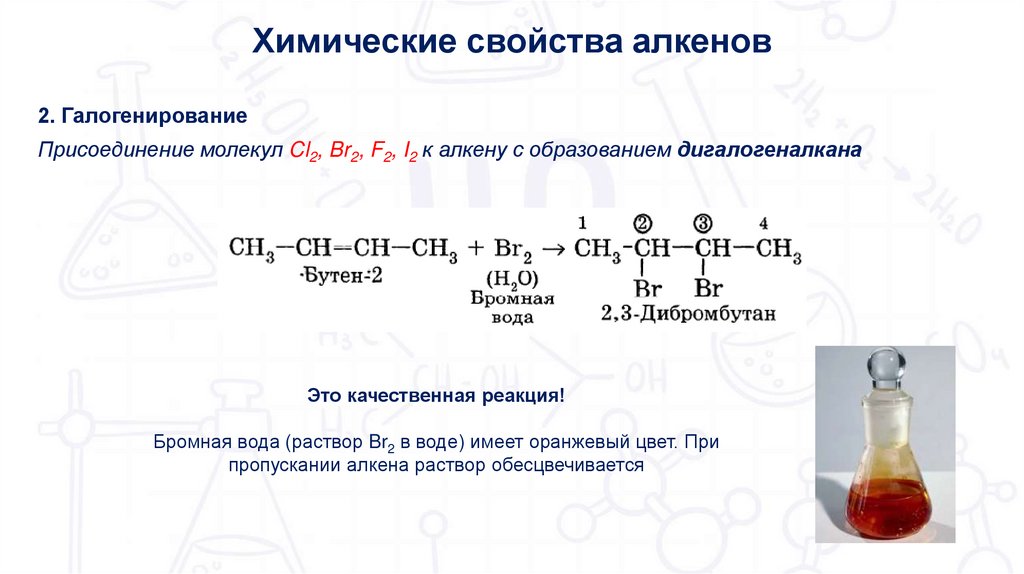
Химические свойства алкенов2. Галогенирование
Присоединение молекул Cl2, Br2, F2, I2 к алкену с образованием дигалогеналкана
Это качественная реакция!
Бромная вода (раствор Br2 в воде) имеет оранжевый цвет. При
пропускании алкена раствор обесцвечивается
11.
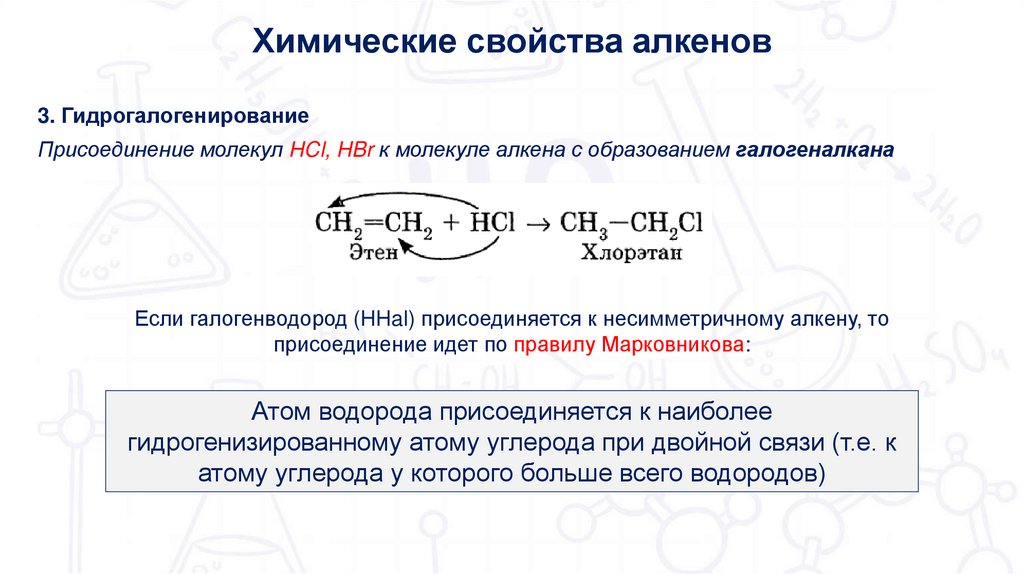
Химические свойства алкенов3. Гидрогалогенирование
Присоединение молекул HCl, HBr к молекуле алкена с образованием галогеналкана
Если галогенводород (HHal) присоединяется к несимметричному алкену, то
присоединение идет по правилу Марковникова:
Атом водорода присоединяется к наиболее
гидрогенизированному атому углерода при двойной связи (т.е. к
атому углерода у которого больше всего водородов)
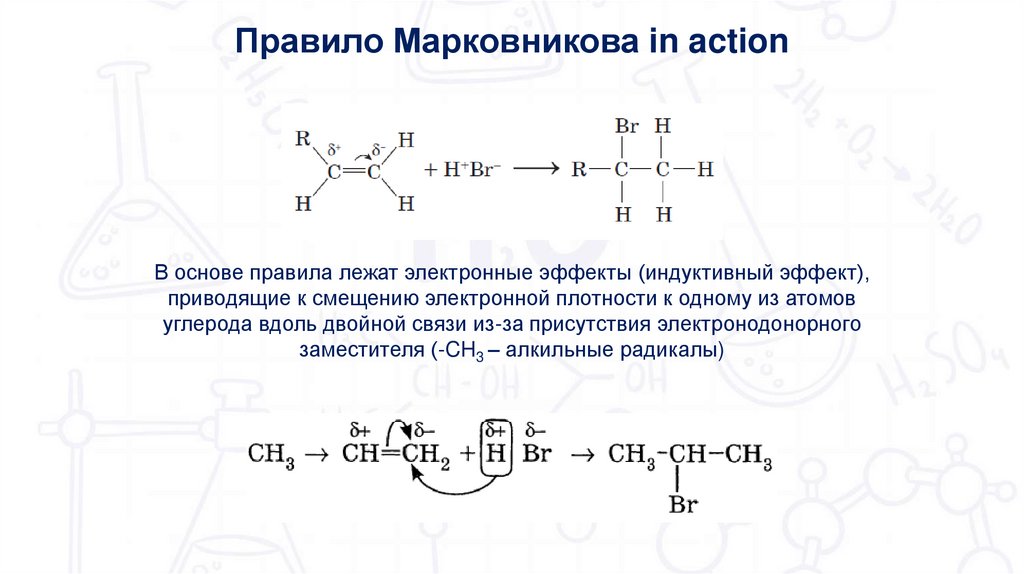
12.
Правило Марковникова in actionВ основе правила лежат электронные эффекты (индуктивный эффект),
приводящие к смещению электронной плотности к одному из атомов
углерода вдоль двойной связи из-за присутствия электронодонорного
заместителя (-CH3 – алкильные радикалы)
13.
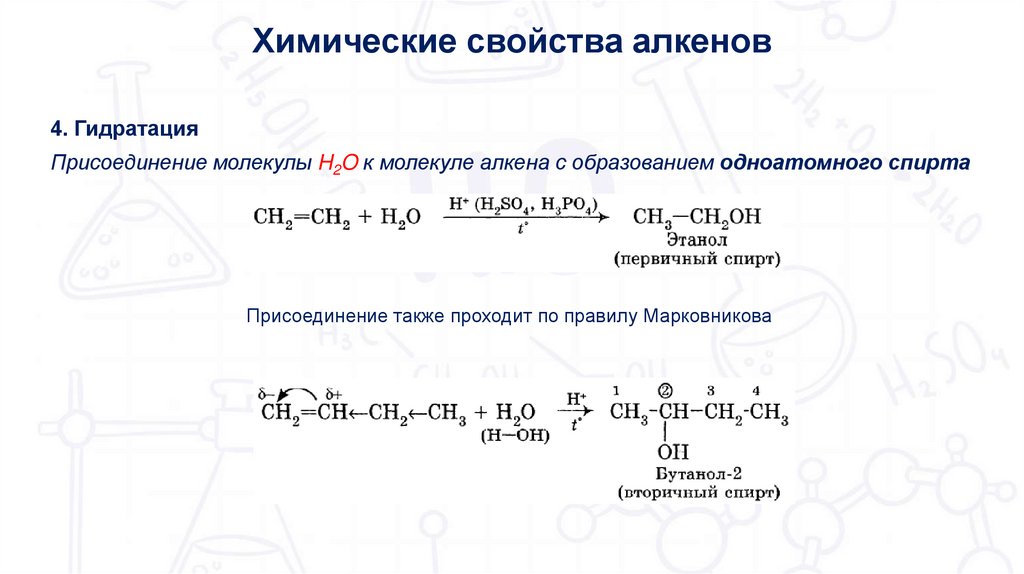
Химические свойства алкенов4. Гидратация
Присоединение молекулы H2O к молекуле алкена с образованием одноатомного спирта
Присоединение также проходит по правилу Марковникова
14.
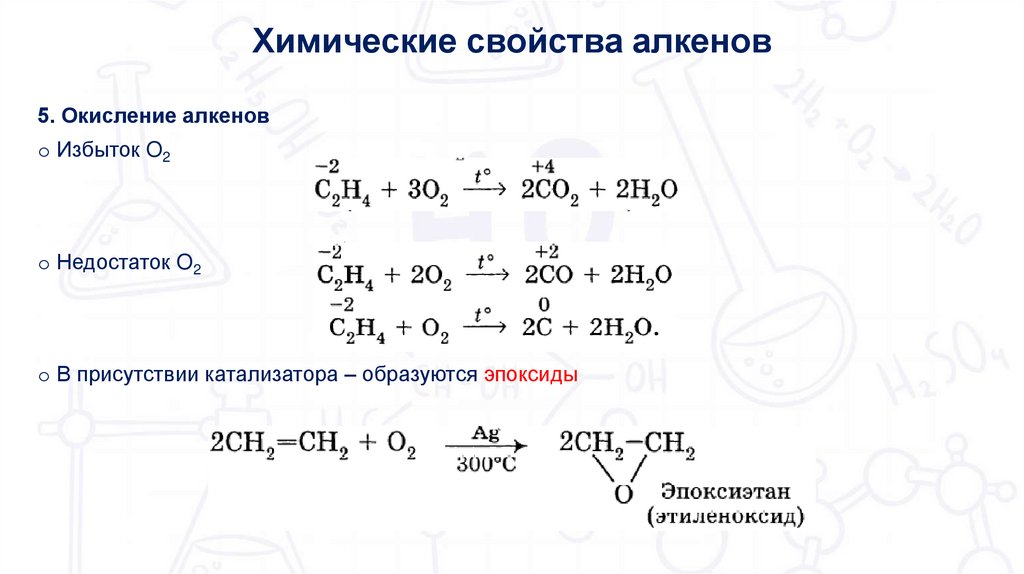
Химические свойства алкенов5. Окисление алкенов
o Избыток O2
o Недостаток O2
o В присутствии катализатора – образуются эпоксиды
15.
Химические свойства алкеновОкисление алкенов. Продолжение.
o Мягкое окисление – реакция Вагнера. В слабощелочной среде, разбавленный раствор KMnO4
Качественная реакция! Раствор перманганата калия обесцвечивается
o Жесткое окисление – в присутствии конц. серной кислоты и нагревании
Происходит разрыв двойной связи
16.
Химические свойства алкенов6. Полимеризация
Процесс присоединения одинаковых молекул (мономеров), за счет разрыва двойных связей, с
образованием полимера
17.
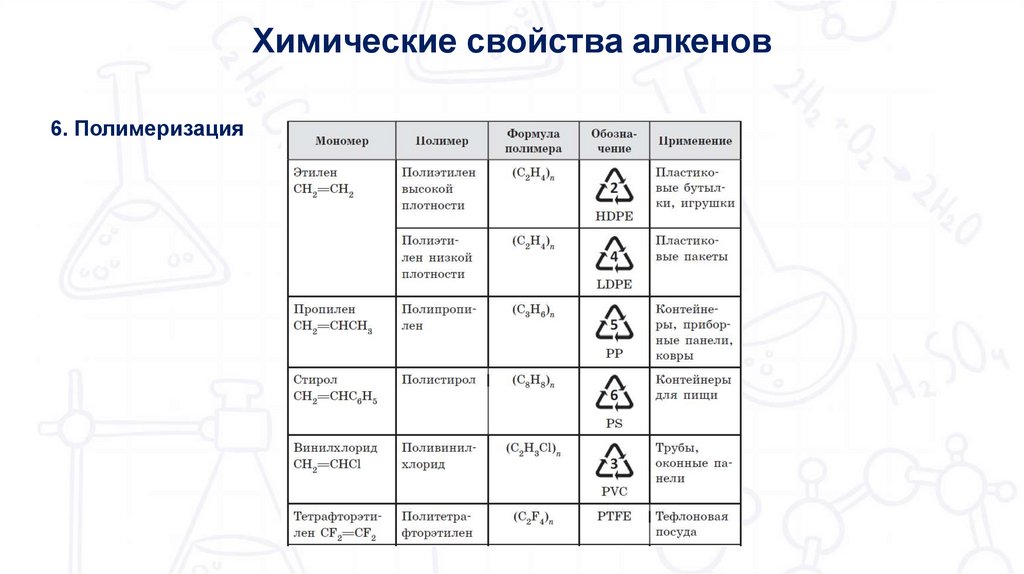
Химические свойства алкенов6. Полимеризация
18.
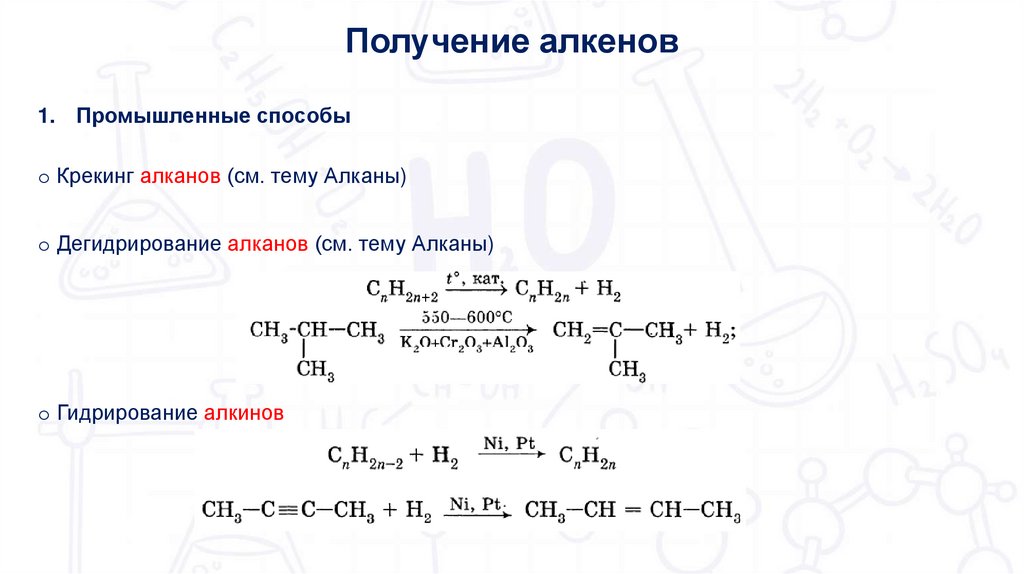
Получение алкенов1. Промышленные способы
o Крекинг алканов (см. тему Алканы)
o Дегидрирование алканов (см. тему Алканы)
o Гидрирование алкинов
19.
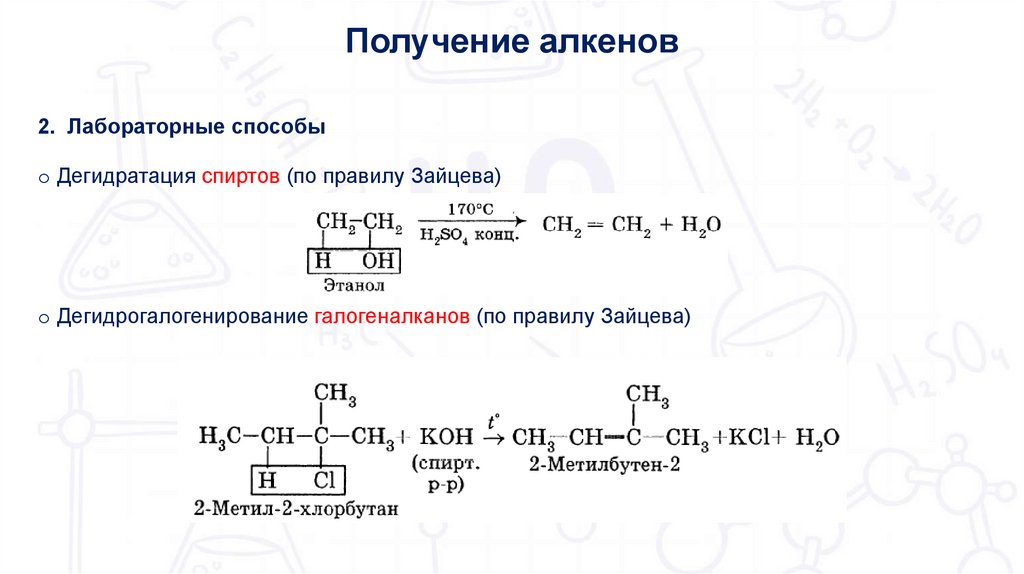
Получение алкенов2. Лабораторные способы
o Дегидратация спиртов (по правилу Зайцева)
o Дегидрогалогенирование галогеналканов (по правилу Зайцева)
20.
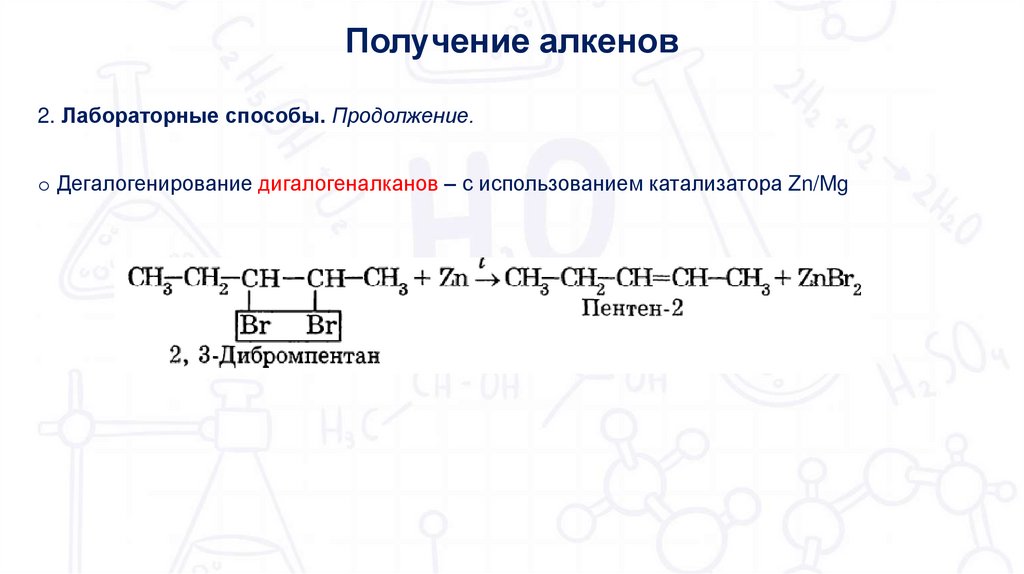
Получение алкенов2. Лабораторные способы. Продолжение.
o Дегалогенирование дигалогеналканов – с использованием катализатора Zn/Mg





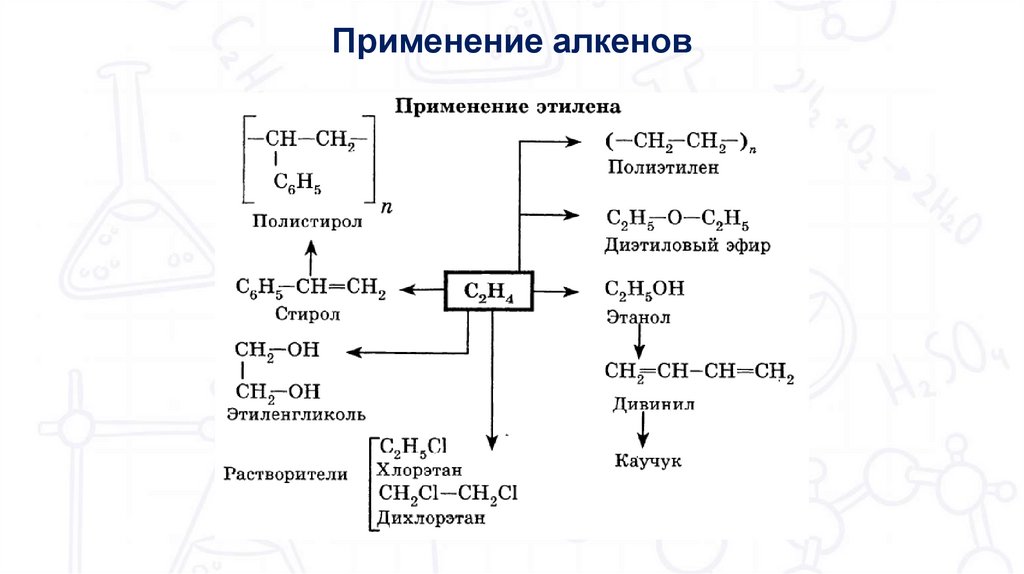
 Химия
Химия








