Похожие презентации:
Серная кислота
1.
2.
Муниципальное бюджетное общеобразовательное учреждение«Средняя общеобразовательная школа с. Коста»
Ардонского района, РСО-Алания
Мамитова Кристина Геннадьевна
Учитель химии и биологии.
3.
S→SO2→SO3 →H2SO44.
«Я растворю любой металл.Меня алхимик получал
В реторте глиняной простой.
Слыву я главной кислотой...
Когда сама я растворяюсь
В воде, то сильно нагреваюсь»
5.
6.
План:1. Состав и строение молекулы:
а) химические формулы
б) виды химической связи в молекуле;
в) относительная молекулярная масса.
2. Физические свойства.
3. Химические свойства:
а) общие с другими кислотами;
б) качественная реакция на сульфат-ион.
4. Применение серной кислоты и ее солей.
7.
.1 Характеристика серной кислоты
Название
Формула (расставить СО )
Наличие кислорода
Основность
Растворимость в воде
Летучесть
Стабильность
8.
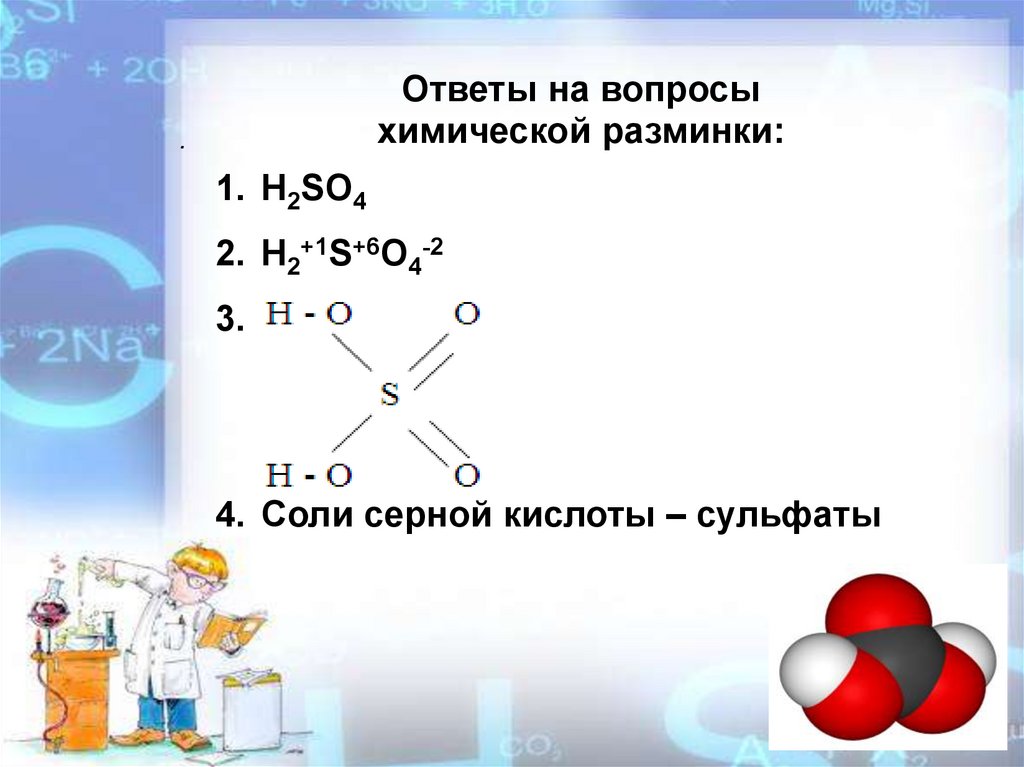
Ответы на вопросыхимической разминки:
.
1. H2SO4
2. H2+1S+6O4-2
3.
4. Соли серной кислоты – сульфаты
9.
Серная кислота H2SO4 — сильная двухосновнаякислота, отвечающая высшей степени окисления
серы (+6). При обычных условиях концентрированная
серная кислота — тяжёлая маслянистая жидкость
без цвета и запаха, гигроскопична.
При растворении кислоты в воде сильно
нагревается.
10.
А как правильно растворять сернуюкислоту?
Сначала вода,
Никогда
Потом кислота.
не добавляйте воду
Иначе будет
в кислоту!
большая беда!
11.
Общие свойства растворов кислот12.
I. Химические свойства разбавленнойсерной кислоты
1.Диссоциация:
H2SO4
H+ + HSO4-
HSO4- ↔ H+ + SO42-
13.
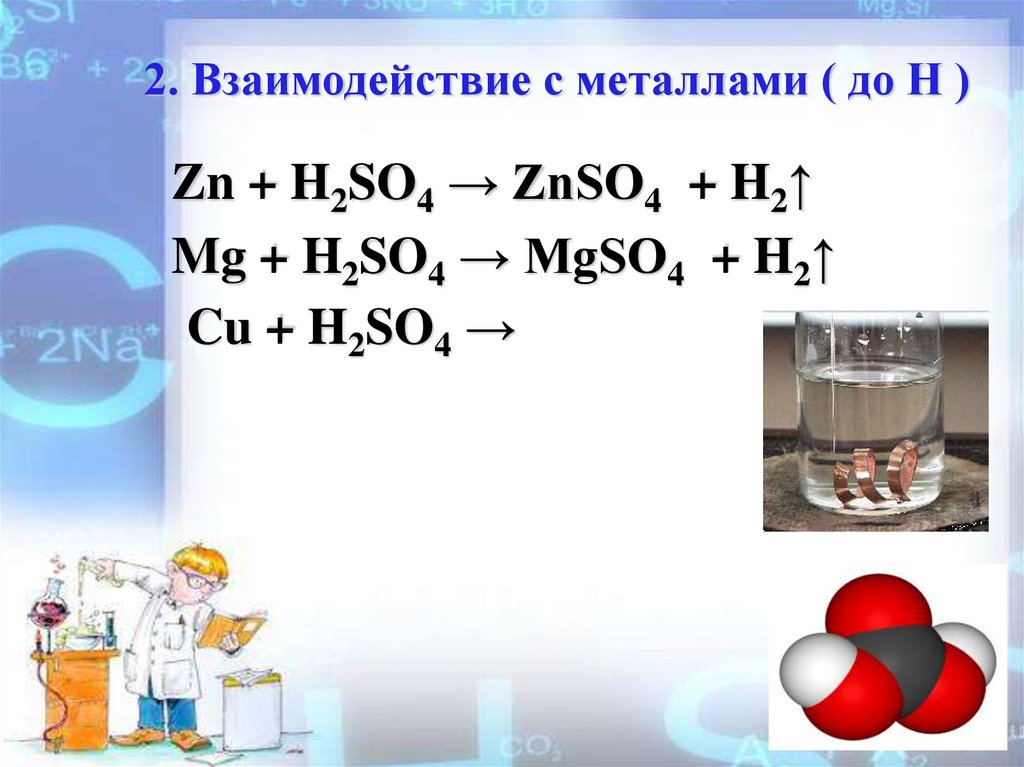
2. Взаимодействие с металлами ( до Н )Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
14.
3. Взаимодействие с оcновными иамфотерными оксидами
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
15.
4. Взаимодействие с основаниями иамфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат
натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
16.
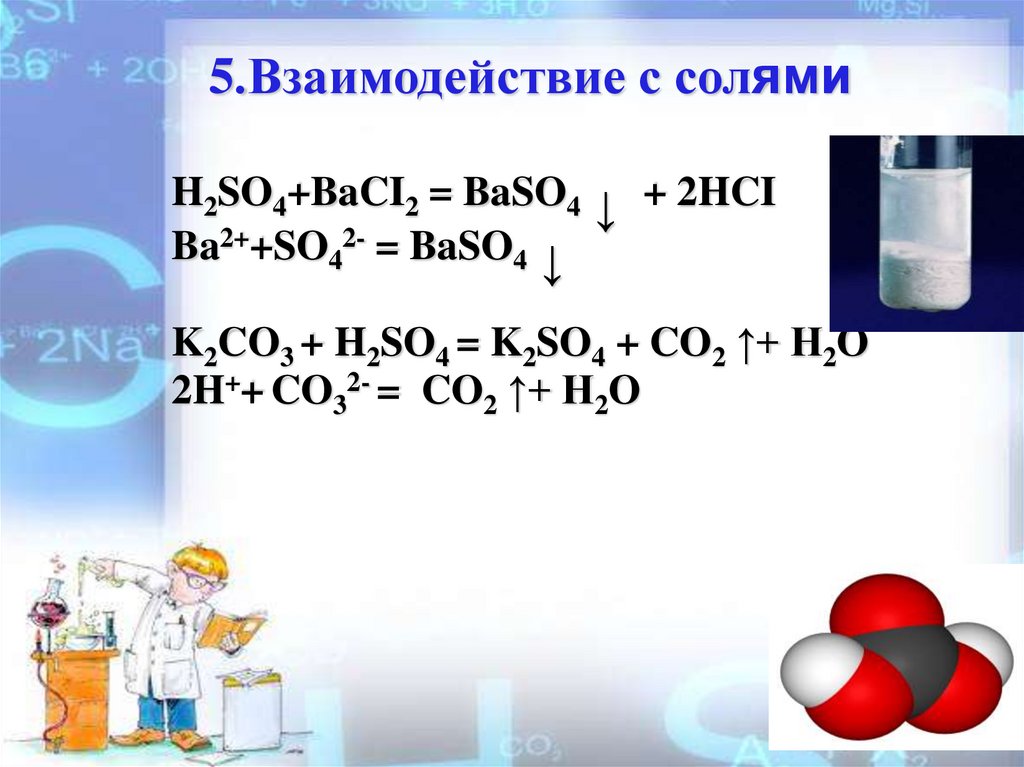
5.Взаимодействие с солямиH2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2++SO42- = BaSO4 ↓
K2CO3 + H2SO4 = K2SO4 + CO2 ↑+ H2O
2H++ CO32- = CO2 ↑+ H2O
17.
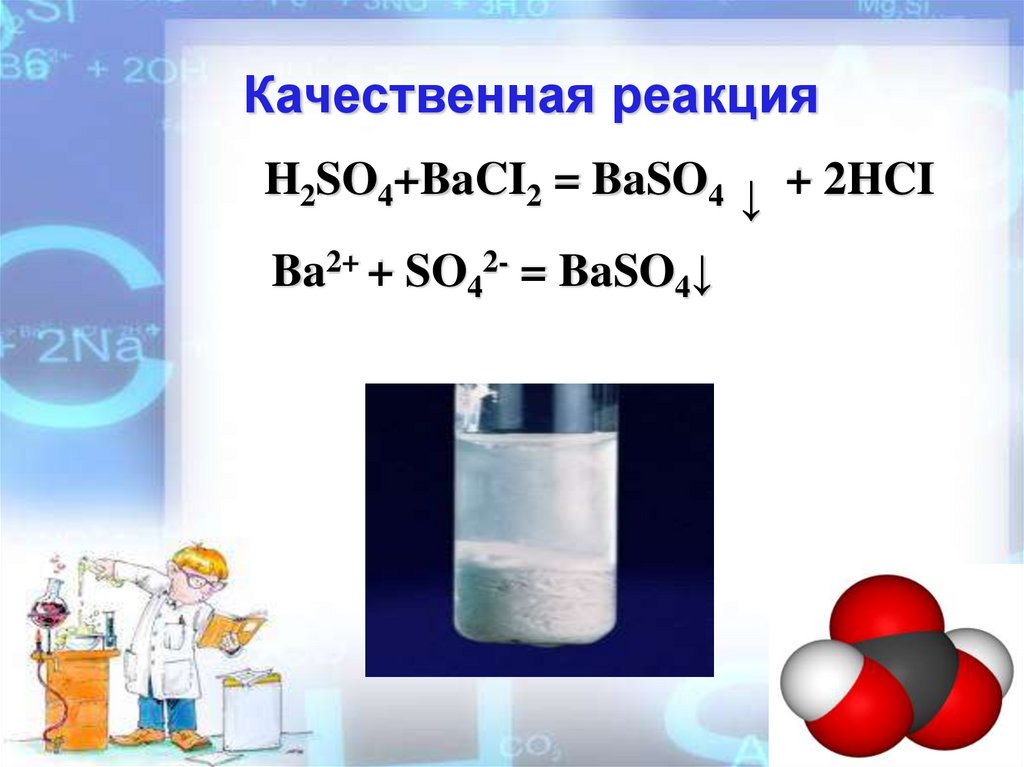
Качественная реакцияH2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2+ + SO42- = BaSO4↓
18.
концентрированная серная кислотаокисляет металлы
а) щелочные металлы
Н 2SO4 (конц) + Ме → Ме2 SO4 + S↓ (или Н 2S ↑) + Н2О
б)щелочноземельные металлы и Zn
Н 2SO4 (конц) + Ме → Ме SO4 + Н 2S ↑ (или SO2 ↑) + Н2О
в)тяжелые металлы (Pb,Cu,Ni,Zn,Cd,Co,Sb,Sn,Bi,Hg,Ag)
и Fe
to c
Н 2SO4 (конц) + Ме → Ме2 ( SO4 )3 + SO2 ↑ + Н2О
II) Кислота вытесняет более летучие кислоты из солей.
Этот способ применяют при получении летучих кислот
2NaCI + Н 2SO4 (конц) → Na2SO4 + 2НCI
19.
Свойства концентрированной сернойкислоты
C12H22O11 + 2H2SO4 = 11C + 2SO2 + CO2 +13H2O
Органические вещества
обугливаются !!!
20.
концентрированная серная кислотаокисляет неметаллы
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
21.
22.
23.
Получение серной кислотыFeS2
S
H2S
SO2 → SO3 → H2SO4
Пирит
Серный колчедан



















 Химия
Химия








