Похожие презентации:
Белки: структура и функции
1.
Лекция: Белки: структура и функции.Белки играют центральную роль в построении живой
материи и осуществлении процессов жизнедеятельности.
| Белки-строение и функционирование живой материи.
(protos-греч. первый, важнейший)
“Жизнь-способ существования белковых тел”...
Ф. Энгельс.
| содержание белков в сухом веществе 40-50%
| в сыром - до 25%
Особенности белковых молекул
1. Неисчерпаемое разнобразие структуры при строгой ее специфичности у индивидуальных белков.
2. Способность к внутримолекулярными взаимодействиями.
3. Белки, вступая во взаимодествие с другими белками, нуклеиновыми кислотами, полисахаридами, липидами, образуют надмолекулярные комплексы-основу субклеточных структур.
4. Изменяют структуру под влиянием внешних воздействий и
восстанавливают ее при их устранении.
5. Обладают уникальной способностью ускорять химические
реакции т.е. осуществляют каталитическую функцию.
2.
Биологические функции белков.1. Пластическая, структурная.
2. Регуляторная:
а) ферменты - регуляторы химических реакций.
б) гормоны - белковой природы- регуляторы
обмена веществ.
в) специфические белки-регуляторы (тропонин)
3. Транспортная (Hb, белки сыворотки крови)
4. Защитная (Ig)
5. Обеспечение видовой и индивидуальной специфичности
(белки, определяющие группу крови)
6. Другие специфические функции:
-опорно-механическая (коллаген)
-сократительная (актин, миозин)
-рецепторная (белки рецепторов)
-генно-регуляторная (гистоны)
-токсикогенная (ботулинус)
-белки памяти
-белки вкуса
7. резервная
8. энергетическая
| Только детально изучив строение белков и их свойства можно понять как
| перечисленные особенности белков, так и их функции.
3.
Белки-высокомолекулярные азотосодержащиеорганические соединения, состоящие из
аминокислот, соединенных пептидной
связью и имеющие сложную
структурную организацию.
Элементарный состав белков:
(% от сухой массы)
С - 50-55%
О - 21-24%
N - 15-18% (в среднем 16%)
Н - 6-7%
S - 0.3-2.5%
зола до 0.5% (Fe, P, Mg...)
Pr содержание = 6.25 белка (г) * содержание белкового азота (г)
(г)
метод
100*1
100г белка - 16г N
=
6.25 Кьельдаля
X
- 1г
16
4.
Структурная единица белка - аминокислотыБелок
гидролиз
(кислотный)
(щелочной)
(ферментативный)
смесь аминокислот
Свойства аминокислот (АК)
1. Все протеиногенные АК - a производные карбоновых кислот:
a
H2N-CH-COOH
|
R
2. Все АК, кроме глицина имеют ассиметрический атом.
3. Оптически активны: левоврвщающие (-) и правоврвщающие (+).
4. Все протеногенные АК относятся к L ряду.
5. Характеризуются амфотерностью.
6. Каждая АК наряду с общими свойствами обладает рядом
специфических.
7. Основной метод обнаружения АК в гидрализатах - ионная
хроматография (в белках-цветные реакции Милона, Сакагуши...)
5.
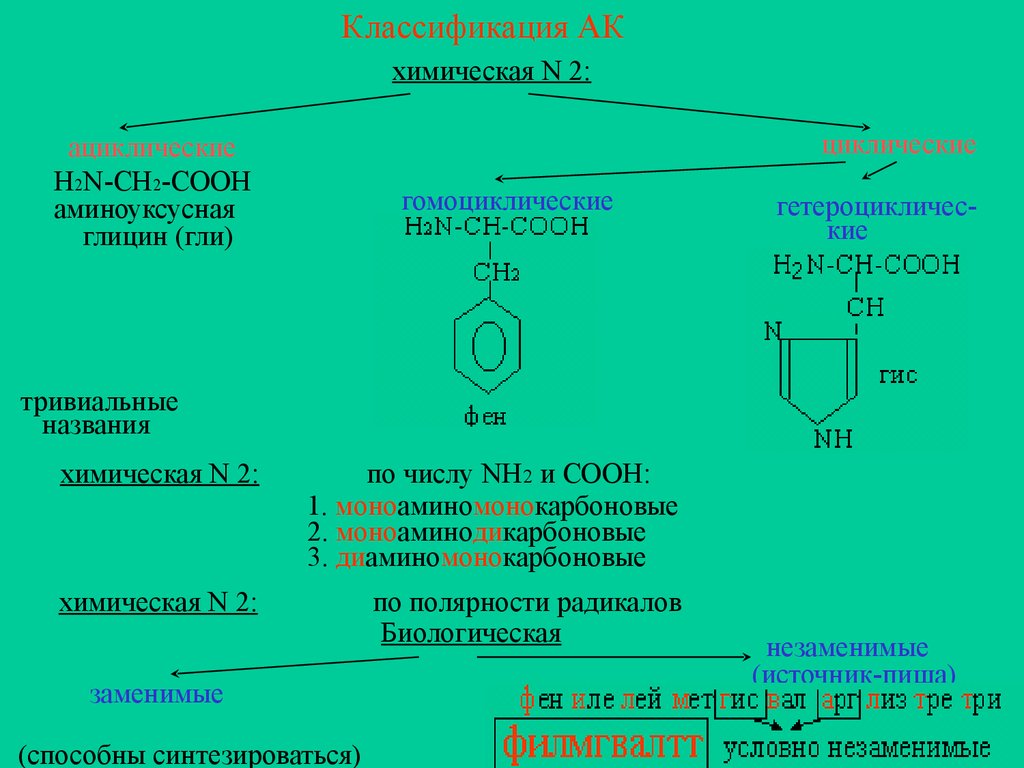
Классификация АКхимическая N 2:
циклические
ациклические
H2N-CH2-COOH
аминоуксусная
глицин (гли)
гомоциклические
гетероциклические
тривиальные
названия
химическая N 2:
по числу NH2 и COOH:
1. моноаминомонокарбоновые
2. моноаминодикарбоновые
3. диаминомонокарбоновые
химическая N 2:
по полярности радикалов
Биологическая
заменимые
(способны синтезироваться)
незаменимые
(источник-пища)
6.
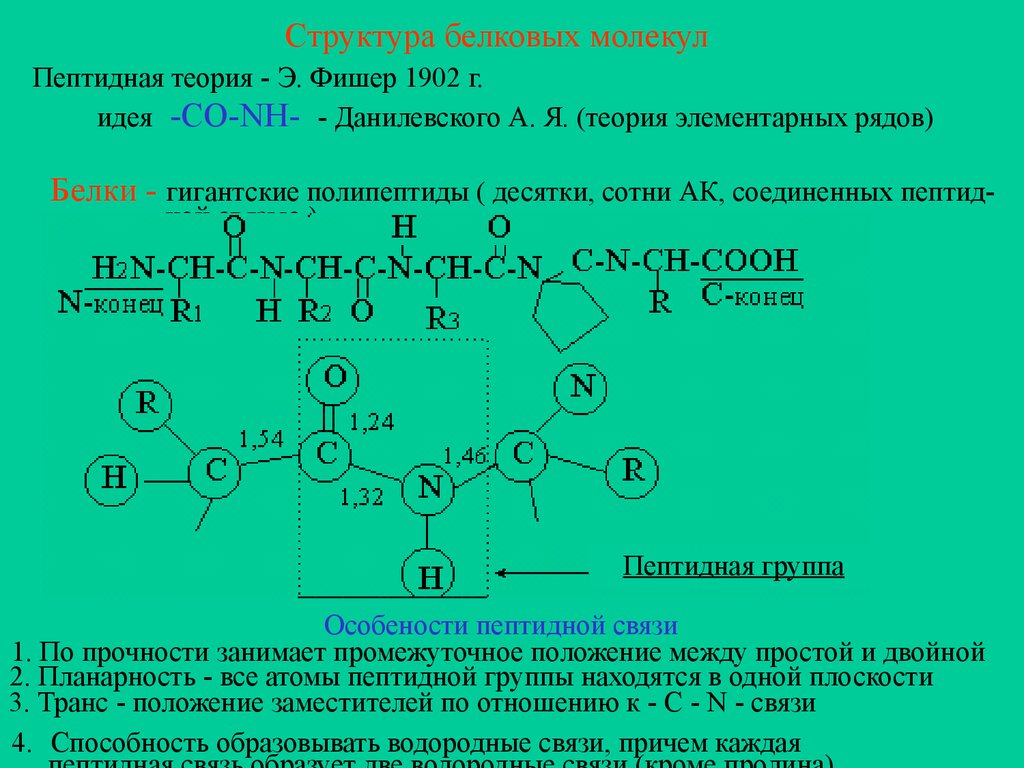
Структура белковых молекулПептидная теория - Э. Фишер 1902 г.
идея -CO-NH- - Данилевского А. Я. (теория элементарных рядов)
Белки - гигантские полипептиды ( десятки, сотни АК, соединенных пептидной связью )
Пептидная группа
Особености пептидной связи
1. По прочности занимает промежуточное положение между простой и двойной
2. Планарность - все атомы пептидной группы находятся в одной плоскости
3. Транс - положение заместителей по отношению к - С - N - связи
4. Способность образовывать водородные связи, причем каждая
7.
Доказательства наличия пептидной связи.1. В природных белках мало свободных СООН и NН2 групп.
2. В процессе гидролиза белка образуется стехиометрическое количество
свободных СООН и NН2 групп.
3. Работа пептидаз и протеаз, специфически расщепляющих петидную связь.
4. Рентгеноструктурный анализ.
5. Химический синтез полипептидов и белков известного строения.
6. Биуретовая реакция.
Биуретовая реакция:
+ NaOH
CuSO4
мочевина
розовая
фиолетовая
окраска
биурет
| Биуретовая реакция - качественная и количественная реакция на
|
пептидную связь.
8.
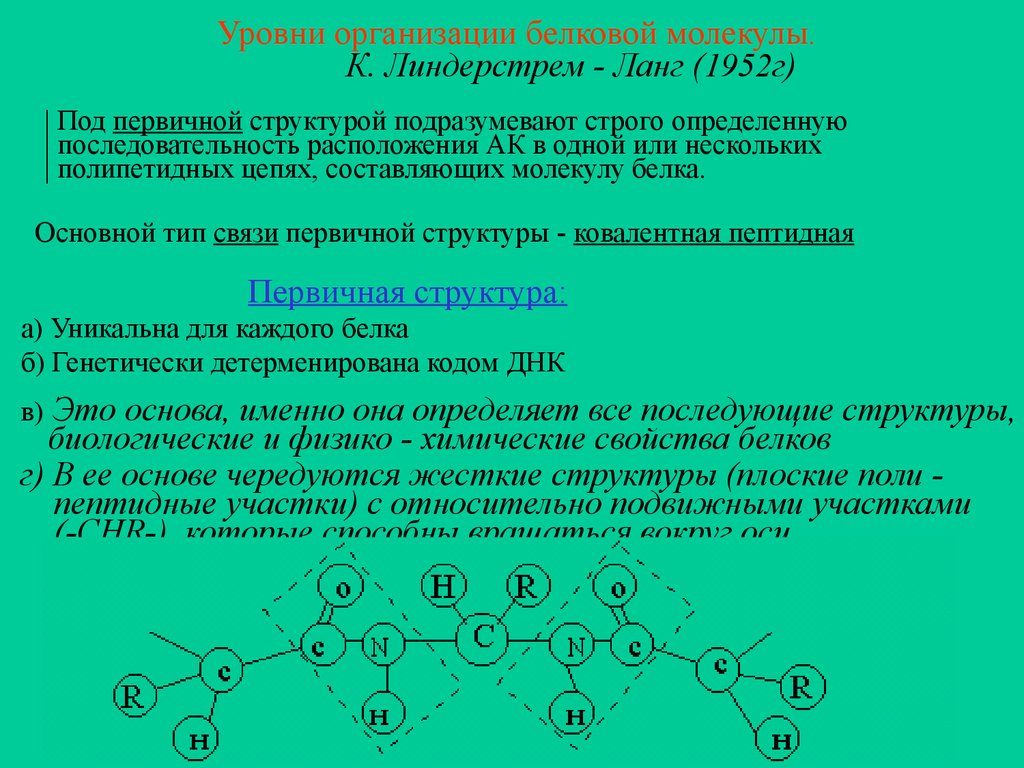
Уровни организации белковой молекулы.К. Линдерстрем - Ланг (1952г)
| Под первичной структурой подразумевают строго определенную
| последовательность расположения АК в одной или нескольких
| полипетидных цепях, составляющих молекулу белка.
Основной тип связи первичной структуры - ковалентная пептидная
Первичная структура:
a) Уникальна для каждого белка
б) Генетически детерменирована кодом ДНК
Это основа, именно она определяет все последующие структуры,
биологические и физико - химические свойства белков
г) В ее основе чередуются жесткие структуры (плоские поли пептидные участки) с относительно подвижными участками
(-CHR-), которые способны вращаться вокруг оси
в)
9.
Вторичная структура|
|
|
|
Вторичная структура - конфигурация полипептидной цепи,
способ укладки полипептидной цепи в упорядоченную структуру
благодаря образованию водородных связей между пептидными
группами одной полипептидной цепи или смежными.
основная связь - водородная межпептидная
По конфигурации вторичная структура
спиральная
(альфа-спираль
право и левовращающие)
слоисто-складчатая
(бета-структура.
кросс-бета-форма)
10.
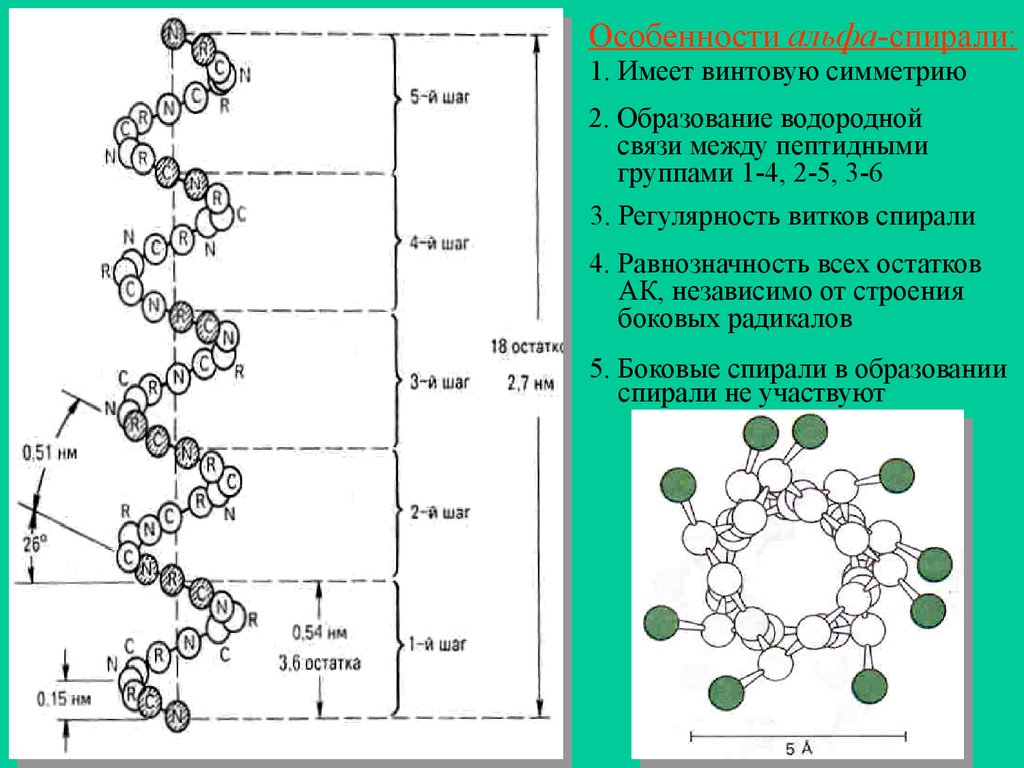
Особенности альфа-спирали:1. Имеет винтовую симметрию
2. Образование водородной
связи между пептидными
группами 1-4, 2-5, 3-6
3. Регулярность витков спирали
4. Равнозначность всех остатков
АК, независимо от строения
боковых радикалов
5. Боковые спирали в образовании
спирали не участвуют
11.
- структура - разновидность вторичной структуры, которая имеет слабоизогнутую конфигурацию полипептидной цепии и формируется за счет
межпептидных водородных связей в пределах отдельных участков одной
полипептидной цепи или смежных цепей.
12.
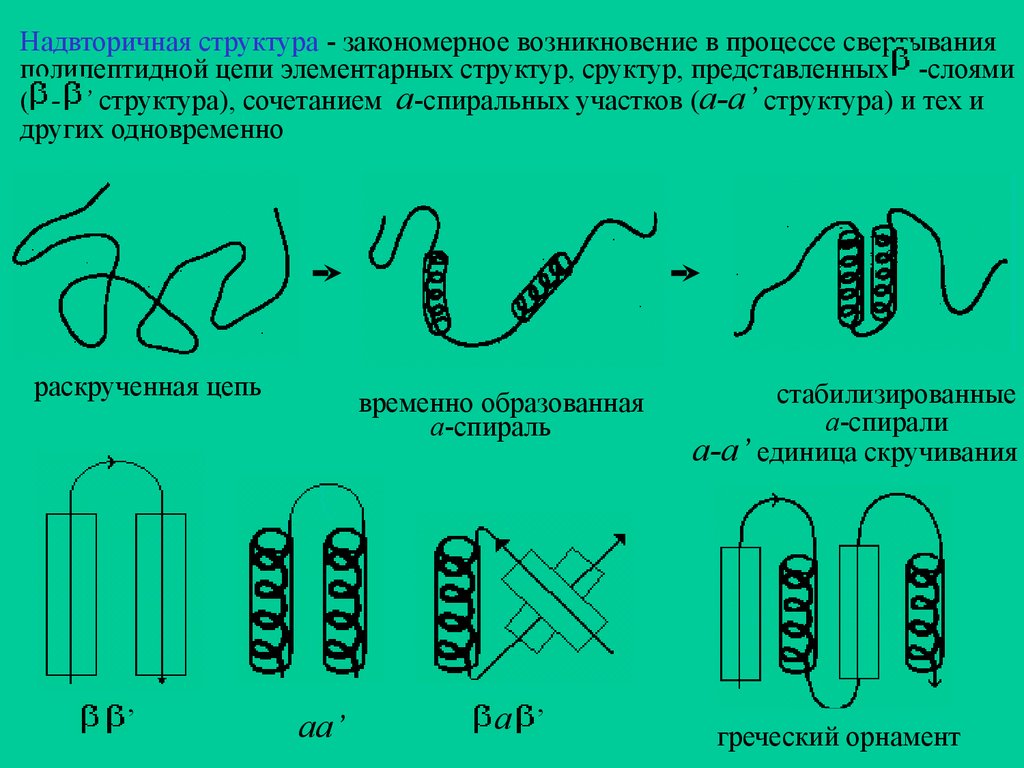
Надвторичная структура - закономерное возникновение в процессе свертыванияполипептидной цепи элементарных структур, сруктур, представленных -слоями
( - ’ структура), сочетанием а-спиральных участков (а-а’ структура) и тех и
других одновременно
раскрученная цепь
,
временно образованная
а-спираль
аа’
a
стабилизированные
а-спирали
a-a’ единица скручивания
,
греческий орнамент
13.
Соотношение альфа-спиралей и бета-структур в белкахПарамиозин
Химотрипсин
Рибонуклеаза
Инсулин
100%
14%
26%
52%
---45%
35%
6%
Третичная структура - способ укладки полипептидной цепи в
пространстве
- уникальна для каждого белка
- формируется путем самоорганизации и в энергетически более
выгодную форму сразу по завершении синтеза белка
- формируется за счет связей между радикалами
АК т.е. предопределена первичной структурой
Связи между радикалами АК,
в основном - слабые:
- водородные
- ионные
- неполярные (Ван дер Вальса)
Под доменом подразумевают обособленную
часть молекулы белка, обладающую в определенной степени структурной и функциональной
автономией
Функциональные центры молекулы белка:
- Активный центр
- Аллостерический центр
- Центры химической модификации (ацетатной,
14.
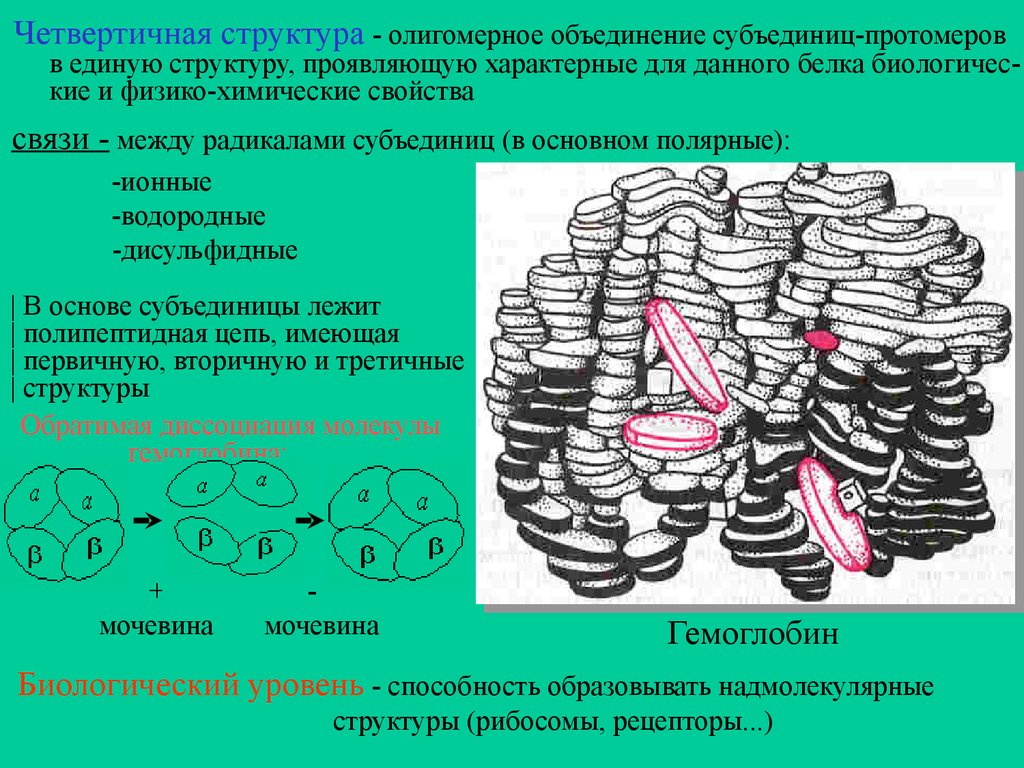
Четвертичная структура - олигомерное объединение субъединиц-протомеровв единую структуру, проявляющую характерные для данного белка биологические и физико-химические свойства
связи - между радикалами субъединиц (в основном полярные):
-ионные
-водородные
-дисульфидные
| В основе субъединицы лежит
| полипептидная цепь, имеющая
| первичную, вторичную и третичные
| структуры
Обратимая диссоциация молекулы
гемоглобина:
+
мочевина
мочевина
Гемоглобин
Биологический уровень - способность образовывать надмолекулярные
структуры (рибосомы, рецепторы...)
15.
Расшифровка структур белковой молекулы| Изучение структуры белковой молекулы-основная задача
| биохимии белка и необходимо для выяснения:
1. Молекулярной основы биологической активности белка;
2. Принципов, на основе которых из полипептидных цепей
формируются высокоспецифичные трехмерные формы;
3. Последовательность АК - связующюе звено между генетической
информацией, заложенной в ДНК и трехмерной структурой,
лежащей в основе биологической активности;
4. Молекулярной патологии изменения в последовательности
АК -- > нарушение функционирования белков -- > болезнь;
5. Путей эволюции;
6. Искусственного синтеза белков;
16.
Методы изучения структур белкаПервичная структура:
1. определение АК состава
а) полный гидролиз
б) ионнообменная хроматография - аминокислотный анализатор
2. идентификация концевых АК
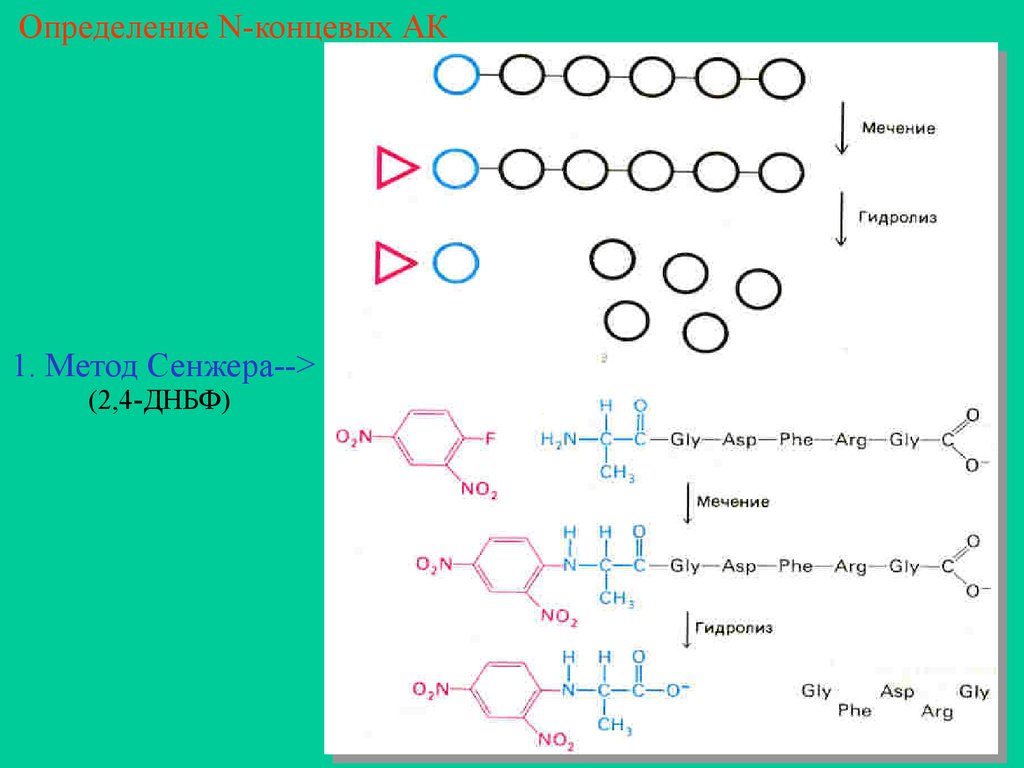
N-концевой АК
а) метод Сэнгера (2,4 ДНБФ)
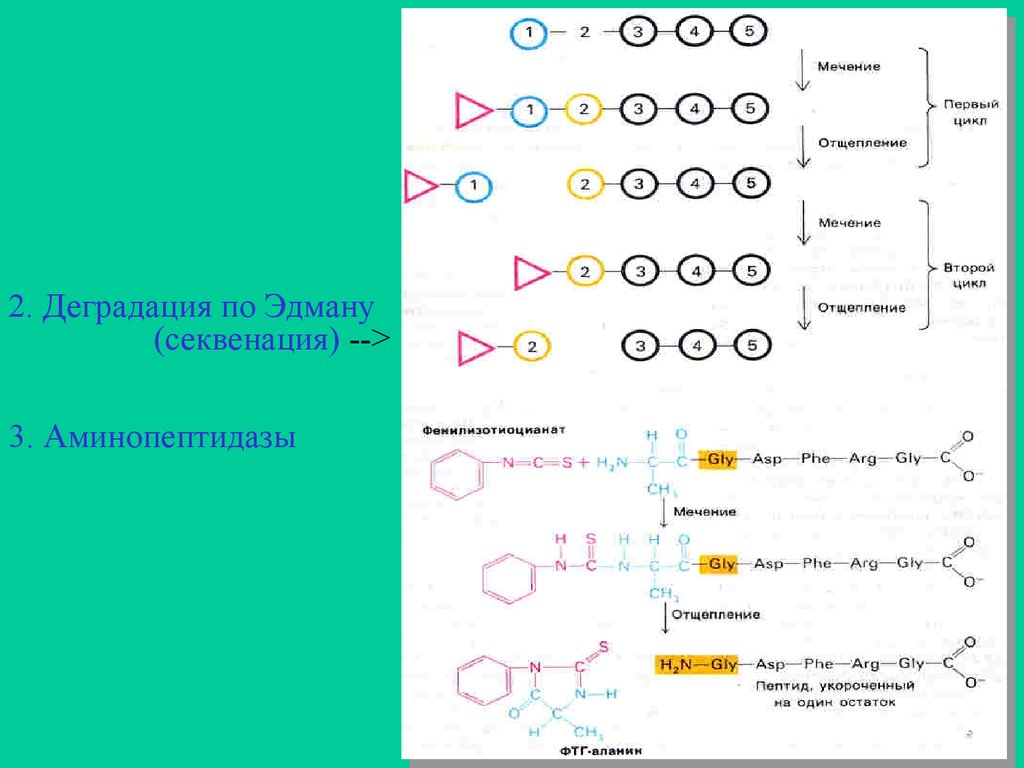
б) метод Эдмана (секвенация)
в) обработка аминопептидазами
С-концевой АК
а) метод Акабори (Н2N - NН2)
б) обработка карбоксипептидазами
3. определение последовательности АК
а) расщепление на пептиды
б) установление последовательности АК в пептидах (N и С концевые
АК, секвенация)
в) сопоставление последовательности АК в перекрывающихся
пептидах
Вторичная структура- спектрополяметрия, УФ-спектрофотометрия, методы
изотопного анализа, ИК- спектроскопия
Третичная структура - электронная микроскопия, рентгеноструктурный анализ
Четвертичная структура- электрофорез, электронная микроскопия
17.
Определение N-концевых АК1. Метод Сенжера-->
(2,4-ДНБФ)
18.
2. Деградация по Эдману(секвенация) -->
3. Аминопептидазы
19.
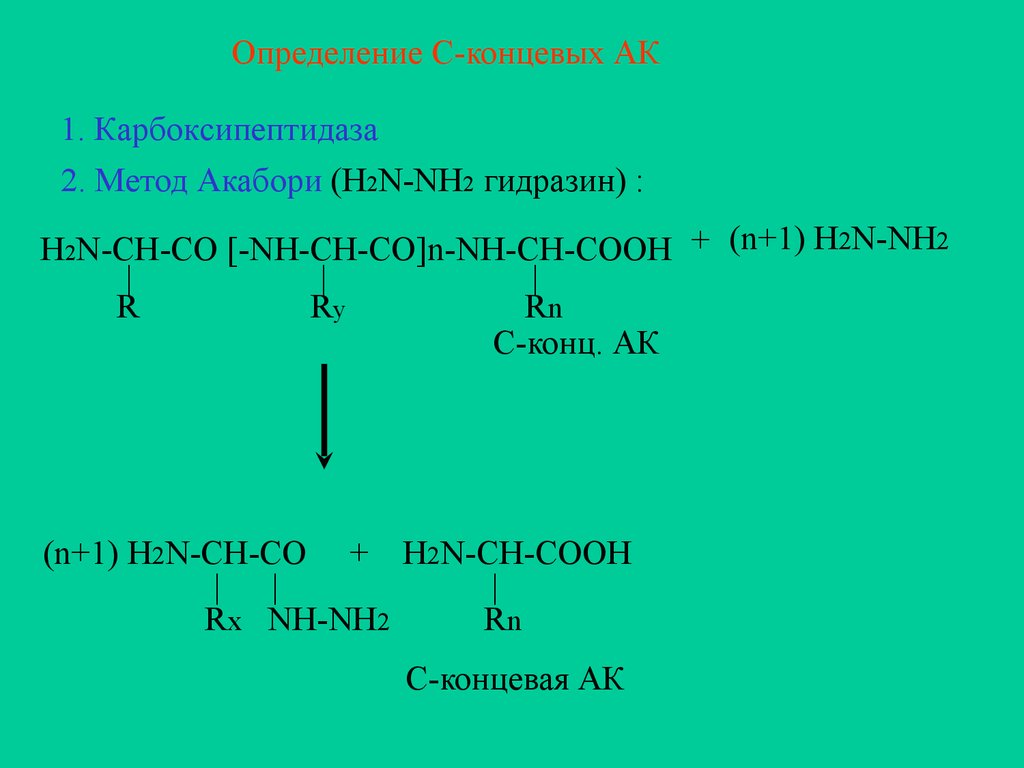
Определение С-концевых АК1. Карбоксипептидаза
2. Метод Акабори (H2N-NH2 гидразин) :
H2N-CH-CO [-NH-CH-CO]n-NH-CH-COOH + (n+1) H2N-NH2
|
|
|
R
Ry
Rn
C-конц. АК
(n+1) H2N-CH-CO + H2N-CH-COOH
|
|
|
Rx NH-NH2
Rn
С-концевая АК
20.
Метод перекрывающихся пептидовБел
осно
осн
ок
бе
жиз
жи
ова
лок
ни
ва
вал --- сер --- тре --- глю --- мет --- гли --- цис --- лей --- гис
вал --- сер --- тре А
глю --- мет --- гли В
цис --- лей --- гис С
вал --- сер --- тре --- глю А’
мет --- гли --- цис
В’
лей --- цис
С’











 Биология
Биология








