Похожие презентации:
Введение в биохимию. Структура и функция белков. Лекция 1-2
1.
Введение в биохимию.Структура и функция белков
ФГБОУ ВО БГМУ Минздрава России
Кафедра Биологической химии
Абдуллина Г.М.
2.
Целью биохимии являетсяизучение
• Химический состав живой материи
• Химические процессы, лежащие в
основе жизненедеятельности
3.
Современная биохимия являетсяфундаментальной наукой, теоретической
основой медицины и фармации
• Статическая биохимия изучает химический состав
живой материи
• Динамическая биохимия изучает обмен веществ
• Функциональная биохимия изучает химические
процессы в непосредственной связи с
физиологической функцией
• Фармацевтическая биохимия использует
биохимические методы для решения задач
фармации
4.
Величайшие открытия в биохимииОткрытие нуклеиновых кислот, Фридрих Мишер (1868)
Пептидная теория строения белков, Эмиль Фишер (1903)
Состав нуклеиновых кислот, правила Чаргаффа (1949)
Открытие α- спирали пептидной цепи, Лайнус Полинг (1951)
Открытие двойной спирали ДНК, Уотсон и Крик (1953)
Регуляция генов прокариот (Lac operon), Жакоб и Моно (1961)
Хемиосмотическая теория окислительного фосфорилирования,
Питер Митчел (1961)
• Расшифровка генетического кода, Ниренберг и Корана (1964)
• Проект Геном человека, определение последовательности ДНК
человека, (1990-2003)
5.
«Жизнь есть способсуществования белковой
материи»
Фридрих Энгельс
6.
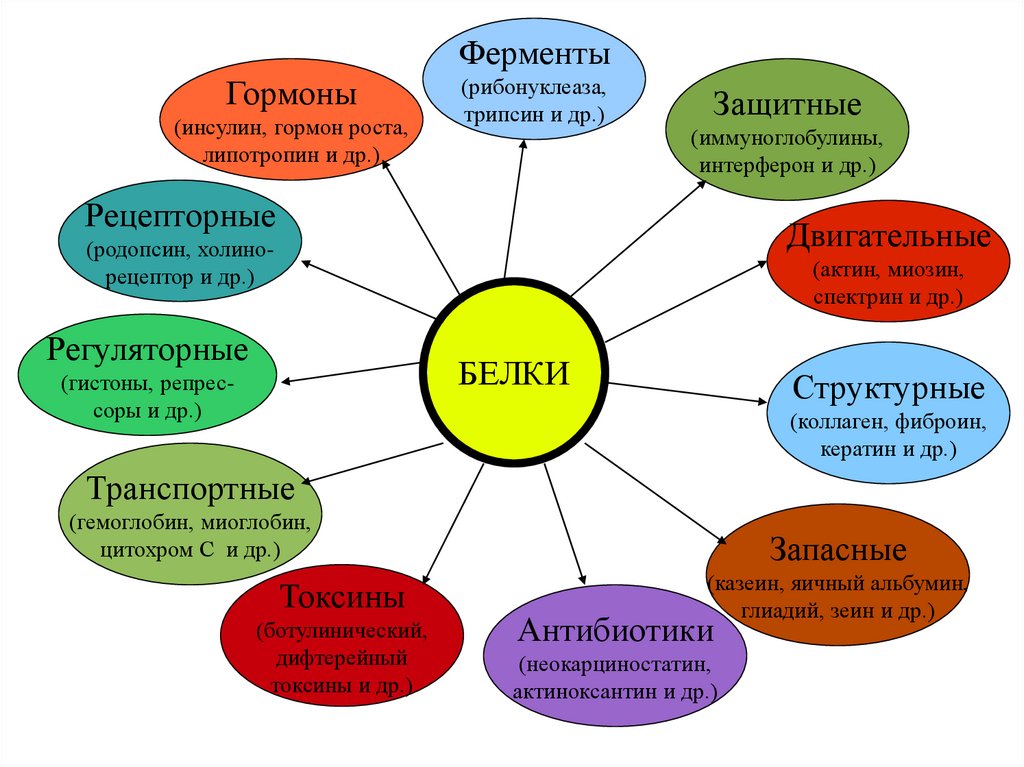
Функции белков• Структурная функция (коллаген, кератин,
эластин)
• Транспортная функция (гемоглобин, альбумин)
• Двигательная функция (сократительные белки
- актин, миозин)
• Иммунная защита (антитела, белки системы
комплемента, цитокины)
• Каталитическая функция (ферменты)
• Регуляторная функция (гормоны - инсулин,
гормон роста...)
• Трофическая функция (казеиноген молока,
овальбумин)
7.
ФерментыГормоны
(инсулин, гормон роста,
липотропин и др.)
(рибонуклеаза,
трипсин и др.)
Защитные
(иммуноглобулины,
интерферон и др.)
Рецепторные
Двигательные
(родопсин, холинорецептор и др.)
(актин, миозин,
спектрин и др.)
Регуляторные
БЕЛКИ
(гистоны, репрессоры и др.)
Структурные
(коллаген, фиброин,
кератин и др.)
Транспортные
(гемоглобин, миоглобин,
цитохром С и др.)
Токсины
(ботулинический,
дифтерейный
токсины и др.)
Запасные
(казеин, яичный альбумин,
глиадий, зеин и др.)
Антибиотики
(неокарциностатин,
актиноксантин и др.)
8.
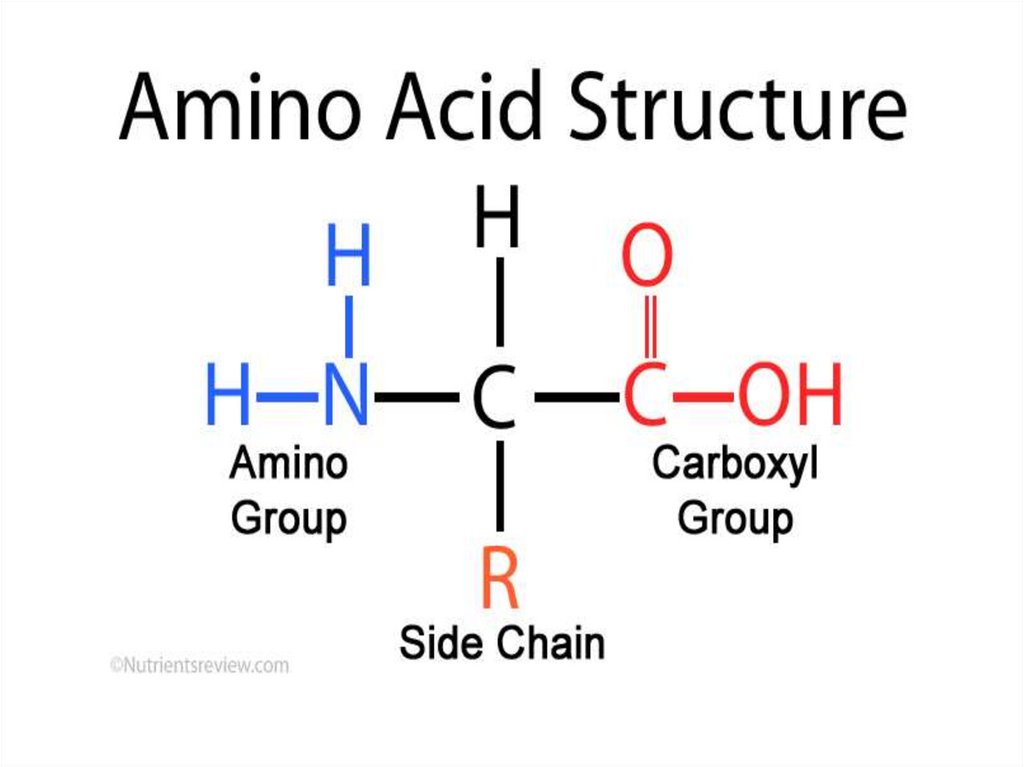
Белки – это высокомолекулярные азотсодержащиесоединения,
биополимеры,
состоящие
из
α-Lаминокислот, соединенных пептидными связями
• А. Бракконо (1820): открытие аминокислоты
глицин в гидролизате белков
• Г. Мульдер (1838): установление элементного
состава белка C40H62N10O2, содержание азота 16%
• А.Я Данилевский (1888): предположение о
наличие в белках пептидной связи –NH-CO• Э. Фишер (1903):пептидная теория строения
белков
9.
Пептидная (амидная) связь является результатомвзаимодействия между –COOH группой одной
аминокислоты и -NH2 группой другой аминокислоты
O
H
O
+
H2N CH C
N CH C
OH
H
OH
R
R
H2O
O
H2N CH C N CH C
R
H R
O
OH
10.
Электронное строение пептиднойсвязи
• Пептидная связь
• копланарна (все атомы пептидной связи
находятся в одной плоскости)
• имеет частично двойной характер
(следствие ρ,π –сопряжения и мезомерии)
• боковые радикалы аминокислот
находятся в транс-конфигурации
11.
копланарность12.
частично двойной характер13.
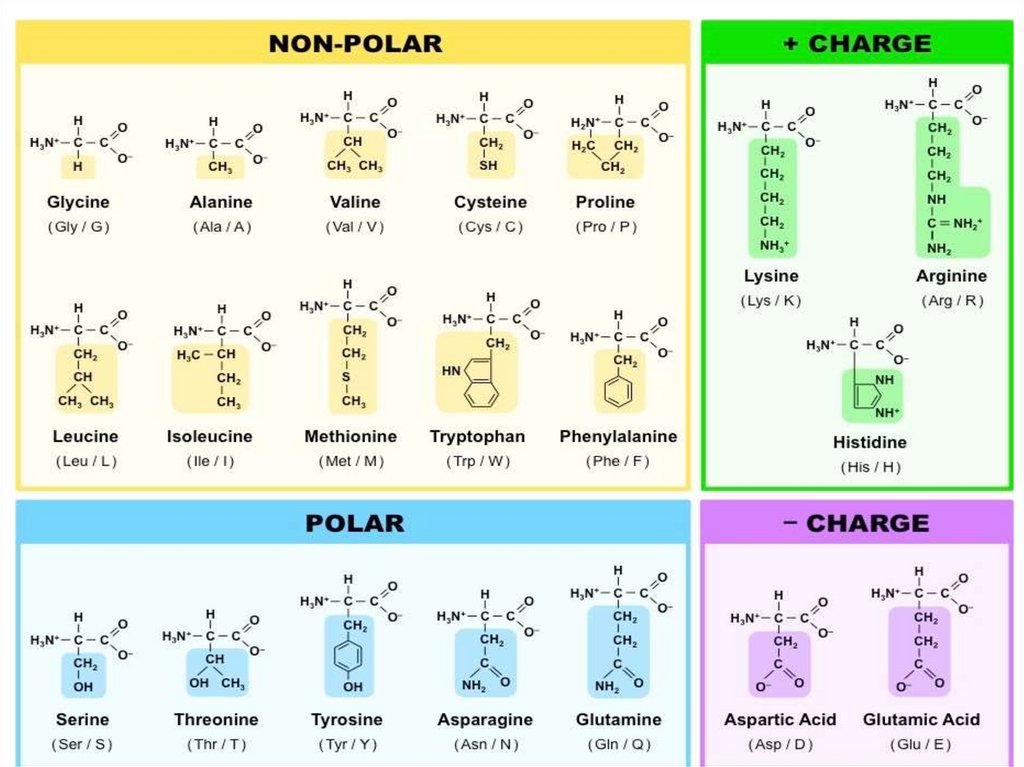
В белках обнаруживается 20аминокислот
(протеиногенные аминокислоты)
• Протеиногенные аминокислоты α, Lаминокислоты, которые классифицируются в
зависимости от характера бокового радикала
(неполярный, полярный, отрицательно
заряженный, положительно заряженный...)
14.
15.
16.
17.
18.
Стереоизомерия аминокислот19.
Уровни организации белковой молекулы(белковые структуры)
• Первичная структура – это последовательность
аминокислот в полипептидной цепи, соединенных с
помощью пептидной связи.
• Вторичная структура – это конфигурация
полипептидной цепи, которая формируется благодаря
взаимодействию функциональных групп остова
пептидной цепи
• Третичная структура – это пространственная
трехмерная форма белковой молекулы
• Четвертичная структура -это объединение нескольких
полипептидных цепей (субъединиц) в единый
олигомерный белок
20.
Остов полипептидной цепи –чередование α-углеродных атомов
и пептидных групп
(полипептидная цепь без боковых
радикалов аминокислот)
O
O
O
O
H2N CH C N CH C N CH C N CH C N CH COOH
R
H R
H R
H R
H R
21.
Первичная структура22.
23.
Вторичная структура – α-спираль иβ-структуры
24.
Связи, стабилизирующие третичную структуру:ионные, дисульфидные, гидрофобные,
водородные
25.
Четвертичная структураСубъединица (протомер)
Олигомер
26.
Аминокислоты – амфотерныесоединения, заряд которых зависит
от рН
+
H3N CH COOH
+ H+
+
H3N CH COO
R
+
-
- H+
H2N CH COO
R
+ H+
COOH
-
+ H+
CH2
COOH
+
-
- H+
H3N CH COOH
H3N CH COO
H3N CH COO
H2N CH COO
pH < 7,0
pH >> 7,0
pH << 7,0
CH2
CH2
CH2
CH2
CH2
+
R
CH2
COO
CH2
-
COO-
27.
Физико-химические свойства белковопределяемые большим размером молекул:
• способность связывать большое количество воды и
образовывать вязкие растворы с коллоидными
свойствами (белки плазмы крови обеспечивают
онкотическое давление и удерживают воду в
сосудистом русле)
• низкая скорость диффузии
• неспособность проникать через полупроницаемые
мембраны
• светорассеивание – (эффект Тиндаля)
• оптическая активность – способность вращать
плоскость поляризованного света
28.
Свойства белков,определяемые наличием как кислых, так и
основных групп и заряда
1. Белки являются амфолитами с буферными
свойствами, потому что они имеют как кислые (COOH), так и основные
COO(-NH2) группы
NH +
(белки поддерживают постоянства рН
COOв жидкостях организма)
NH
3
3
+
COO-
2. Белковые молекулы заряжены - полиионы и могут
быть разделены методом электрофореза
29.
Электрофорез в клиническойлаборатории используется для
разделения белков плазмы крови.
• 1. Электрофоретическое разделение
осуществляется при рН 8,6. Белки
заряжаются отрицательно ( диссоциация –
COOН групп) и движутся к аноду
• 2. После завершения пробега белки
фиксируются метанолом
• 3. Затем окрашиваются
• 4.Белковые фракции определяются
количественно методом денситометрии
30.
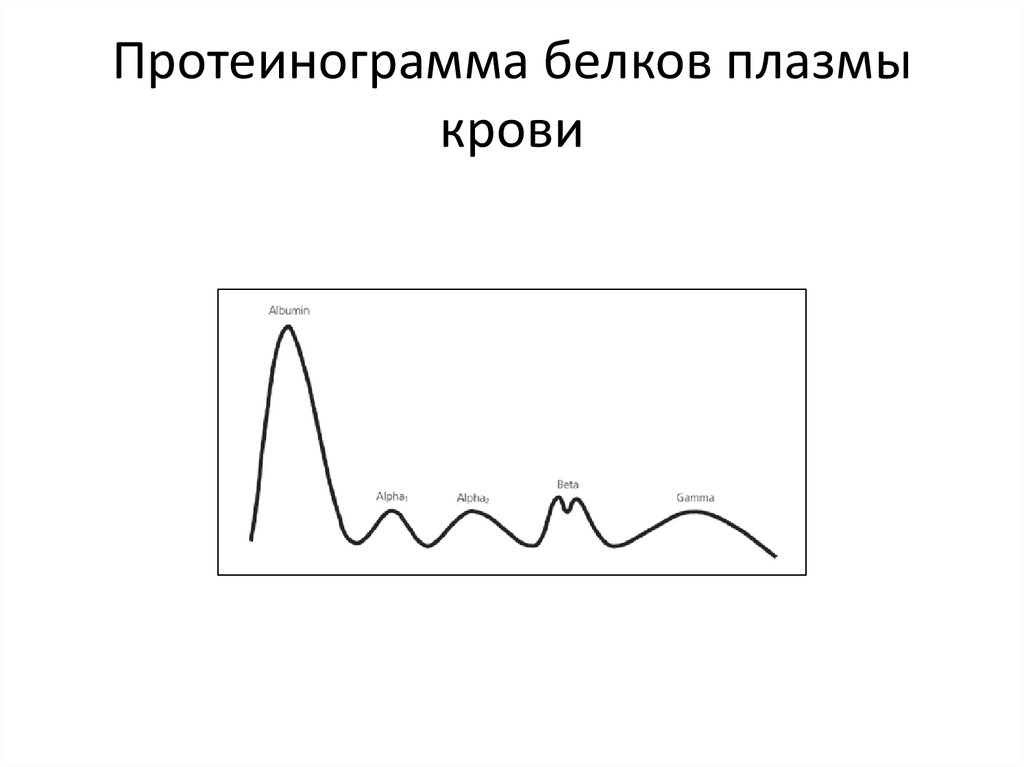
Протеинограмма белков плазмыкрови
31.
При электрофорезе на бумаге (иполиакриламидном геле) более чем
200
белков
плазмы
крови
разделяются на 5 фракций:
Альбумины 55-65 %
α1 –глобулины - 4-7%
α2-глобулины - 5-9%
β-глобулины - 7-14%
γ-глобулины - 14-22%
32.
Аминокислоты с ионизируемыми кибоковыми радикалами
С отрицательно заряженными радикалами (аспартат, глутамат)
+
H3N CH COO
-
+
H3N
CH
CH2
CH2
COO-
CH2
COO -
COO -
С положительно заряженными стороной радикалами
(гистидин, лизин, аргинин)
+
H3N CH COO
CH2
N
NH+
+
H3N
CH
COO -
+
H3N
COO -
CH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
NH
NH3+
C
NH2
NH2+
33.
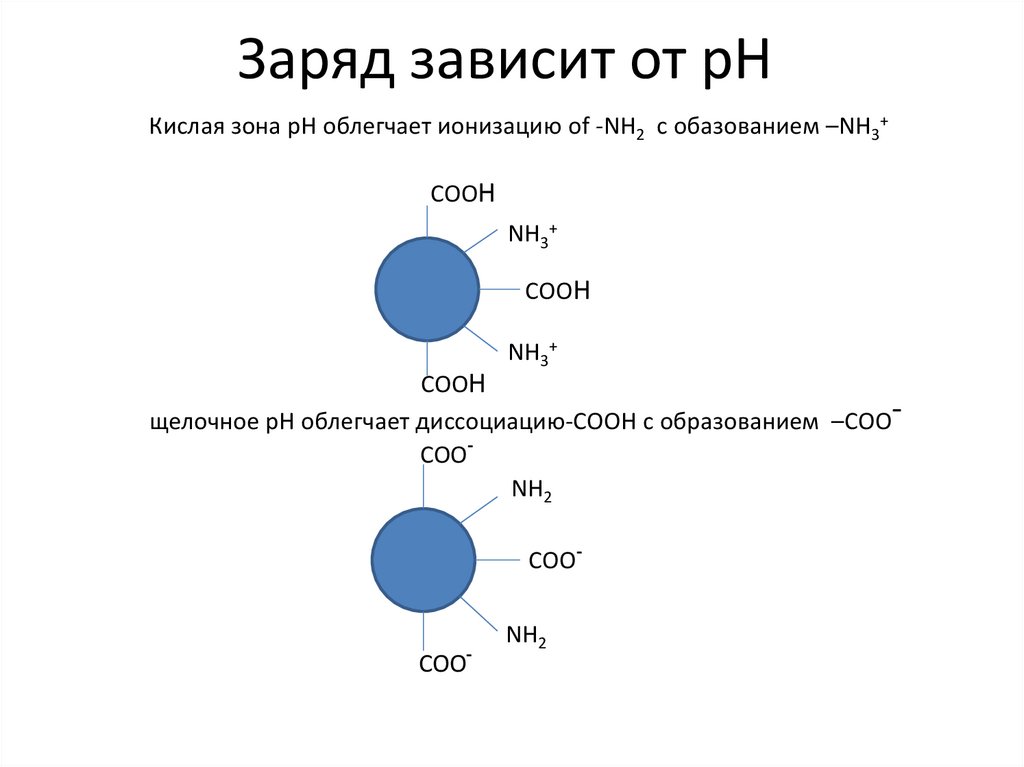
Заряд зависит от рНКислая зона рН облегчает ионизацию of -NH2 с обазованием –NH3+
COOH
NH3+
COOH
NH3+
COOH
щелочное рН облегчает диссоциацию-COOH с образованием –COOCOONH2
COO-
-
COO
NH2
34.
при определенном рН количество положительнозаряженных групп равно числу отрицательно
заряженных групп –
суммарный заряд равен нулю
NH3+
COO-
COO-
NH3+
35.
• Изоэлектрическая точка - это рН, при которомбелок является электрически нейтральным
(суммарный заряд равен нулю)
• В изоэлектрическом состоянии белок не
подвижен в электрическом поле и менее
стабилен в водном растворе
• Изоэлектричесая точка основных белков с
преобладанием основных аминокислот
(аргинин, гистидин, лизин) находится в
щелочной среде (пример – ядерные белки
гистоны)
• Изоэлектрическая точка кислых белков с
преобладанием кислых аминокислот
(аспарата, глутамата) находится в кислой среде
(белки клейковины злаковых)
36.
Растворимость• Глобулярные белки как правило растворимы в воде
благодаря
следующему
распределению
функциональных
групп:
полярные
радикалы
располагаются снаружи, неполярные гидрофобные
находятся внутри белковых частиц.
• Заряд и гидратная оболочка стабилизируют белковую
молекулу в растворе.
HO
+ HN
3
HO
2HNOC
COO-
CONH2
+
-
COO-
+
-
NH3+
37.
Осаждение белков• Высаливание – осаждение белков добавлением солей
щелочных и щелочноземельных металлов– NaCl,
(NH4)2SO4).
• Механизм: нейтрализация заряда и удаление гидратной
оболочки. Процесс обратим, нативная конформация не
нарушается, биологическая активность не теряется.
• Денатурация - нарушение нативной конформации путем
разрыва слабых связей, стабилизирующих вторичную,
третичную и четвертичную структуры белка, не влияя на
первичную структуру. Процесс необратим и связан с
потерей биологической активности
38.
Денатурирующие агенты• Физические: повышенная температура,
ультразвук, ионизирующая радиация…
• Химические : тяжелые металлы, органические
растворители, минеральные и органические
кислоты, основания, мочевина
Нативная
конформация
Денатурированный белок
39.
Нарушения фолдинга белков• Фолдинг белка - процесс формирования третичной
структуры (конформации), связанную с
биологической активностью. Фолдинг белка - это
спонтанный самопроизвольный процесс, который
контролируется специфическими белками
шаперонами.
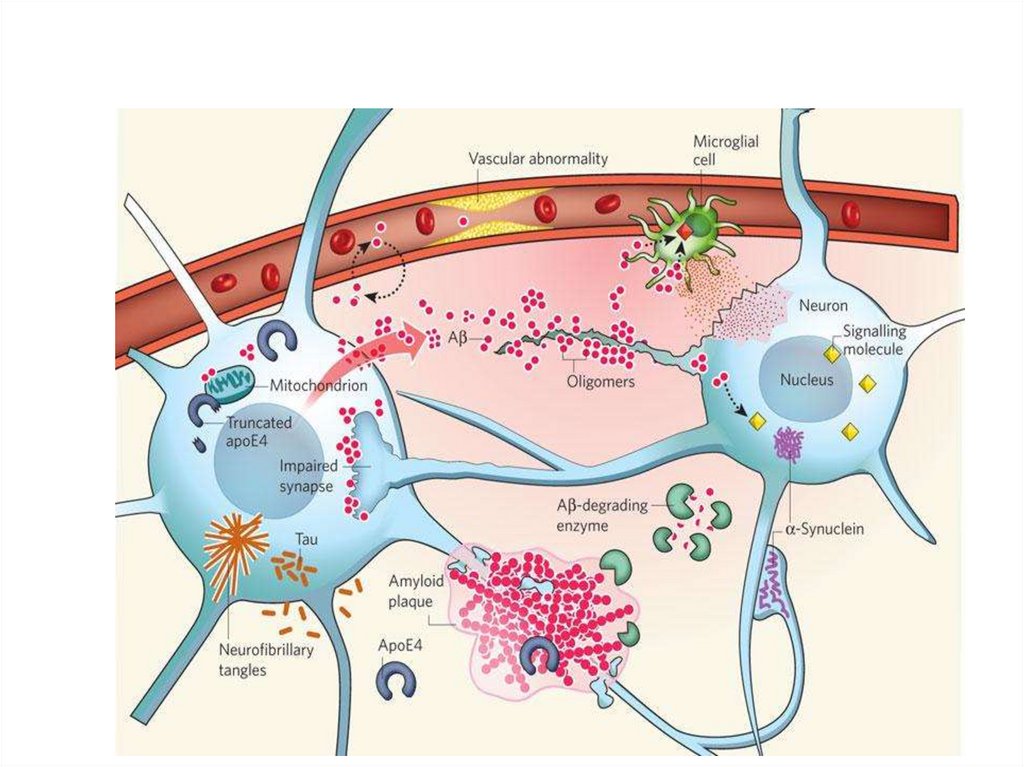
• Болезни, вызванные накоплением белков с
нарушенной конформацией (мисфолдинг белков):
• Болезнь Альцгеймера - нейродегенеративное
заболеванием, вызванным осаждением
фибриллярного амилоидного белка в головном
мозге.
• Амилоид - фибриллярный агрегат, состоящий из
множественных копий белка с неправильной
конформацией.
40.
41.
• Prion diseases (Creutzfeldt–Jakob disease,kuru, “mad cow disease’’)
• Prions (proteinaceous infectious particle)
are misfolded proteins with the ability to
transmit their misfolded shape onto normal
variants of the same protein.
• The abnormal three-dimensional structure is
suspected of conferring infectious properties,
collapsing nearby protein molecules into the
same shape.
42.
.There are two classes of proteins on the basisof their composition
• 1. Simple proteins which are made up of
amino acids exclusively.
• Examples:
• Histones – nuclear basic proteins
characterized by the high content of basic
amino acids (lysine, arginine, histidine)
• 2. Conjugated proteins in addition to amino
acids have some non-protein part referred to
as prosthetic group
43.
• HoloproteinApoprotein
Prosthetic
group
Conjugated proteins are classified on the basis of the chemical nature of their prosthetic group:
Prosthetic group
Conjugated protein
1.
Carbohydrates
1.
Glycoproteins and proteoglicans
2.
Lipids
2.
Lipoproteins
3.
Colored chemical groups – heme 3.
Chromoproteins
[red], flavin [yellow]
4.
Phosphoric acid
1.
Phosphoproteins
5.
Ribonucleic or deoxyribonucleic 2.
Nucleoproteins
acids – RNA, DNA
6.
Specific metals
1.
Metaloproteins
44.
Nucleoproteins – complex of nucleicacids (RNA, DNA) with proteins
• Nucleic acids are biopolymers, composed of
nucleotides linked with the help of 3‘-5’phosphodiester bonds
• The each nucleotide consists of 3 components:
• Nucleic base + pentose sugar + phosphate
group
45.
Primary structure of nucleic acids is a polynucleotidechain (in human DNA up to 3 billion nucleotides)
46.
Secondary structure of DNA is a double helix- twoantiparallel polynucleotide chains, stabilized by
hydrogen bonds between complementary bases
Adenine
Thymine
Guanine
Cytosine
47.
Tertiary structure is a packing of DNA inchromatin.
DNA of 23 pairs of chromosomes with the total
length up to 2 meters are condensed into a size of
nucleus (5 nanometers)
Chemical composition of chromatin:
• 2/3 by weight – proteins (50% histone and
50% of non-histone proteins)
• 1/3 - DNA
48.
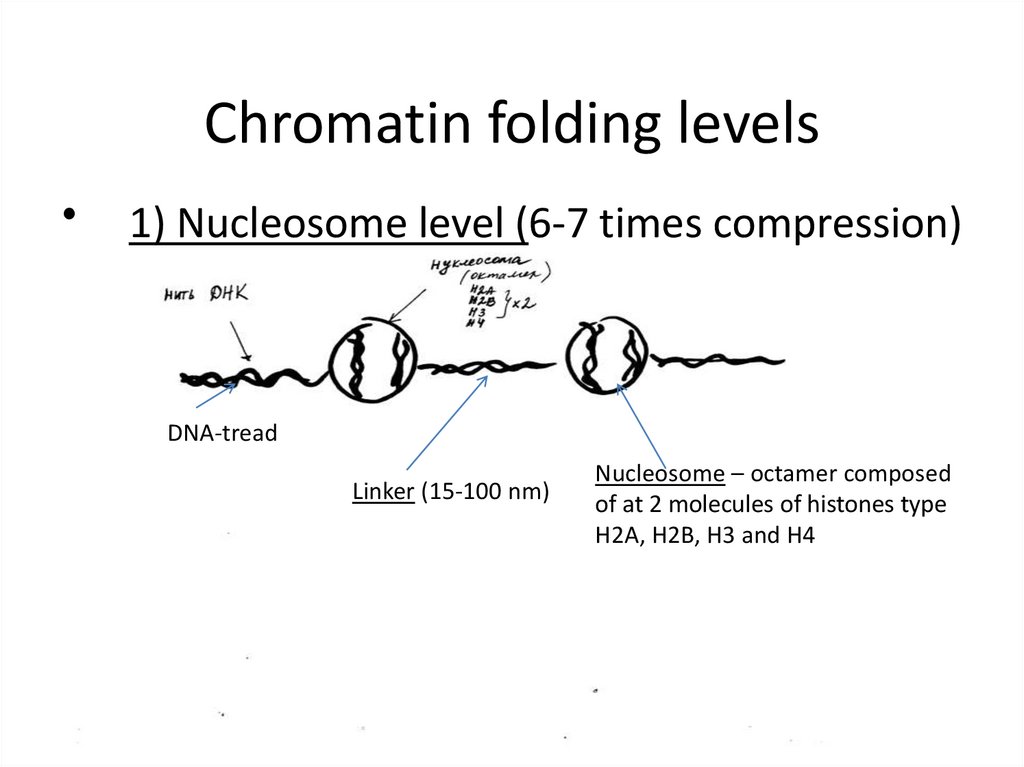
Chromatin folding levels1) Nucleosome level (6-7 times compression)
DNA-tread
Linker (15-100 nm)
Nucleosome – octamer composed
of at 2 molecules of histones type
H2A, H2B, H3 and H4










































 Биология
Биология Химия
Химия








