Похожие презентации:
Введение в биохимию. Строение и функции белков
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по теме:«ВВЕДЕНИЕ в БИОХИМИЮ.
Строение и функции
белков-1»
КРАСНОДАР
2009
2. БИОХИМИЯ -
БИОХИМИЯ наука, изучающая химическийсостав живых организмов,
химические процессы, которые
лежат в основе
жизнедеятельности и
обеспечивают организму
сложную морфологическую
целостность и высокую
функциональную активность
3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ -
ПОЗНАНИЕ ХИМИЧЕСКИХОСНОВ ЖИЗНИ,
УСЛОВИЙ И
МЕХАНИЗМОВ ЕЁ
ВОЗНИКНОВЕНИЯ И
РАЗВИТИЯ
4. Основные признаки живого:
• Важнейшее проявлениежизни – непрекращающийся
обмен веществом и
энергией организма с
окружающей средой;
5.
• Сложность и высокийуровень структурной
организации живого;
6.
• Наличие строгоопределенных функций у
каждого компонента живого;
• Способность к точному
самовоспроизведению
(способность к росту,
самообновлению,
размножению);
7.
• Необходимостьподдержания
постоянства условий
существования
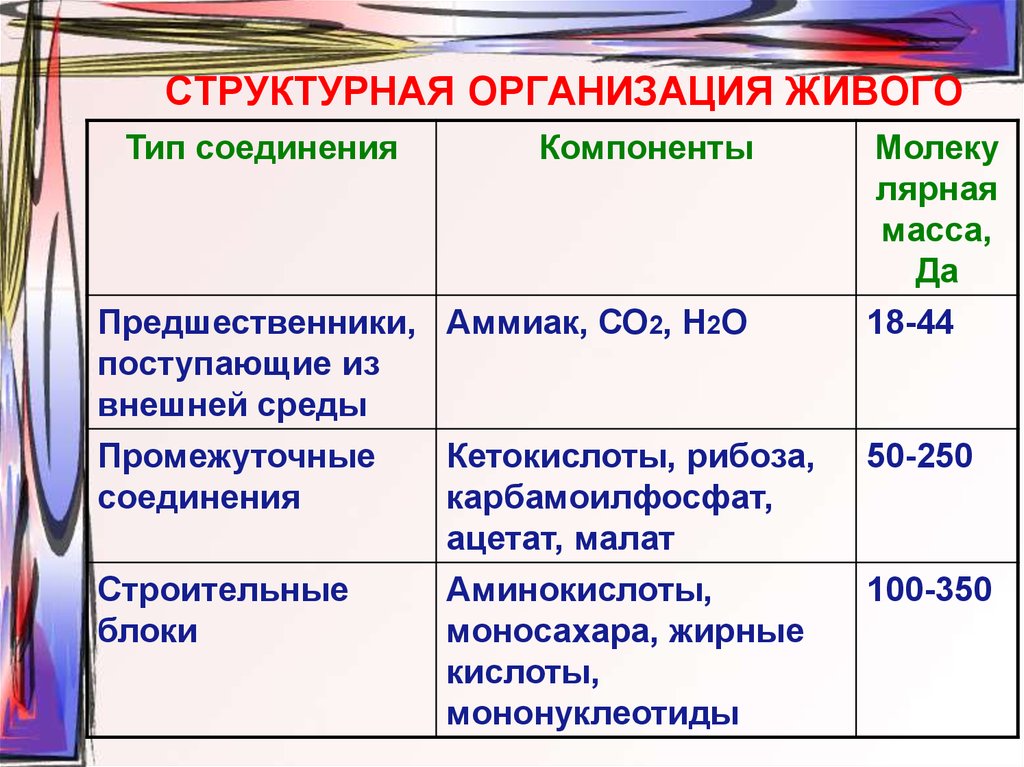
8. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ЖИВОГО
Тип соединенияКомпоненты
Предшественники, Аммиак, СО2, Н2О
поступающие из
внешней среды
Промежуточные
Кетокислоты, рибоза,
соединения
карбамоилфосфат,
ацетат, малат
Строительные
Аминокислоты,
блоки
моносахара, жирные
кислоты,
мононуклеотиды
Молеку
лярная
масса,
Да
18-44
50-250
100-350
9.
МакромолекулыБелки, липиды,
сложные углеводы,
нуклеиновые кислоты
3
6
10 - 10
3
9
Надмолекулярные Полиферментные
10 - 10
комплексы
системы, рибосомы,
сократительные
системы
Клеточные
Ядро, митохондрии,
органеллы
микросомы, лизосомы
ЖИВАЯ КЛЕТКА
10. Метаболизм -
Метаболизм совокупностьхимических превращений
веществ от момента
поступления их в клетку
до выделения конечных
продуктов
11. Метаболизм
Катаболизм –совокупность
поэтапных
ферментативных
процессов
расщепления
сложных молекул
до простых.
Идет с
высвобождением
энергии –
экзэргонический
процесс
Анаболизм –
совокупность
поэтапных
ферментативных
процессов
построения
сложных веществ из
более простых
предшественников.
Идет с затратой
энергии,
эндэргонический
процесс
12. Живые организмы
аутотрофные,гетеротрофные, которые
синтезирующие
органические
соединения из
неорганических
не способны
синтезировать
органические вещества из
неорганических. Для
синтеза необходимых для
своей жизнедеятельности
органических веществ им
требуются органические
вещества, произведённые
другими организмами
13. Разделы биохимии:
• Статическая биохимия;• Динамическая;
• Функциональная;
• Молекулярная биология.
14. Задачи медицинской биохимии:
• Изучение химическогосостава и химических
процессов, протекающих
в больном и здоровом
организме;
15.
• Разработка методов,позволяющих выявлять
нарушение биохимических
процессов с целью
диагностики заболеваний;
16.
• Разработка основфармакотерапии и
• рационального питания
здорового и больного
человека.
17. Объекты биохимического исследования
Целостный организм;
Изолированные органы;
Срезы органов и тканей;
Гомогенаты тканей;
Субклеточные структуры;
Молекулы.
18. Методы биохимии
• Химические (качественный иколичественный анализ);
• Физические (изотопный,
ультрацентрифугирование,
ультразвуковой);
• Физико-химические (рН,
хроматография, электрофорез, диализ);
• Гистологический;
• Биологический (опыты на животных);
• Биохимический (ферментативный
анализ).
19. 1903 год Карл Небберг
Предложил термин биохимия.Биохимия – наука о химическом
составе живых организмов,
химических превращениях,
протекающих в организме
животных и растений
20.
Ганс Карл Симонфон Эйлер (ван
Улер)
немецко-шведский
биохимик (1873-1964).
Выдающаяся личность:
лауреат Нобелевской
премии (1929 г.),
Большого креста
Федеральной службы
ФРГ (1959 г.). Почетный
академик 7 университетов
мира.
Создал первый
учебник по
медицинской
химии
21.
А. Я. Данилевский( 1838 - 1923 )
Первая кафедра
медицинской
химии
(1862 год)
22. Профессор Н.П.Пятницкий – основатель кафедры биохимии КГМУ
23. Профессор П.Г.Сторожук
24. Профессор И.М. Быков
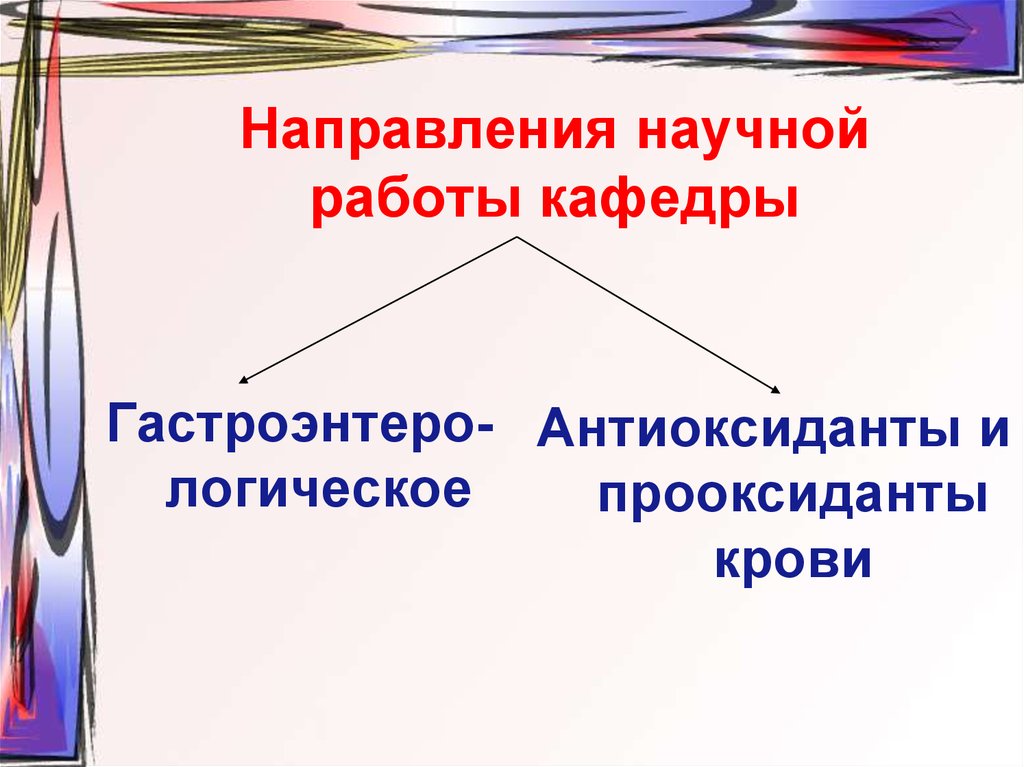
25. Направления научной работы кафедры
Гастроэнтеро- Антиоксиданты илогическое
прооксиданты
крови
26. БЕЛКИ-
БЕЛКИВЫСОКОМОЛЕКУЛЯРНЫЕАЗОТСОДЕРЖАЩИЕ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ,
МАЛО ОТЛИЧАЮЩИЕСЯ ПО
ЭЛЕМЕНТАРНОМУ СОСТАВУ, НО
РЕЗКО ОТЛИЧАЮЩИЕСЯ ПО
ХИМИЧЕСКОМУ СОСТАВУ,
СТРОЕНИЮ, СВОЙСТВАМ,
ФУНКЦИЯМ И СОСТАВЛЯЮЩИЕ
ОСНОВУ ВСЕГО ЖИВОГО
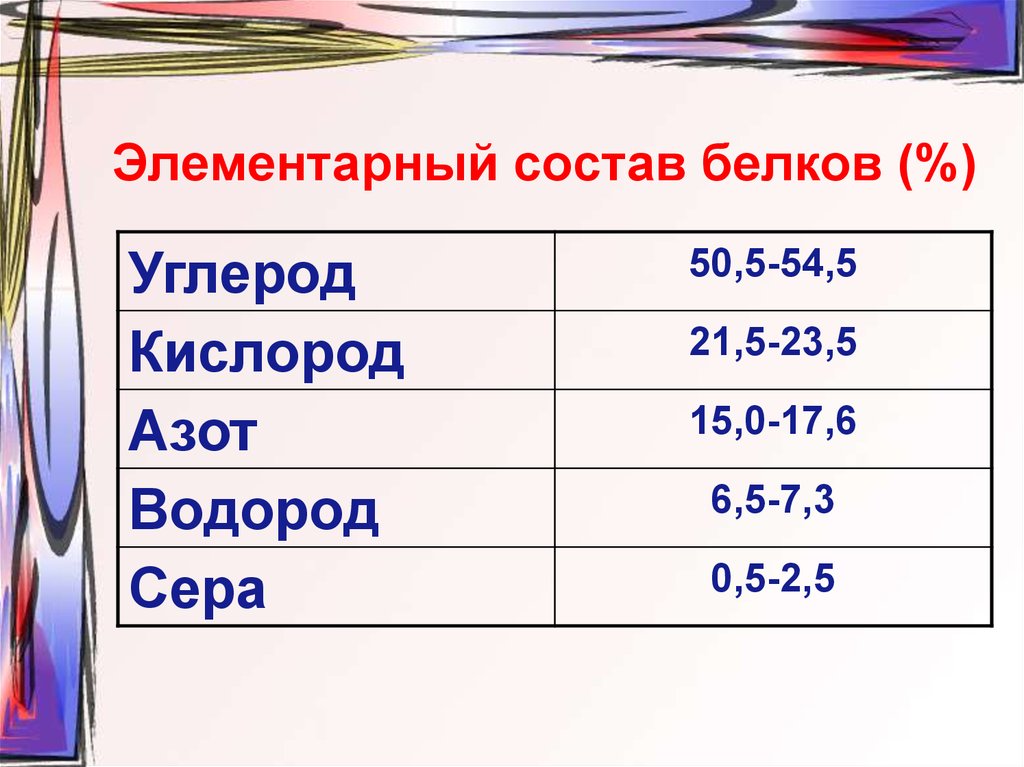
27. Элементарный состав белков (%)
УглеродКислород
Азот
Водород
Сера
50,5-54,5
21,5-23,5
15,0-17,6
6,5-7,3
0,5-2,5
28. Химический состав белков (аминокислотный)
ЗаменимыеНезаменимые
Глицин
Аланин
Серин
Метионин
Валин
Лейцин
Цистеин
Аспарагиновая кислота
Глутаминовая кислота
Изолейцин
Треонин
Лизин
Тирозин
Аспарагин
Глутамин
Фенилаланин
Триптофан
Аргинин
Пролин
Гистидин
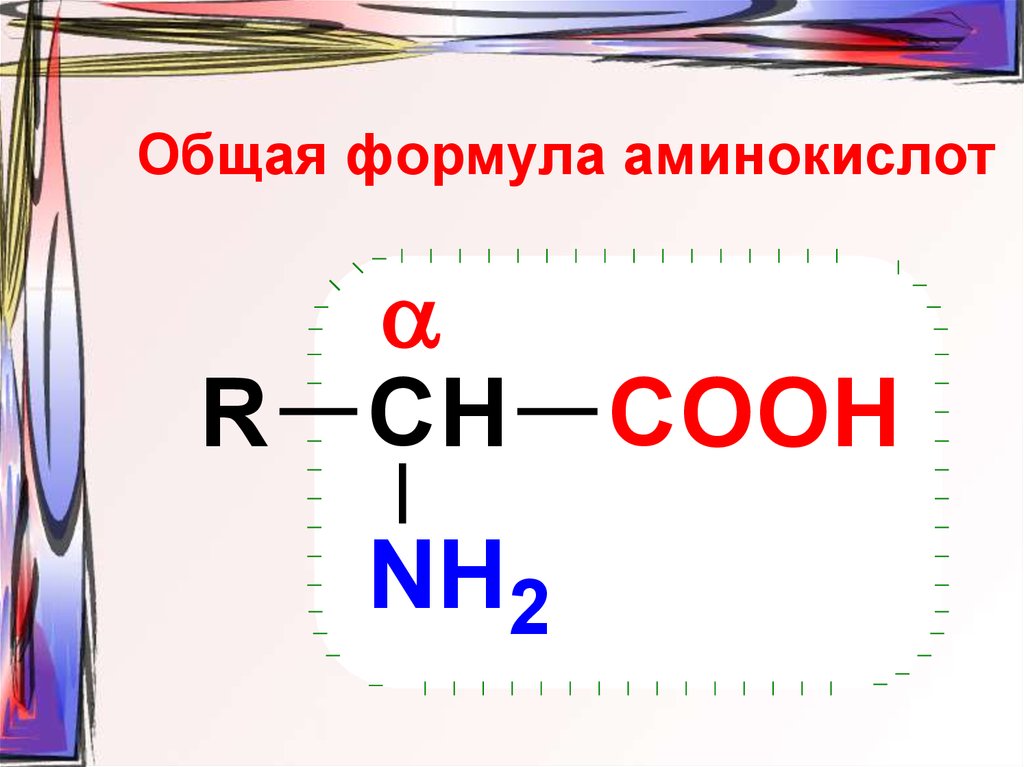
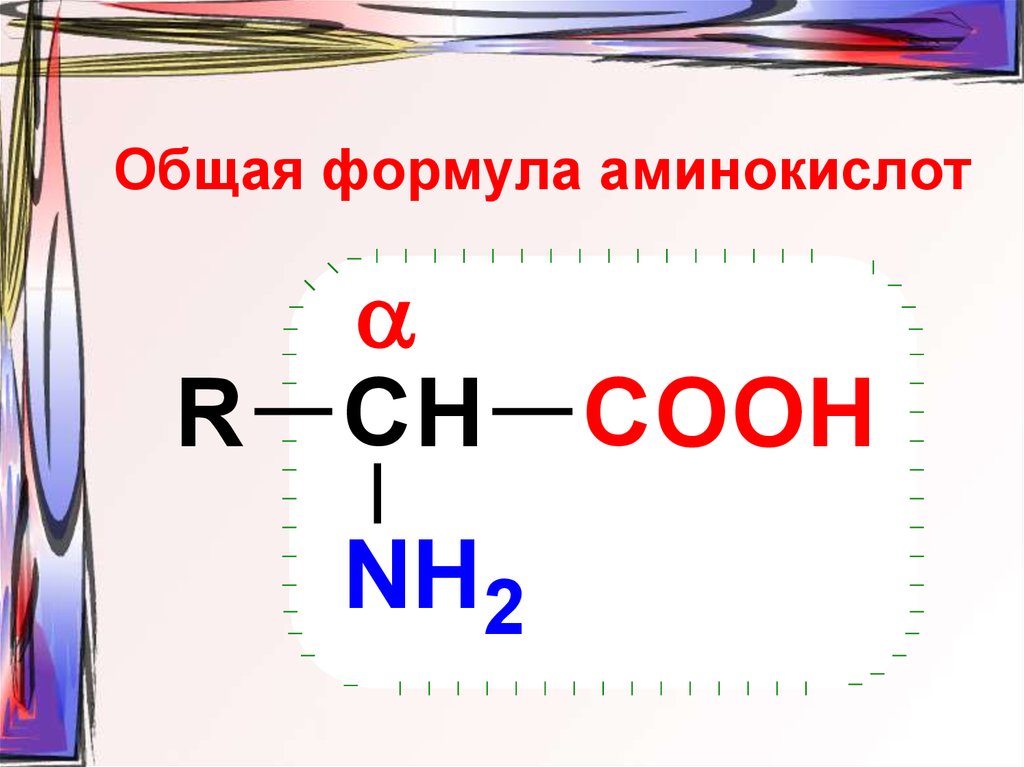
29. Общая формула аминокислот
RСН
NH2
COOH
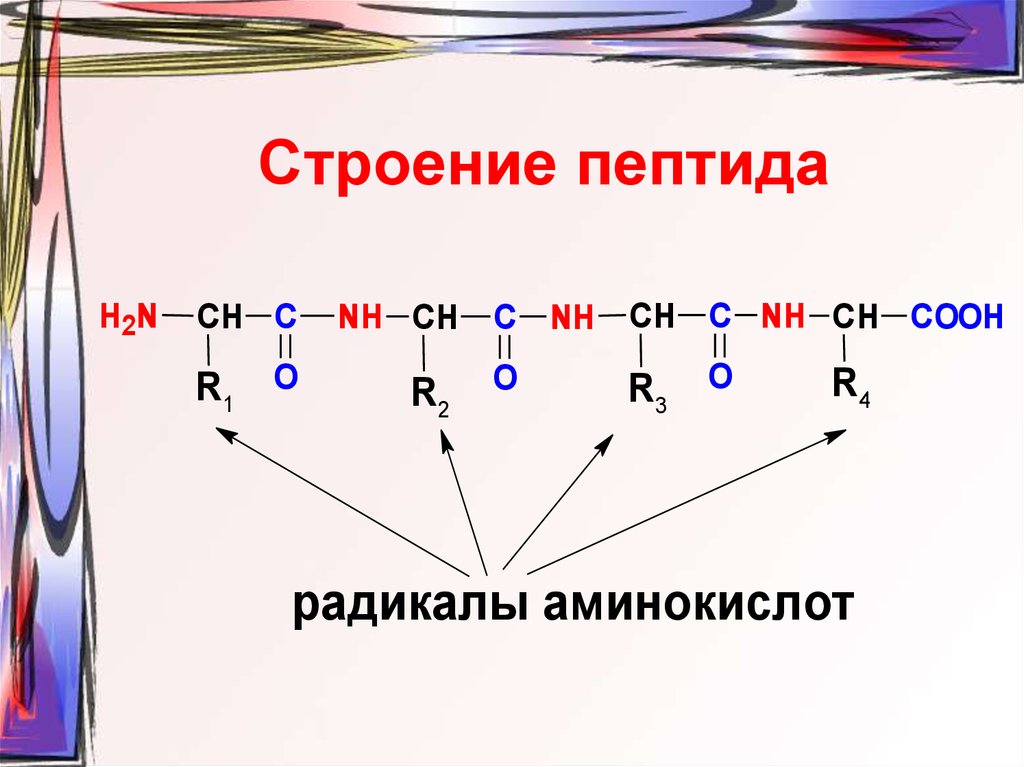
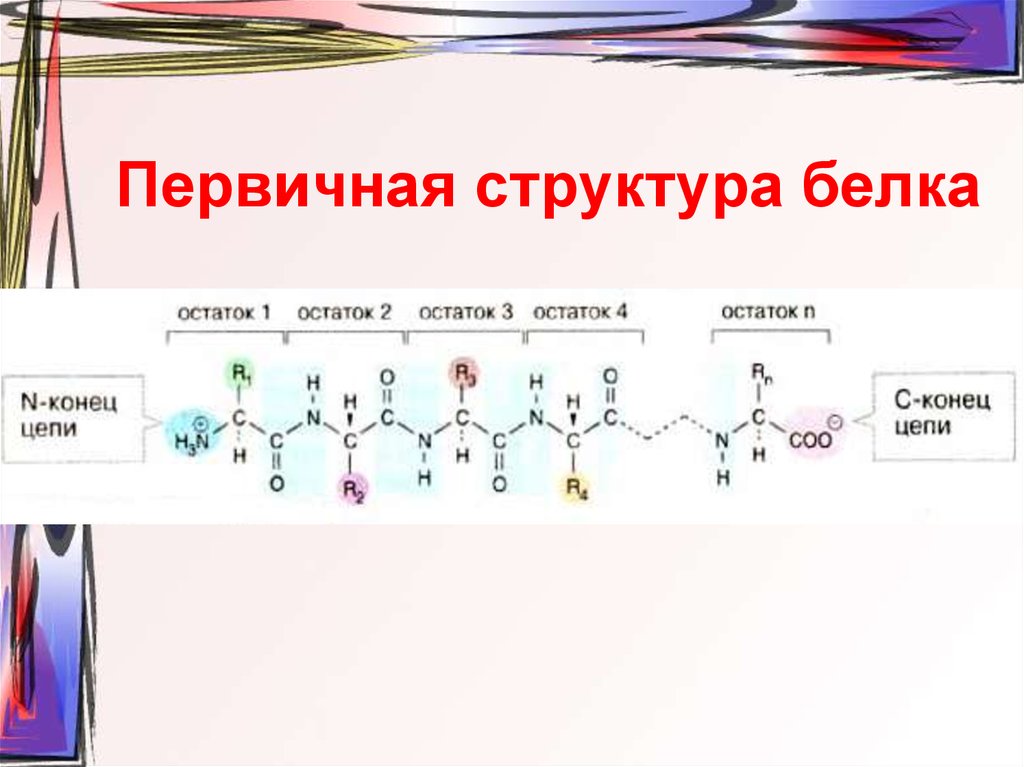
30. Строение пептида
H2NCH C
R1 O
NH CH C NH CH C NH CH COOH
R2
O
R3
O
R4
радикалы аминокислот
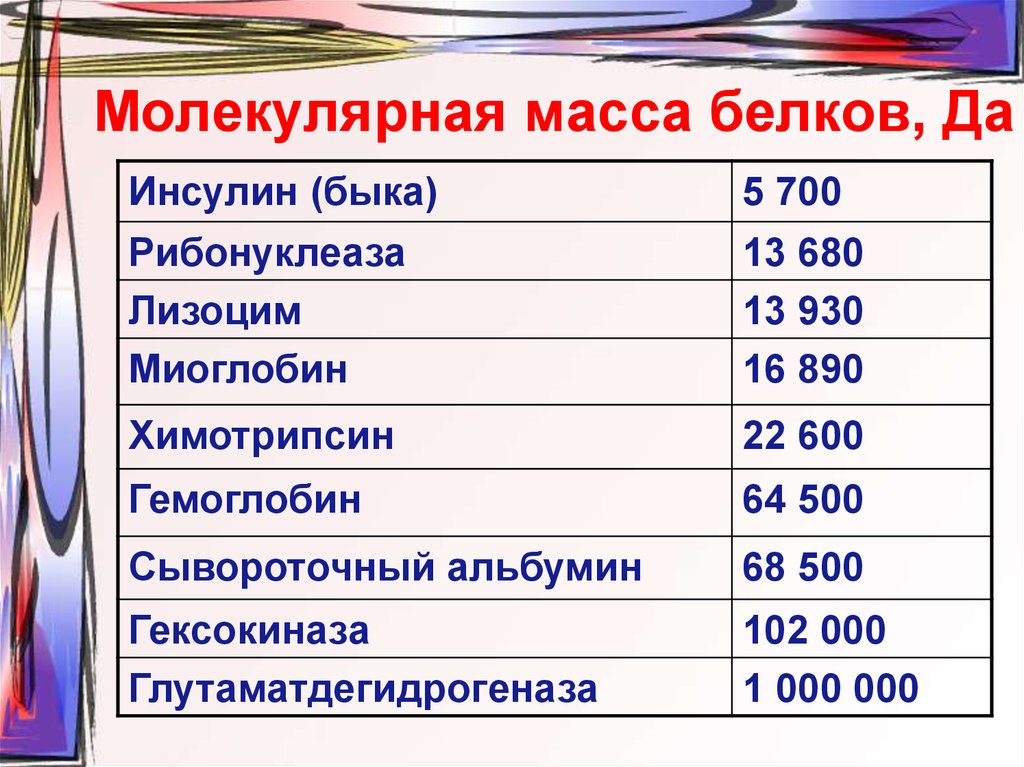
31. Молекулярная масса белков, Да
Инсулин (быка)5 700
Рибонуклеаза
Лизоцим
Миоглобин
13 680
13 930
16 890
Химотрипсин
22 600
Гемоглобин
64 500
Сывороточный альбумин
68 500
Гексокиназа
Глутаматдегидрогеназа
102 000
1 000 000
32. Форма белковых молекул
• Глобулярные(шарообразные)
• Фибриллярные
(нитевидные)
33. Физико-химические свойства белков:
• Растворимость;• Гидратация;
• Ионизация.
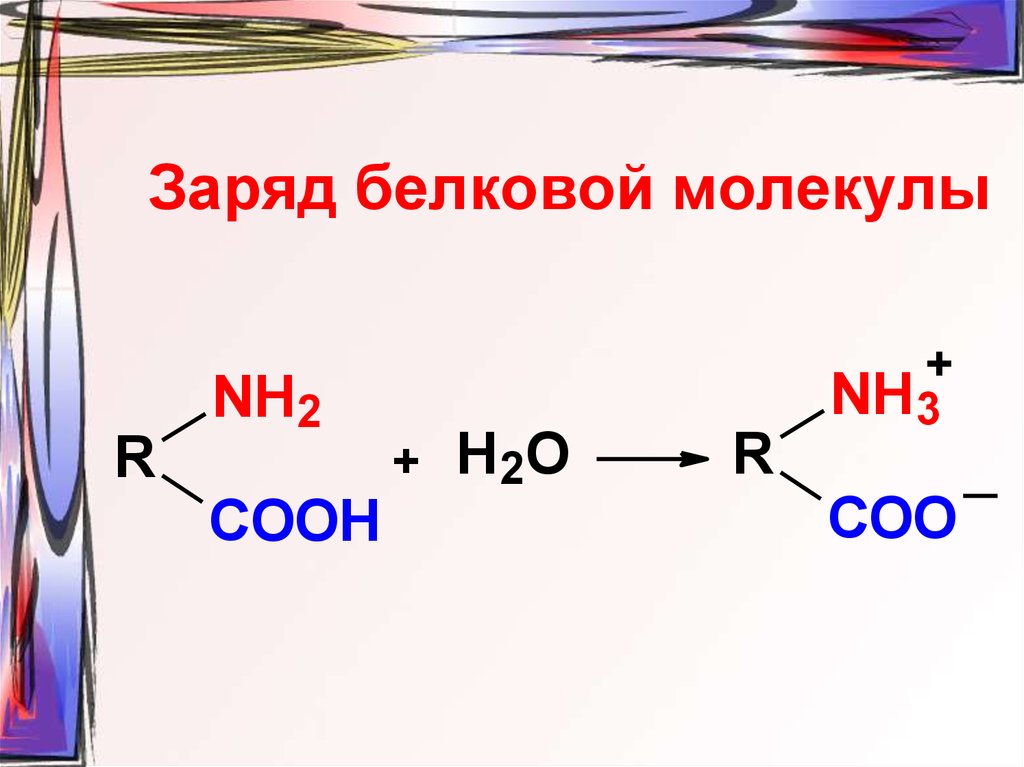
34. Заряд белковой молекулы
R+
NH2
+
COOH
Н2О
R
NH3
COO
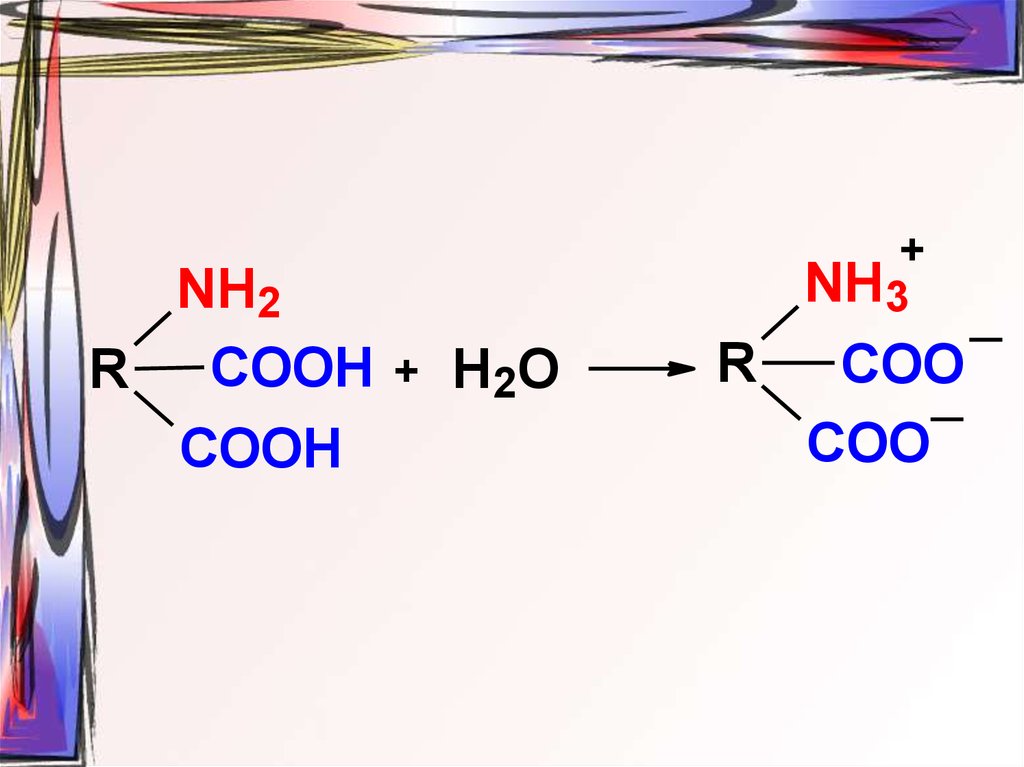
35.
NH2R COOH + Н2О
COOH
+
NH3
R
COO
COO
36.
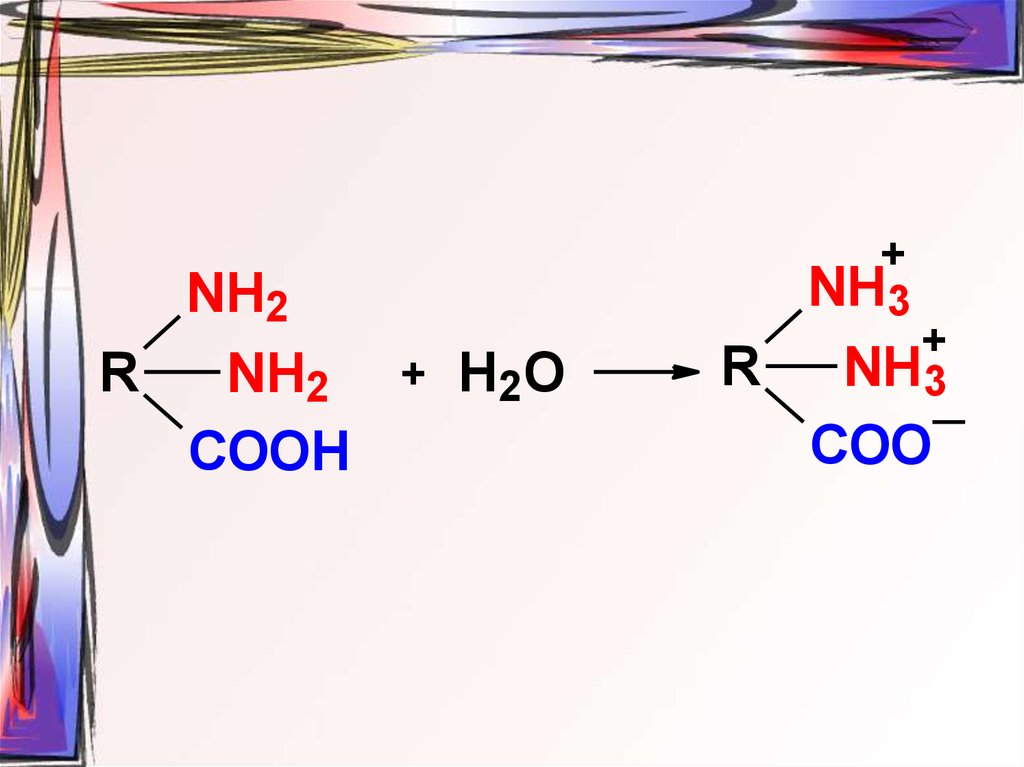
NH2R
NH2 + Н2О
COOH
+
NH3
+
R
NH3
COO
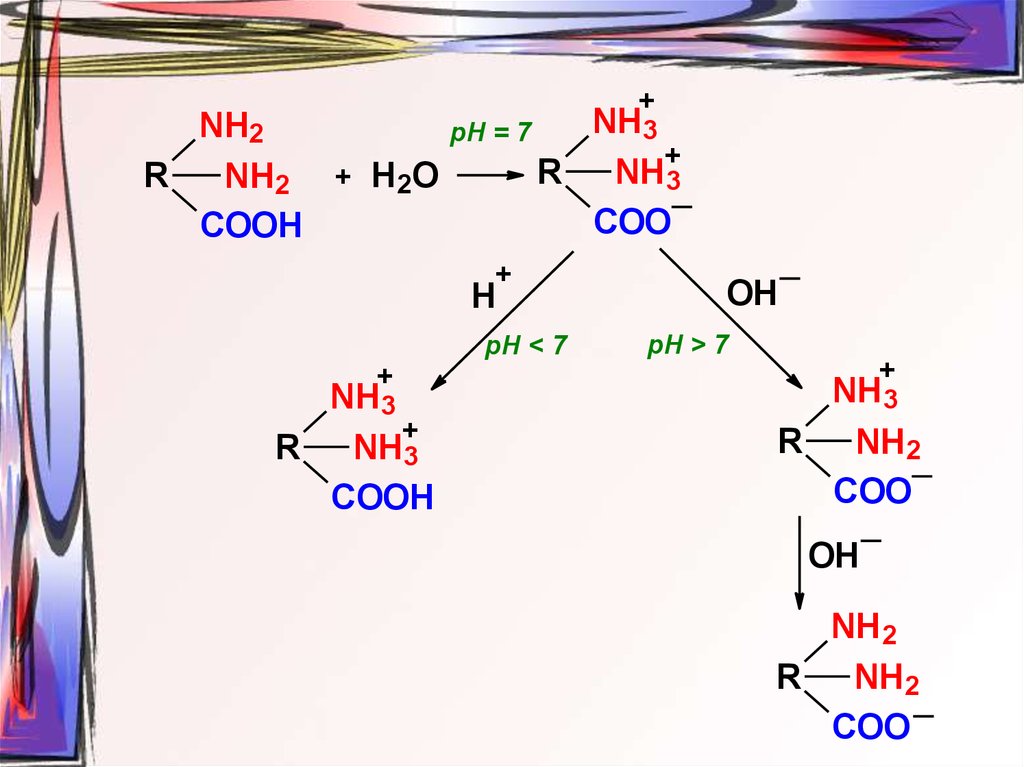
37. Ионизация
R+
рН = 7
NH2
+
Н 2О
R
NH3
COO
COOH
+
Н
рН < 7
ОН
рН > 7
+
R
NH3
R
COOH
NH2
COO
38.
+NH3
NH2
рН = 7
R
COO
R
COOH + Н2О
COO
COOH
+
Н
рН < 7
+
NH3
R
COOH
COO
+
Н
+
NH3
R
COOH
COOH
ОН
рН > 7
NH2
R
COO
COO
39.
+NH3
NH2
рН = 7
+
R
NH
+
R
Н2О
NH2
3
COO
COOH
+
Н
рН < 7
+
NH3
+
R
NH3
COOH
ОН
рН > 7
+
NH3
R
NH2
COO
ОН
NH2
R
NH2
COO
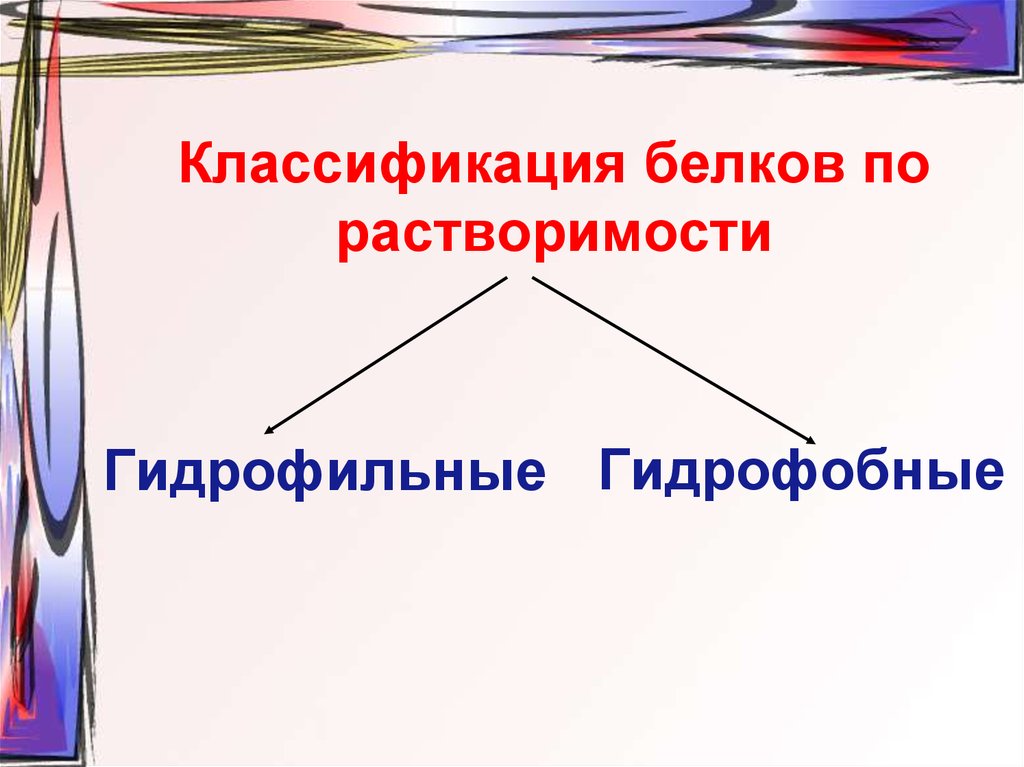
40. Классификация белков по растворимости
Гидрофильные Гидрофобные41. Гидратация
42. Общая формула аминокислот
RСН
NH2
COOH
43. Пептидная связь
H2N СН COOH +H2N СН COOH
СН2
CH3
аланин
OH
серин
Н2О
H2N СН CO NH СН COOH
CH3
СН2
OH
пептидная связь
аланилсерин
44. Первичная структура белка
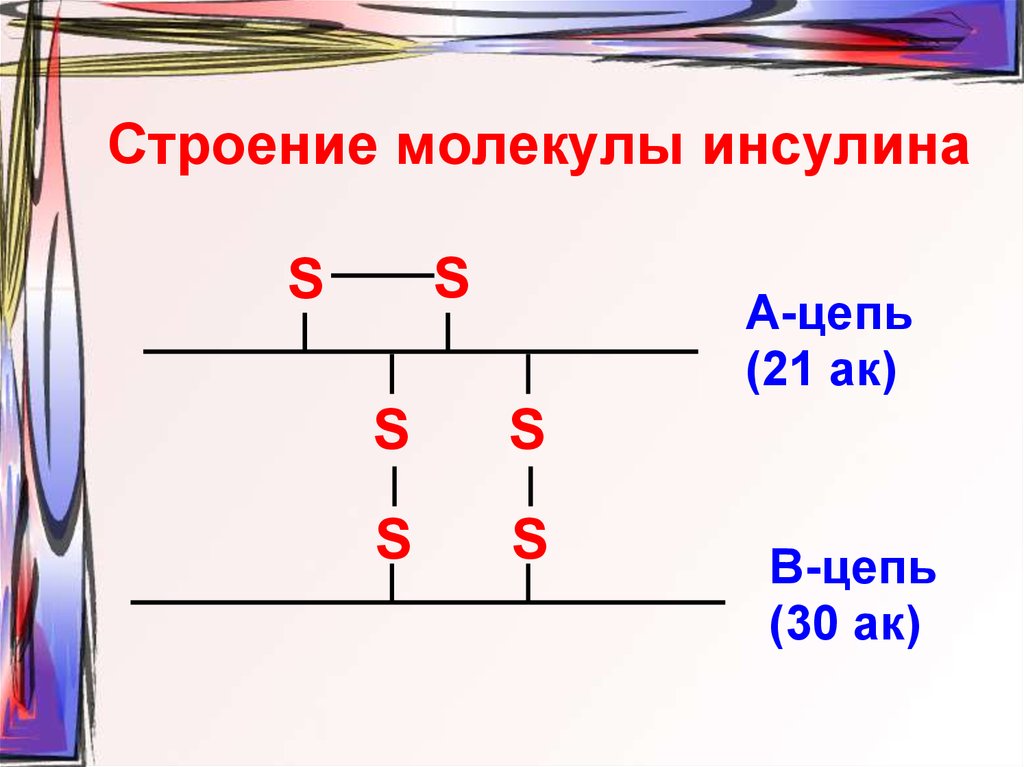
45. Строение молекулы инсулина
SS
А-цепь
(21 ак)
S
S
S
S
В-цепь
(30 ак)
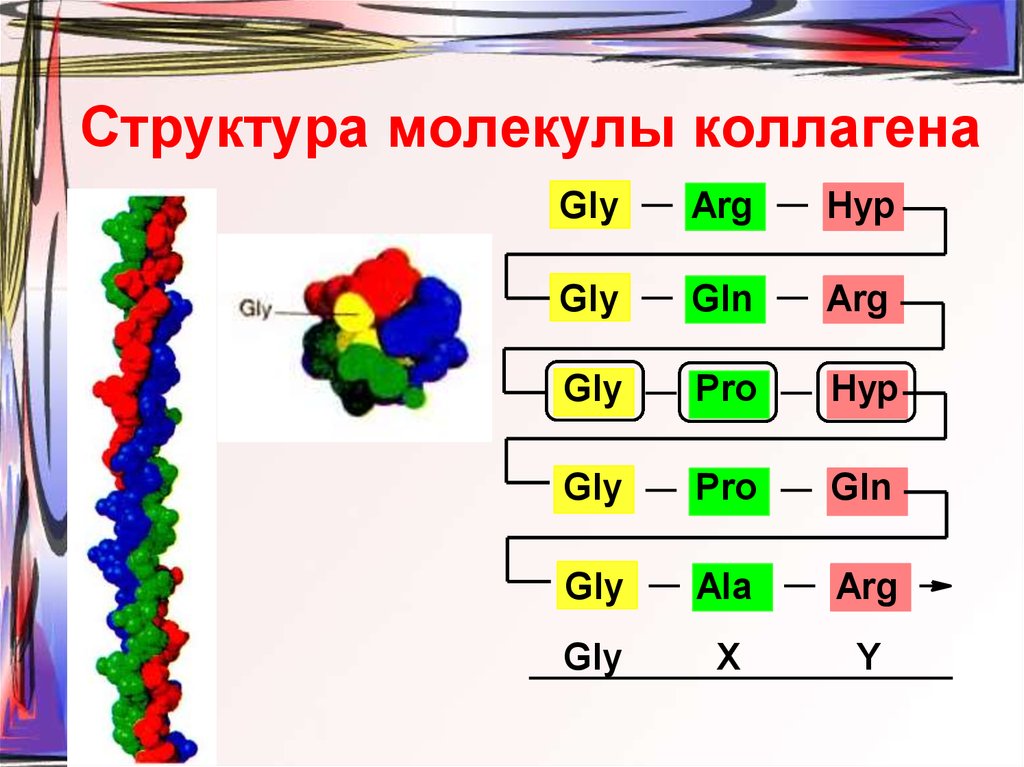
46. Структура молекулы коллагена
GlyArg
Hyp
Gly
Gln
Arg
Gly
Pro
Hyp
Gly
Pro
Gln
Gly
Ala
Arg
Gly
X
Y
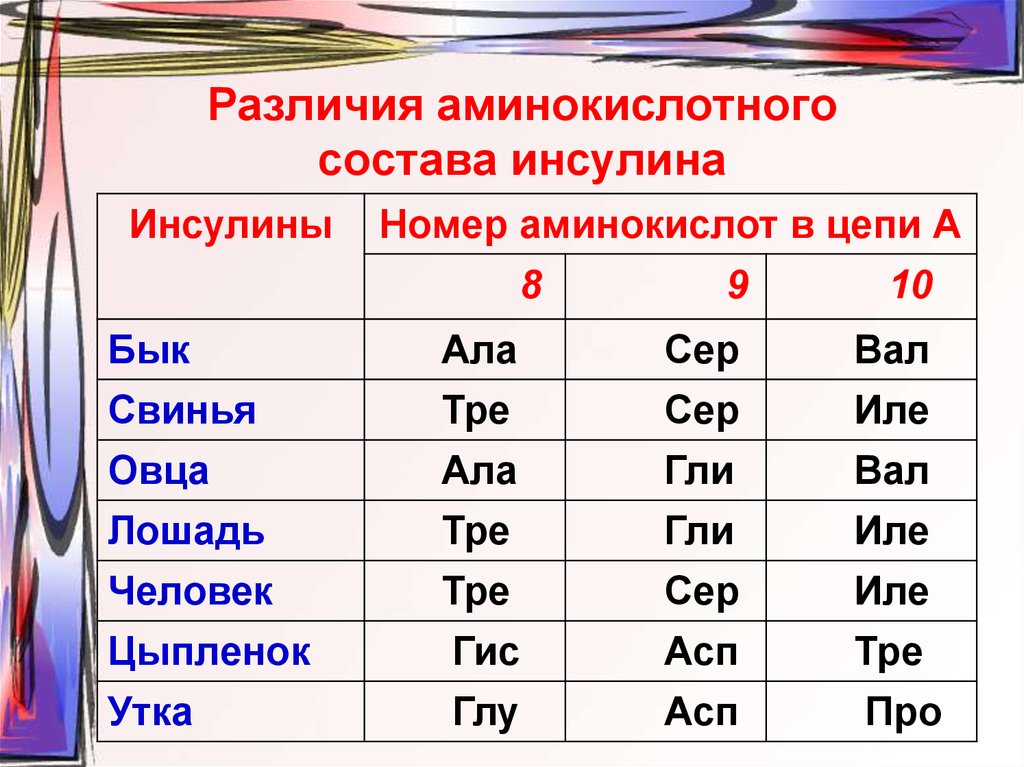
47. Различия аминокислотного состава инсулина
ИнсулиныНомер аминокислот в цепи А
8
9
10
Бык
Ала
Сер
Вал
Свинья
Тре
Сер
Иле
Овца
Ала
Гли
Вал
Лошадь
Тре
Гли
Иле
Человек
Тре
Сер
Иле
Цыпленок
Гис
Асп
Тре
Утка
Глу
Асп
Про
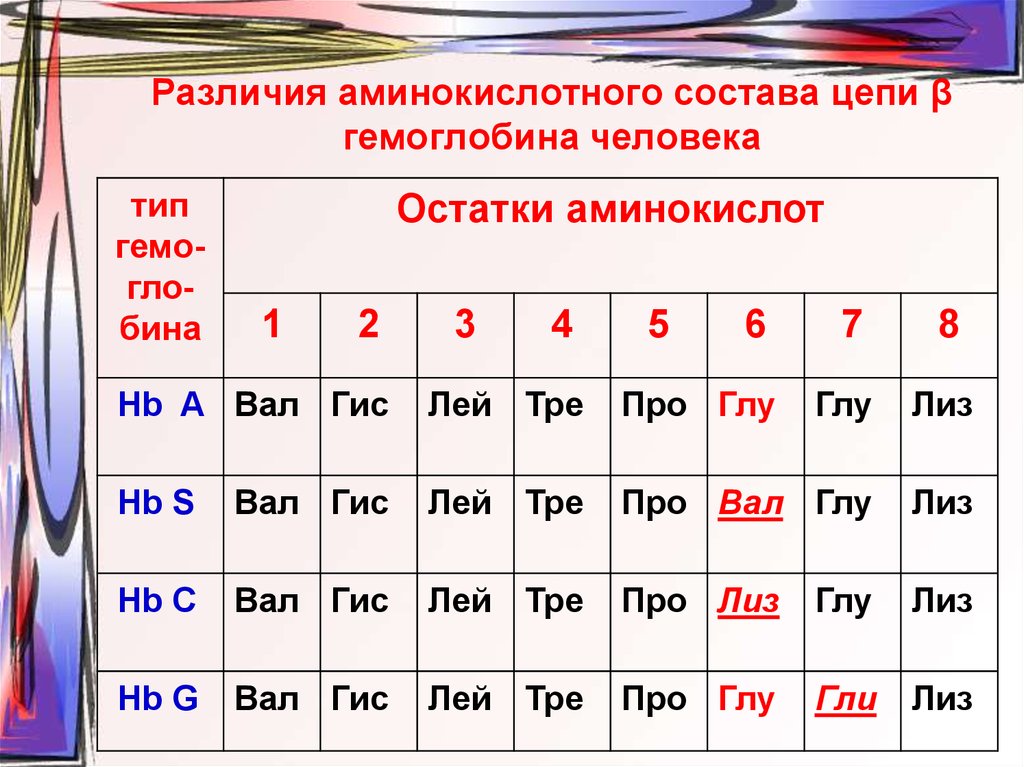
48. Различия аминокислотного состава цепи β гемоглобина человека
типгемоглобина
Остатки аминокислот
1
2
3
4
5
6
7
8
Hb A Вал Гис
Лей Тре
Про Глу
Глу
Лиз
Hb S
Вал Гис
Лей Тре
Про Вал Глу
Лиз
Hb C
Вал Гис
Лей Тре
Про Лиз
Глу
Лиз
Hb G
Вал Гис
Лей Тре
Про Глу
Гли
Лиз
49. Гидролиз
полныйнеполный
50. Гидролиз
• Кислый;• Щелочной;
• Ферментативный.
51. Гидролиз
жесткиймягкий
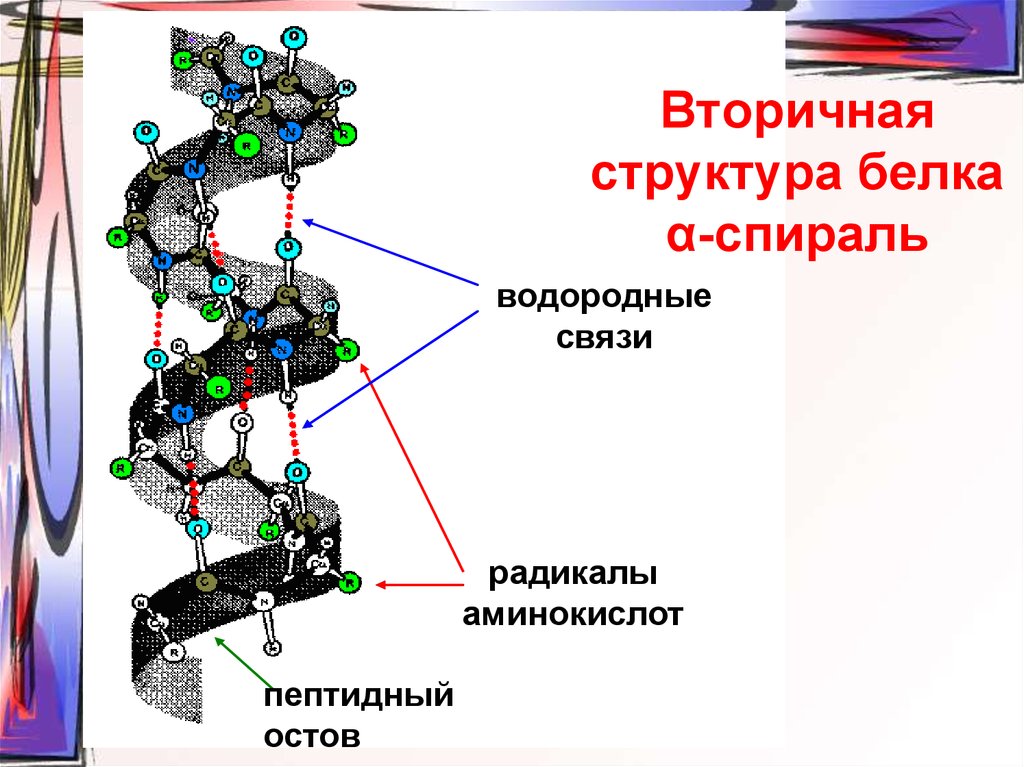
52. Вторичная структура белка α-спираль
водородныесвязи
радикалы
аминокислот
пептидный
остов
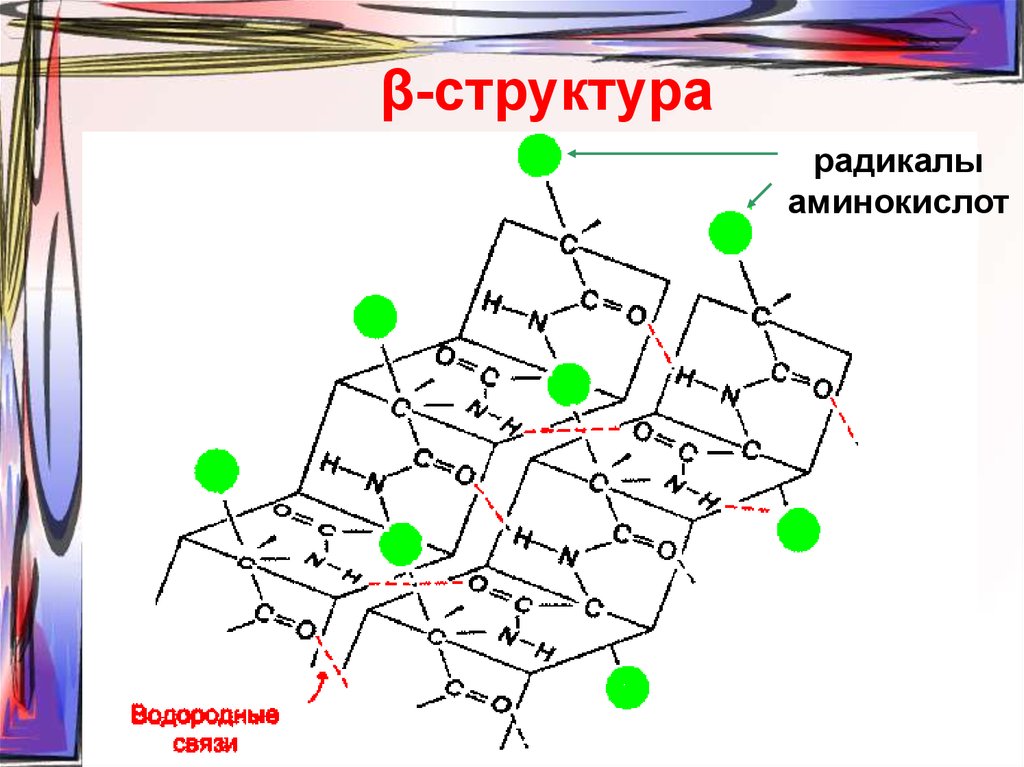
53. β-структура
радикалыаминокислот
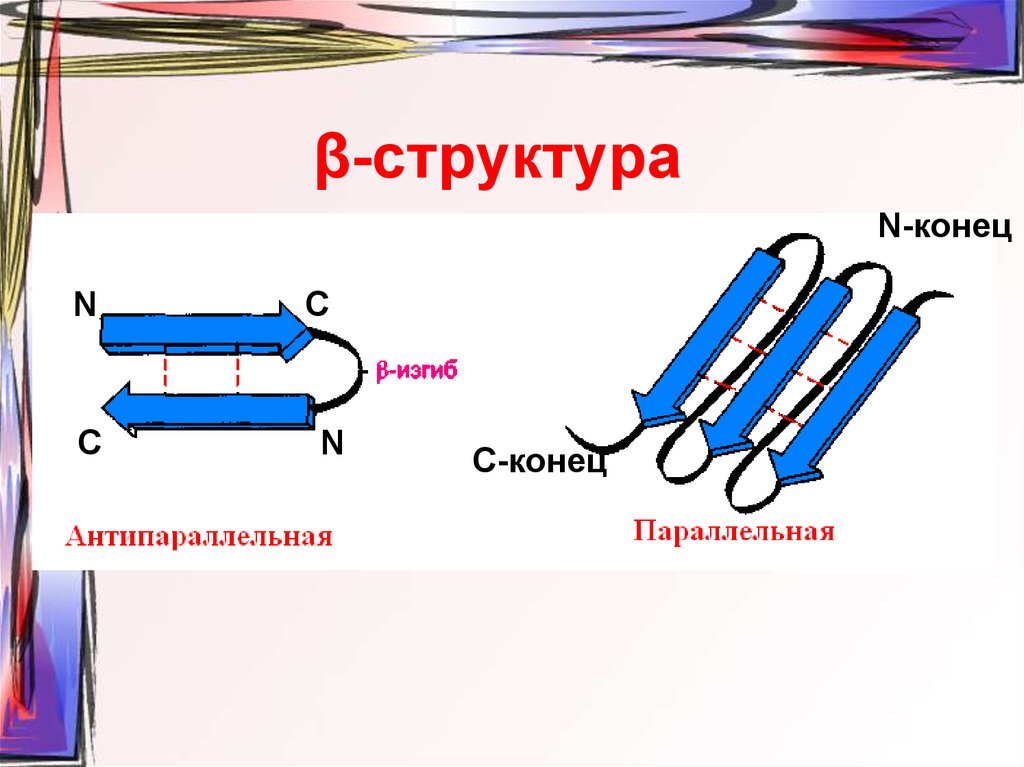
54. β-структура
N-конецN
C
C
N
С-конец
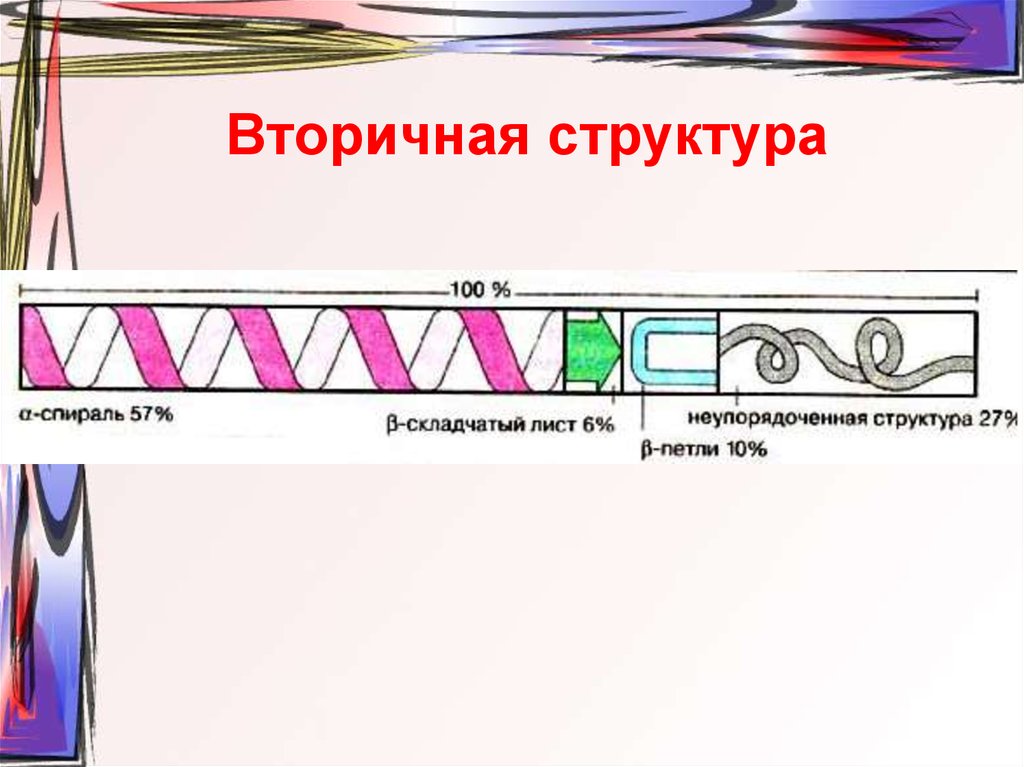
55. Вторичная структура
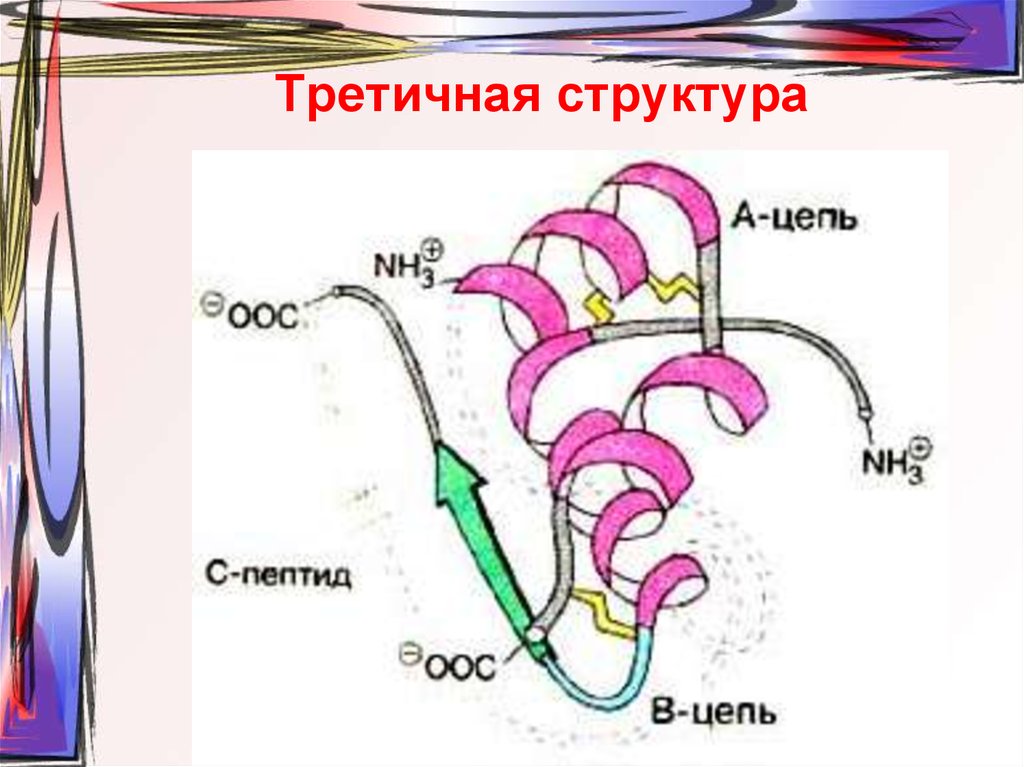
56. Третичная структура
57. Третичная структура
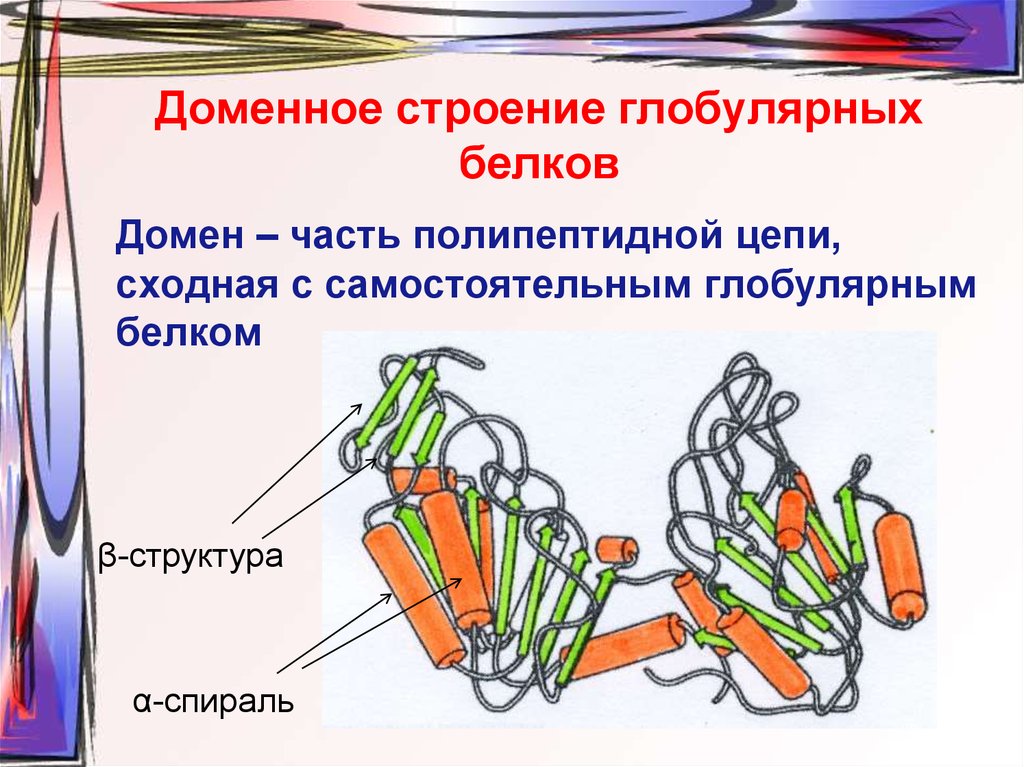
58. Доменное строение глобулярных белков
Домен – часть полипептидной цепи,сходная с самостоятельным глобулярным
белком
β-структура
α-спираль

































 Биология
Биология








