Похожие презентации:
Электролитическая диссоциация
1.
Способность проводитьэлектрический ток — одна из
важнейших характеристик растворов
веществ.
2.
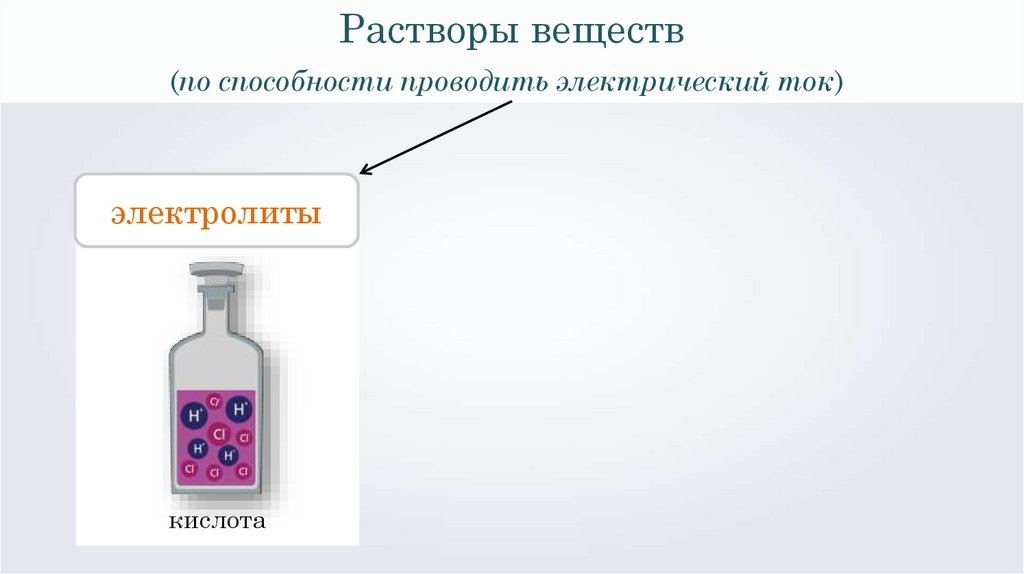
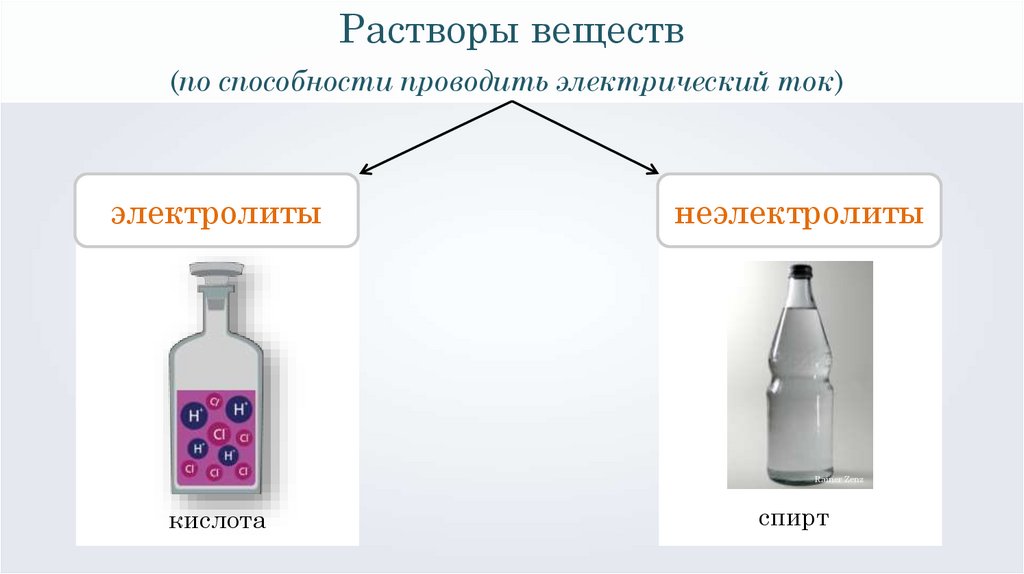
Растворы веществ(по способности проводить электрический ток)
электролиты
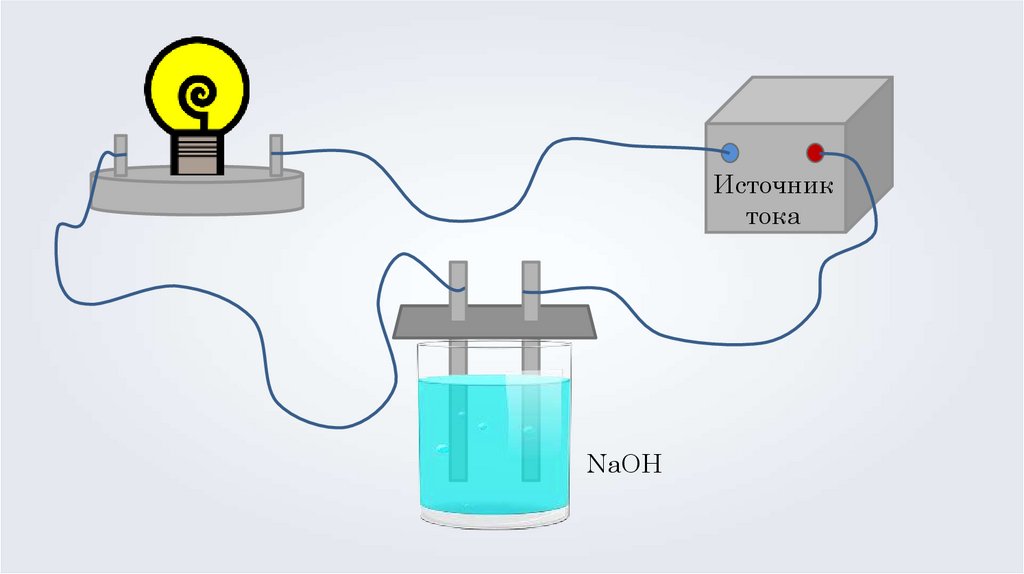
кислота
3.
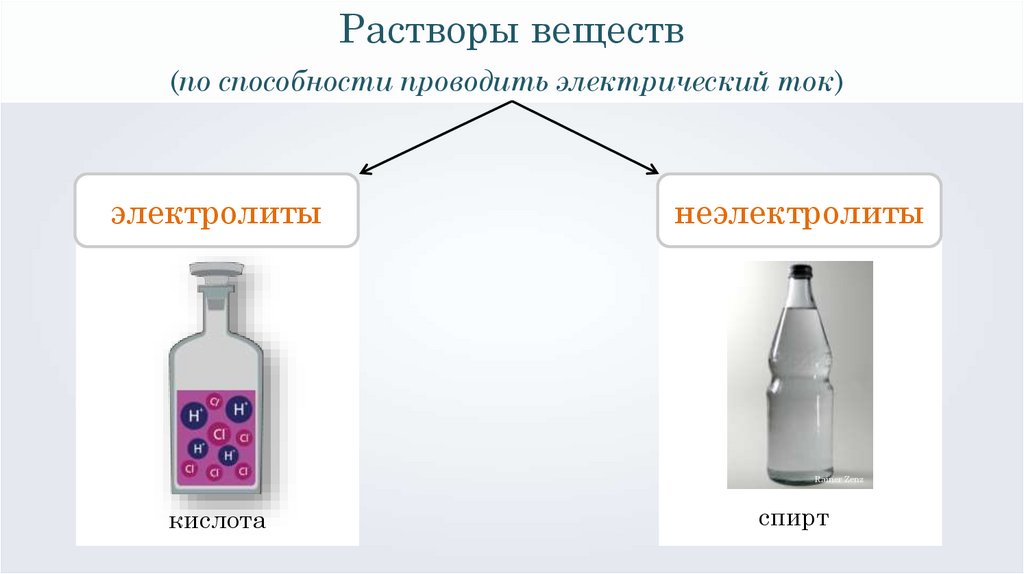
Растворы веществ(по способности проводить электрический ток)
электролиты
неэлектролиты
1
Rainer Zenz
кислота
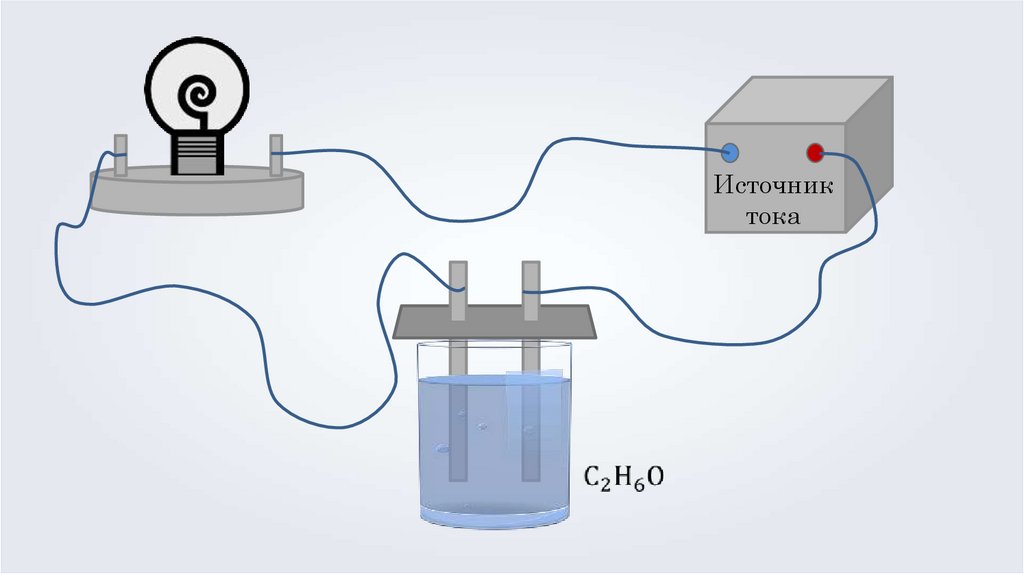
спирт
4.
Источниктока
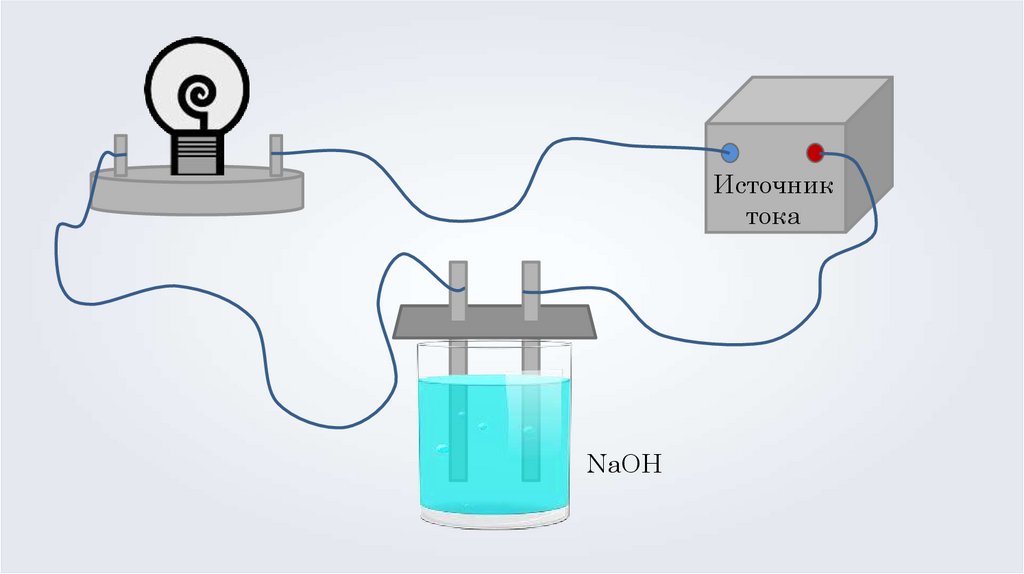
5.
Источниктока
NaOH
6.
Источниктока
NaOH
7.
Источниктока
8.
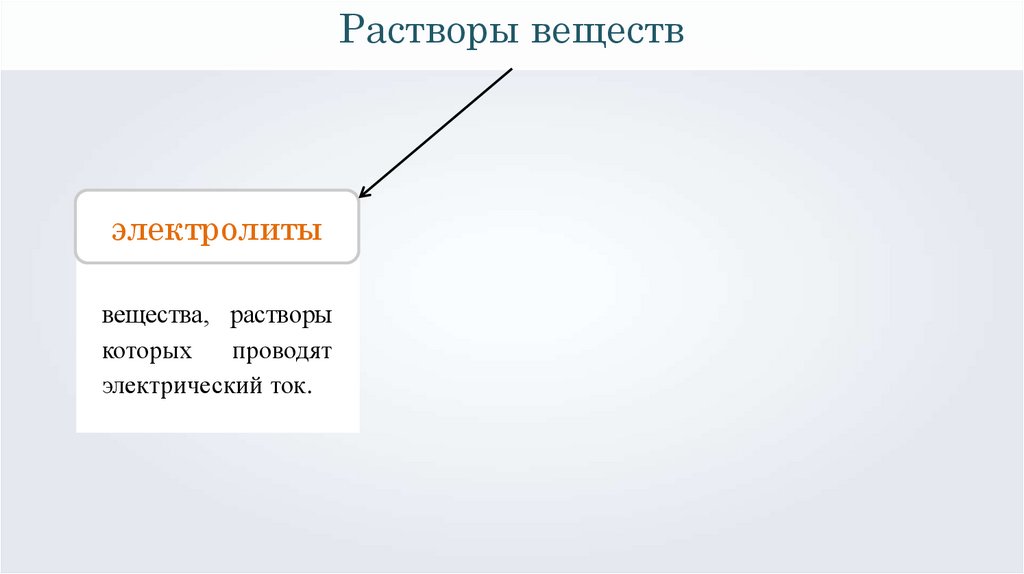
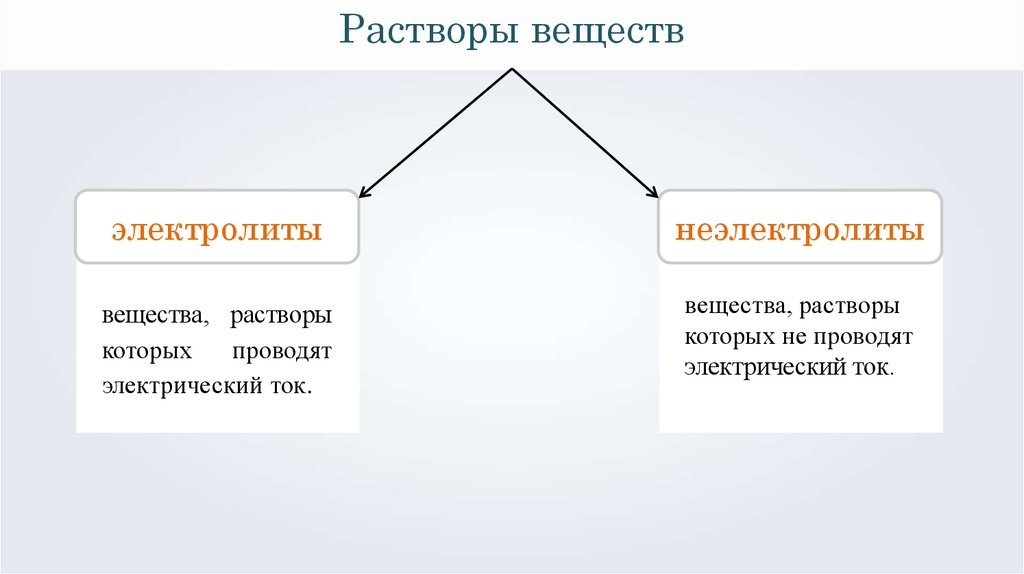
Растворы веществ9.
Растворы веществэлектролиты
вещества, растворы
которых
проводят
электрический ток.
10.
Растворы веществэлектролиты
неэлектролиты
вещества, растворы
которых
проводят
электрический ток.
вещества, растворы
1 проводят
которых не
электрический ток.
11.
12.
13.
XIX век — полученопредставление об
образовании ионов в
растворах электролитов.
Майкл Фарадей
14.
1877 год — сформулированатеория электролитической
диссоциации.
Сванте Аррениус
15.
–+
+
–
Электролитическая
диссоциация — процесс распада
электролита на ионы.
16.
Иван АлексеевичКаблуков
Владимир
Александрович
Кистяковский
17.
–+
–
+
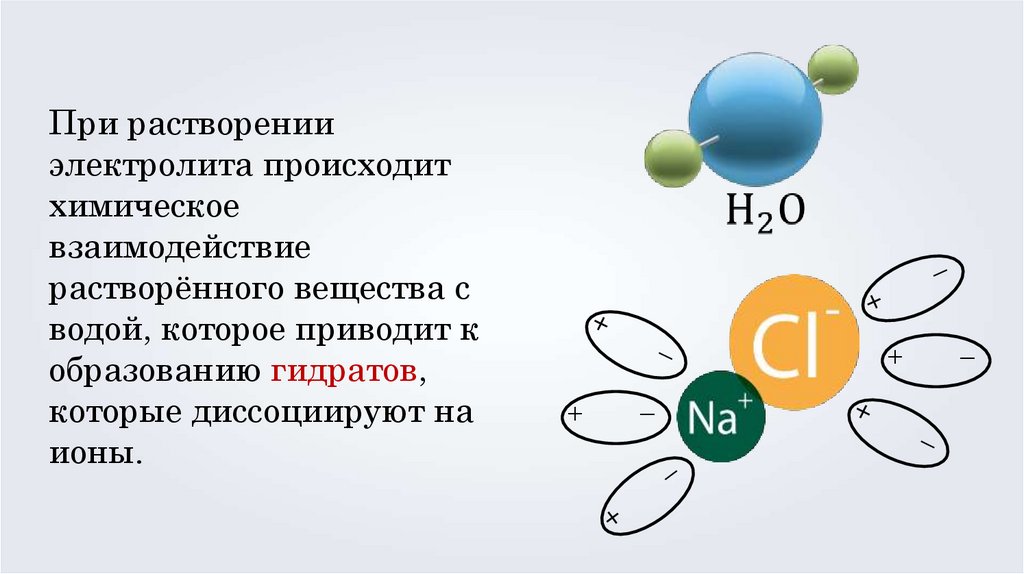
При растворении
электролита происходит
химическое
взаимодействие
растворённого вещества с
водой, которое приводит к
образованию гидратов,
которые диссоциируют на
ионы.
18.
Диссоциация вещества–
+
–
+
19.
Диссоциация вещества+
–
+
+
–
–
+
–
–
+
+
–
–
+
–
+
20.
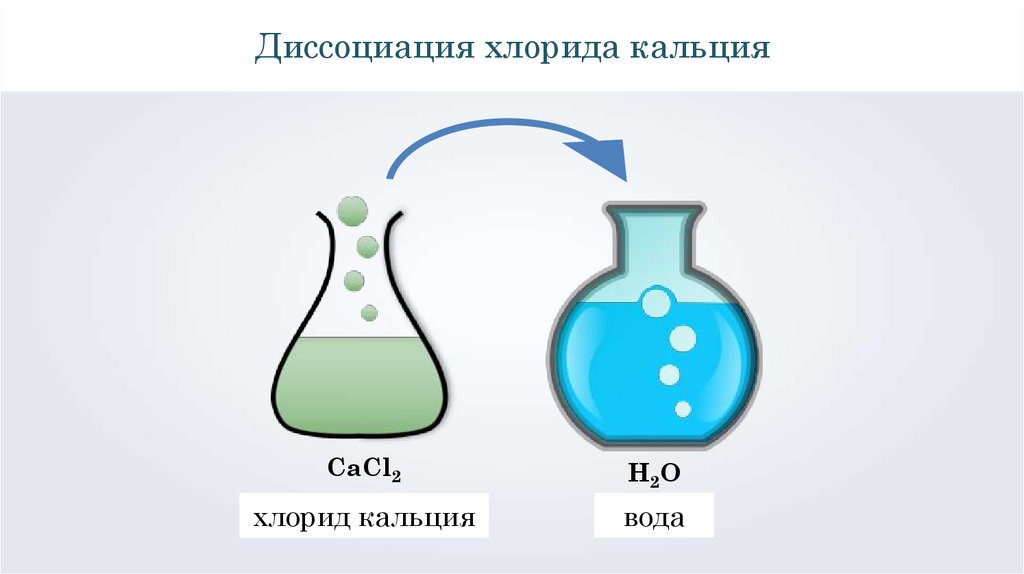
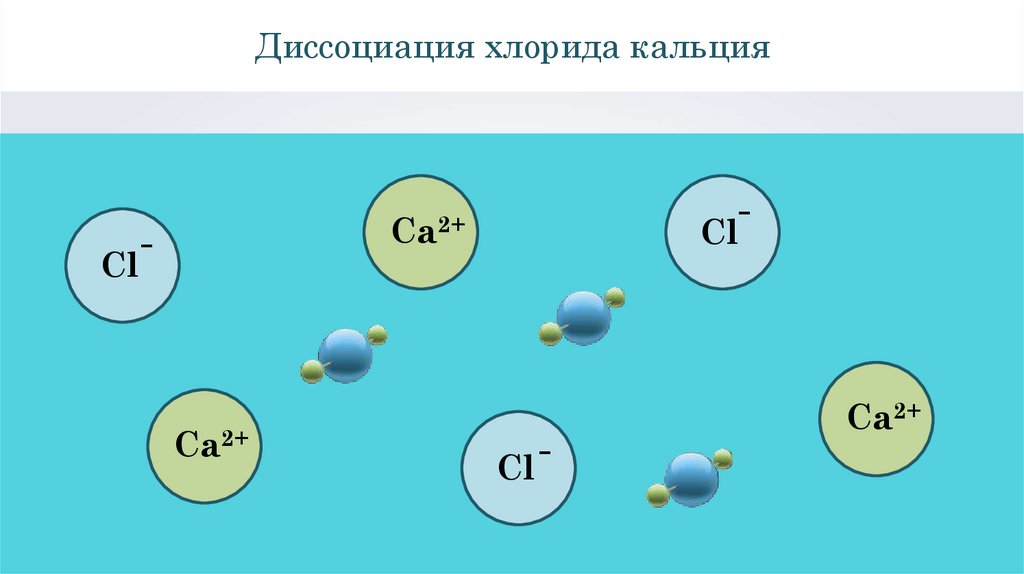
Диссоциация хлорида кальцияCaCl2
H2O
хлорид кальция
вода
21.
Диссоциация хлорида кальцияCl
Cl
Ca2+
-
Ca2+
Cl
-
Ca2+
22.
Процессы при диссоциациивеществ в воде
1. Ориентация двухполярных молекул воды около
ионов кристалла.
2. Взаимодействие молекул воды с противоположно
заряженными ионами поверхностного слоя
кристалла или гидратация.
3. Распад кристалла электролита
на гидратированные ионы (диссоциация).
23.
Уравнение диссоциации хлорида кальцияCaCl2 =
Ca2+
+ 2Cl
Каждая частица хлорида
кальция диссоциирует на
катионы кальция и
анионы хлора.
CaCl2
хлорид кальция
24.
–+
–
Ассоциация — процесс, при
котором хаотически движущиеся
гидратированные ионы могут
столкнуться и объединиться.
+
25.
nДa = nр
Степень диссоциации (α) — это
отношение количества вещества
электролита, распавшегося на ионы
(nД), к общему количеству
растворённого вещества (nр).
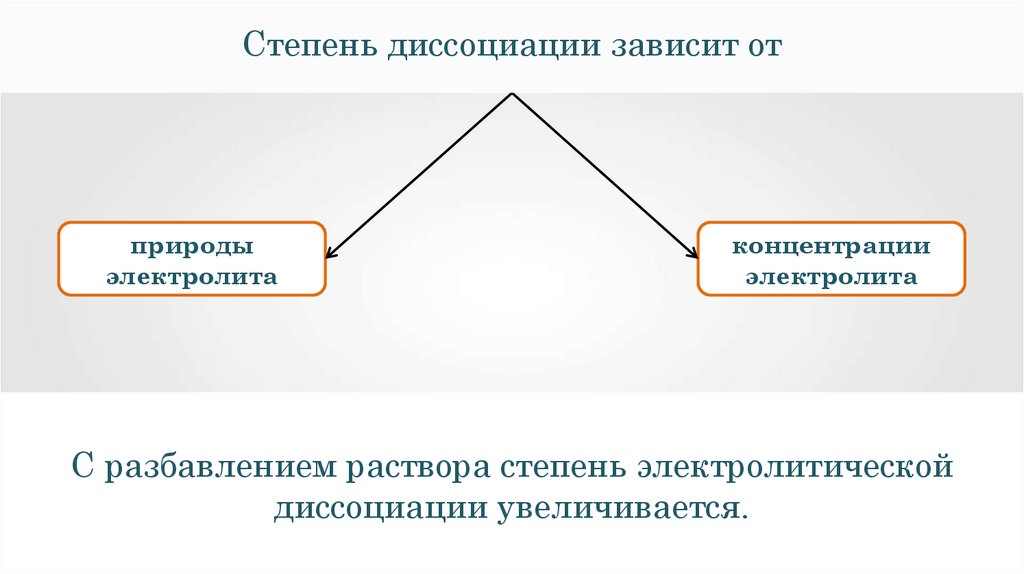
26.
Степень диссоциации зависит отприроды
электролита
концентрации
электролита
С разбавлением раствора степень электролитической
диссоциации увеличивается.
27.
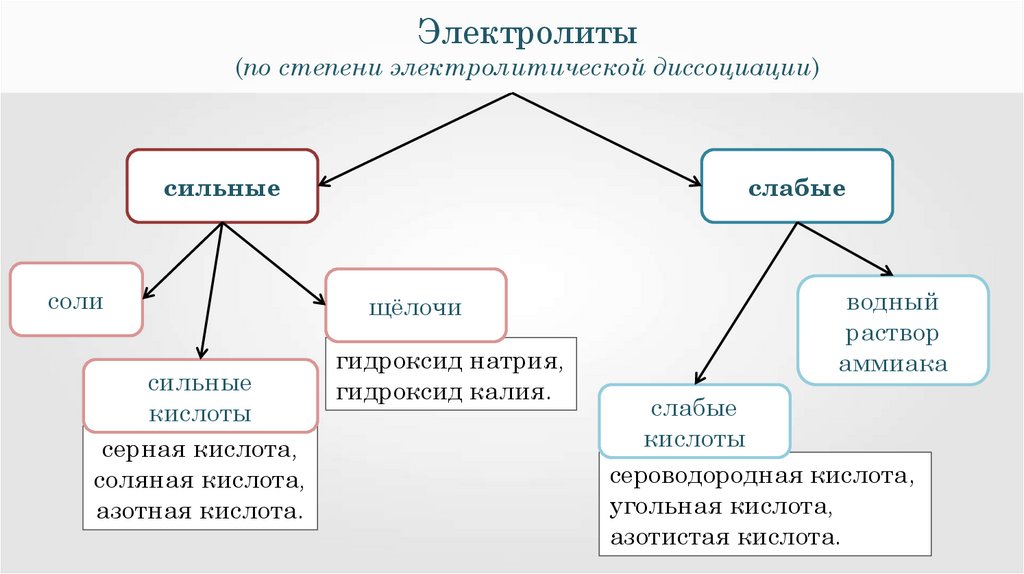
Электролиты(по степени электролитической диссоциации)
сильные
соли
сильные
кислоты
серная кислота,
соляная кислота,
азотная кислота.
слабые
щёлочи
гидроксид натрия,
гидроксид калия.
водный
раствор
аммиака
слабые
кислоты
сероводородная кислота,
угольная кислота,
азотистая кислота.
28.
Растворы веществ(по способности проводить электрический ток)
электролиты
неэлектролиты
1
Rainer Zenz
кислота
спирт
29.
Электролитическая диссоциацияхарактеризуется степенью диссоциации, в
соответствии с которой электролиты
разделены на сильные и слабые.













 Химия
Химия








