Похожие презентации:
Строение электронных оболочек атомов
1.
Урок:Строение
электронных
оболочек атомов
2.
Электронная оболочка – совокупностьвсех электронов в атоме окружающих ядро
Каждый электрон имеет свою траекторию
движения и запас энергии
Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его
труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
3.
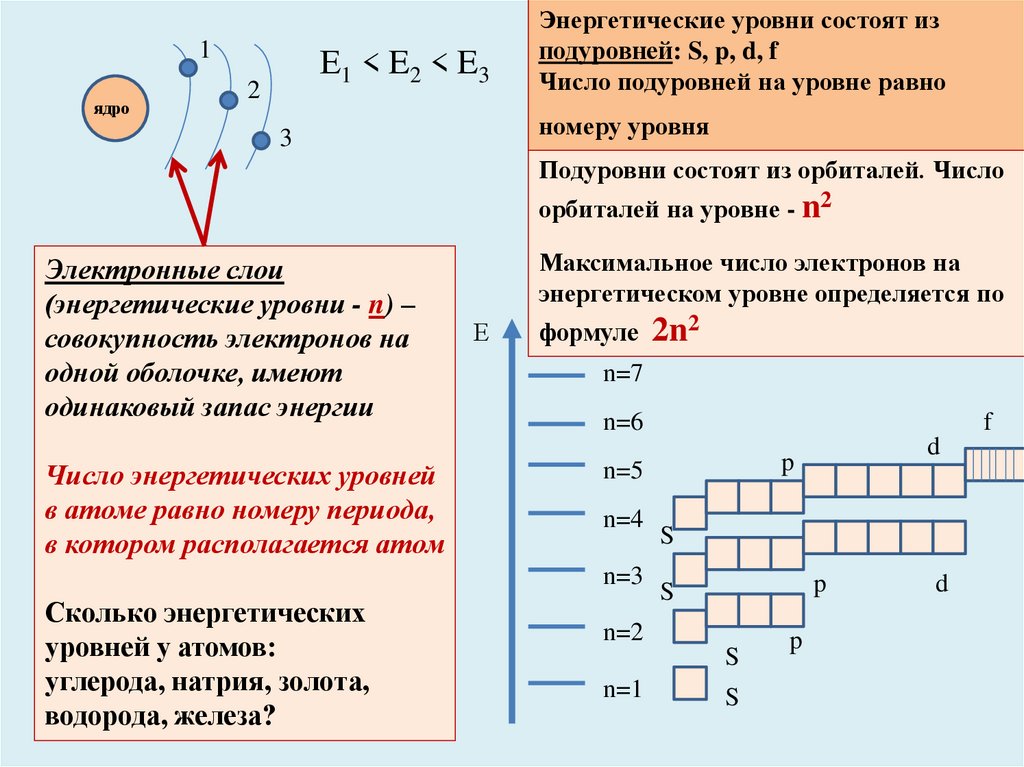
1ядро
Е1 < E2 < E3
2
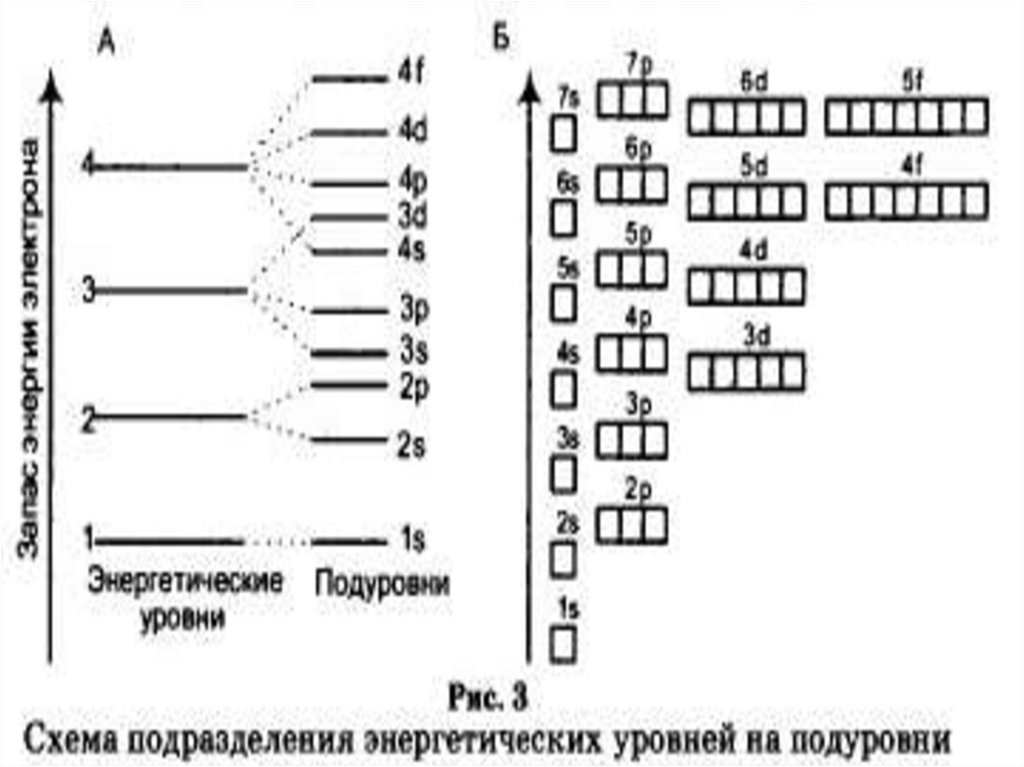
Энергетические уровни состоят из
подуровней: S, p, d, f
Число подуровней на уровне равно
номеру уровня
3
Подуровни состоят из орбиталей. Число
орбиталей на уровне - n2
Электронные слои
(энергетические уровни - n) –
совокупность электронов на
одной оболочке, имеют
одинаковый запас энергии
Число энергетических уровней
в атоме равно номеру периода,
в котором располагается атом
Максимальное число электронов на
энергетическом уровне определяется по
Е
формуле
n=7
n=6
f
n=4
S
p
S
n=2
S
n=1
d
p
n=5
n=3
Сколько энергетических
уровней у атомов:
углерода, натрия, золота,
водорода, железа?
2n2
S
p
d
4.
Энергетические уровни, содержащиемаксимальное число электронов, называются
завершенными. Они обладают повышенной
устойчивостью и стабильностью
Энергетические уровни, содержащие
меньшее число электронов, называются
незавершенными
n=1 – 1 подуровень (s), 2 электрона
n=2 – 2 подуровня (s, р), 8 электронов
n=3 – 3 подуровня (s, р, d), 18 электронов
n=4 – 4 подуровня (s, р, d, f), 32 электрона
5.
ЗАПОМНИТЕ!!!!Электроны, расположенные на последней
электронной оболочке, называются
внешними
Число внешних электронов для
химических элементов главных подгрупп
равно номеру группы, в которой находится
элемент
6.
Форма электронных облаков - областьнаиболее вероятного местонахождения
электрона в пространстве
s – облако
р – облака
f – облако
d - облака
7.
1 периодН+1
n=1
1
+
1 S1
S
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
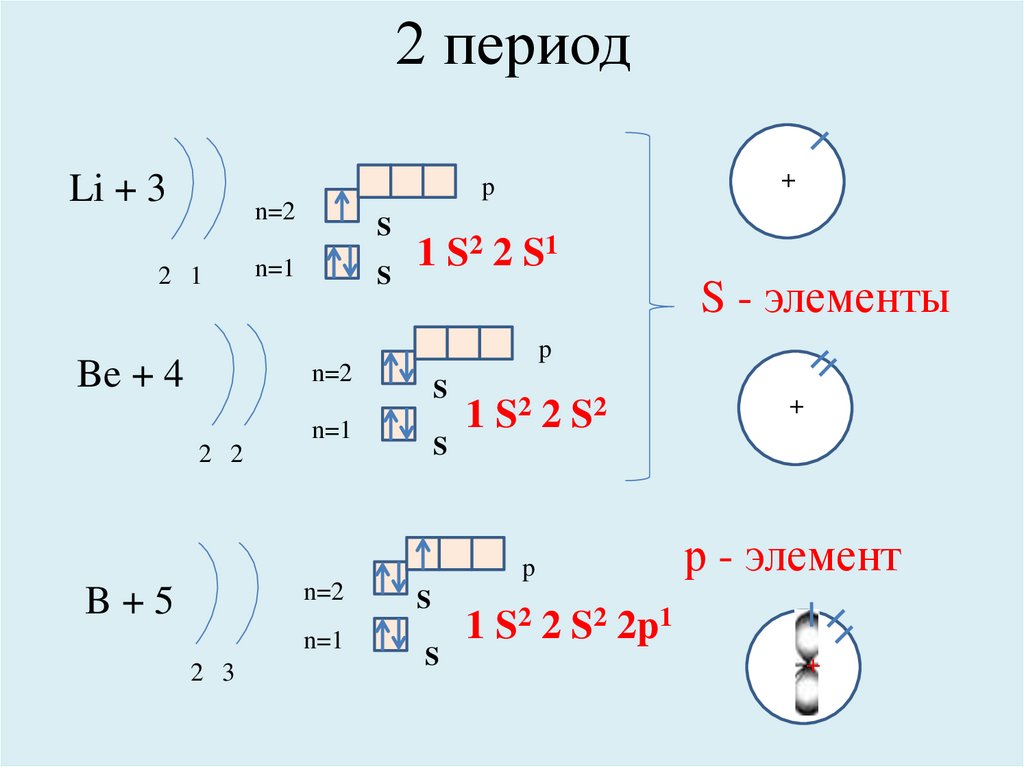
S - элементы
2 спаренных электрона на завершенной оболочке
+
8.
2 периодLi + 3
+
p
n=2
2 1
S
n=1
S
1 S 2 2 S1
S - элементы
p
Be + 4
n=2
S
n=1
1 S2 2 S 2
S
2 2
p
n=2
B+5
n=1
2 3
+
S
S
р - элемент
1 S2 2 S2 2p1
++
9.
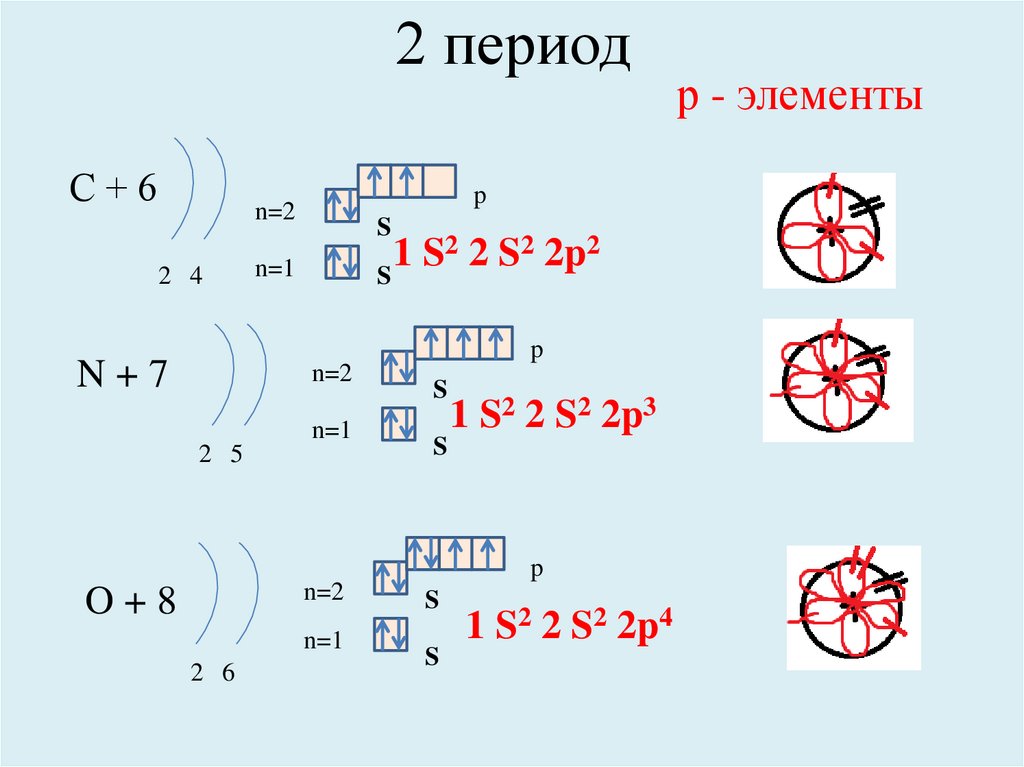
2 периодС+6
p
n=2
2 4
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
р - элементы
10.
2 периодF+9
2 7
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
р - элементы
n=2
p
S
2 2 S2 2p6
1
S
S
n=1
2 8
3 период
d
n=3
Na + 11
n=2
2 8 1
n=1
S
p
p
S
S
1 S2 2 S2 2p6 3 S1
S - элемент
11.
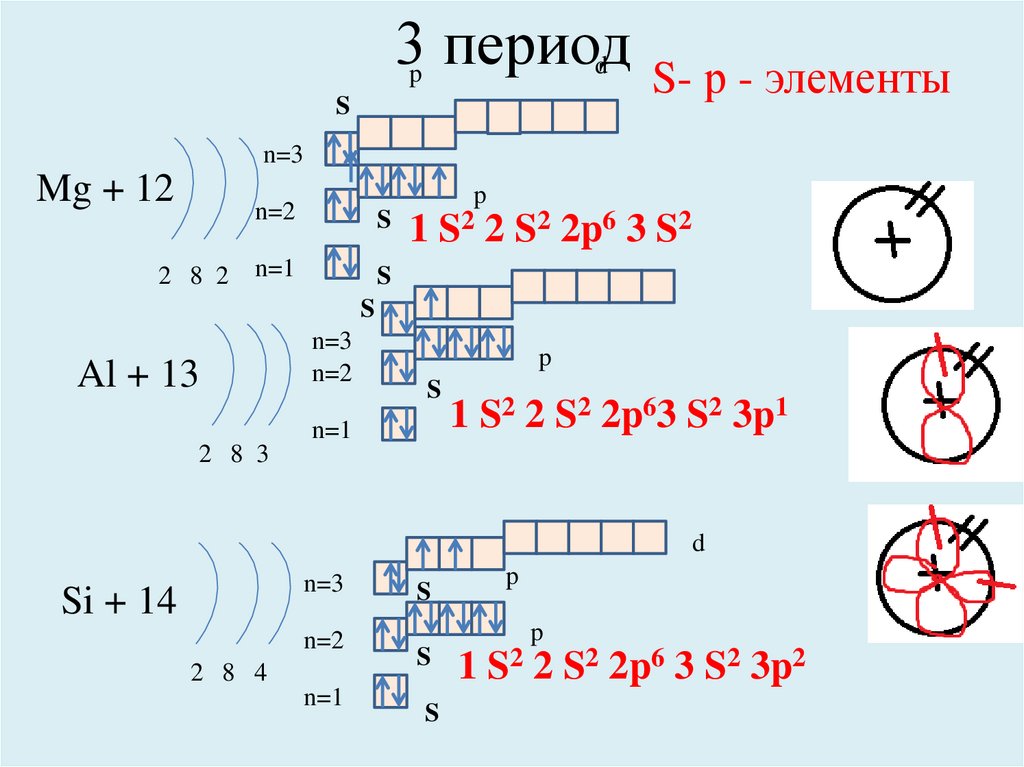
3p периодd
S
S- р - элементы
n=3
Mg + 12
2 8 2
n=2
S
n=1
S
1
p
S2 2
S2 2p6 3 S2
S
Al + 13
n=3
n=2
p
S
n=1
1 S2 2 S2 2p63 S2 3p1
2 8 3
d
n=3
Si + 14
n=2
2 8 4
n=1
S
p
p
S
S
1 S2 2 S2 2p6 3 S2 3p2
12.
3p периодd
S
n=3
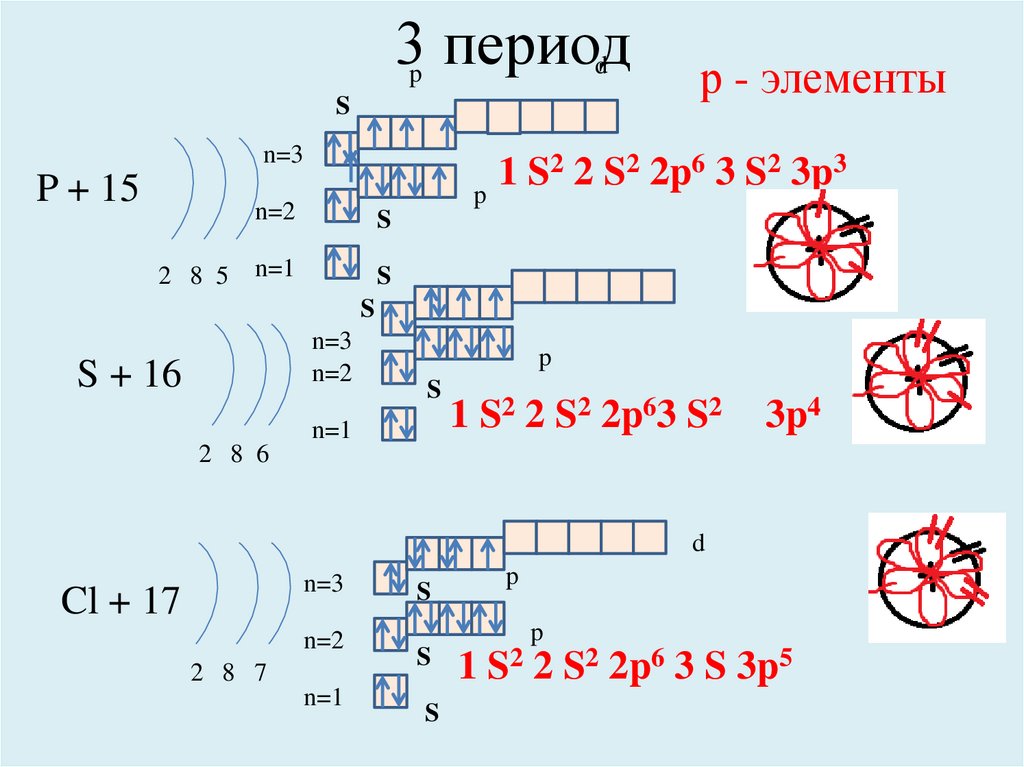
P + 15
2 8 5
р - элементы
2 2 S2 2p6 3 S2 3p3
1
S
p
n=2
S
n=1
S
S
n=3
n=2
S + 16
p
S
n=1
1 S2 2 S2 2p63 S2
3p4
2 8 6
d
n=3
Cl + 17
n=2
2 8 7
n=1
S
p
p
S
S
1 S2 2 S2 2p6 3 S 3p5
13.
3 периодp
d
S
n=3
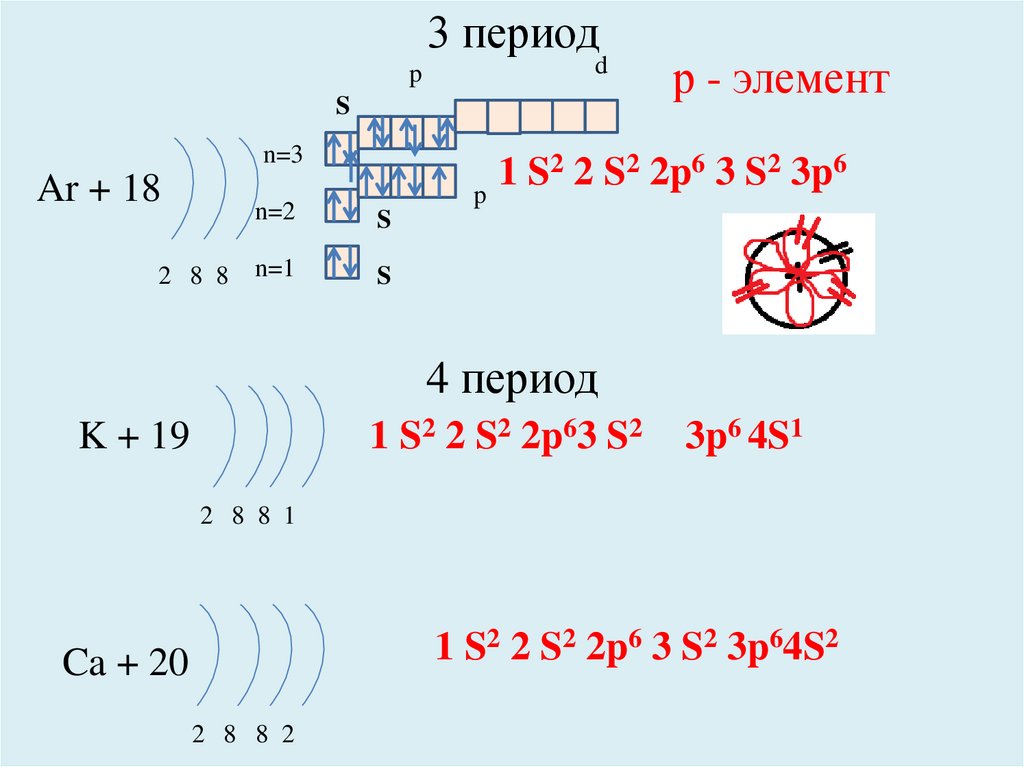
Ar + 18
2 8 8
р - элемент
2 2 S2 2p6 3 S2 3p6
1
S
p
n=2
S
n=1
S
4 период
1 S2 2 S2 2p63 S2
K + 19
3p6 4S1
2 8 8 1
1 S2 2 S2 2p6 3 S2 3p64S2
Ca + 20
2 8 8 2
14.
15.
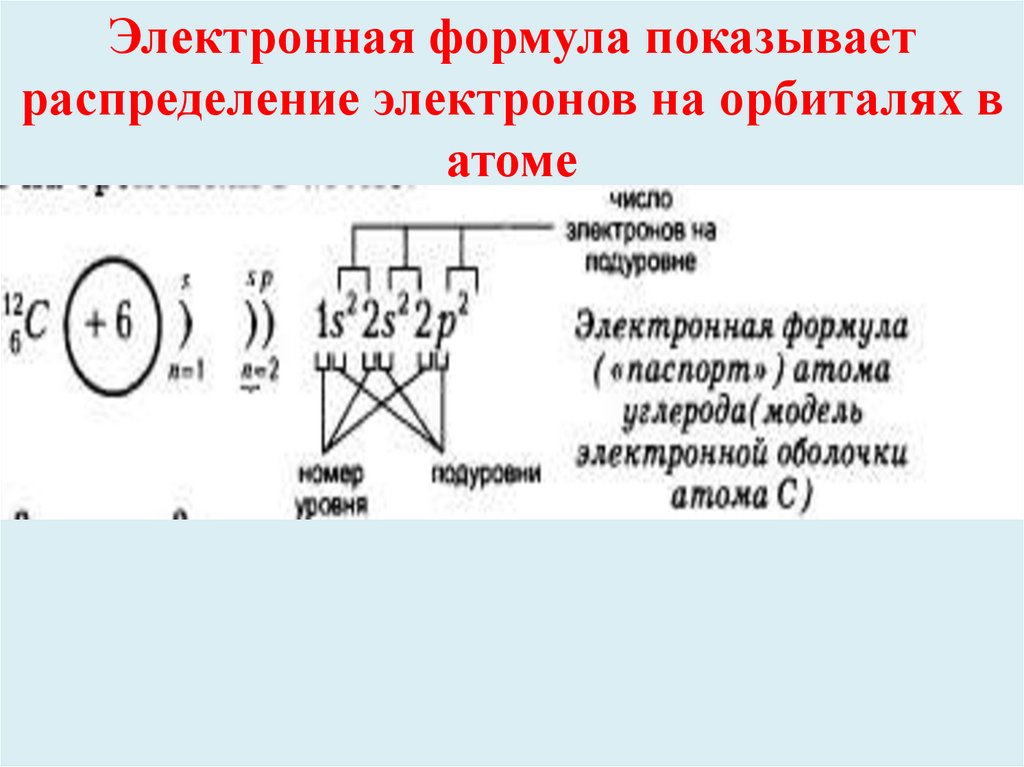
Электронная формула показываетраспределение электронов на орбиталях в
атоме
16.
Принцип минимума энергии приформировании электронной оболочки
1s1-22s1-22p1-63s1-23p1-64s1-23d1-104p1-65s1-2
4d1-105p1-66s1-2 4f1-145d1-106p1-6 7s1-2
При написании электронной формулы
распределять электроны, количество
которых в сумме должна быть равной
порядковому номеру элемента!!!








 Химия
Химия








