Похожие презентации:
Строение электронных оболочек атомов
1. Тема: Строение электронных оболочек атомов Цели урока: 1. Сформировать представления об электронной оболочек атома и
ТЕМА: СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВЦЕЛИ УРОКА:
1. СФОРМИРОВАТЬ ПРЕДСТАВЛЕНИЯ ОБ ЭЛЕКТРОННОЙ
ОБОЛОЧЕК АТОМА И ЭНЕРГЕТИЧЕСКИХ УРОВНЯХ
2. РАССМОТРЕТЬ ЭЛЕКТРОННОЕ СТРОЕНИЕ ЭЛЕМЕНТОВ 1-3
ПЕРИОДОВ
8 класс
2. Электронная оболочка атома- это
совокупность всех электронов в атоме,окружающих ядро
Каждый электрон имеет свою траекторию движения
и запас энергии
Электроны расположены на различном расстоянии
от ядра: чем ближе электрон к ядру, тем он прочнее
с ним связан, его труднее вырвать из электронной
оболочки
По мере удаления от ядра запас энергии электрона
увеличивается, а связь с ядром становится слабее
3. Электронная оболочка
:Электронная
оболочка
Состоит из энергетических уровней или
электронных слоев.
Число энергетических уровней в атоме равно
номеру периода.
Энергетические уровни обозначают:
+ х ) ) ) и т. д.
↑
заряд ядра
Внутри каждого уровня выделяют подуровни,
на которых расположены электроны различных
форм
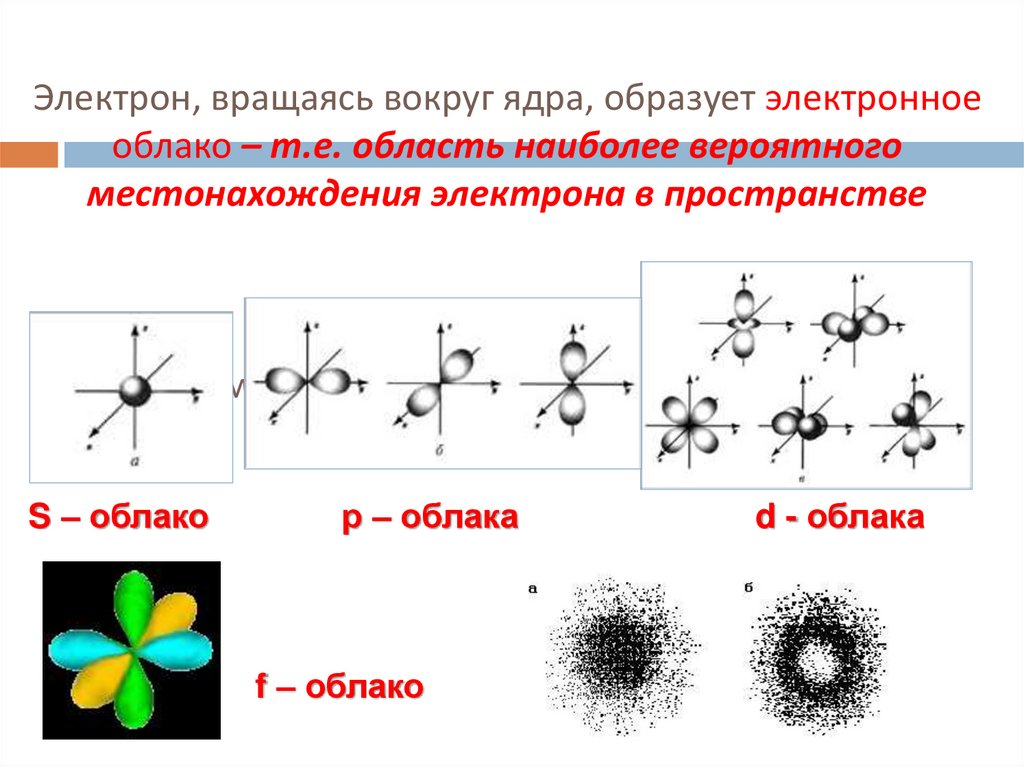
4. Электрон, вращаясь вокруг ядра, образует электронное облако – т.е. область наиболее вероятного местонахождения электрона в
пространствеФорма электронных облаков (орбиталей)
S – облако
р – облака
f – облако
d - облака
5. Строение энергетических уровней
Нам каждомуровне число электронов
Строение
энергетических
уровней
ограничено и находится по формуле N e=2n2
Число подуровней в уровне равно номеру
уровня.
1 уровень – 1 подуровень → s- электроны
2 уровень – 2 подуровня → s и p- электроны
3 уровень – 3 подуровня → s, p, d-электроны
6.
Энергетические уровни, содержащиемаксимальное число электронов, называются
завершенными. Они обладают повышенной
устойчивостью и стабильностью
Энергетические уровни (n), содержащие меньшее
число электронов, называются незавершенными
n=1 – 1 подуровень (S), максимально 2 электрона
n=2 – 2 подуровня (S, р), максимально 8
электронов
n=3 – 3 подуровня (S, р, d), максимально 18
электронов
7. Запомните!
Электроны, расположенные напоследней электронной оболочке,
называются внешними.
Число внешних электронов для
химических элементов главных подгрупп
равно номеру группы, в которой
находится элемент
На каждой электронной орбитали может
находиться не более 2-х электронов
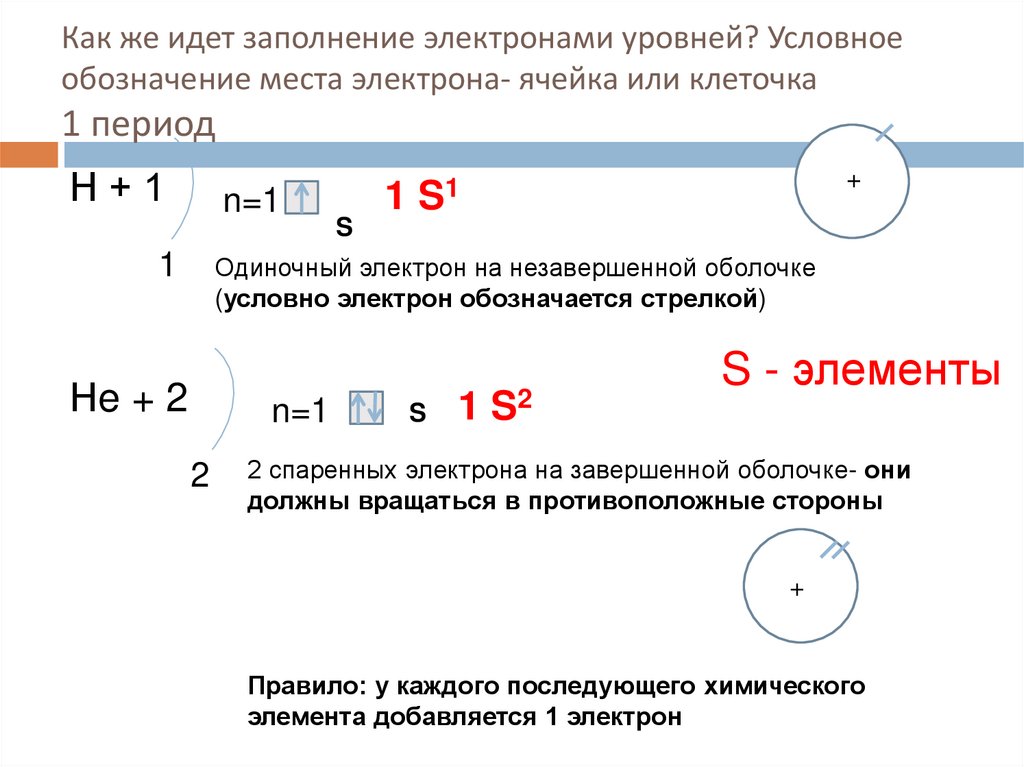
8. Как же идет заполнение электронами уровней? Условное обозначение места электрона- ячейка или клеточка 1 период
Н+1n=1
1
S
+
1 S1
Одиночный электрон на незавершенной оболочке
(условно электрон обозначается стрелкой)
Нe + 2
n=1
2
S
1 S2
S - элементы
2 спаренных электрона на завершенной оболочке- они
должны вращаться в противоположные стороны
+
Правило: у каждого последующего химического
элемента добавляется 1 электрон
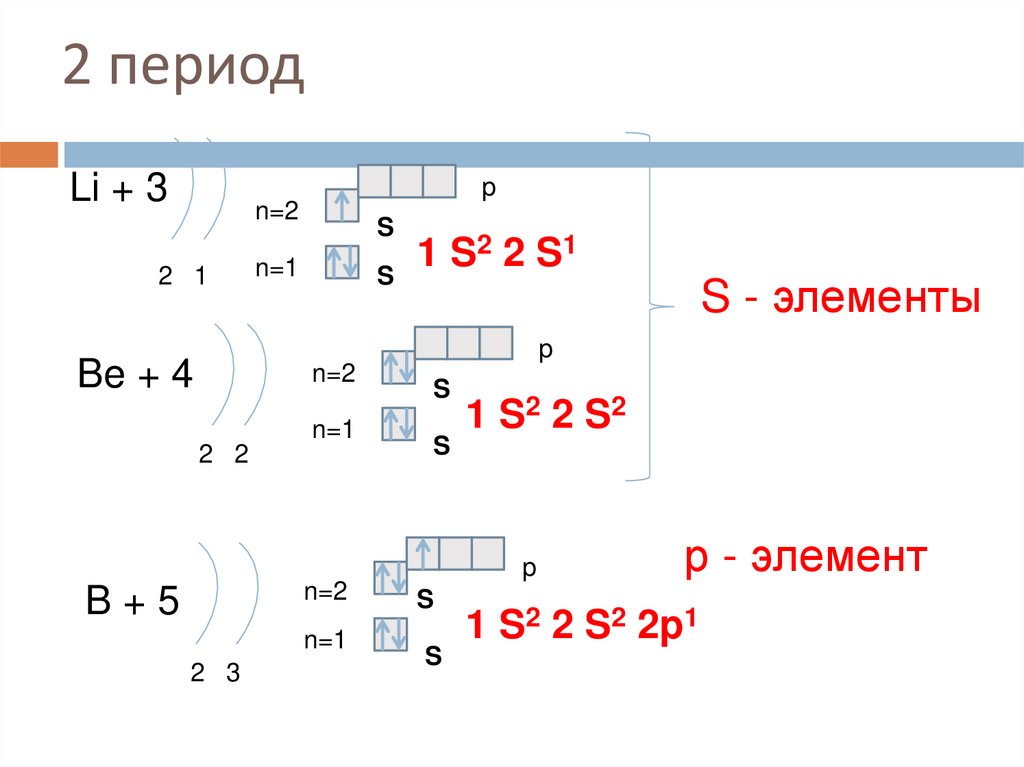
9. 2 период
Li + 3p
n=2
2 1
S
n=1
S
1 S2 2 S1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
1 S2 2 S 2
p
n=2
B+5
n=1
2 3
S
S
р - элемент
1 S2 2 S2 2p1
10. 2 период
С+6р - элементы
p
n=2
2 4
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
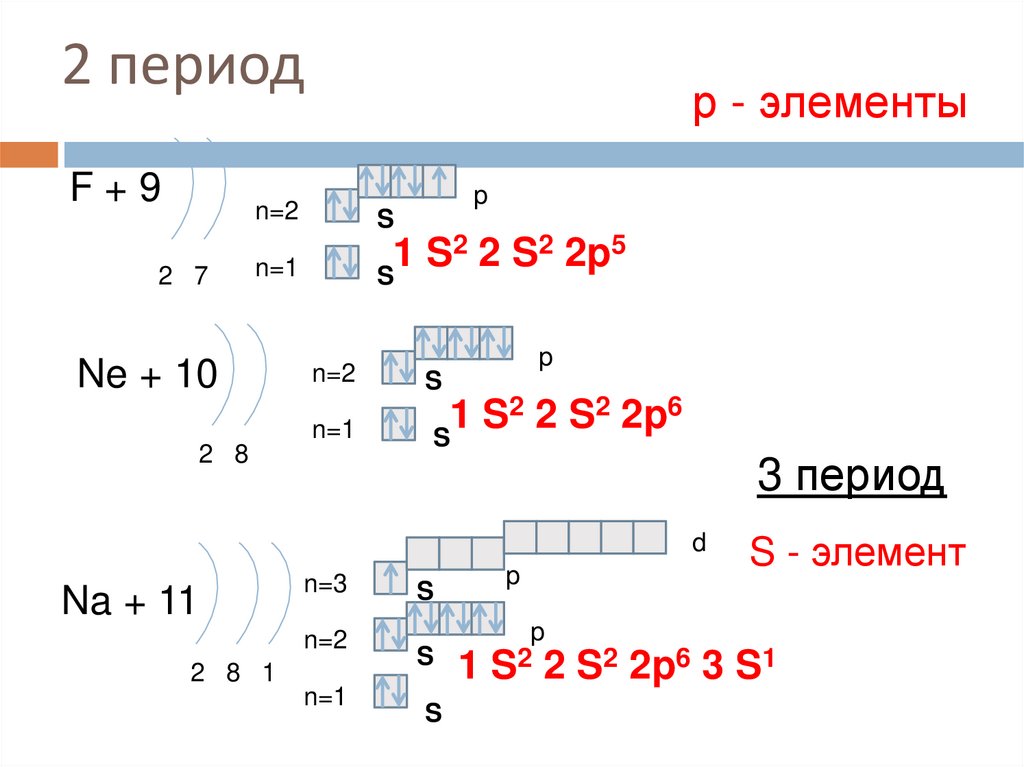
11. 2 период
F+92 7
р - элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
n=2
n=1
2 8
p
S
2 2 S2 2p6
1
S
S
3 период
d
Na + 11
n=3
n=2
2 8 1
n=1
p
S
S
S
1
p
S2 2
S - элемент
S2 2p6 3 S1
12. 3 период
dp
S
S- р - элементы
n=3
Mg + 12
n=2
S
2 8 2 n=1
S
S
Al + 13
n=3
n=2
n=1
2 8 3
1
p
S2 2
S2 2p6 3 S2
p
S
1 S2 2 S2 2p63 S2 3p1
13. Выводы:
Причина сходства химических элементовзаключается в одинаковом строении внешних
энергетических уровней их атомов
Одинаковое строение внешних
энергетических уровней периодически (т.е.
через определенные промежутки - периоды)
повторяется, поэтому периодически
повторяются и свойства химических
элементов
14. Домашнее задание
Параграф , записать в тетрадь информацию изпрезентации
Зарисовать строение химических элементов 1-3
периода










 Химия
Химия








