Похожие презентации:
Строение электронных оболочек атомов
1. Тема урока: Строение электронных оболочек атомов
2. Цель урока: развитие химической компетентности учащихся в области современного представления о строении атома
3. Вспомни!
4.
Назад1. Чему равно общее количество
электронов в атоме?
5.
Назад2. Что такое энергетический
уровень?
6.
Назад3. Определите число протонов, электронов
и нейтронов в данном атоме.
7.
Назад4. Определите число протонов, электронов и
нейтронов в данном атоме.
8.
Актуализация знаний1.
Определите число протонов, электронов и нейтронов в атомах
элементов: золота.
2.
Порядковый номер элемента в таблице Д.И. Менделеева равен 35. Какой
это элемент? Чему равен заряд ядра этого атома? Сколько протонов,
электронов, нейтронов в его атоме?
9.
Ребята, мы с вами знаем что у каждого из насесть свой дом. А как думаете у электронов есть
свои домики? А комнаты?
10. Электронная оболочка – это совокупность всех электронов в атоме, окружающих ядро
Электроны расположены на различномрасстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его
труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
11.
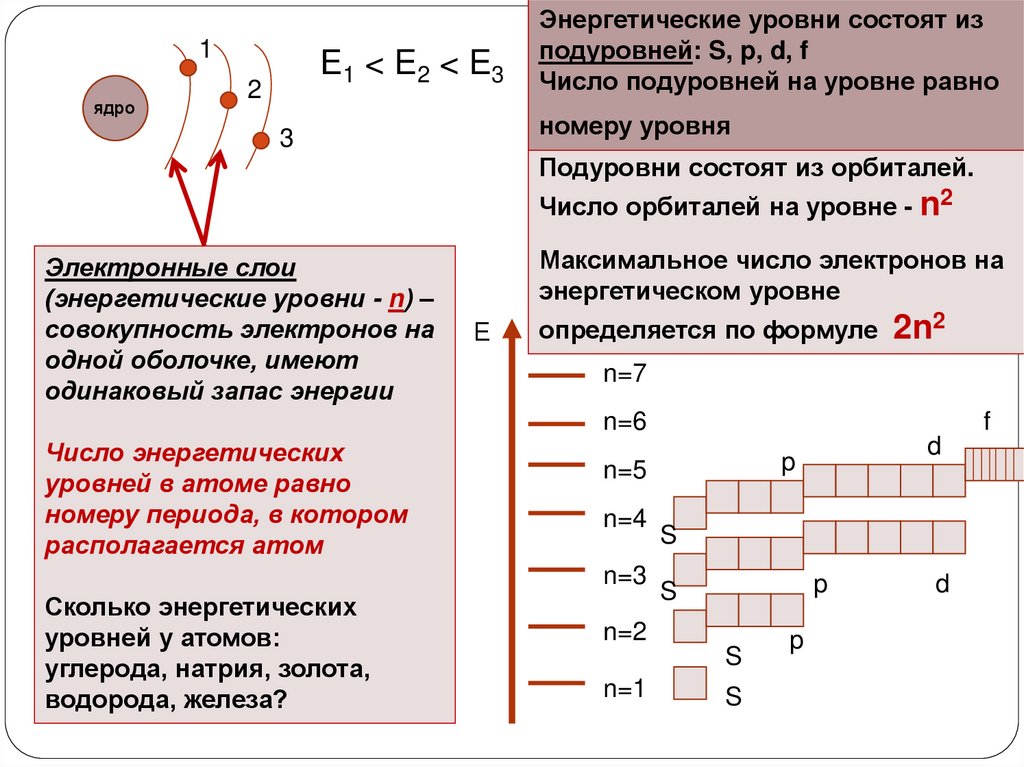
1ядро
Е1 < E2 < E3
2
Энергетические уровни состоят из
подуровней: S, p, d, f
Число подуровней на уровне равно
номеру уровня
3
Подуровни состоят из орбиталей.
Число орбиталей на уровне - n2
Электронные слои
(энергетические уровни - n) –
совокупность электронов на
одной оболочке, имеют
одинаковый запас энергии
Максимальное число электронов на
энергетическом уровне
Е
определяется по формуле 2n2
n=7
n=6
Число энергетических
уровней в атоме равно
номеру периода, в котором
располагается атом
n=4
S
p
S
n=2
S
n=1
d
p
n=5
n=3
Сколько энергетических
уровней у атомов:
углерода, натрия, золота,
водорода, железа?
f
S
p
d
12.
Энергетические уровни, содержащиемаксимальное число электронов, называются
завершенными. Они обладают повышенной
устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее
число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
13. ЗАПОМНИТЕ!
Электроны, расположенные напоследней электронной оболочке,
называются внешними.
Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
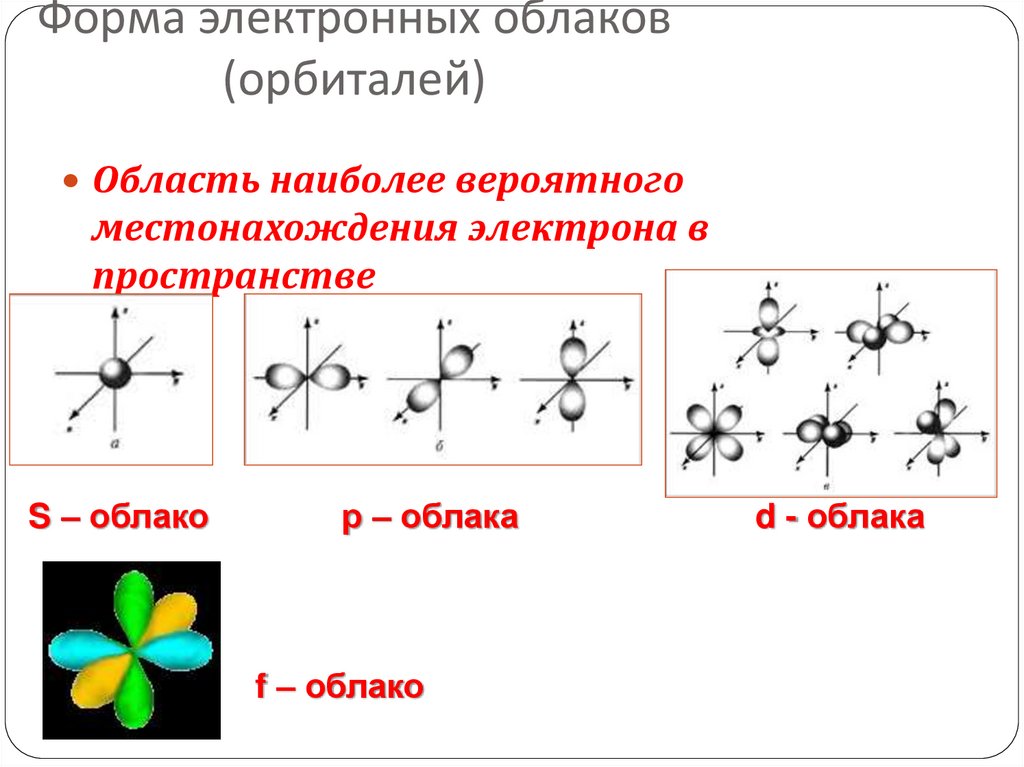
14. Форма электронных облаков (орбиталей)
Область наиболее вероятногоместонахождения электрона в
пространстве
S – облако
р – облака
f – облако
d - облака
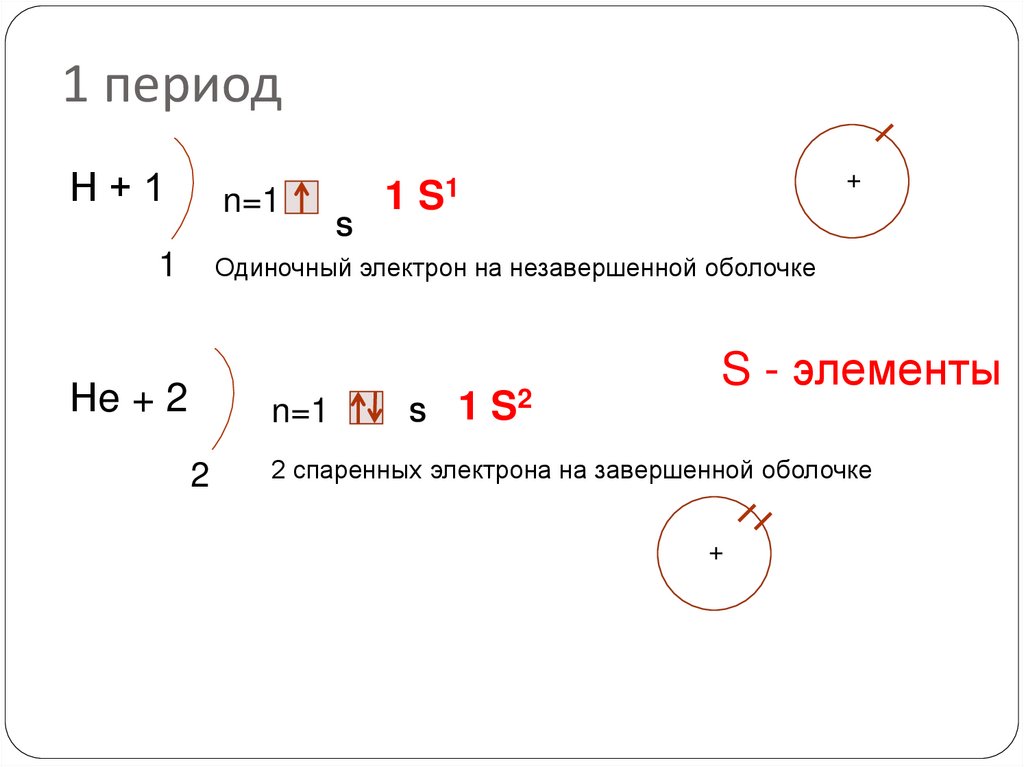
15. 1 период
Н+1n=1
1
S
+
1 S1
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
S - элементы
2 спаренных электрона на завершенной оболочке
+
16.
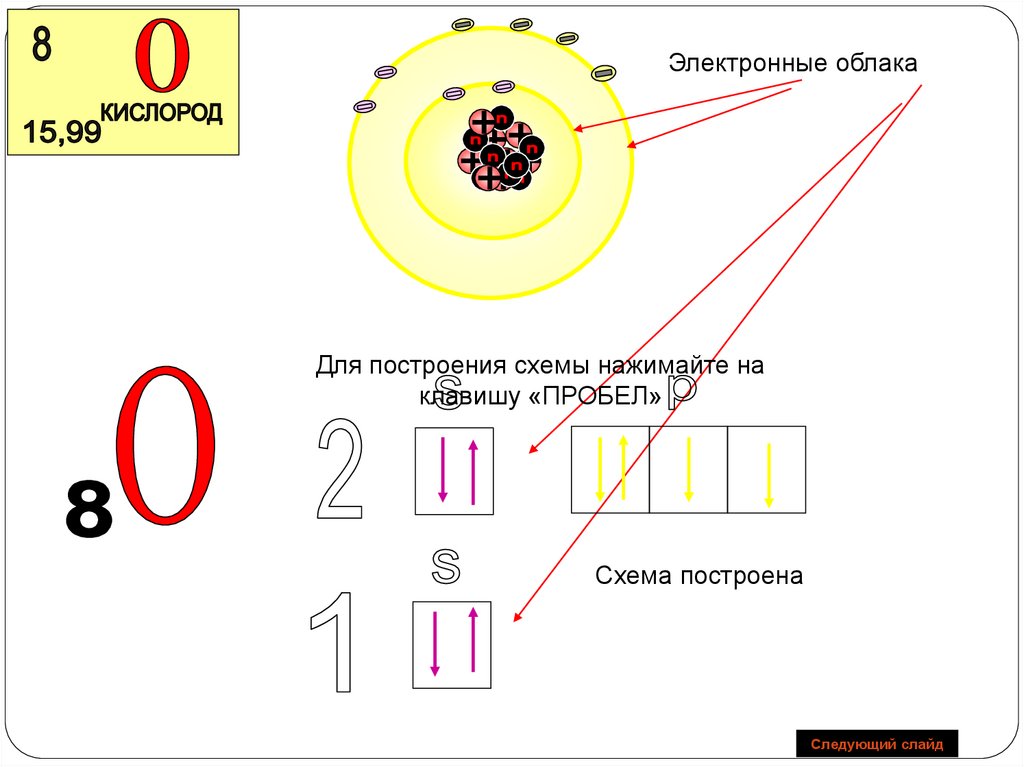
Электронные облакаДля построения схемы нажимайте на клавишу
«ПРОБЕЛ»
Схема построена
Следующий слайд
17.
Электронные облакаДля построения схемы нажимайте на
клавишу «ПРОБЕЛ»
Схема построена
Следующий слайд
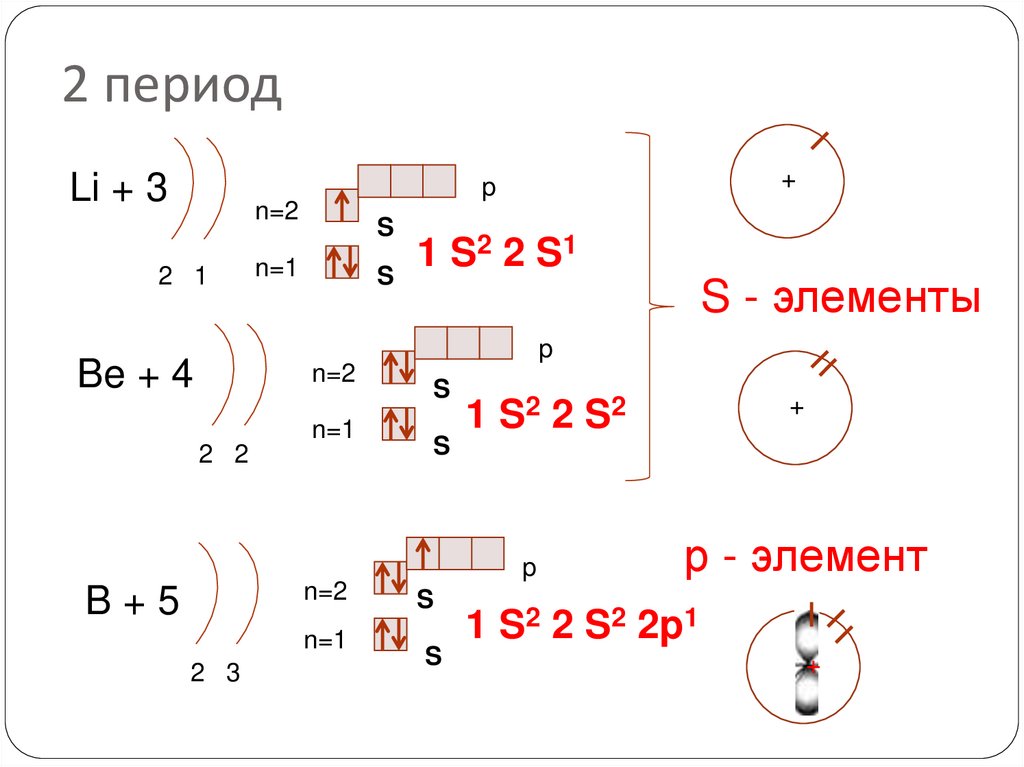
18. 2 период
Li + 3+
p
n=2
2 1
S
2 2 S1
1
S
S
n=1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
p
n=2
B+5
n=1
2 3
S
S
+
1 S2 2 S 2
р - элемент
1 S2 2 S2 2p1
++
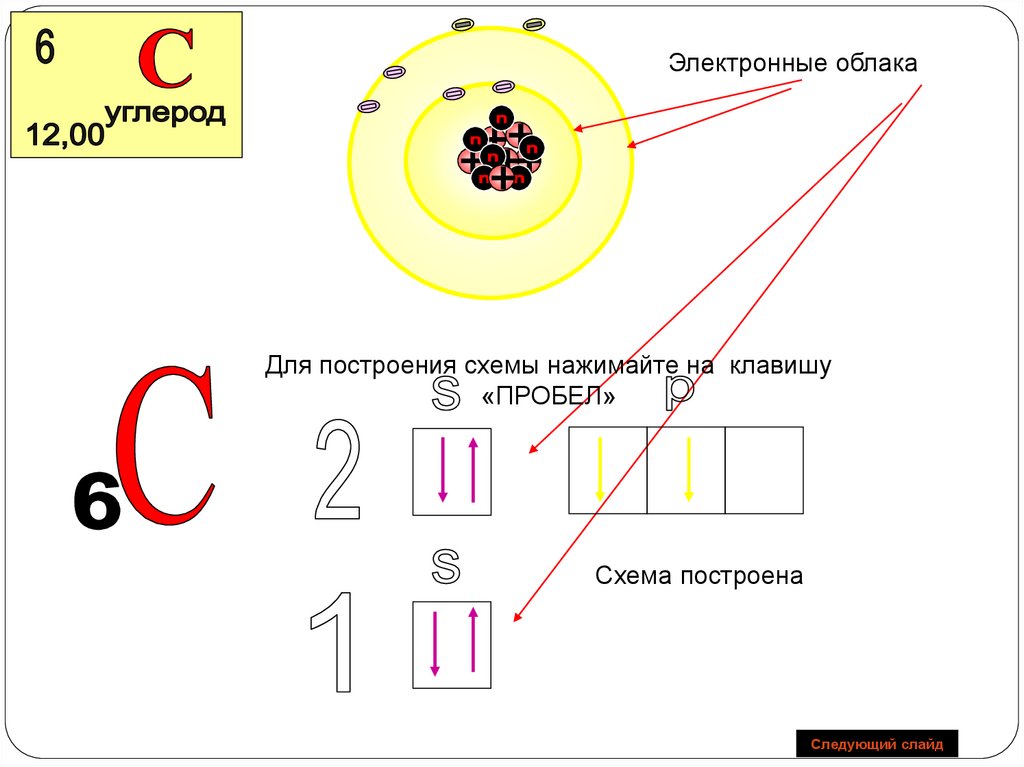
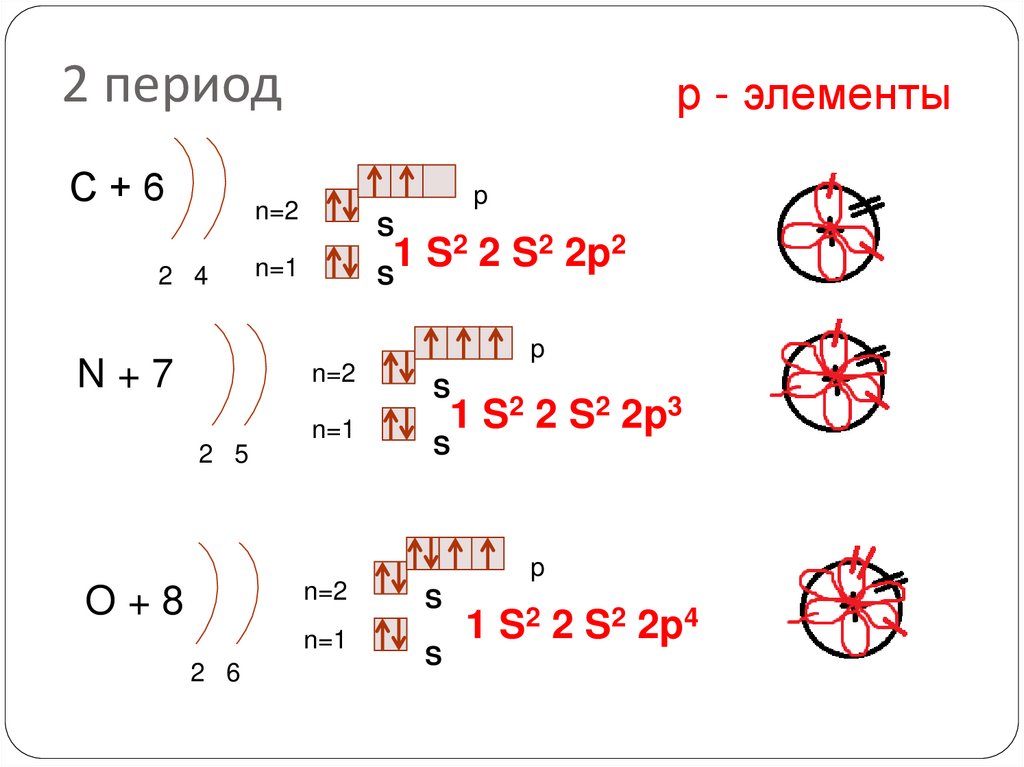
19. 2 период
С+6р - элементы
p
n=2
2 4
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4













 Химия
Химия








