Похожие презентации:
Окислительно-восстановительное равновесие
1.
Окислительновосстановительноеравновесие
12.12.2021
2.
Почему одни ОВР протекают, а другие нет?• Возможность протекания окислительно-восстановительной
реакции зависит от
• 1) природы окислителя и восстановителя
• 2) условий проведения реакции: концентраций растворов
реагентов и рН среды.
• Возможность самопроизвольного протекания любого процесса
связана с его энергией Гиббса. – максимально возможная
полезная работа, которую может совершить хим система.
3.
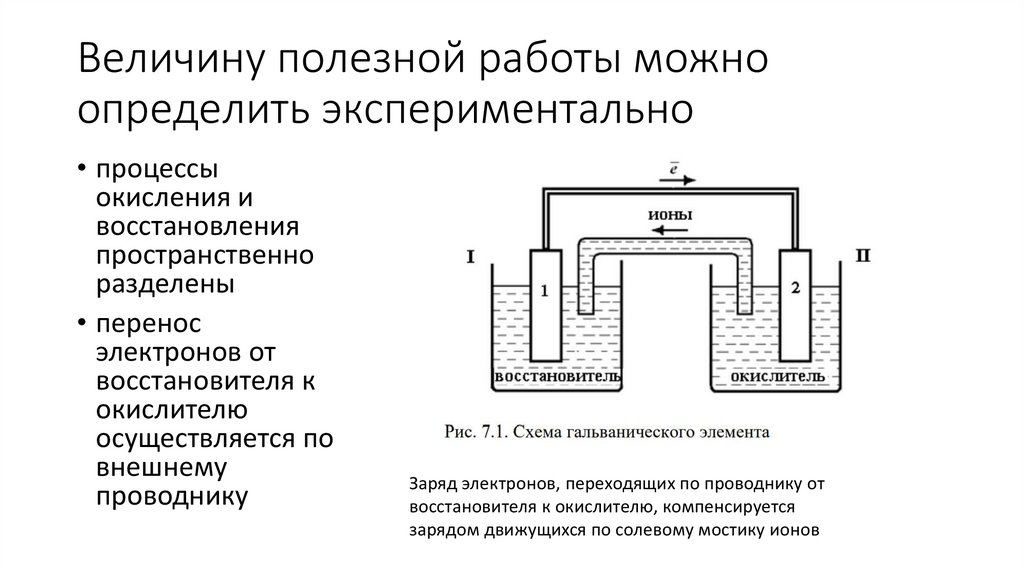
Величину полезной работы можноопределить экспериментально
• процессы
окисления и
восстановления
пространственно
разделены
• перенос
электронов от
восстановителя к
окислителю
осуществляется по
внешнему
проводнику
Заряд электронов, переходящих по проводнику от
восстановителя к окислителю, компенсируется
зарядом движущихся по солевому мостику ионов
4.
В гальваническом элементе за счет химическойреакции совершается электрическая работа
• n — число электронов, переходящих от восстановителя к
окислителю;
• F — число Фарадея, 96485 Кл, равное по модулю заряду одного
моль электронов;
• ΔЕ — разность электрических потенциалов (в вольтах),
возникающая между металлическими пластинками 1 и 2
5.
Поскольку все процессы в гальваническомэлементе протекают при постоянных Т и р
• окислительно-восстановительная реакция самопроизвольна
(ΔrG < 0), когда разность электрических потенциалов в гальваническом
элементе положительна (ΔE > 0)
• возможность пространственного разделения процессов окисления и
восстановления позволяет представлять ΔЕ как разность собственных
характеристик полуреакций, составляющих окислительновосстановительный процесс — их электродных потенциалов.
6.
Пример 17.
Как может возникать потенциалНакопление электрического заряда на пластинке рано или поздно затрудняет дальнейший переход ионов,
и устанавливается равновесие.
8.
СВЭ• Абсолютную величину потенциала,
возникающего на границе металл – раствор,
измерить невозможно, поэтому его
определяют относительно какого-либо
электрода, который называется электродом
сравнения. Для получения сопоставимых
значений электродные потенциалы
различных электродов измеряют
относительно одного и того же электрода
сравнения, в качестве которого выбран
стандартный водородный электрод.
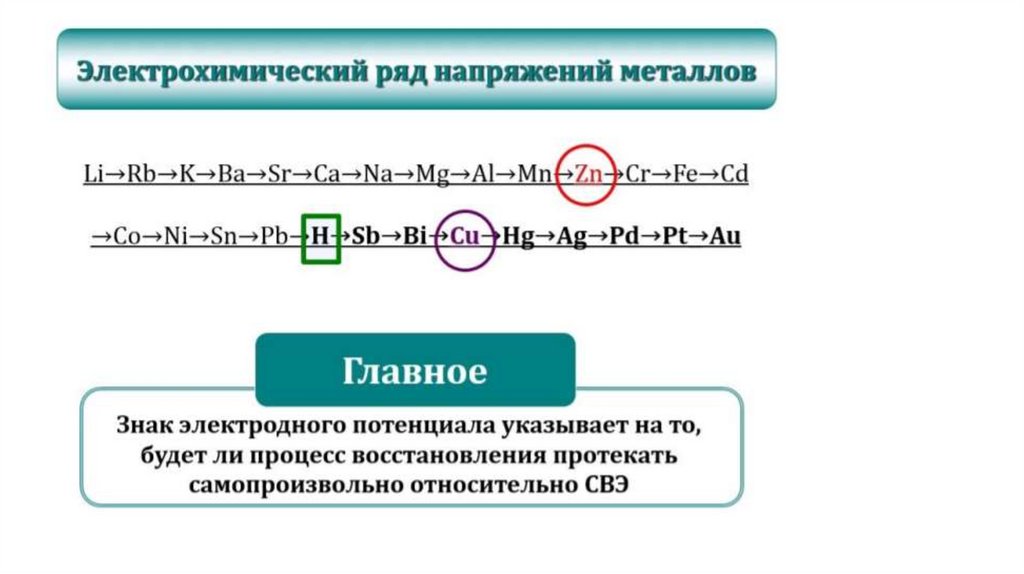
• Потенциал СВЭ = 0 при любой Т
9.
Измерение потенциала исследуемогоэлектрода
10.
Электродный потенциал металлическогоэлектрода
• это потенциал гальванического элемента, составленного из
исследуемого и стандартного водородного электродов.
• Если измерения производятся при стандартной температуре 298
К и при условии, что активность ионов металла M(n+) в растворе
равна единице, электродный потенциал называется стандартным
электродным потенциалом металла и обозначается Е0.
• Все полуреакции записываются в виде процессов восстановления
11.
12.
13.
ОВРПолуреакция окисления
Полуреакция восстановления
14.
15.
Электрохимическая ячейка16.
17.
18.
19.
20.
21.
22.
Зависимость реального потенциала от pHсреды
23.
Зависимость реального потенциала отобразования малорастворимых соединений




























 Химия
Химия








