Похожие презентации:
Уравнение Клаузиуса-Клапейрона. Диаграммы
1.
Лекция 9Уравнение Клаузиуса-Клапейрона. Диаграммы
состояния однокомпонентных систем
(продолжение). Диаграммы состояния воды,
серы, фосфора и углерода. Углеродные
наноматериалы.
2.
Лекция 8Условия фазового и мембранного равновесия.
Правило фаз.
Диаграммы состояния однокомпонентных систем.
3.
2 баллаХимическая реакция. Отметьте правильные утверждения
1) Энергия Гиббса самопроизвольной химической реакции
должна убывать.
2) При самопроизвольной реакции (dG)сист.<0
3) Условие химического равновесия: равенство химических
потенциалов продуктов и реагентов (с учетом стехиометрии).
4) При самопроизвольной реакции энергия Гиббса закрытой
системы при постоянных p,T должна убывать.
5) При самопроизвольной реакции энергия Гельмгольца закрытой
системы при постоянных V,T должна убывать.
4.
dG SdT Vdp i dni Tdsii
dF SdT pdV i dni Tdsi
i
dG T , p ,n Tdsi 0 dF T ,V ,n Tdsi 0
5.
2(dG )T , p Tdsi i dni N 2O4 2 NO2 dnN 2O4
i
2
(dF )T ,V Tdsi i dni N 2O4 2 NO2 dnN 2O4
i
G
nN2O4
N2O4 2 NO2 0
T , p
F
nN2O4
N2O4 2 NO2 0
T ,V
6.
2 баллаСтандартная энергия Гиббса химической реакции ∆G0. :
Найдите правильные утверждения:
1) Равна изменению энергии Гиббса при переходе от реагентов в
стандартном состоянии к продуктам в стандартном состоянии;
2) Определяется только при стандартных температурах 0К и 298К;
3) Достигает минимума при постоянной температуре и давлении;
4) Для самопроизвольных реакций - меньше нуля.
5) Равна изменению энергии Гиббса в реакции, когда равновесие
достигнуто;
7.
2 баллаКонстанта равновесия К газовой химической реакции :
Найдите правильные утверждения:
1) С температурой растет,
2) Безразмерна,
3) Является константой только для идеальных газов, а для
реальных газов должна быть заменена константой Кf, выраженной
через фугитивности;
4) Не зависти от общего давления в системе ( при постоянной
температуре)
5) В состоянии равновесия достигает минимального значения.
8.
2 баллаФазовое равновесие.
Найдите правильные утверждения:
1) Температуры всех фаз должны быть одинаковы;
2) В равновесии могут находится С-Ф+2 компонента;
3) При самопроизвольном движении к фазовому равновесию
dsi >0 и dGСист.<0
4) Равенство химических потенциалов для каждого компонента во
всех фазах - достаточное условие фазового равновесия;
5) Равенство химических потенциалов для каждого компонента во
всех фазах (если компонент присутствует в фазе) - необходимое
условие фазового равновесия;
9.
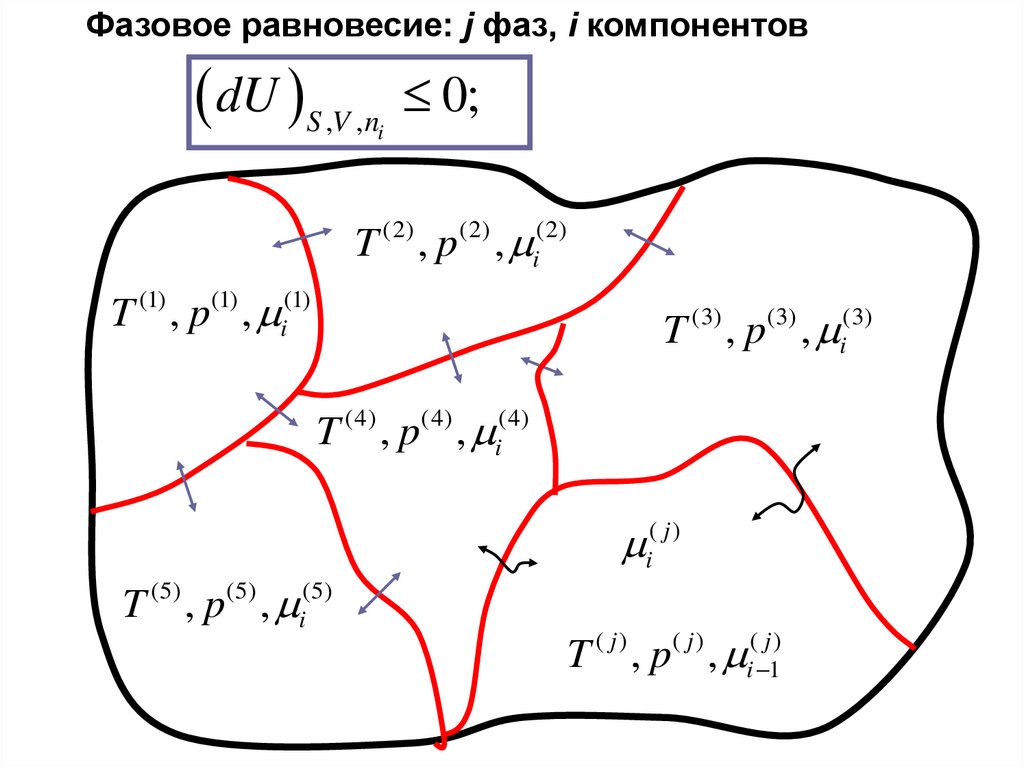
Фазовое равновесие10.
Фазовое равновесие: j фаз, i компонентовdU S ,V ,n
0;
i
T , p ,
(2)
(2)
(2)
i
T (1) , p(1) , i(1)
T (3) , p(3) , i(3)
T , p ,
(4)
(4)
(4)
i
i( j )
T (5) , p(5) , i(5)
T , p ,
( j)
( j)
( j)
i 1
11.
Фазовое равновесие. Две фазы, два компонента2
(dU ) S ,V ,n1 , n2 TdS pdV i dni Tdsi 0
i 1
(dU ) S ,V ,n1 , n2 dU (1) dU (2)
T (1) dS (1) p (1) dV (1) 1(1) dn1(1) 2(1) dn2(1)
T (2) dS (2) p (2) dV (2) 1(2) dn1(2) 2(2) dn2(2) 0
dS (1) dS (2) dS 0; dV (1) dV (2) dV 0
dn1(1) dn1(2) dn1 0; dn2(1) dn2(2) dn2 0
(dU ) S ,V ,n1 , n2 Tdsi 0 dU (1) dU (2)
T (1) T (2) dS (1) p (1) p (2) dV (1)
(1)
1
1(2) dn1(1) 2(1) 2(2) dn2(1) 0
T (1) T (2) ; p (1) p (2)
1(1) 1(2) ; 2(1) 2(1)
12.
Химические потенциалы чистого (газ., жд., тв.) компонента1 1 ; 1 2 f (n1 1 ; n1 2 ) ?
1,ч ,газ. ( p, T )
0
1,ч ., газ .
1,ч ,тв. ( p, T )
0
1,ч .,тв .
p1
n1RT
(T , p ) RT ln 0 ; p1
p
V
0
p
(T , p ) V1,ч.,тв.dp
0
0
1,ч.,тв .
0
(T , p )
p0
p
1,ч ,жд. ( p, T ) 1,0ч.,жд. (T , p 0 ) V1,ч.,жд.dp 1,0ч.,жд. (T , p 0 )
p0
13.
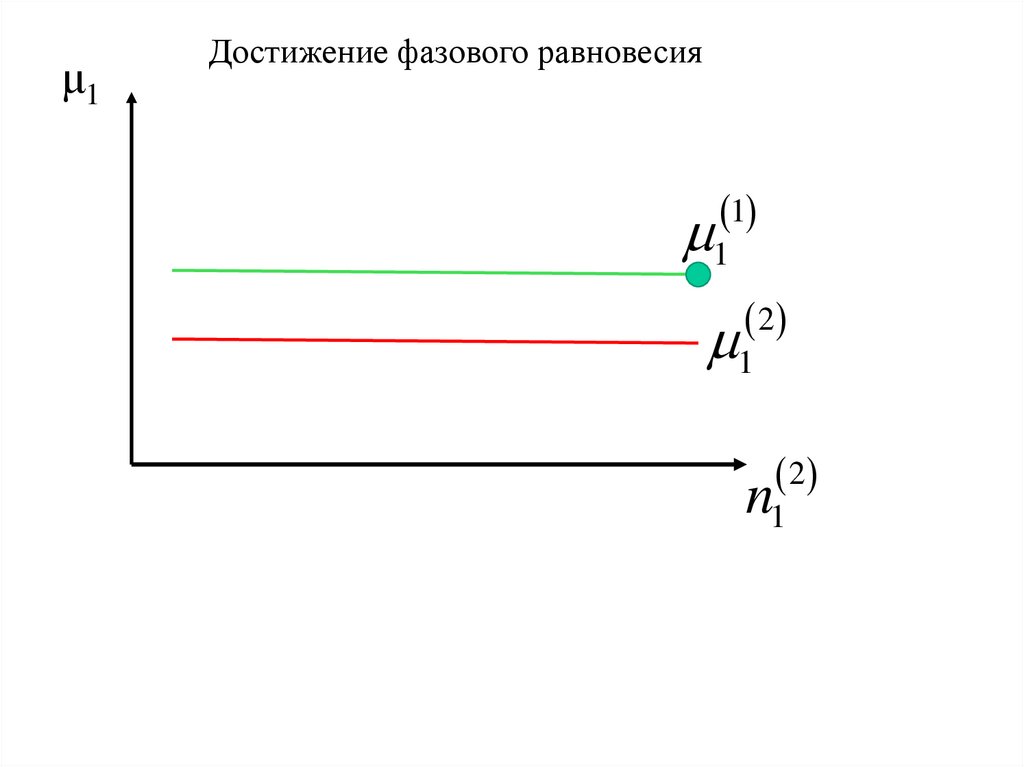
μ1Достижение фазового равновесия
1
1
2
1
2
n1
14.
Достижение равновесия в химической реакции2NO2
μ (NO2), μ (N2O4)
2μ (NO2)
N2O4
μ (N2O4)
p(NO2) + p(N2O4) = const
Рав.
p(N2O4)
p(NO2)
15.
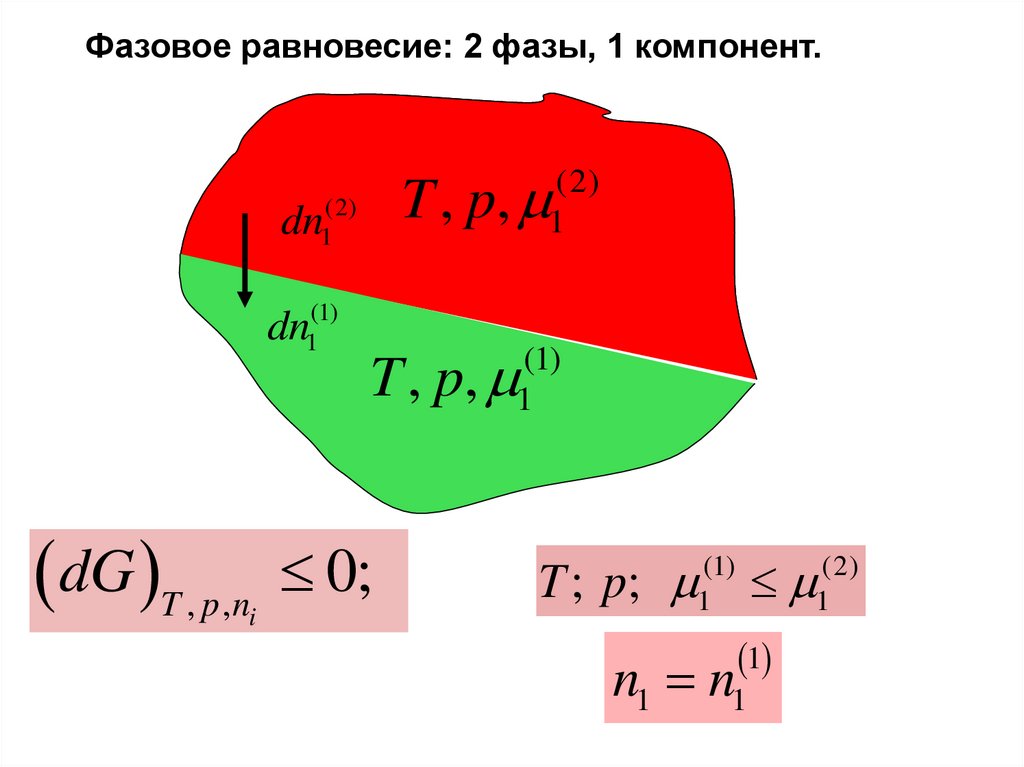
Фазовое равновесие. Две фазы, один компонент.2
(dU ) S ,V ,n1 , n2 TdS pdV i dni Tdsi 0
i 1
(dU ) S ,V ,n1 , n2 dU (1) dU (2)
T (1) dS (1) p (1) dV (1) 1(1) dn1(1) T (2) dS (2)
p (2) dV (2) 1(2) dn1(2) 0
dS (1) dS (2) dS 0; dV (1) dV (2) dV 0
dn1(1) dn1(2) dn1 0;
(dU ) S ,V ,n1 Tdsi 0 dU (1) dU (2)
T (1) T (2) dS (1) p (1) p (2) dV (1)
(1)
1
1(2) dn1(1) 0
T (1) T (2) ; p (1) p (2)
1(1) 1(2)
16.
Фазовое равновесие: 2 фазы, 1 компонент. U f (n1(1) )(2)
1
dn
(1)
1
dn
dU S ,V ,n
1
T , p,
(2)
1
1(1) 1(2)
T , p,
1(1) 1(2) dn1(1) 0
n1(1) n1(1) равн.
(1)
1
T ; p;
(1)
1
(2)
1
1(1) 1(2)
n1(1) n1
17.
Фазовое равновесие: 2 фазы, 1 компонент.T , p,
(2)
1
(2)
1
dn
dn1(1)
dG T , p ,n
i
T , p,
0;
(1)
1
T ; p; 1(1) 1(2)
1
n1 n1
18.
Энергия Гиббса двух фаз в однокомпонентной системе(dG ) p ,T ,n 0
(1)
(2)
(3)
19.
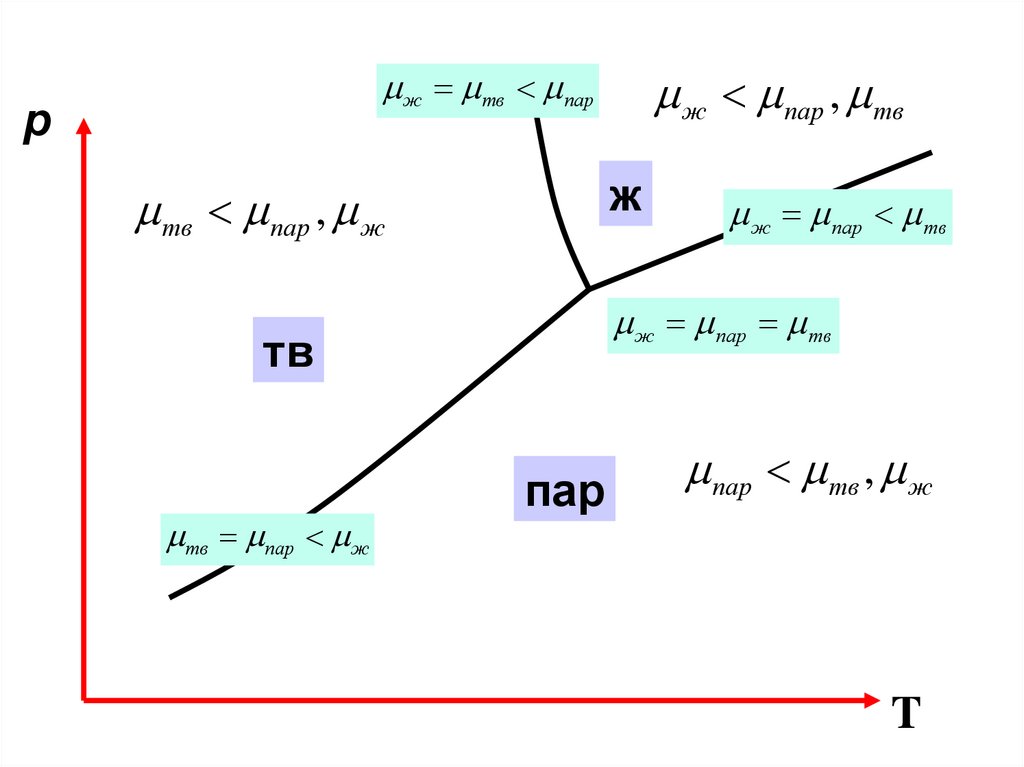
ж пар , твж тв пар
p
ж
тв пар , ж
ж пар тв
тв
тв пар ж
ж пар тв
пар
пар тв , ж
T
20.
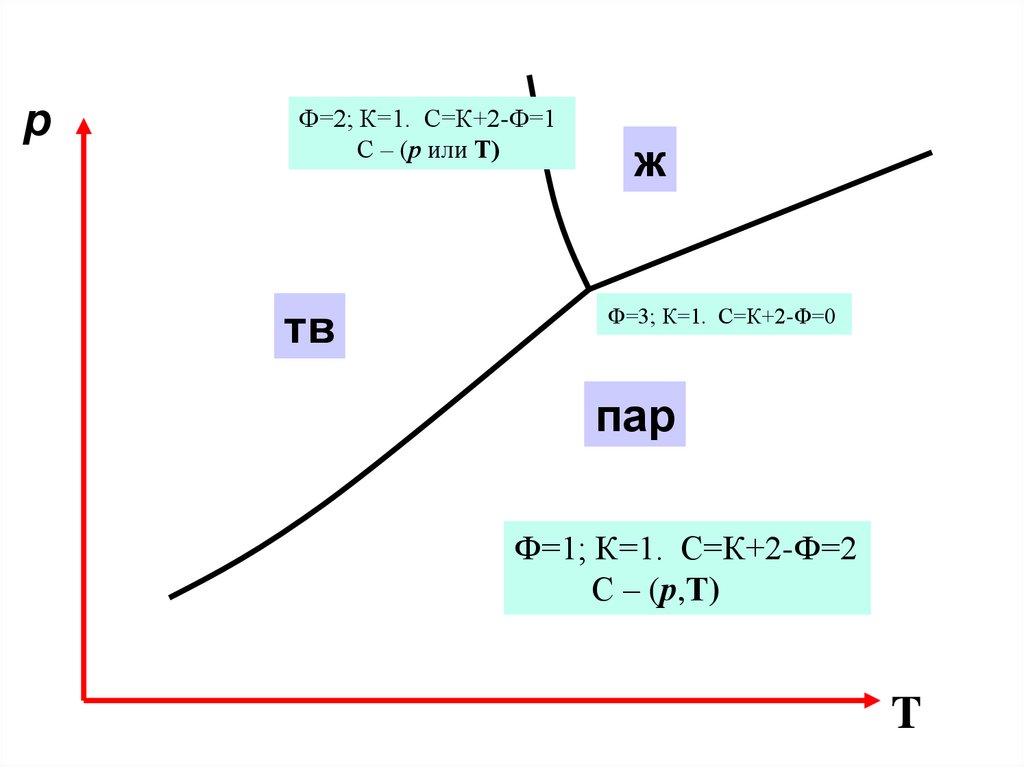
pФ=2; К=1. С=К+2-Ф=1
С – (р или Т)
тв
ж
Ф=3; К=1. С=К+2-Ф=0
пар
Ф=1; К=1. С=К+2-Ф=2
С – (р,Т)
T
21.
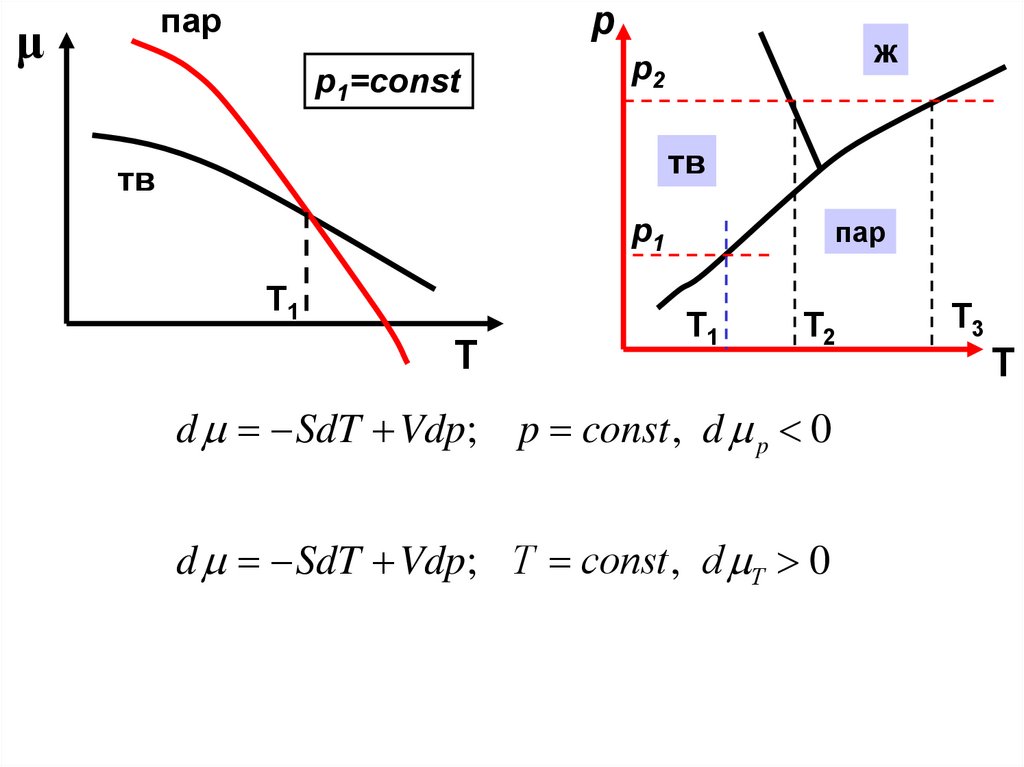
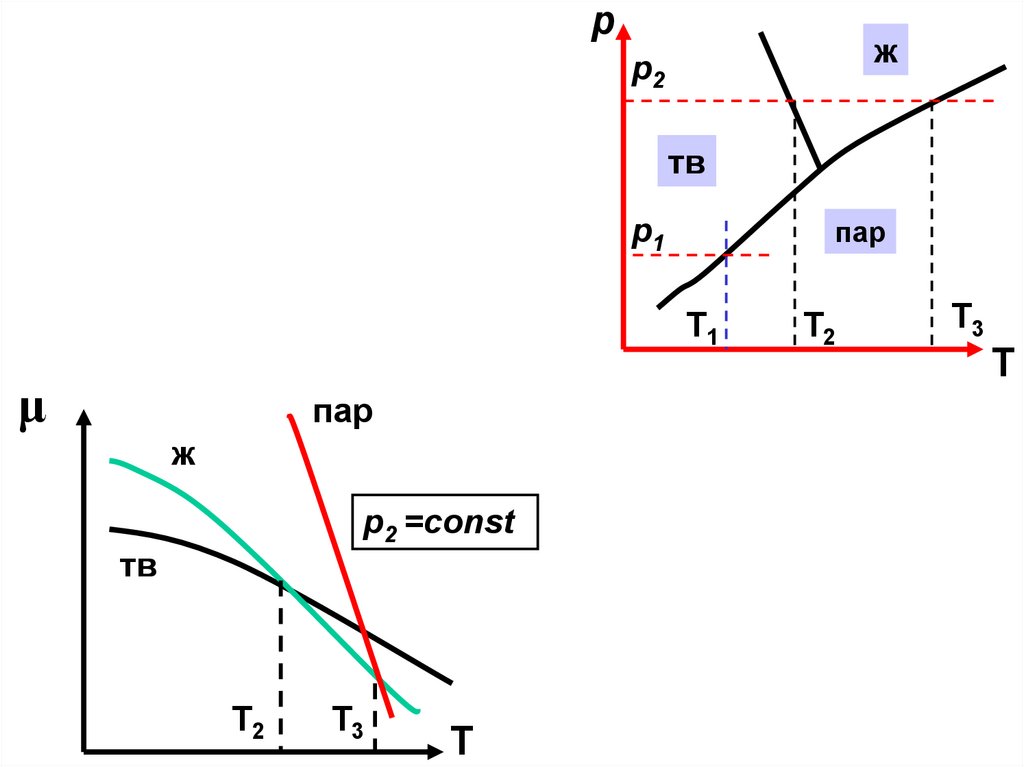
рпар
μ
p1=const
ж
p2
тв
тв
пар
p1
Т1
Т
Т1
Т2
d SdT Vdp; p const , d p 0
d SdT Vdp; Т const , d Т 0
Т3
Т
22.
рж
p2
тв
пар
p1
Т1
μ
пар
ж
p2 =const
тв
Т2
Т3
Т
Т2
Т3
Т
23.
рж
p2
тв
пар
p1
Т1
Т3
Т2
Т
μ
тв
T1=const
пар
p1
р
24.
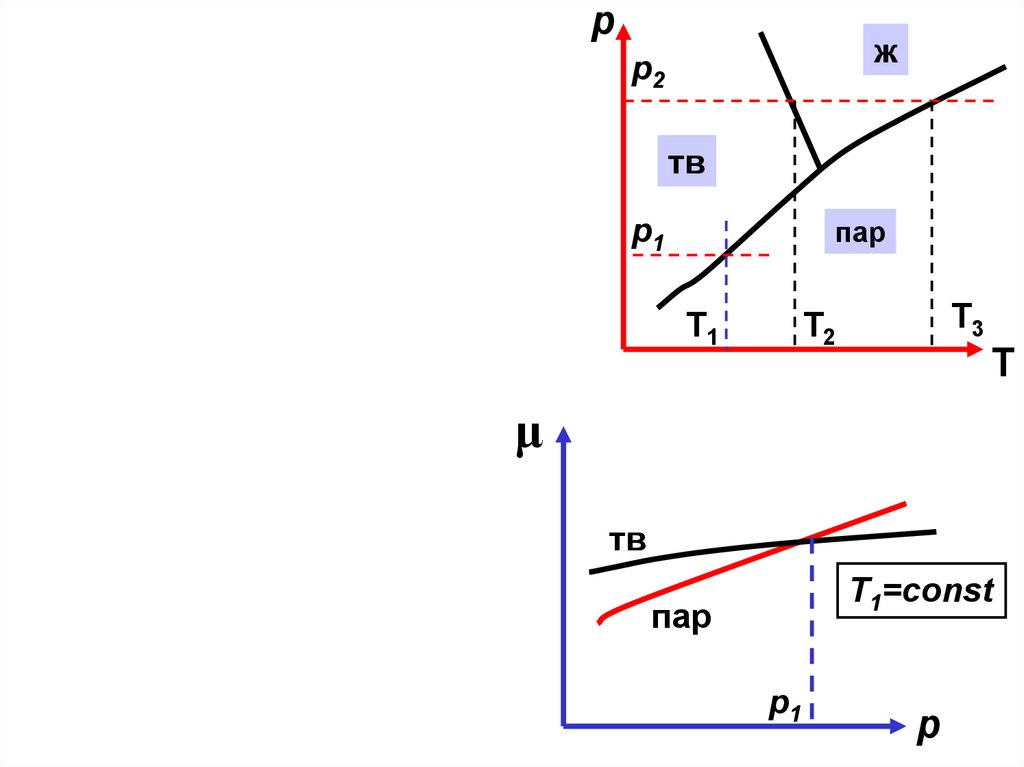
рпар
μ
ж
p2
p1=const
тв
тв
пар
p1
Т1
Т1
Т
μ
пар
p2 =const
тв
T1=const
пар
Т2
Т3
Т
μ
ж
тв
Т3
Т2
Т
p1
р
25.
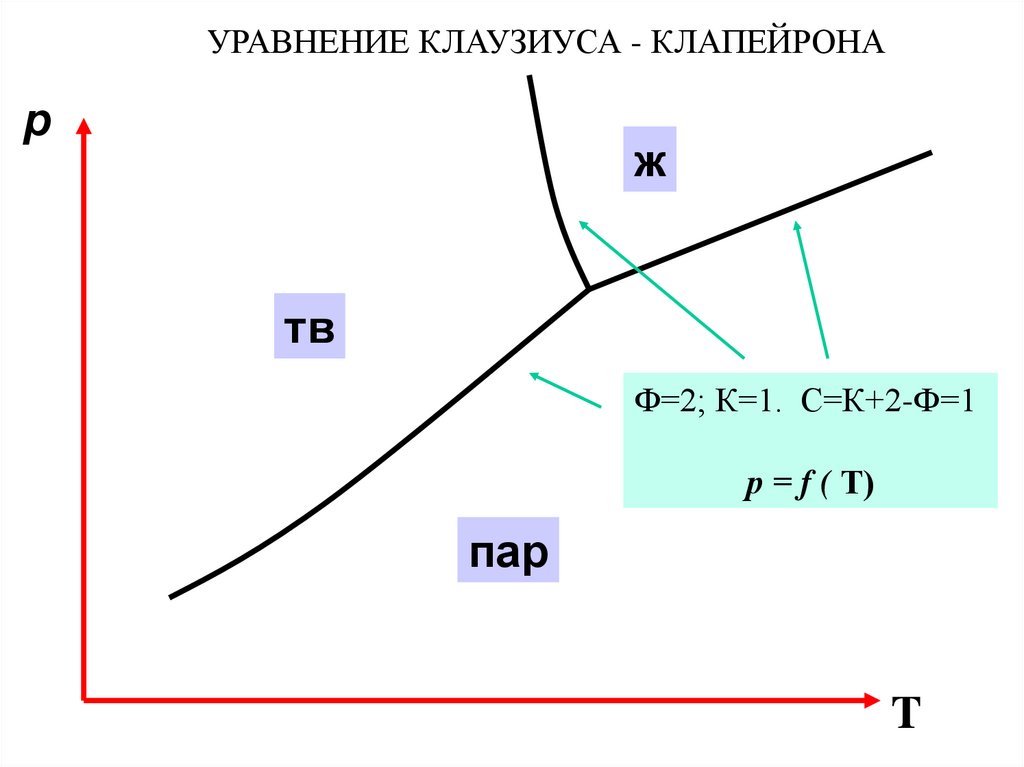
УРАВНЕНИЕ КЛАУЗИУСА - КЛАПЕЙРОНАp
ж
тв
Ф=2; К=1. С=К+2-Ф=1
р = f ( Т)
пар
T
26.
УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНАdT (1) dT (2) ; dp (1) dp (2) ; d 1(1) d 1(2)
d 1(1) d 1(2)
(1)
d 1(1) S (1) dT V (1) dp
d 1(2) S (2) dT V (2) dp
(2)
dp S (1) S (2)
(1)
(2)
dT V V
27.
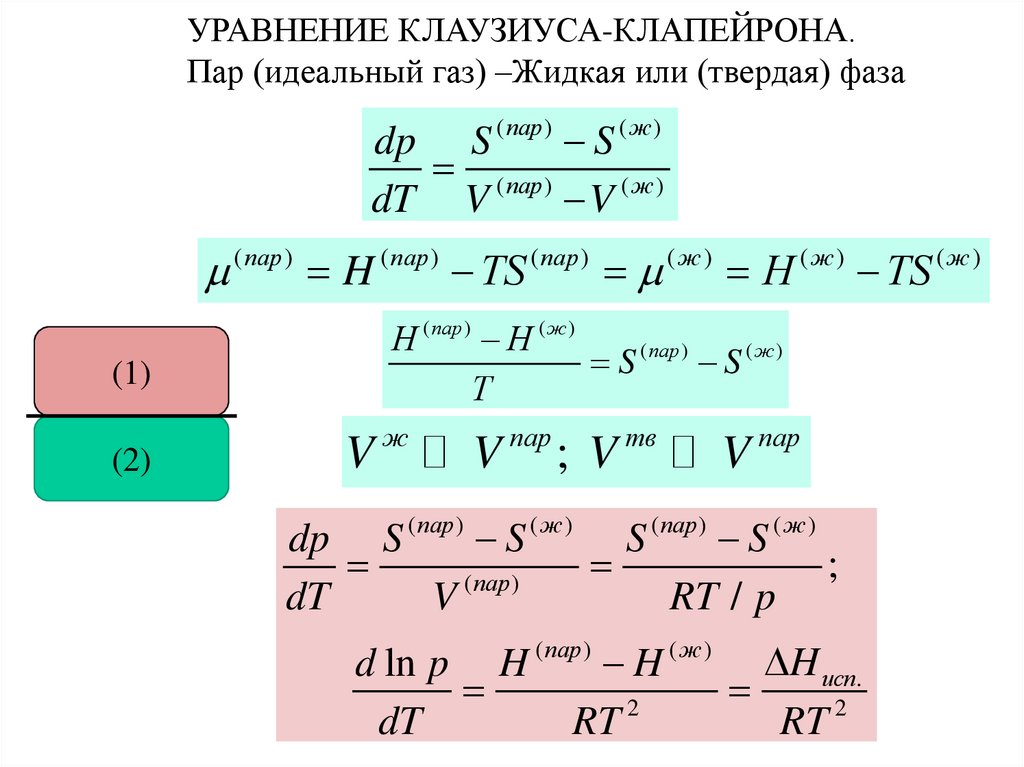
УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА.Пар (идеальный газ) –Жидкая или (твердая) фаза
dp S ( пар ) S ( ж )
( пар )
dT V
V (ж)
( пар )
H
ТS
( пар )
(ж)
H
(ж)
ТS
Н ( пар ) Н ( ж )
S ( пар ) S ( ж )
Т
(1)
(2)
( пар )
V
ж
V
пар
;V
тв
V
пар
dp S ( пар ) S ( ж ) S ( пар ) S ( ж )
;
( пар )
dT
V
RT / p
d ln p H ( пар ) H ( ж ) H исп.
2
dT
RT
RT 2
(ж)
28.
УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА.Жидкость – Твердая фаза
dp S ( тв ) S ( ж )
( тв )
dT V
V (ж)
(1)
(2)
( тв )
H
( тв )
ТS
( тв )
(ж)
H
(ж)
ТS
Н ( тв ) Н ( ж )
S ( тв ) S ( ж )
Т
dp S ( тв ) S ( ж )
H ( тв ) H ( ж )
( тв )
;
(ж)
( тв )
(ж)
dT V
V
T V
V
dp H плав. d ln T плавV
;
dT T плавV
dp
H плав.
(ж)
29.
ФАЗОВЫЕ ДИАГРАММЫ ОДНОКОМПОНЕНТНЫХСИСТЕМ
30.
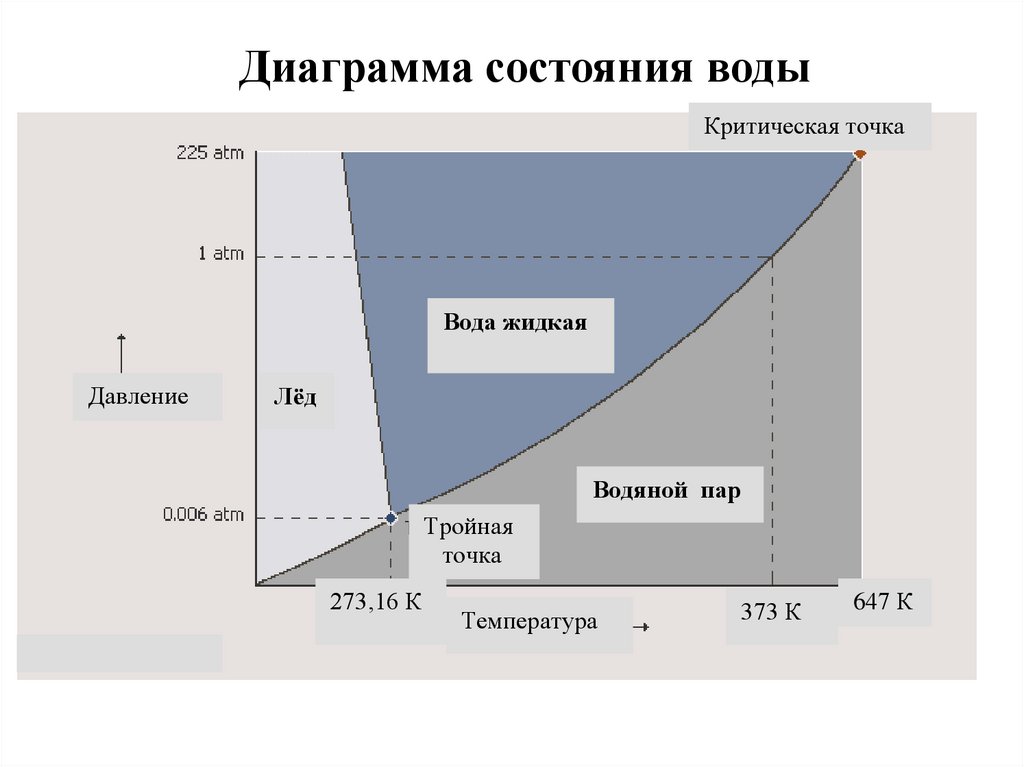
Диаграмма состояния водыКритическая точка
Вода жидкая
Давление
Лёд
Водяной пар
Тройная
точка
273,16 К
Температура
373 К
647 К
31.
Зависимость (dр/dT) для плавленияЛед
Н2О
32.
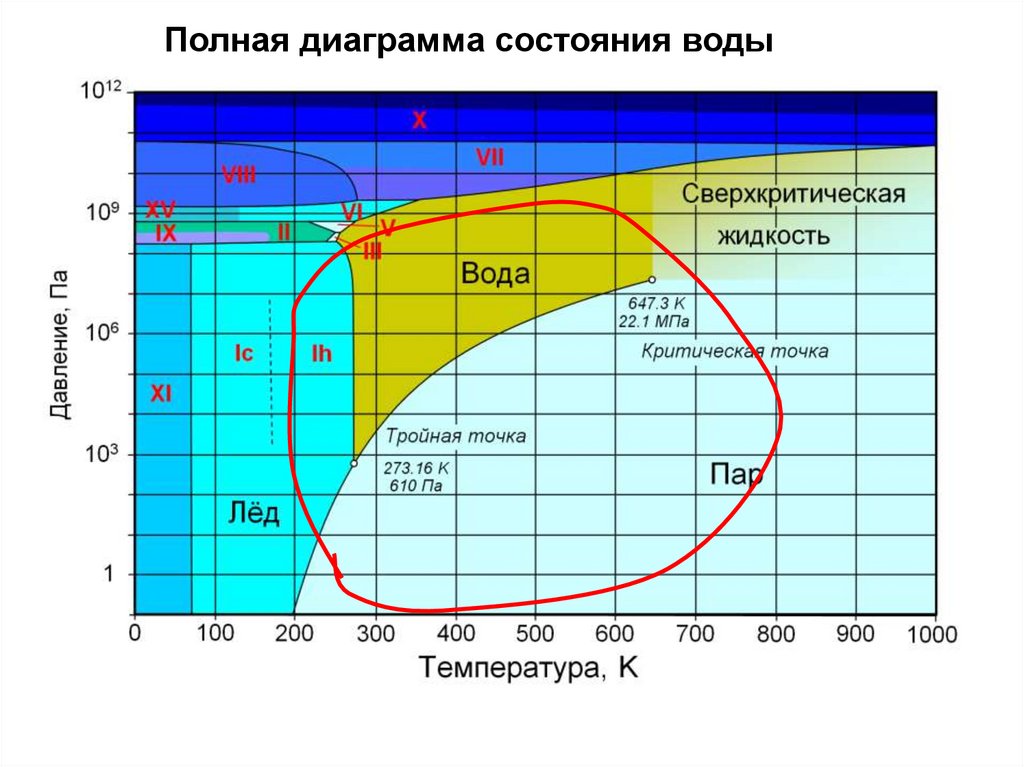
Полная диаграмма состояния воды33.
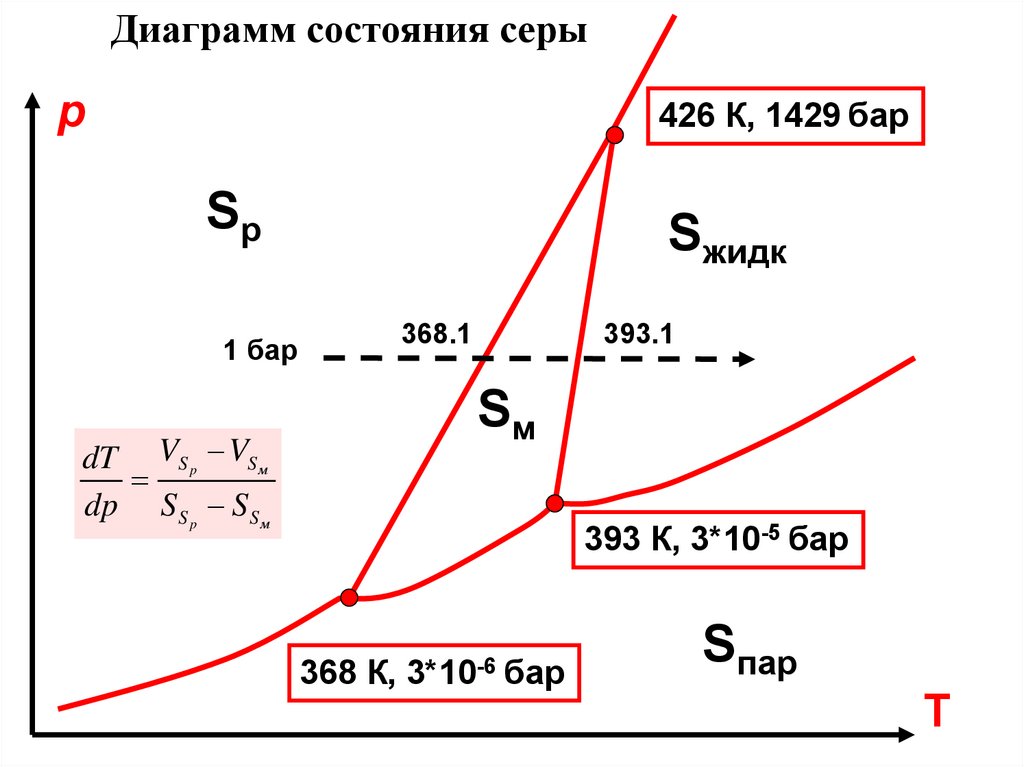
Диаграмм состояния серыр
426 К, 1429 бар
Sр
Sжидк
368.1
1 бар
393.1
Sм
dT VS p VS м
dp S S p S S м
393 К, 3*10-5 бар
368 К,
3*10-6
бар
Sпар
Т
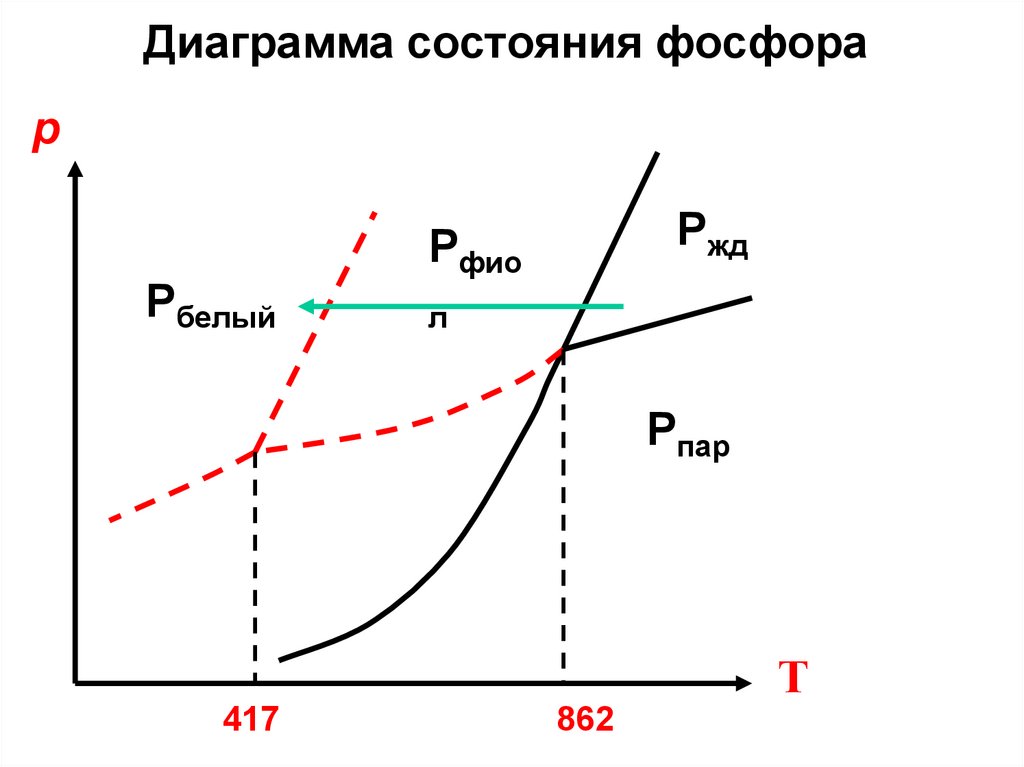
34.
Диаграмма состояния фосфорар
Рбелый
Ржд
Рфио
л
Рпар
Т
417
862
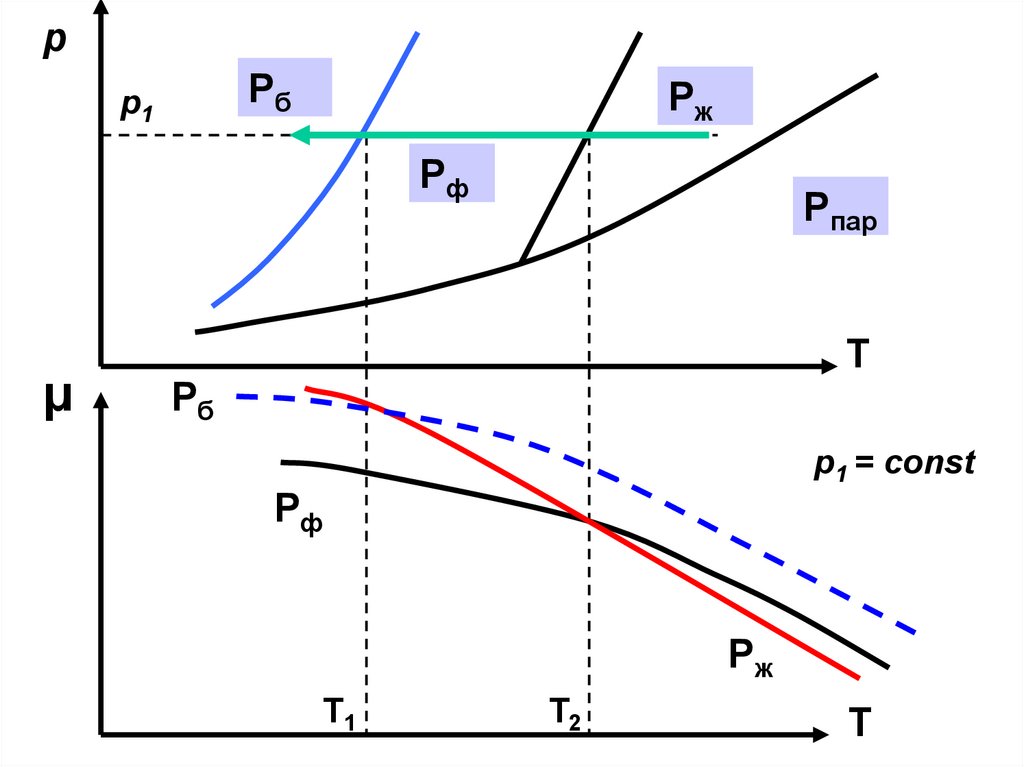
35.
pPб
p1
Pж
Pф
μ
Pпар
T
Pб
p1 = const
Pф
Pж
T1
T2
T
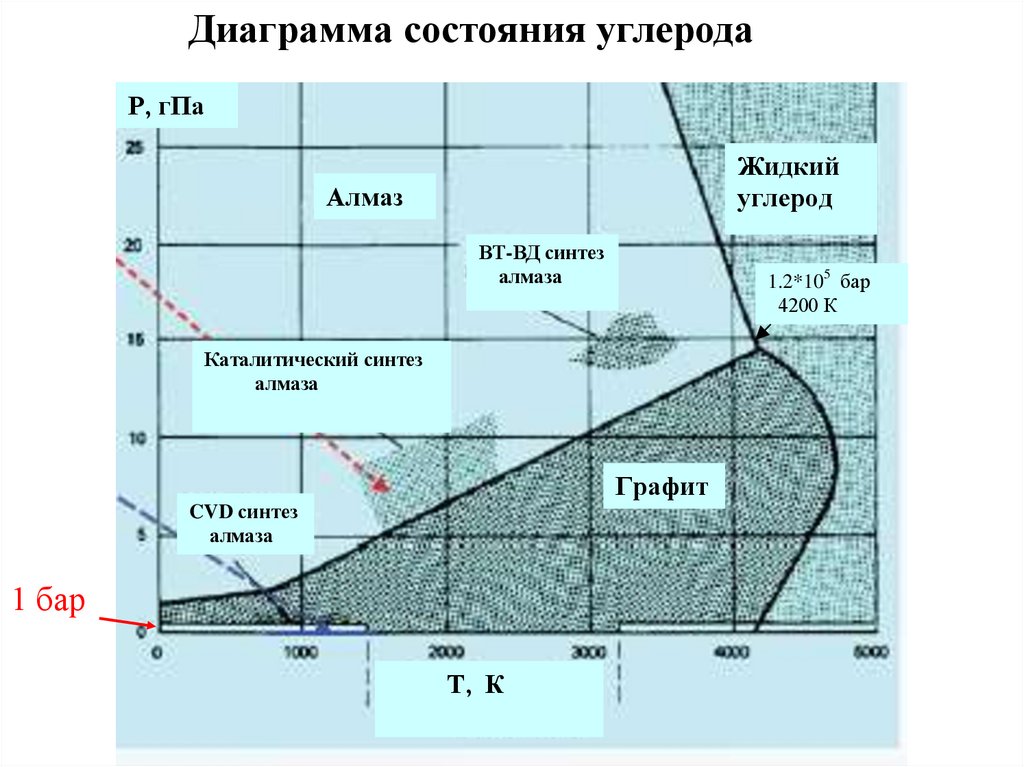
36.
Диаграмма состояния углеродаР, гПа
Жидкий
углерод
Алмаз
ВТ-ВД синтез
алмаза
1.2*105 бар
4200 К
Каталитический синтез
алмаза
Графит
CVD синтез
алмаза
1 бар
Т, К
37.
Графит и алмаз, монотропный переход (?)μ
p = 1 бар = const
Алмаз
3.6 кДж/моль
Графит
500 К
T
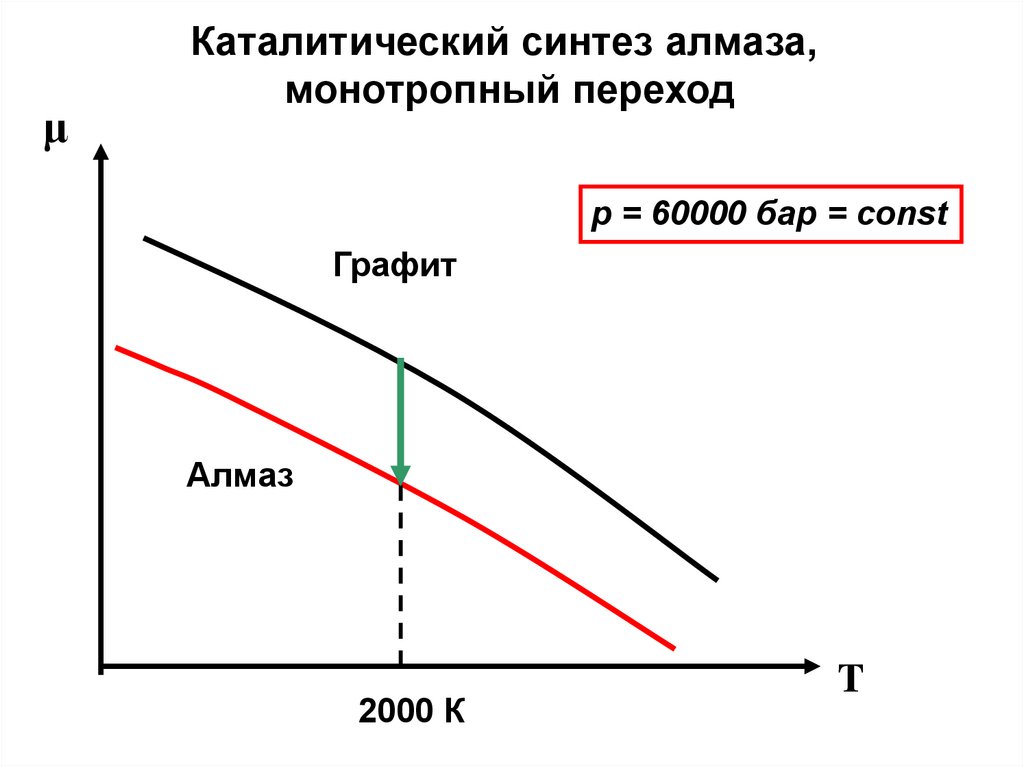
38.
μКаталитический синтез алмаза,
монотропный переход
p = 60000 бар = const
Графит
Алмаз
2000 К
T
39.
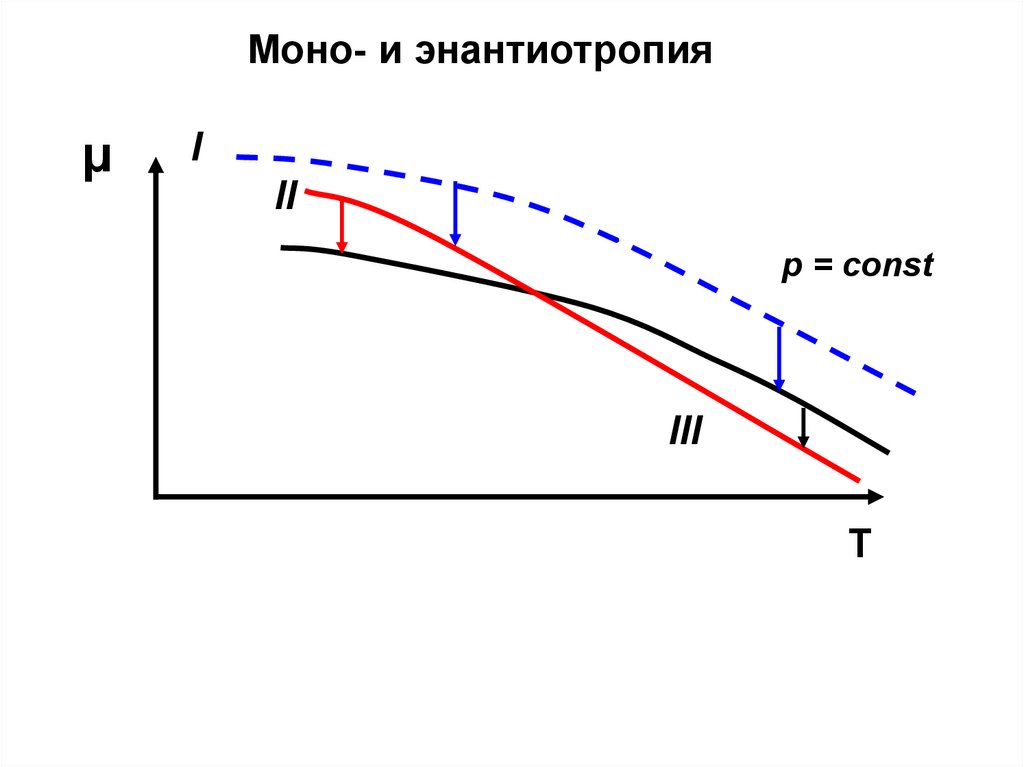
Моно- и энантиотропияμ
I
II
p = const
III
T
40.
НАНОУГЛОРОДНЫЕ МАТЕРИАЛЫ41.
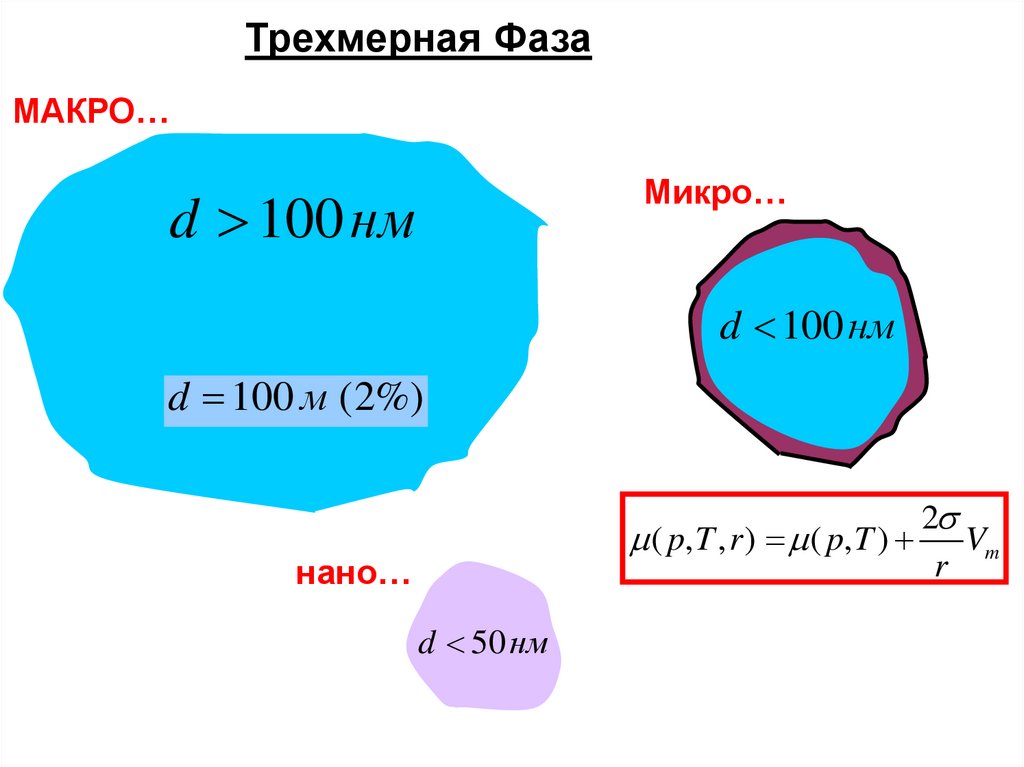
Трехмерная ФазаМАКРО…
Микро…
d 100 нм
d 100 нм
d 100 м (2%)
2
( p, T , r ) ( p, T ) Vm
r
нано…
d 50 нм
42.
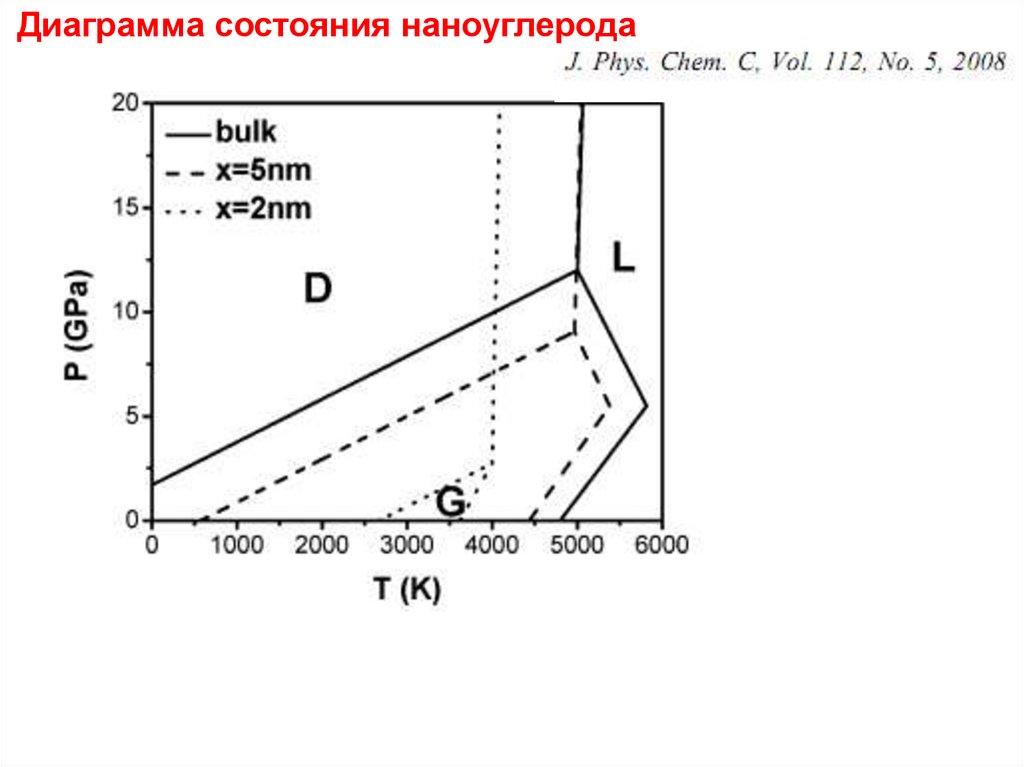
Диаграмма состояния наноуглерода43.
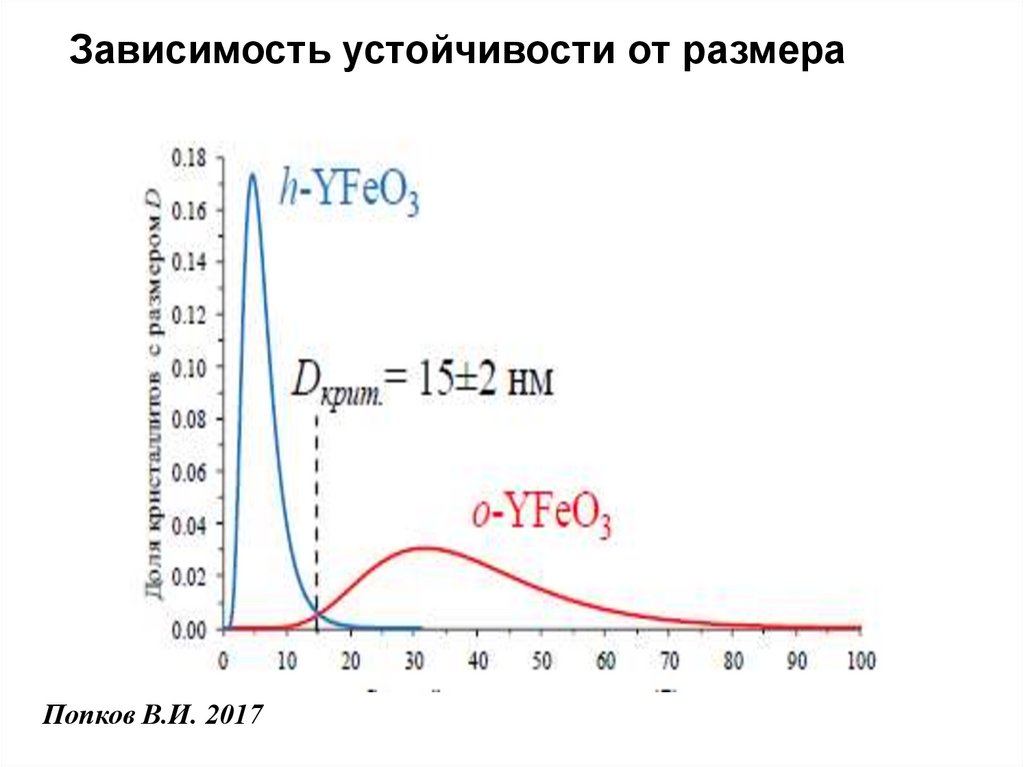
Зависимость устойчивости от размераПопков В.И. 2017



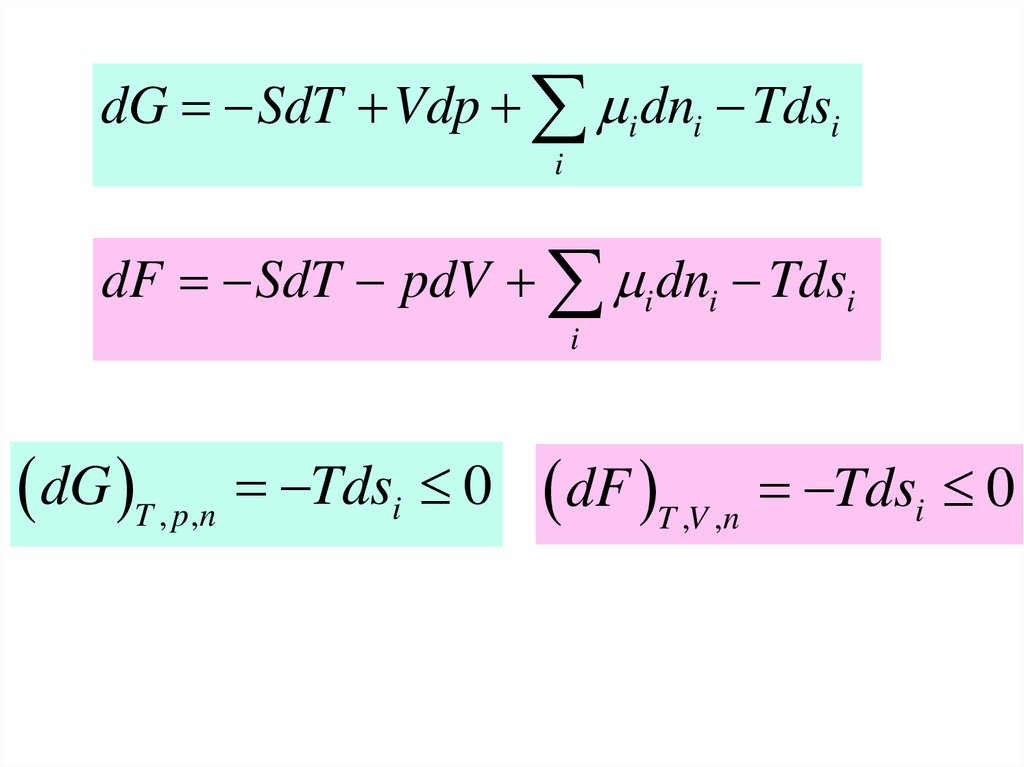
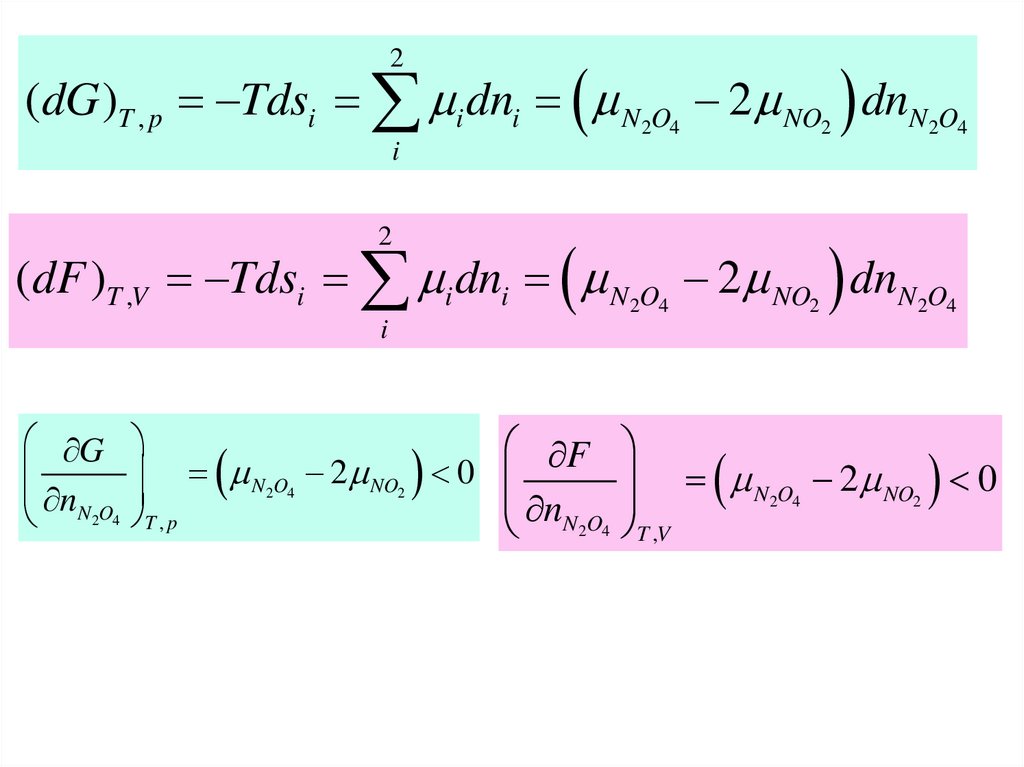
















 Физика
Физика
![II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус) II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус)](https://cf3.ppt-online.org/files3/thumb/s/shTr2KkzXY6Gb1DP9c5MVIEZmtq4nJoUfBC7Ll.jpg)







