Похожие презентации:
Положение металлов в ПС, особенности строения их атомов, физические свойства
1.
Положение металловв Периодической системе,
особенности строения их атомов,
физические свойства
2.
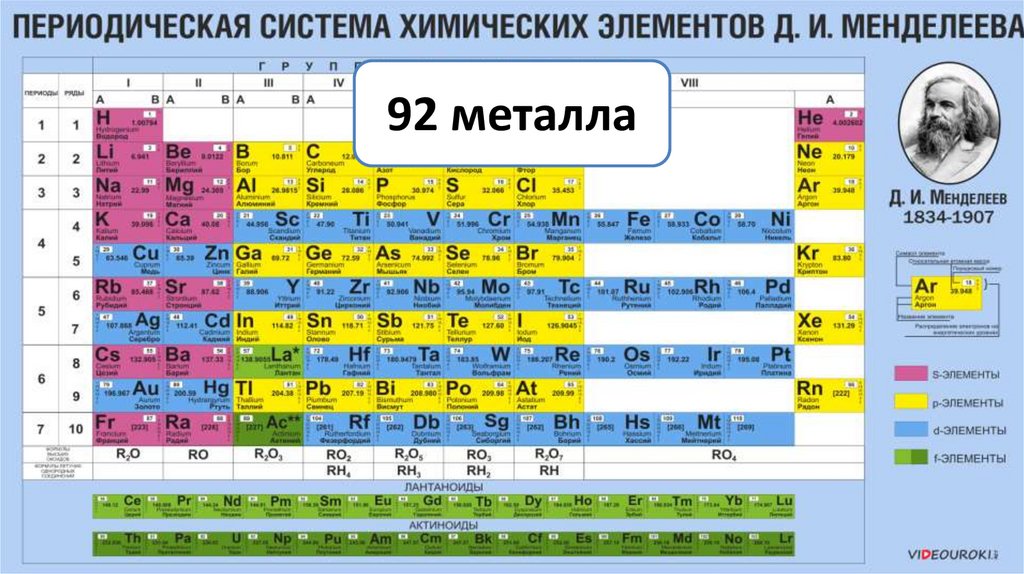
92 металла3.
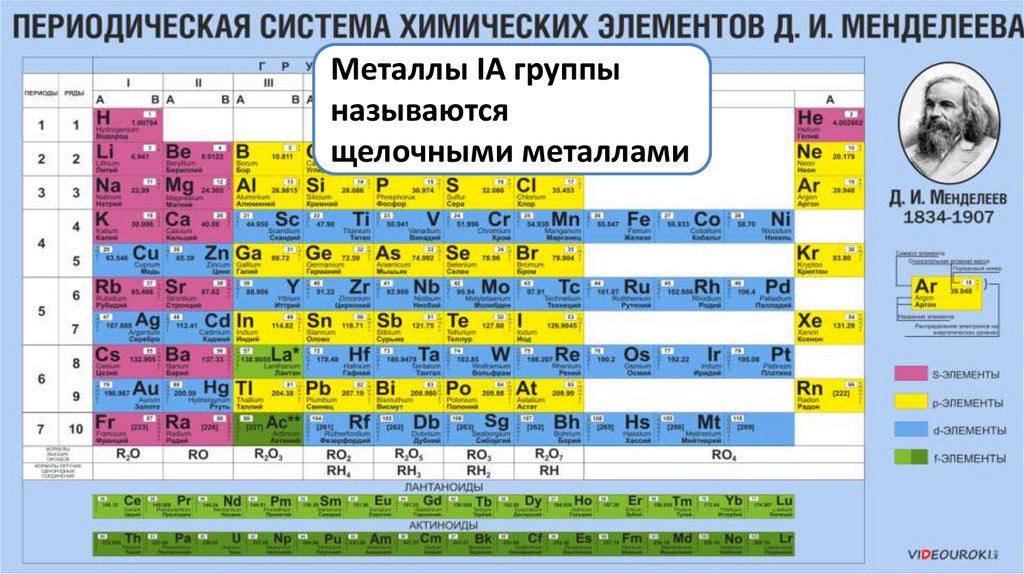
Металлы IA группыназываются
щелочными металлами
4.
ГидроксидыИмеют
один щелочных
электрон
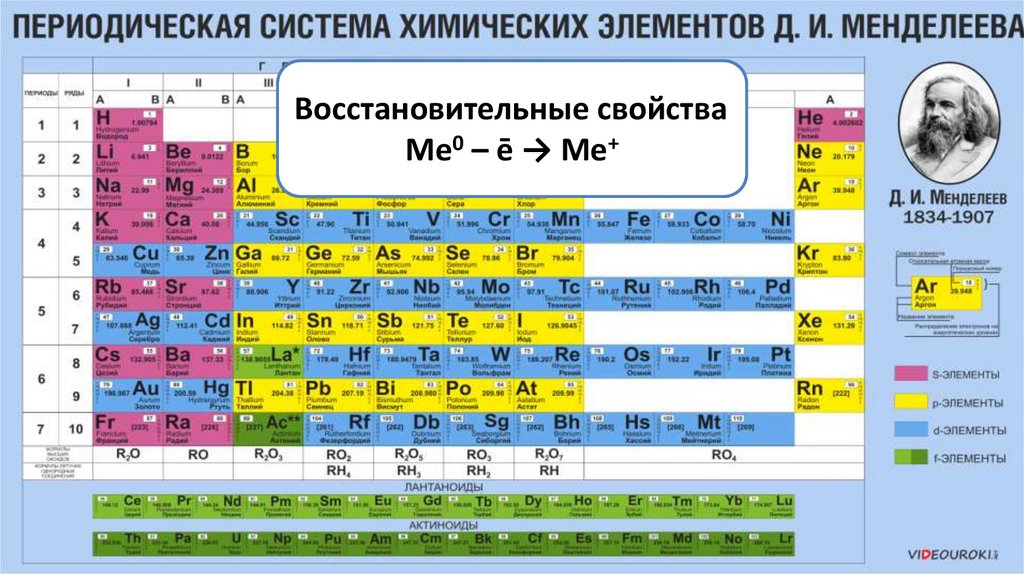
Восстановительные
свойства
металлов
на
внешнем
уровне
Ме0 ––ēщёлочи
→
Ме+
5.
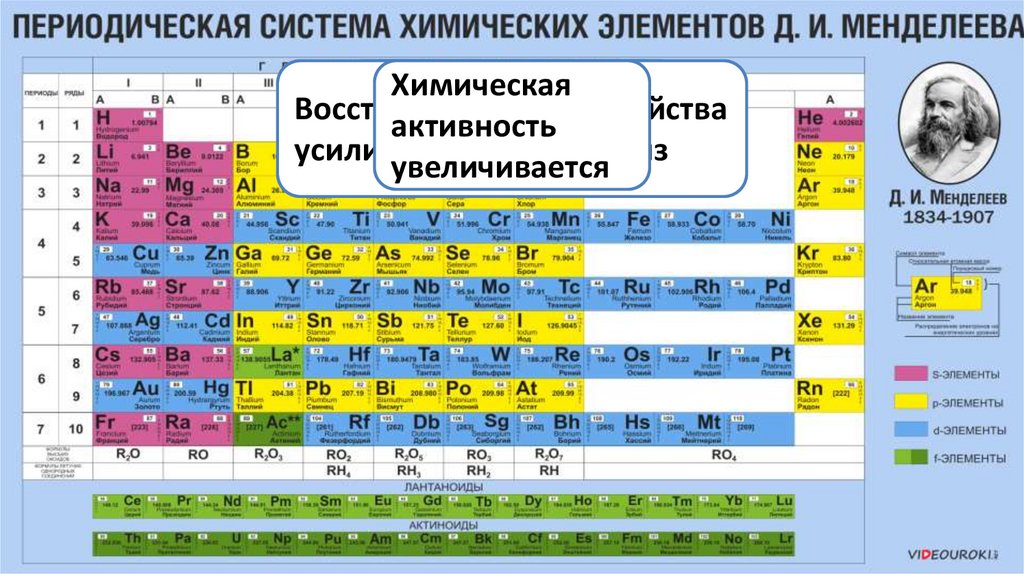
ХимическаяРастёт
способность
Увеличиваются
Восстановительные
свойства
активность
к радиусы
отдаче
внешнего
атомов
усиливаются
сверху
увеличиваетсявниз
электрона
6.
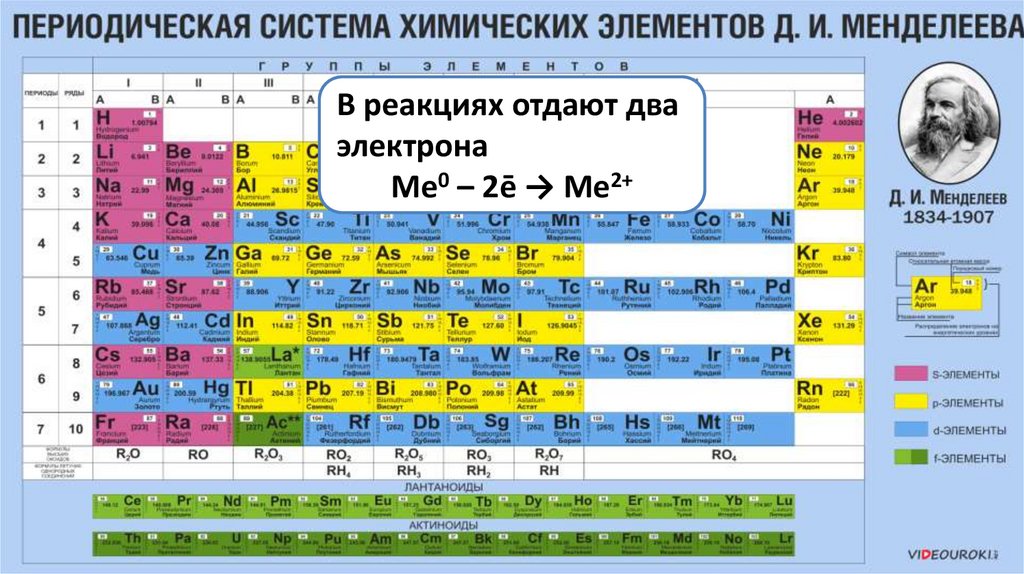
МеталлыIIA
группы
ВЯвляются
реакцияхсильными
отдают
два
являются типичными
электрона
восстановителями
металлами
Ме0 – 2ē → Ме2+
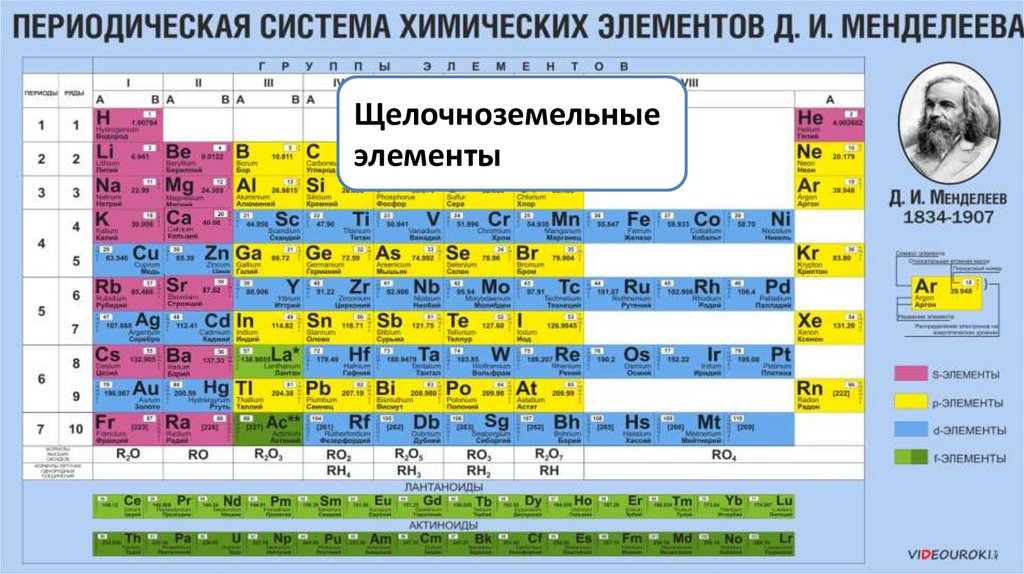
7.
Щелочноземельныеэлементы
8.
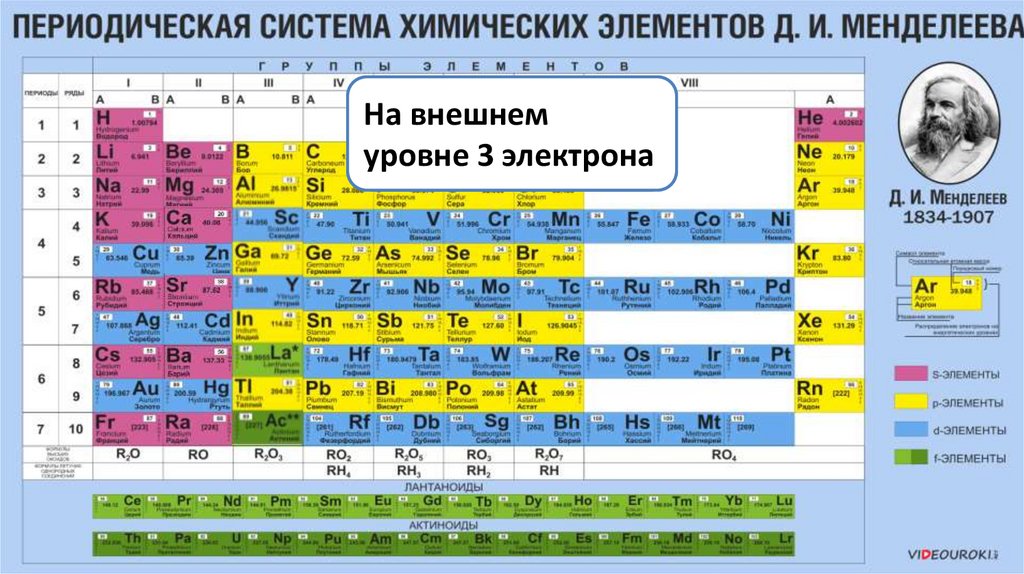
На внешнемМе0 – 3ē → Ме3+
уровне 3 электрона
9.
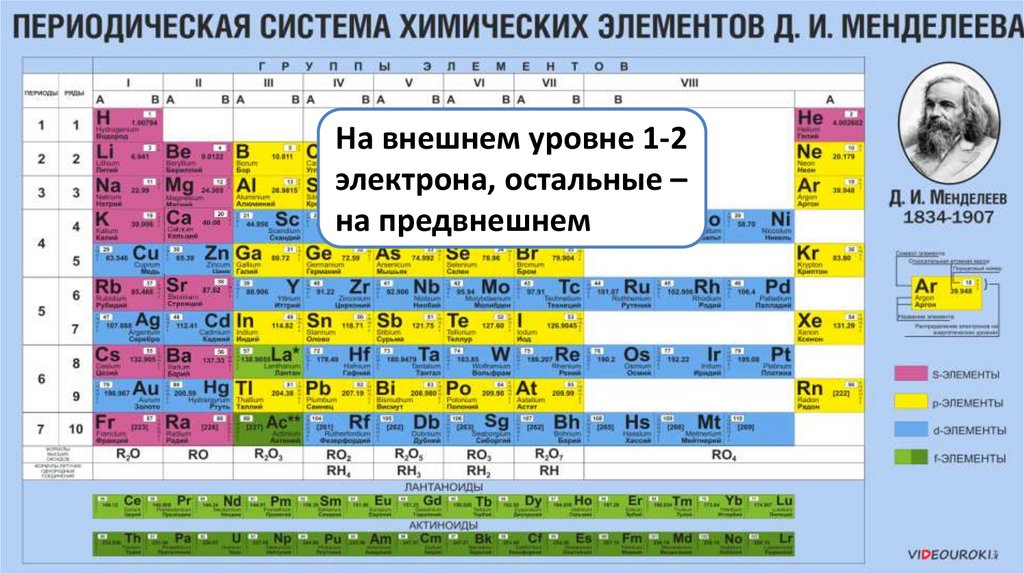
НаЭлементы
внешнем
побочных
уровне 1-2
электрона,
подгрупп все
остальные
являются–
на
металлами
предвнешнем
10.
ЗАПОМНИТЕ!У металлов сравнительно большие радиусы
атомов
Их внешние электроны значительно удалены
от ядра и слабо с ним связаны
Содержат на внешнем уровне от 1 до
3 электронов
11.
ЗАПОМНИТЕОни легко отдают электроны, превращаясь при
этом в положительные ионы
Они являются восстановителями
Металлы не могут присоединять электроны
12.
Деление элементов наметаллы и неметаллы
условно
13.
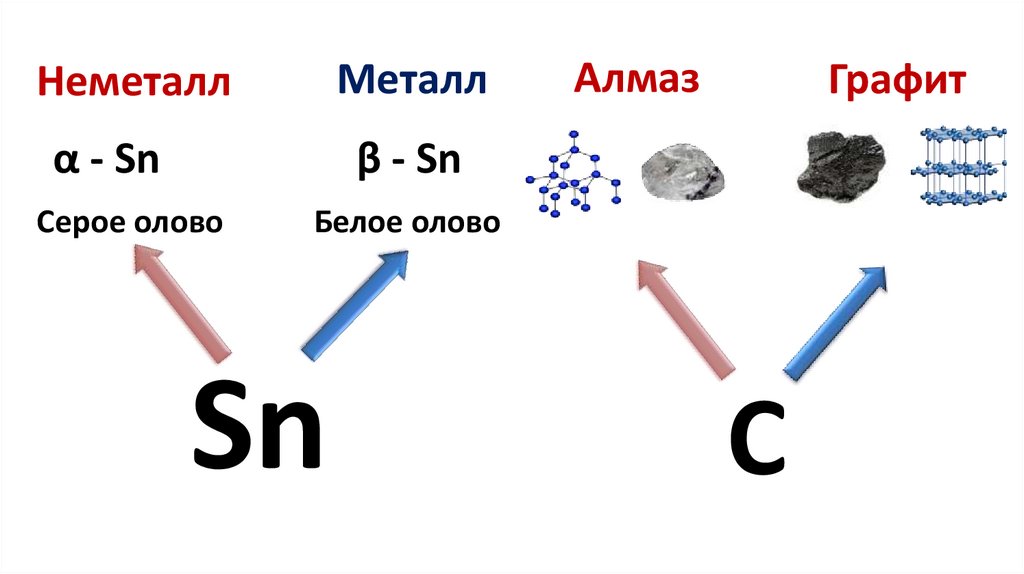
МеталлНеметалл
α - Sn
Алмаз
Графит
β - Sn
Серое олово
Белое олово
Sn
С
14.
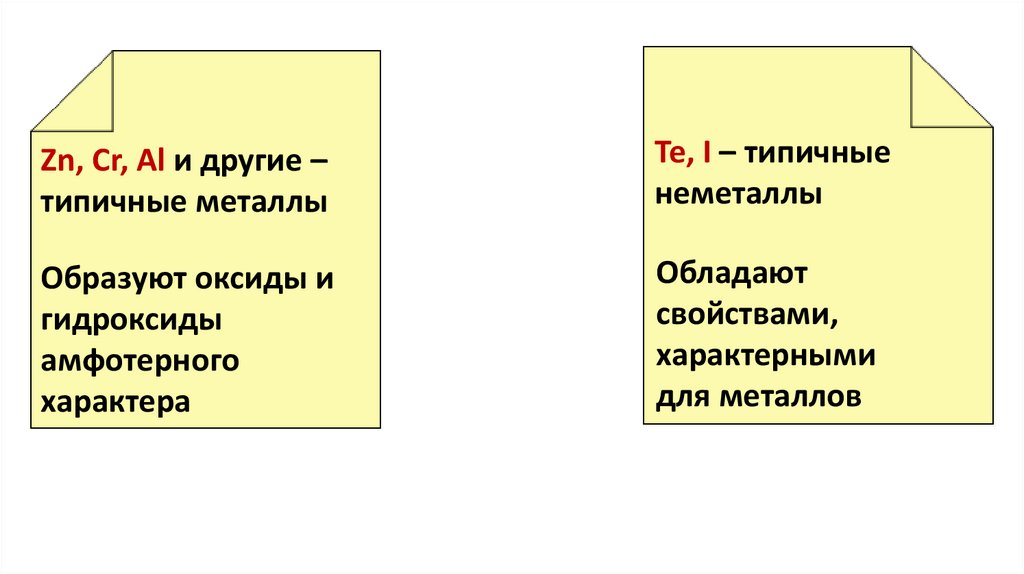
Zn, Cr, Al и другие –типичные металлы
Te, I – типичные
неметаллы
Образуют оксиды и
гидроксиды
амфотерного
характера
Обладают
свойствами,
характерными
для металлов
15.
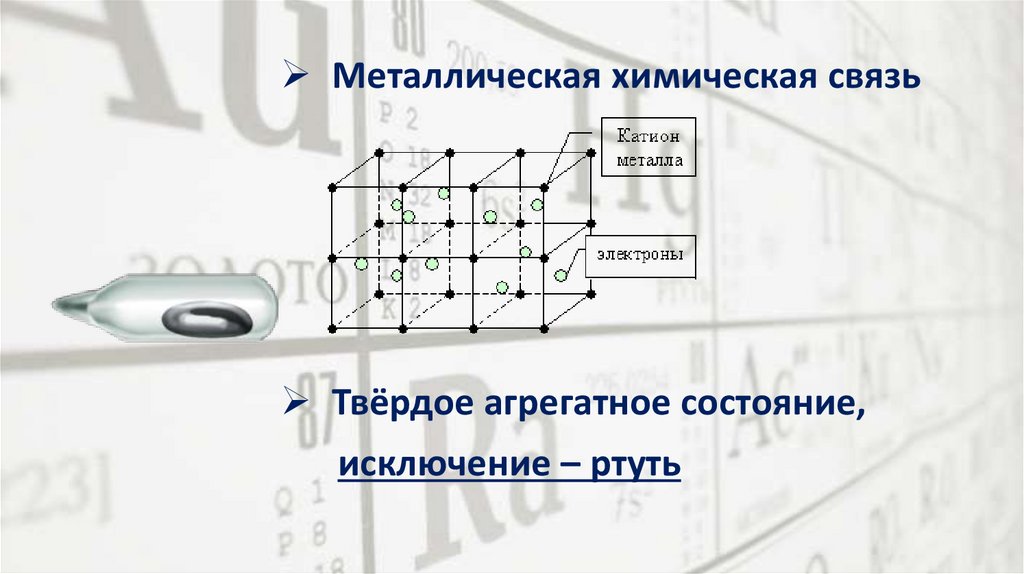
Металлическая химическая связьТвёрдое агрегатное состояние,
исключение – ртуть
16.
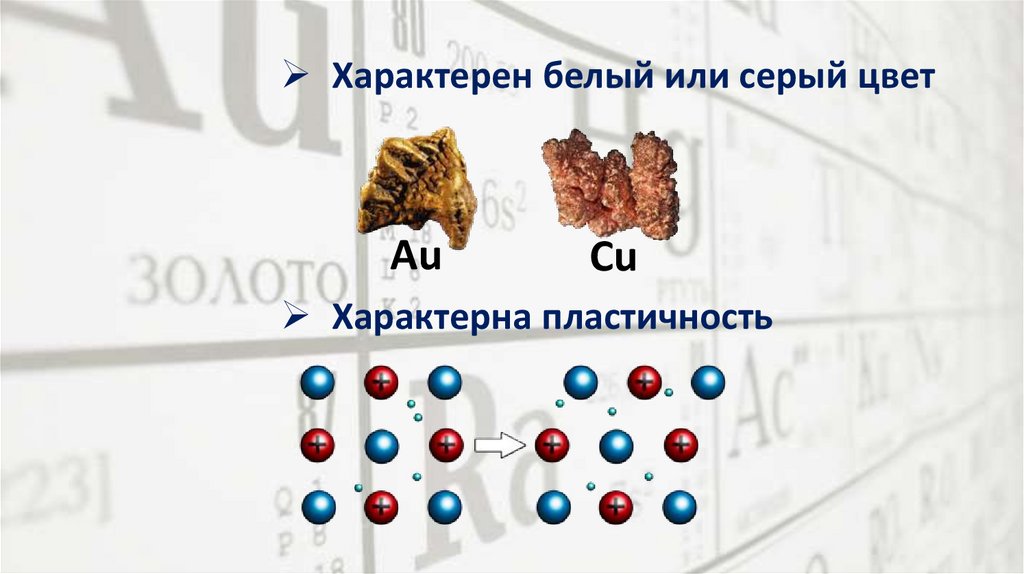
Характерен белый или серый цветAu
Cu
Характерна пластичность
17.
Характерен белый или серый цветAu
Cu
Характерна пластичность
18.
Наиболее пластичные металлы:Au
Ag
Cu
19.
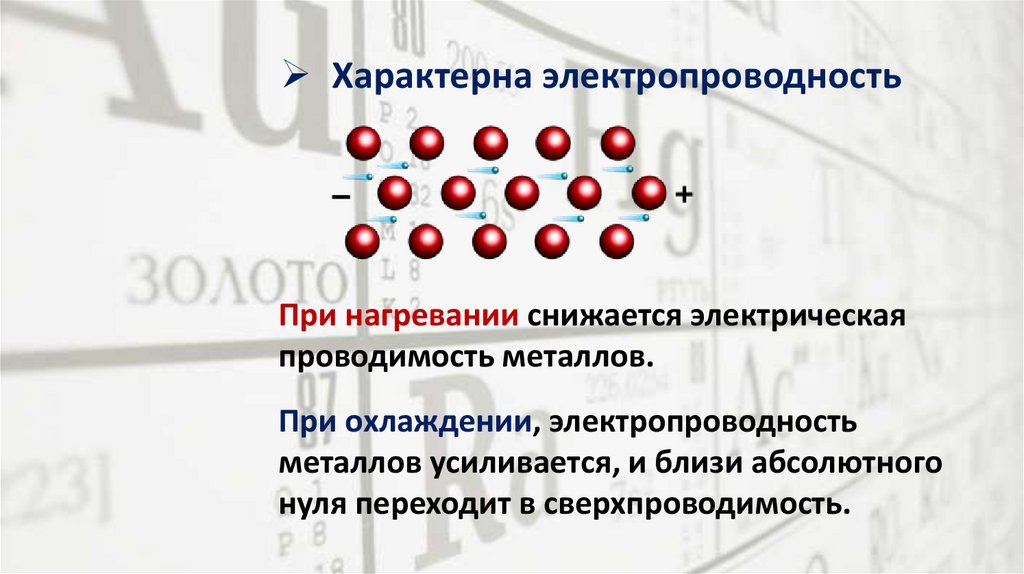
Характерна электропроводностьПри нагревании снижается электрическая
проводимость металлов.
При охлаждении, электропроводность
металлов усиливается, и близи абсолютного
нуля переходит в сверхпроводимость.
20.
Наиболее электропроводны:Ag, Cu
Наименее электропроводны:
Mn, Pb, Hg, W
21.
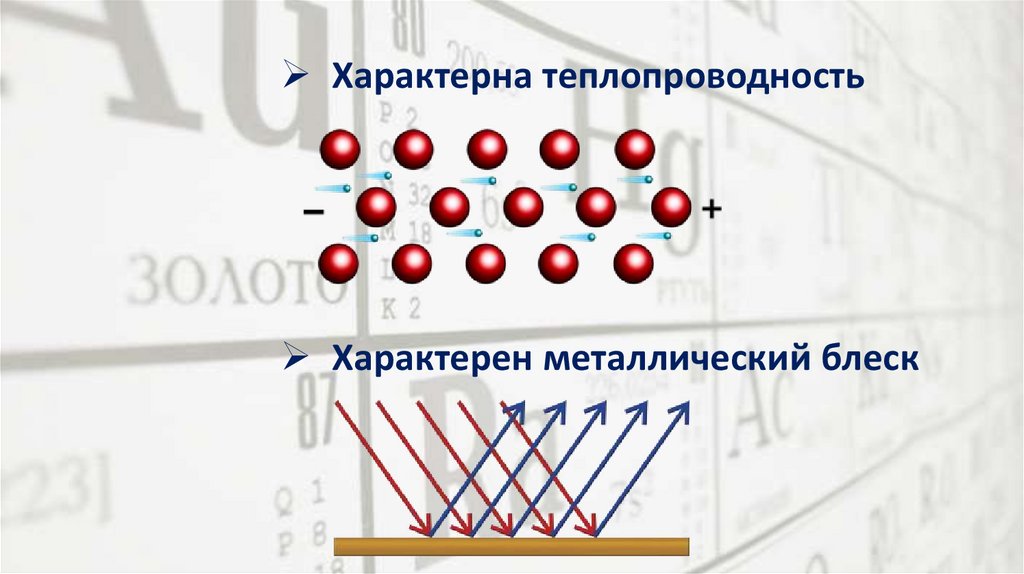
Характерна теплопроводностьХарактерен металлический блеск
22.
Самые твёрдые металлы – это металлыпобочной подгруппы VIA группы
Хром
Титан
Молибден
23.
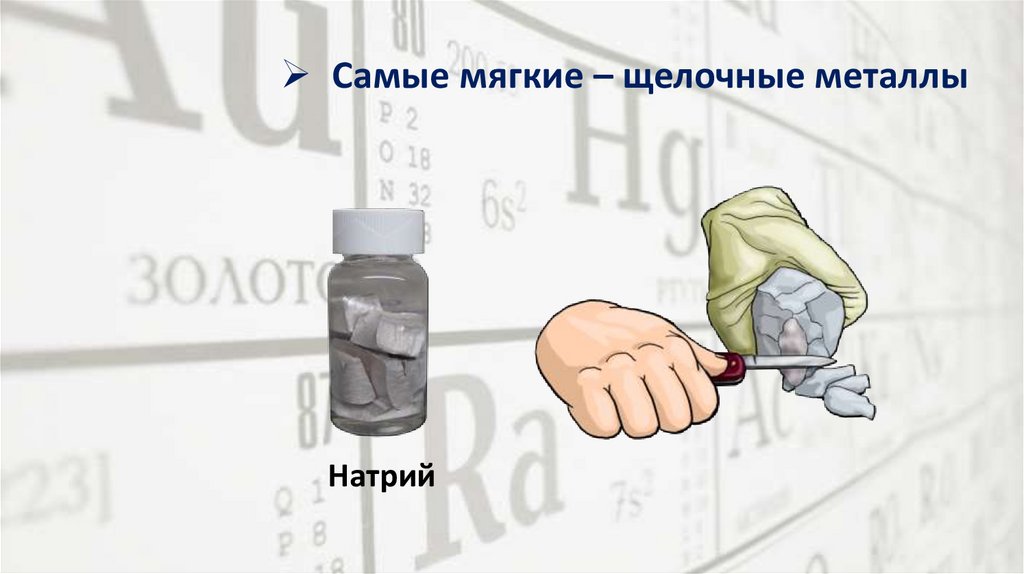
Самые мягкие – щелочные металлыНатрий
24.
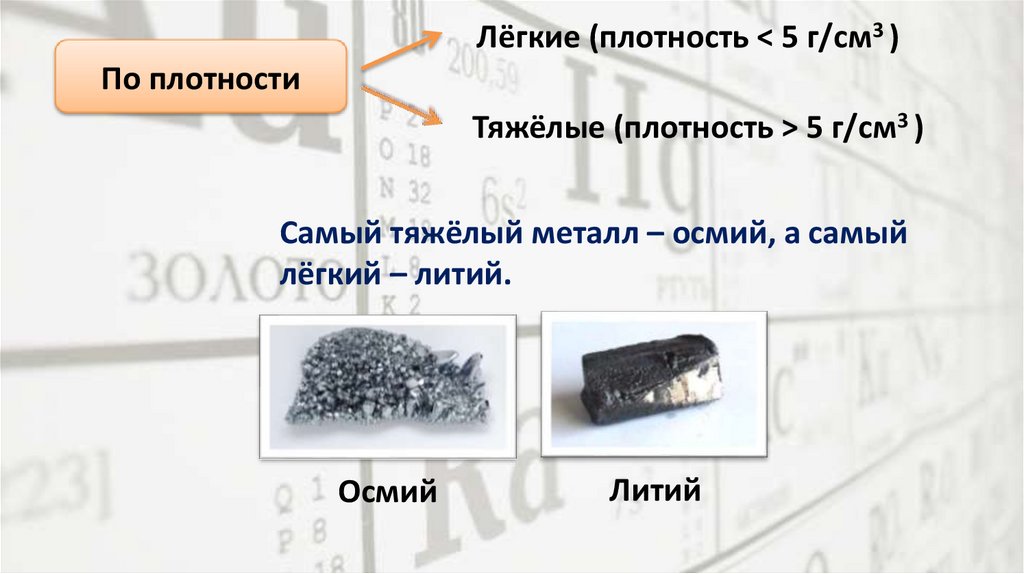
Лёгкие (плотность < 5 г/см3 )По плотности
Тяжёлые (плотность > 5 г/см3 )
Лёгкие металлы: щелочные и
щелочноземельные металлы, алюминий.
Из переходных металлов к ним относятся
скандий, иттрий и титан.
25.
Лёгкие (плотность < 5 г/см3 )По плотности
Тяжёлые (плотность > 5 г/см3 )
Самый тяжёлый металл – осмий, а самый
лёгкий – литий.
Осмий
Литий
26.
Легкоплавкие (Т пл. < 1000 0С)По температуре
плавления
Тугоплавкие ( Т пл. > 1000 0С)
Самый легкоплавкий металл – ртуть, а
самый тугоплавкий – вольфрам.
Ртуть
Вольфрам
27.
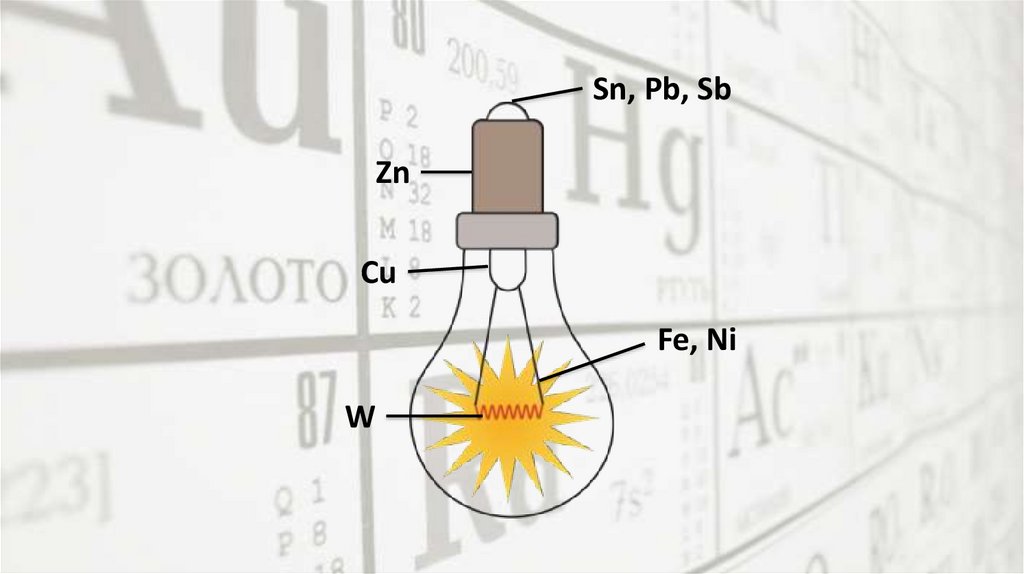
Sn, Pb, SbZn
Cu
Fe, Ni
W
28.
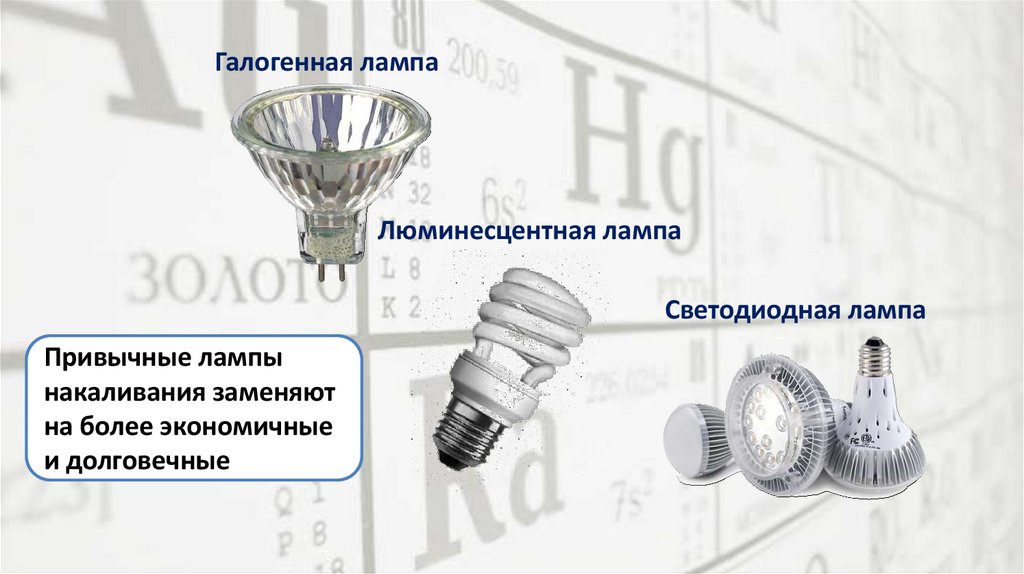
Галогенная лампаЛюминесцентная лампа
Светодиодная лампа
Привычные лампы
накаливания заменяют
на более экономичные
и долговечные
29.
Чёрные металлы – этожелезо и его сплавы
30.
Цветные – это всеостальные металлы
31.
Золото, серебро, платинаи некоторые другие металлы
относятся к драгоценным
32.
Дляметаллов
характерна
Физические
свойства
металлов:
Большинство
элементов
в
У
металлов
на
внешнем
Металлы
проявляют
металлическая
кристаллическая
твёрдость,
металлический
блеск,
Периодической
системе
энергетическом
уровне
от
восстановительные
свойства
решётка
ковкость
пластичность,
относятся
кметаллическая
металлам тепло и –
1 до 3ии
электронов
химическая связь
электропроводность














 Химия
Химия








