Похожие презентации:
Теплота згоряння. Температура горіння
1. ТЕМА 2 МАТЕРІАЛЬНИЙ І ТЕПЛОВИЙ БАЛАНС ПРОЦЕСУ ГОРІННЯ
Лекція 5ТЕПЛОТА ЗГОРЯННЯ.
ТЕМПЕРАТУРА ГОРІННЯ.
2. План лекції
1. Тепловий ефект хімічної реакції.2. Теплота згоряння. Види теплоти
згоряння. Розрахункове визначення
теплоти згоряння
3. Поняття та види температури горіння
речовин.
4. Визначення температури горіння речовин
та матеріалів.
3. 1. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ
Тепловий ефект реакції - кількістьтеплоти, що виділяється чи поглинається
системою при протіканні в ній необоротної
хімічної реакції за умови сталості
температури й об’єму (Т, V = const) чи
температури і тиску (Т, P = const).
Хімічна енергія перетворюється в теплову.
Початковий і кінцевий рівні енергії системи
різняться між собою на величину теплоти
реакції Q.
Eкін – Eпоч = Q
4.
Якщо Eкін <Eпоч, то Q > 0, реакція супроводжу-єтьсявиділенням тепла і зветься екзотермічною.
Якщо Eкін >Eпоч, то Q < 0, реакція супроводжу-ється
поглинанням тепла і зветься ендотермічною
Для визначення теплоти реакції застосовують
перший закон термодинаміки:
- dQ = dU + PdV = dH – VdP
Якщо горіння відбувається при P =const (dP=0),
теплота реакції дорівнює різниці повних ентальпій
системи в початковому і кінцевому стані:
Qр = - dH = - H
Якщо горіння відбувається при V =const (dV=0),
теплота реакції дорівнює різниці між внутрішньою
енергією системи в початковому і кінцевому стані:
Qv = - dU = - U
5.
Стандартна теплота реакції - різниця міжстандартними теплотами утворення продуктів
реакції і вихідних речовин.
Qр = - Нхр = - ( nкін Ноf кін - nпоч Ноf поч ),
Стандартна теплота утворення речовини
Ноf - теплота реакції, в якій утворюється один
моль речовини зі складових його елементів за
стандартних умов (Р=101,3 кПа, Т = 298К).
6. 2. ТЕПЛОТА ЗГОРЯННЯ
Теплота згоряння - кількість тепла, щовиділяється під час повного згоряння одиниці
кількості ГР за умови, що вихідна суміш та кінцеві
ПГ знаходяться за стандартних умов.
ΔÍ
о
о
n
ΔH
n
ΔH
гс f гс
гор пг і
f пг
і
і
Оскільки ГР 1 моль, а теплота утворення О2 та N2
дорівнює 0, тепловий ефект реакції горіння
становить:
ΔÍ
гор
і
о
n пг і ΔH f пг
і
о
ΔH f гр
7.
2.1. Види теплоти згорянняЗалежно від того, як визначають одиницю
кількості ГР, розрізняють теплоти згоряння:
молярну Q - кількість тепла, що виділяється при
згорянні 1 молю ГР (кДж/моль),
масову Q/ - кількість тепла, що виділяється при
згорянні 1 кг ГР (кДж/кг),
об’ємну Q// - кількість тепла, що виділяється при
згорянні 1 м3 ГР (кДж/м3).
8.
Залежно від агрегатного стану Н2О, якаутворилася під час горіння і знаходиться в
ПГ, розрізняють вищу та нижчу теплоту
згоряння.
Вища теплота згоряння Qв - кількість
тепла, що виділяється при повному згорянні
одиниці кількості ГР за умови, що вода в ПГ
знаходиться у рідкому стані.
Нижча теплота згоряння Qн - кількість
тепла, що виділяється при повному згорянні
одиниці кількості ГР за умови, що вода в ПГ
знаходяться в газоподібному стані.
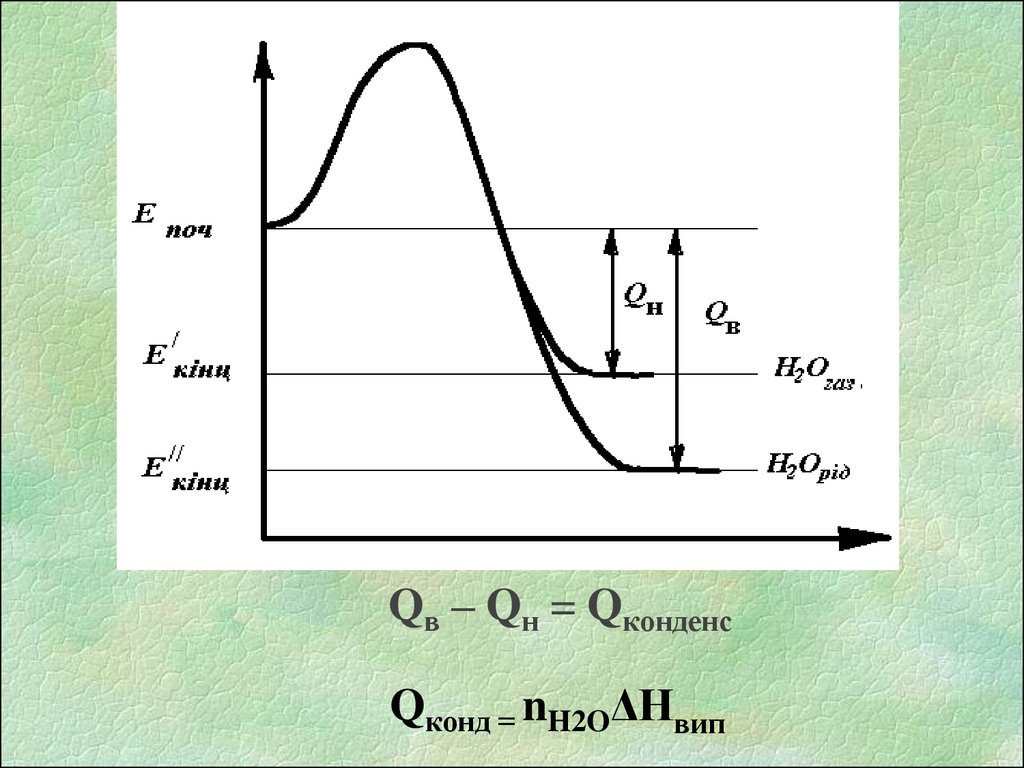
9.
Qв – Qн = QконденсQконд = nH2OΔHвип
10.
При урахуванні хімічного недопалу,вологості матеріалу, втрати на теплове
випромінювання, визначають практичну
або робочу теплоту згоряння матеріалу
Qнр.
11. 2.2. Розрахунок теплоти згоряння
Горюча речовина індивідуального складуМолярна теплота згоряння
Qгор
масова
об'ємна
n
i 1
о
nпг і ΔHf пг
і
о
ΔHf гр
Qгор 1000
/
Qгор
//
Qгор
μ
Qгор 1000
Vμ
, кДж/моль
, кДж/кг
, кДж/м3
12.
Горючі матеріали складного хімічного складусуміш газів
"
Qн в сум
n
"
Qн в iri
i 1
n
"
Qн в i
i 1
i
100
тверді або рідкі складні матеріали
Qскл = Qi gi
Ств + (О2 + 3,76 N2) = CO2 + 3,76 N2
Qв
o
ni Hf пгi
o
Hf гр
393,78 0
кДж
393,78 моль
Qв(Н)=285,83кДж/моль; Qв(S)= 297,09 кДж/моль
13.
Внесок кожного елементу в масову теплотузгоряння:
Qв 1000 φi 10 Qв φi
'
/
qв Qвgi
μi
100
μi
10 393,08 φ C
'
327,6 φ C кДж/ кг;
С: q в
12
10 285,83 φ H
'
1429,1 φ H кДж/ кг;
Н: q в
2
10 297,09 φ S
'
92,8 φ S кДж/ кг.
S: q в
32
Qв’ = 327,6 С + 1429,2 Н + 92,8 S ; кДж/ кг
14. ФОРМУЛА МЕНДЄЛЄЄВА
Враховує наявність в ГР оксигену, нітрогену та вологи.Вища теплота згоряння:
Q′в= 339,4 С +1256,8 Н +108,9( S – O – N),
кДж/кг
Нижча теплота згоряння:
Qн / = Qв/ -Qконд
Q конд g H 2O ΔHвип
18 W
H
2
2510 25,1(9 H W )
100
Qн/= 339,4 С + 1256,8 Н + 108,9 ( S - O - N) –
– 25,1(9 Н + W), кДж/ кг
де W – мас. відсоток вологи в ГР
15. ПРАКТИЧНЕ ЗНАЧЕННЯ ТЕПЛОТИ ЗГОРЯННЯ
1) Використовують для розрахунку пожежноїнавантаги, що є характеристикою теплового
впливу пожежі на будівельні конструкції.
Пожежна навантага Р - кількість тепла, що
може виділитися при згорянні речовин з
одиниці поверхні підлоги приміщення.
n
/
m
Q
i н
Р i 1
і
Sпідл
Розрізняють постійну і тимчасову пожежну
навантагу.
16.
2) Використовуютьдля
визначення
горючості речовини.
Речовини є негорючими, якщо вони не
відносяться до вибухонебезпечних та їх Qн/
менша за 2100 кДж/кг або 1830 кДж/м3.
3)
Використовують
при
розрахунку
параметрів пожежної небезпеки речовин,
таких як температура горіння, температура
вибуху, максимальний тиск вибуху, нижча
концентраційна межа поширення полум’я.
17. 3. ПОНЯТТЯ ТА ВИДИ ТЕМПЕРАТУРИ ГОРІННЯ РЕЧОВИН
Температура горіння - температура, до якоїнагріваються продукти горіння в зоні реакції.
Розрахувати температуру горіння можна знаючи
величину теплоти згоряння. Рівняння теплового
балансу під час горіння має вигляд:
Qгор– Qнед = Qнагр. пг + Qтвт,
Залежно від умов, в яких протікає процес горіння,
розрізняють температури горіння
калориметричну,
теоретичну,
адіабатичну,
дійсну.
18.
Калориметрична температура горіння температура, до якої нагріваються ПГ, якщовиконуються наступні умови:
1) вихідна система знаходиться за
стандартних умов (То=298 К, Ро=101,3 кПа);
2) відбувається повне згоряння ГР, при цьому
повітря
для
горіння
надходить
у
стехіометричному співвідношенні;
3) в процесі утворення ПГ не відбувається їх
дисоціація;
4) немає тепловтрат від системи в
навколишнє середовище.
19.
Через відсутність тепловтрат і недопалувважаємо, що все тепло, що виділилося під час
реакції, іде на нагрівання ПГ.
ПГ в зоні реакції мають високу температуру,
отже вода в ПГ залишається в газоподібному стані,
тому в розрахунках використовують нижчу
теплоту згоряння.
Qнед = Qтвт = 0,
Qнагрів пг = Qн
QнагрПГ nпг i cp
i
Тгор кал Тст
пг i
(Тгор Тст )
Qн
n пг i cp
i
пг i
20.
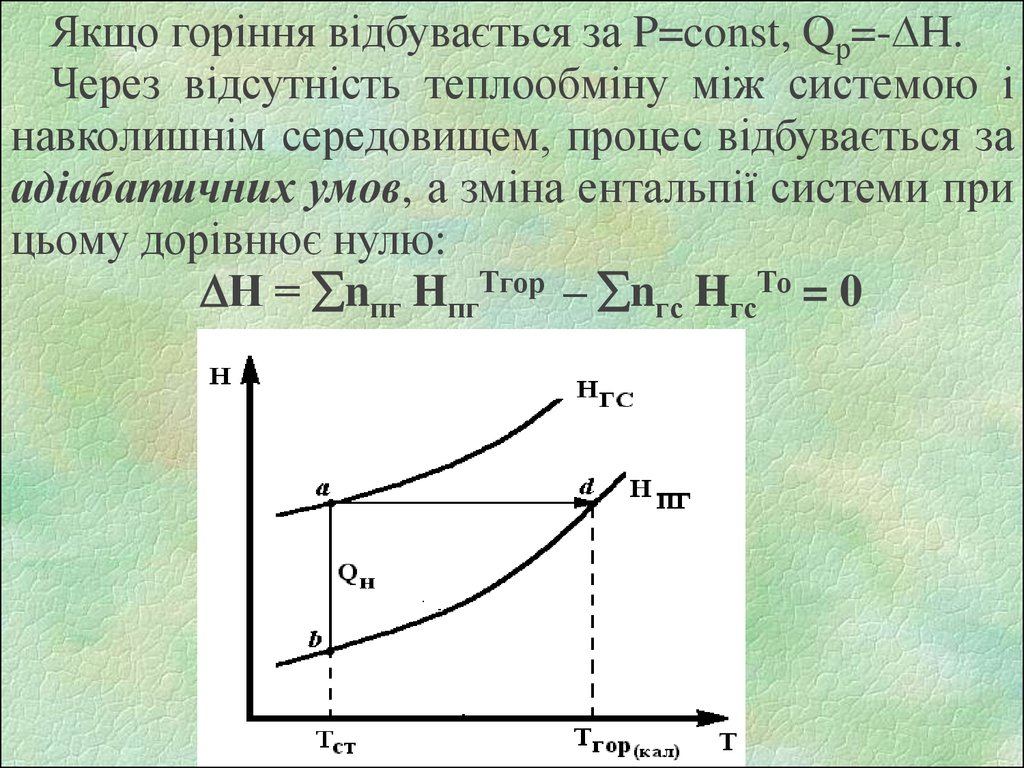
Якщо горіння відбувається за P=const, Qр=- H.Через відсутність теплообміну між системою і
навколишнім середовищем, процес відбувається за
адіабатичних умов, а зміна ентальпії системи при
цьому дорівнює нулю:
Н = nпг HпгТгор – nгс HгсТо = 0
21.
Якщо Тгор достатньо висока, то ПГ можутьдисоціювати з витратою значної кількості тепла.
2СО2 = 2СО + О2 – 566 кДж
2Н2О = 2Н2 + О2 – 478 кДж
Теоретична температура горіння - ступінь
нагрітості продуктів горіння з урахуванням їх
дисоціації, якщо виконуються наступні умови:
1) вихідна ГС знаходиться за стандартних умов;
2) відбувається повне згоряння горючої суміші
стехіометричного складу;
3) відбувається суттєва дисоціація ПГ;
4) немає тепловтрат від системи в навколишнє
середовище.
22.
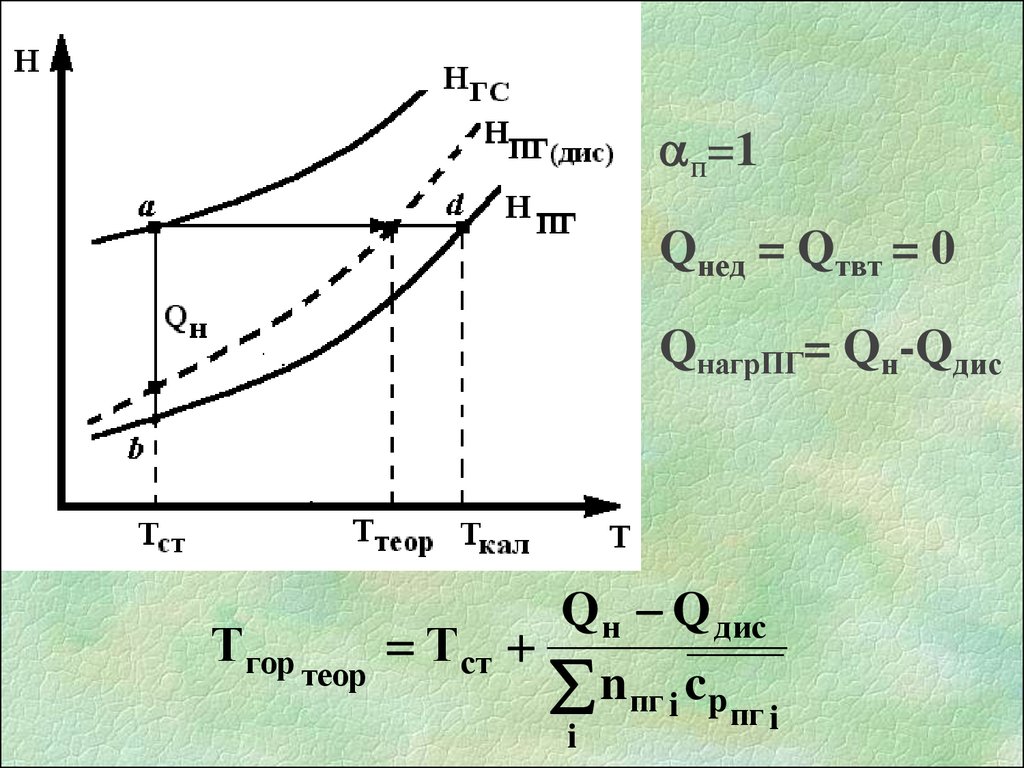
п=1Qнед = Qтвт = 0
QнагрПГ= Qн-Qдис
Тгор теор Тст
Q н Q дис
n пг i cp пг i
i
23.
Адіабатична температура горіння температура, до якої нагріваютьсяпродукти горіння за умов:
1)
вихідна
ГС
знаходиться
за
стандартних умов;
2) горіння відбувається з надлишком чи
нестачею повітря;
3) дисоціація ПГ не відбувається;
4) немає тепловтрат від системи в
навколишнє середовище.
24.
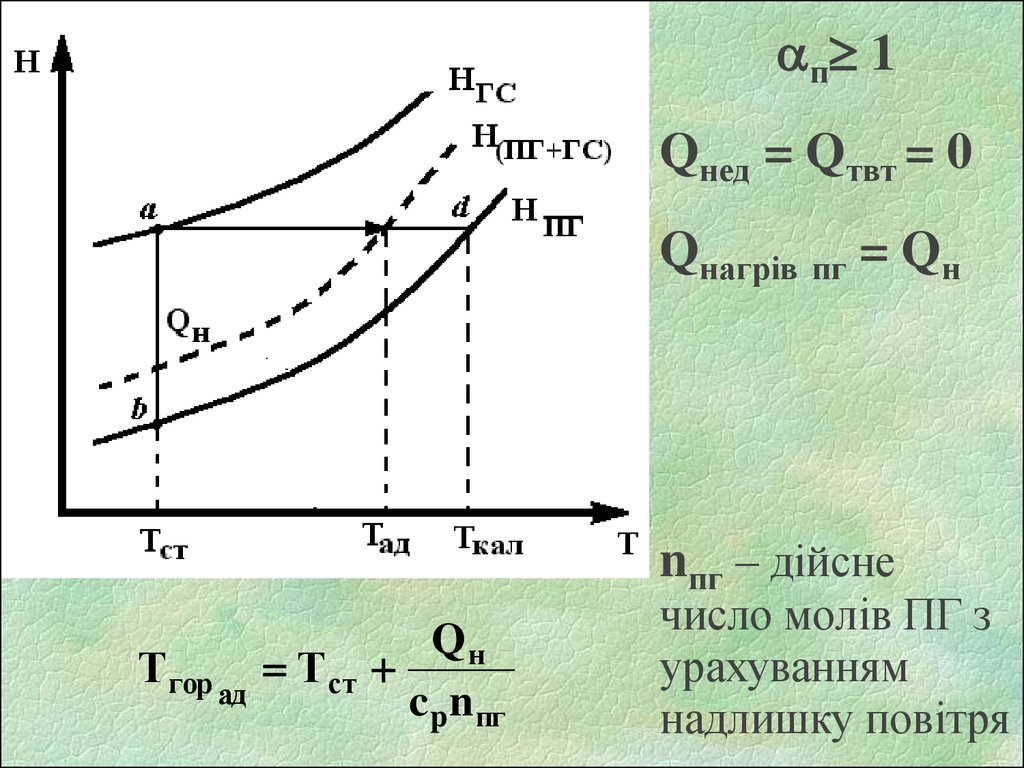
п 1Qнед = Qтвт = 0
Qнагрів пг = Qн
nпг – дійсне
Тгор ад Тст
Qн
c p n пг
число молів ПГ з
урахуванням
надлишку повітря
25.
Дійсна температура горіння – температура,до якої нагріваються продукти горіння за
реальних умов, при цьому враховується:
1) горіння може проходити з надлишком
або нестачею повітря,
2) значні тепловтрати у навколишнє
середовище,
3) початкові умови, в яких знаходиться
вихідна
горюча
суміш,
можуть
відрізнятися від стандартних..
26.
Тгор дійснQ н Q твт Q недоп
с p n пг
То
де Qнедоп - кількість тепла, яка не
реалізується в зоні горіння внаслідок
хімічного або фізичного недопалу.
Qнед = (1- ) Qн,
- коефіцієнт повноти згоряння = 0,9 0,75
Qтвт - кількість тепла, що втрачається в
навколишнє середовище.
27.
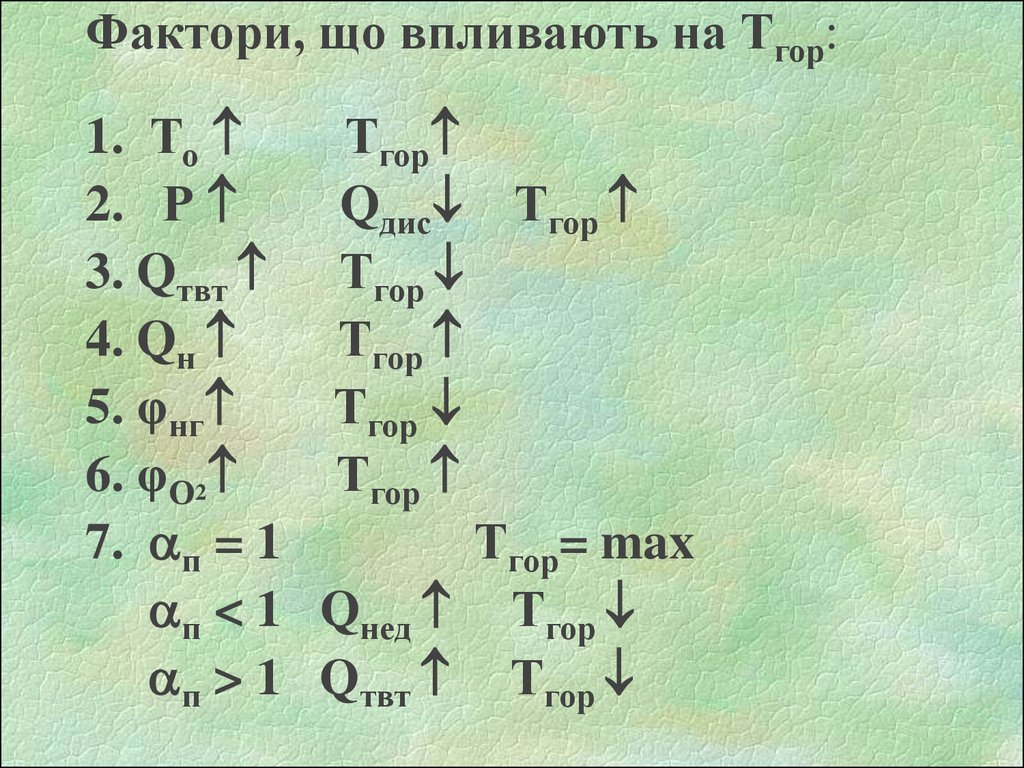
Фактори, що впливають на Тгор:1. То
Тгор
2. Р
Qдис Тгор
3. Qтвт Тгор
4. Qн
Тгор
5. φнг
Тгор
6. φО2
Тгор
7. п = 1
Тгор= max
п < 1 Qнед Тгор
п > 1 Qтвт Тгор
28. Завдання на самопідготовку
1. Вивчити матеріалДемидов, Шандыба, Щеглов, Горение
и свойства горючих веществ, стор. 29 –
33.
Демидов, Саушев. Горение и свойства
горючих веществ, стор. 24-42.























 Химия
Химия








