Похожие презентации:
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
1. ТЕМА 2 МАТЕРІАЛЬНИЙ І ТЕПЛОВИЙ БАЛАНС ПРОЦЕСУ ГОРІННЯ
ЛекціяОСНОВНІ ПОНЯТТЯ
МАТЕРІАЛЬНОГО БАЛАНСУ.
РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА
ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ
РЕЧОВИН ТА МАТЕРІАЛІВ
2. План лекції.
1. Основні поняття матеріального балансу процесугоріння
2. Розрахунок об’єму повітря та продуктів згоряння
при горінні індивідуальних речовин.
2.1. Горіння горючого газу індивідуального складу
2.2. Горіння індивідуальних речовин у рідкому або
твердому агрегатному стані
3. Розрахунок об’єму повітря та продуктів згоряння
при горінні матеріалів складного складу
3.1. Горіння суміші газів.
3.2. Горіння твердих і рідких матеріалів складного
складу.
3. 1. Основні поняття матеріального балансу процесу горіння
Матеріальний баланс реакції горіння – рівністьміж кількістю речовин, що вступають у реакцію, та
кількістю речовин, що утворюються внаслідок цієї
реакції.
Узагальнений запис матеріального балансу
реакції горіння в повітрі:
ГР + О2 + 3,76 N2 = niПГi
Стехіометричний коефіцієнт показує скільки
молів кисню необхідно для повного згоряння
одного молю горючої речовини.
4.
Розрізняють питомі та повні, теоретичні та дійснікількості повітря, що витрачається на згоряння горючої
речовини, та продуктів згоряння.
питома кількість повітря - кількість повітря, яка
необхідна для згоряння одиниці кількості горючої
речовини (1 моль, 1 м3, 1 кг);
nпов [моль/моль] або vпов [м3/м3], [м3/кг]
питома кількість продуктів згоряння - кількість
продуктів горіння, що утворюється при згоряння одиниці
кількості горючої речовини (1 моль, 1 м3, 1 кг);
nпг [моль/моль] або vпг [м3/м3], [м3/кг]
повна кількість повітря - кількість повітря, яка
необхідна для згоряння певної кількості горючої
речовини;
Nпов = nпов ·nгр [моль] або Vпов = vпов ·vгр [м3]
Vпов = vпов ·mгр [м3]
5.
теоретичнакількість
повітря
мінімальна кількість повітря, яка необхідна
для повного згоряння горючої речовини
(noпов, voпов , Noпов, Voпов);
дійсна кількість повітря - кількість
повітря, яка витрачається на згоряння
горючої речовини за даних умов (nпов, vпов ,
Nпов, Vпов).
Різниця між кількістю повітря, що дійсно
іде на горіння, і теоретично необхідною
кількістю повітря, називається надлишком
повітря.
о
vпов vпов vпов
6.
Коефіцієнт надлишку повітря ( п)показує у скільки разів кількість повітря,
що дійсно надходить до зони горіння,
відрізняється від теоретично необхідної
кількості повітря для повного згоряння
горючої речовини.
v пов
о
v пов
о
vпов vпов
о
vпов vпов vпов
о
vпов
1
7. кінетичне горіння
= 1 (vпов = vопов) - суміш ГР з повітрям єстехіометричною.
1 (vпов < vопов) - суміш багата (надлишок ГР і нестача
Ок), утворюються продукти неповного згоряння.
α min
100 в
v опов в
в - найбільший вміст ГР в суміші з повітрям, за якого ще
може виникнути горіння;
1 (vпов > vопов) - суміш бідна (нестача ГР і надлишок
Ок), продукти горіння містять в собі надлишок повітря.
α max
100 н
v опов н
н - найменший вміст ГР в суміші з повітрям, за якого
вже може виникнути горіння.
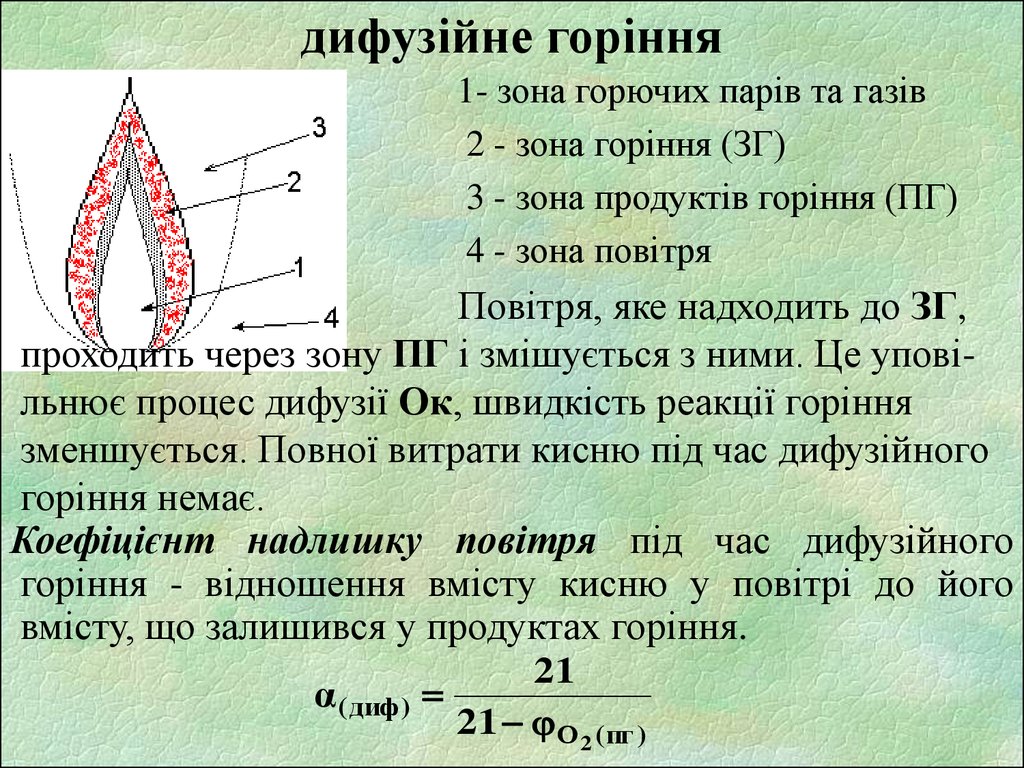
8. дифузійне горіння
1- зона горючих парів та газів2 - зона горіння (ЗГ)
3 - зона продуктів горіння (ПГ)
4 - зона повітря
Повітря, яке надходить до ЗГ,
проходить через зону ПГ і змішується з ними. Це уповільнює процес дифузії Ок, швидкість реакції горіння
зменшується. Повної витрати кисню під час дифузійного
горіння немає.
Коефіцієнт надлишку повітря під час дифузійного
горіння - відношення вмісту кисню у повітрі до його
вмісту, що залишився у продуктах горіння.
α( диф )
21
21 О 2 (пг )
9.
Продукти горіння – це газоподібні, тверді та рідкіречовини, що утворюються при взаємодії окисника з
горючою речовиною у процесі горіння.
Склад продуктів горіння залежить від складу горючої
речовини та умов протікання реакції горіння.
Класифікація продуктів горіння:
за агрегатним станом
газоподібні
СО, СО2, N2, SO2
рідкі
H2O, C2H5OH,
CH2O, смоли
тверді
C (сажа) , Na2O, Р2О5
за повнотою згоряння
повного згоряння
СО2, N2, SO2, H2O, НCl, Na2O
неповного згоряння
СО, H2S, CH2O, смоли, C (сажа)
за реакційною спроможністю
хімічно інертні
СО2, N2,H2O, Na2O
реакційноздатні
продукти неповного згоряння (СО, СH2O, C),
НCl, SO2
10.
Дим - дисперсна система, що складається зтвердих і рідких часток (дисперсної фази),
завислих у газовому дисперсійному середовищі.
Небезпека диму обумовлена:
непрозорість (обумовлена присутністю твердих
продуктів горіння)
знижена концентрація кисню (φкр < 14%);
підвищена температура (tкр = 70°С);
можливість
утворення
вибухонебезпечних
концентрацій продуктів неповного згоряння;
токсичність продуктів горіння
Середньосмертельна концентрація диму L50 вміст диму, що викликає загибель 50 %
піддослідних тварин при заданій експозиції.
11. 2. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ РЕЧОВИН ІНДИВІДУАЛЬНОГО СКЛАДУ
12.
1 ГР + (О2 + 3,76 N2) = niПГiпитоме теоретичне число молів
повітря: nопов=(1+3,76)· =4,76· , моль/моль;
продуктів горіння:
nоПГ = nПГi, моль/моль;
питоме дійсне число молів
повітря:
nпов = nопов · , моль/ моль
продуктів горіння:
nпг = nопг + ∆nопов= nопг+( -1)nопов моль/ моль
13. 2.1. ГОРІННЯ ГАЗУ ІНДИВІДУАЛЬНОГО СКЛАДУ
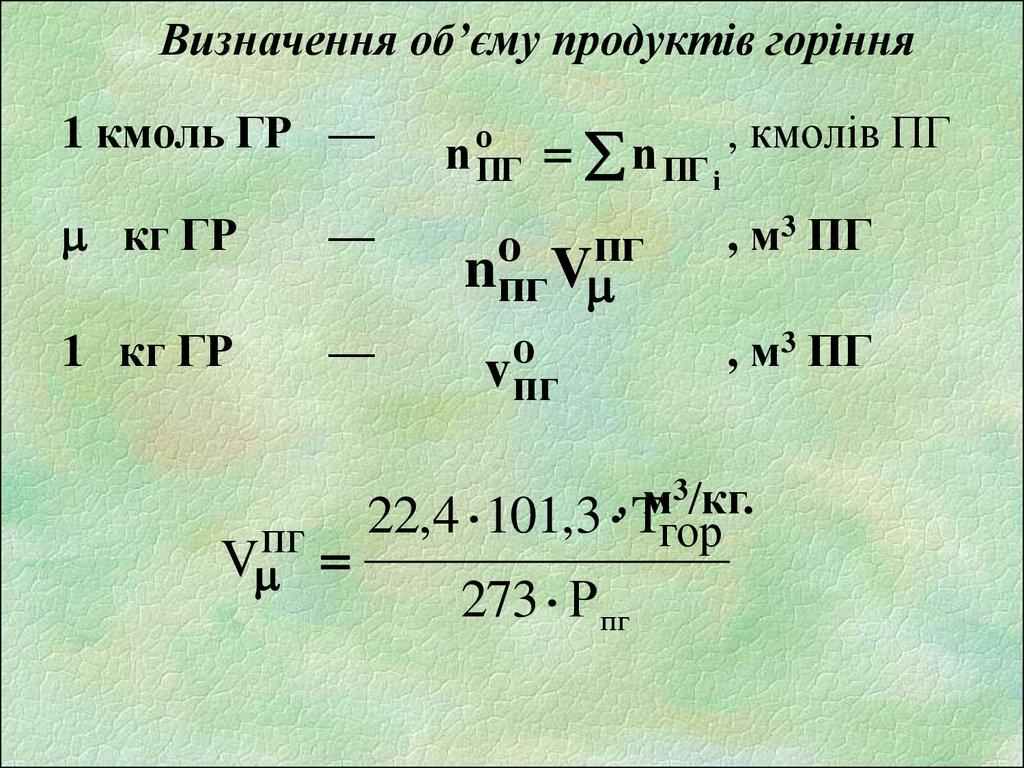
1 кмоль газу за даних Р і Т займає об’єм V м3.PV
22,4 101,3
T
273
101,3 T
V 22,4
273 P
Визначення об’єму повітря:
1 кмоль ГР — nопов = 4,76· , кмолів повітря
V ГР м3 ГР
1 м3 ГР
— nопов · V пов, м3 повітря
— vопов ,
м3 повітря
v oпов
4,76 V пов
V гр
, м3/м3
14.
Якщо ГР і повітря знаходяться за однаковихумов, то
Vµгр = Vµ пов.
питомі об’єми повітря
теоретичний:
vопов = 4,76 , м3/м3;
дійсний:
vпов = 4,76 · , м3/м3
При горінні заданої кількості горючого газу Vгг
м3 визначають
повні об’єми повітря
теоретичний:
Vопов = vопов ·Vг.г, м3;
дійсний:
Vпов = vпов ·Vг.г, м3
15.
Визначення об’єму продуктів горіння1 ГР + (О2 + 3,76 N2) = niПГi
n оПГ n ПГ, і кмолів ПГ
1 кмоль ГР
—
V ГР м3 ГР
1м3 ГР
nопг V пг , м3 ПГ
—
vопг
—
voпг
пг
n
V
пг і
V гр
, м3 ПГ
, м3/м3.
Якщо ГР і ПГ знаходяться за однакових умов, то V гр V пг
питомі об’єми ПГ
vопг nпг і
теоретичний :
, м3/м3
дійсний : vпг vопг vпов nпг і 1 4,76 , м3/м3
16.
Під час горіння ПГ мають підвищенутемпературу (температуру горіння), при
цьому відбувається їх розширення:
Тгор
Vпг
То
Vпг
Tгор
Tо
17. 2.2. ГОРЮЧА РЕЧОВИНА ІНДИВІДУАЛЬНОГО СКЛАДУ У КОНДЕНСОВАНОМУ СТАНІ
1 кмоль ГР важить кгВизначення об’єму повітря
1 ГР + (О2 + 3,76 N2) = niПГi
1 кмоль ГР — nопов = 4,76· , кмолів повітря
кг ГР
— nопов · Vµ пов,
1 кг ГР
— vопов ,
м3 повітря
м3 повітря
18.
питомі об’єми повітря:теоретичний
дійсний :
о
v пов
4,76
v пов 4,76
пов
V
пов
V
, м3/кг;
, м3/кг.
повні об’єми повітря:
теоретичний
Vопов = vопов · mГР, м3;
дійсний :
Vпов = vпов · mГР, м3
19.
Визначення об’єму продуктів горіння1 кмоль ГР —
кг ГР
—
1 кг ГР
—
пг
V
о
n ПГ
n ПГ і
о пг
nпг V
о
vпг
, кмолів ПГ
, м3 ПГ
, м3 ПГ
3/кг.
,
м
22,4 101,3 Tгор
273 Р пг
20.
питомий теоретичний об’єм ПГ:о
v ПГ
V ПГ
ГР
n ПГ і , м3/кг,
питомий дійсний об’єм ПГ:
vпг = vопг + ( - 1) vопов, м3/кг
повний теоретичний об’єм ПГ
Vопг = vопг mгр, м3;
повний дійсний об’єм ПГ
Vпг = vпг mгр, м3
21. 3. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ МАТЕРІАЛІВ СКЛАДНОГО СКЛАДУ
22. 3.1. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ СУМІШІ ГАЗІВ
Визначення об’єму повітря:питомий теоретичний: vпов
o
vпов
v
r ,м3/м3
пов i
і
сум
і
i 4,76
4,76 і
і i
100 100 і
сум
і
якщо присутній кисень:
і i О
2
4
,
76
і
voпов
і i
О2
100
21
сум
і
23. Визначення об’єму продуктів згоряння
Питомий теоретичний:o
v пг
сум
vопг ri
і
і
vопг = nПГi, м3
Негорючі компоненти вихідної
переходять у продукти горіння.
суміші
При горінні 1 м3 метану
CH4 + 2(О2 + 3,76 N2) = CO2 + 2H2O +2·3,76N2
утворюються
1 м3 CO2,
2 м3 H2O
та
7,52 м3 N2
24. Питомі об’єми продуктів згоряння деяких газів
Найменуванняречовин
Водень-H2
Оксид вуглецю -CO
Сірководень-Н2S
Метан-CH4
Ацетілен-С2Н2
Етан C2H6
Етилен - C2H4
Пропан C3H8
Бутан C4H10
Пентан C5H12
3
Об’єм продуктів згоряння, м /м
СО2
Н2О
N2
SO2
1.0
1.88
1.0
1.88
1.0
5.64
1.0
1.0
2.0
7.52
2.0
1.0
9.4
2.0
3.0
13.16
2.0
2.0
11.28
3.0
4.0
16.8
4.0
5.0
24.4
5.0
6.0
30.08
3
25.
Визначеннятаблиці
об’ємних
відповідні
voпг
сум
зводиться
часток
з використанням
до
перемноження
компонентів
коефіцієнти
ri
на
таблиці
з
наступним їхнім додаванням по колонках.
26.
питомий дійсний:об'єм повітря vпов
об'єм ПГ
vпг
сум
сум
о
vпг
сум
о
vпов
сум
, м3/м3
1
о
vпов ,
сум
м3/м3
повний теоретичний:
об'єм повітря
об'єм ПГ
повний дійсний:
об'єм повітря
об'єм ПГ
Vо
пов
о
V
пг
voпов
сум
o
v пг
сум
Vпов vпов
Vпг v пг
сум
сум
Vсум , м3
Vсум , м3
Vсум , м3
Vсум
, м3
27. 3.2. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ СКЛАДНИХ РЕЧОВИН В КОНДЕНСОВАНОМУ СТАНІ
Визначення об’єму повітря:o
о
v
v
g i
питомий теоретичний
пов
пов
і
і
скл
Загальний об’єм повітря складається із об’ємів
повітря, що витрачається на горіння кожного
елементу, за вирахуванням кількості повітря, що
відповідає кількості кисню в речовині.
vопов скл
vопов(С)
С
S
H
O
о
о
о
vпов(S)
vпов(Н)
vпов(О)
100
100
100
100
28.
1 кмоль кисню (32кг) міститься в 4,76 кмоляхповітря (4,76V м3), тоді 1 кг кисню відповідає об’єму повітря:
о
v пов (O )
4,76V
32
, м3/кг.
Реакції горіння елементів речовини (С, Н, S).
С + (О2 + 3,76N2) = СО2 + 3,76N2
12 кг – 4,76 Vµ м3
1 кг – voпов (C) м3
о
v пов ( С )
4,76V
12
, м3/кг.
29.
Н2 +0,5 (О2 + 3,76 N2) = Н2О + 0,5 3,76 N2
2 кг — 0,5 4,76 V м3
о
v пов ( H )
1 кг —
о
vпов ( Н )
S
+
0,5 4,76V
2
, м3/кг.
(О2 + 3,76 N2) = SО2 + 3,76 N2
32 кг — 4,76 V м3
1 кг
—
о
v пов ( S )
о
vпов (S )
4,76V
32
, м3/кг.
30.
vпов cкл4,76Vμ і і О 3
, м / кг
100 і і
32
Якщо ГР складається з С, Н, О, S, то
v опов cкл
4,76 Vμ С
S O м3/кг.
H
,
4 100 3
8
Якщо прийняти, що V = 22,4 м3/кмоль
о
vпов cкл
S O м3/кг.
С
0,267
H
,
8
3
31. Визначення об’єму продуктів горіння
питомий теоретичнийо
о
v пг cкл v пг g i
i
і
С + (О2 + 3,76N2) = СО2 +
12 кг
22,4 м3
1 кг
voCO2
22,4
1,88 м3/кг.
12
3,76 22,4
7,0 м3/кг.
12
o
vCO 2
o
v N2
3,76N2
3,76·22,4 м3
voN2
32.
Якщо в ГР міститься оксиген, то повітря длягоріння знадобиться менше. Це означає, що до
зони реакції, а потім і в ПГ надійде менше азоту.
В повітрі на 1 кмоль кисню (32 кг) приходиться
3,76 кмолів або 3,76V м3 азоту, тоді наявність 1 кг
оксигену зменшує об’єм азоту в ПГ на величину:
о
v пг ( N 2 )
3,76V
, м3/кг.
Якщо в складі ГР міститися нітроген та волога,
то при горінні вони переходять у газоподібні ПГ.
Об’єм 1 кг азоту і пари води за нормальних умов
дорівнює:
3
3
V
V
м
м .
о
;
v опг ( N )
,
v пг (н О)
,
28 кг
18 кг
2
32
2
33. Питомий об’єм продуктів горіння елементів
Vo
3
-1
v пг і
i , м кг .
i
3
Хімічний
Об’єм продуктів згоряння, м /кг
елемент
СО2 Н2О
N2
SO2 P2O5
Карбон С 1,88
—
7,0
—
—
Гідроген Н —
11,2 21,0
—
—
Сульфур S
—
—
2,63
0,7
—
Фосфор P
—
—
4,7
—
0,36
Нітроген N —
—
0,8
—
—
Оксиген О —
—
-2,63
—
—
Волога W —
1,24
—
—
—
34.
Визначеннятаблиці
масових
відповідні
o
v пг
скл
зводиться
часток
з використанням
до
перемноження
компонентів
коефіцієнти
gi
на
таблиці
з
наступним їхнім додаванням по колонках.
35.
питомий дійсний:vпов
об'єм повітря
об'єм ПГ
vпг
скл
скл
о
vпг
скл
о
3/м3
vпов
,
м
скл
1
о
, м3/м3
vпов
скл
повний теоретичний:
об'єм повітря
Vо
об'єм ПГ
о
V
пг
пов
voпов
mгр
скл
o
vпг
скл
mгр
, м3
, м3
повний дійсний:
об'єм повітря
Vпов vпов
об'єм ПГ
Vпг vпг
скл
скл
mгр
, м3
mгр , м3
36. Завдання на самопідготовку:
Вивчити матеріал1. Демидов, Шандыба, Щеглов:- Горение и
свойства горючих веществ, стор. 18-29.
2.Демидов, Саушев. Горение и свойства
горючих веществ, стор. 24-42.


































 Химия
Химия








