Похожие презентации:
Енергетичний баланс процесу горіння
1.
ЕНЕРГЕТИЧНИЙ БАЛАНСПРОЦЕСУ ГОРІННЯ
2. План лекції
1. Тепловий ефект хімічної реакції.2. Теплота згоряння. Види теплоти згоряння
3. Розрахунок теплоти згорання
4. Температура горіння речовини та її види
5. Розрахунок адіабатичної темератури горіння
3. 1. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ
Тепловий ефект реакції – кількість теплоти, щовиділяється чи поглинається системою при протіканні
в ній необоротної хімічної реакції в умовах сталості
температури і об’єму чи температури і тиску.
Початковий
і
кінцевий рівні енергії
відрізняються
між
собою на величину
теплоти реакції Q.
Eкін – Eпоч = Q
4.
За І законом термодинаміки теплота хімічноїреакції:
- dQ = dU + PdV = dH – VdP
За незмінного тиску (dP = 0) теплота реакції
виражається як різниця між ентальпією системи в
початковому і кінцевому станах.
Q = - dH = - H
За незмінного об’єму (dV = 0) теплота реакції
виражається як різниця між внутрішньою енергією
системи в початковому і кінцевому станах.
Q = - dU = - U
5.
Стандартна теплота реакції - різниця міжстандартними теплотами утворення продуктів
реакції і вихідних речовин.
Q = - ( nкін Ноf кін - nпоч Ноf поч ),
Стандартна теплота утворення речовини Ноf
- теплота утворення одного молю речовини із
елементів, за стандартних умов (Р=101,3кПа,Т=
298К).
.
6. 2. ТЕПЛОТА ЗГОРЯННЯ. ВИДИ ТЕПЛОТИ ЗГОРЯННЯ
Теплота згоряння – кількість тепла, що виділяється приповному згорянні одиниці кількості горючої речовини
за стандартних умов.
n
Н гор n пг і Hоf пг n гс Hоf гс
і
i 1
Оскільки реакція горіння складається на 1 моль горючої
речовини, а горюча суміш містить горючу речовину,
та прості речовини - кисень й азот, тепловий ефект
реакції горіння становить:
n
Нгор n пг і Hоf пг і Hоf гр
i 1
7.
Розрізняють теплоти згоряння:молярну Q – розрахунок на 1 моль горючої речовини
(кДж/моль) за законом Гесса:
n
Qгор n пг і Hоf пг Hоf гр
i 1
і
масову Q/ - розрахунок на 1 кг горючої речовини
Qгор 1000
(кДж/кг),
/
Qгор
об’ємну Q// - розрахунок на 1 м3 горючої речовини
Qгор 1000
(кДж/м3).
//
Qгор
V
8.
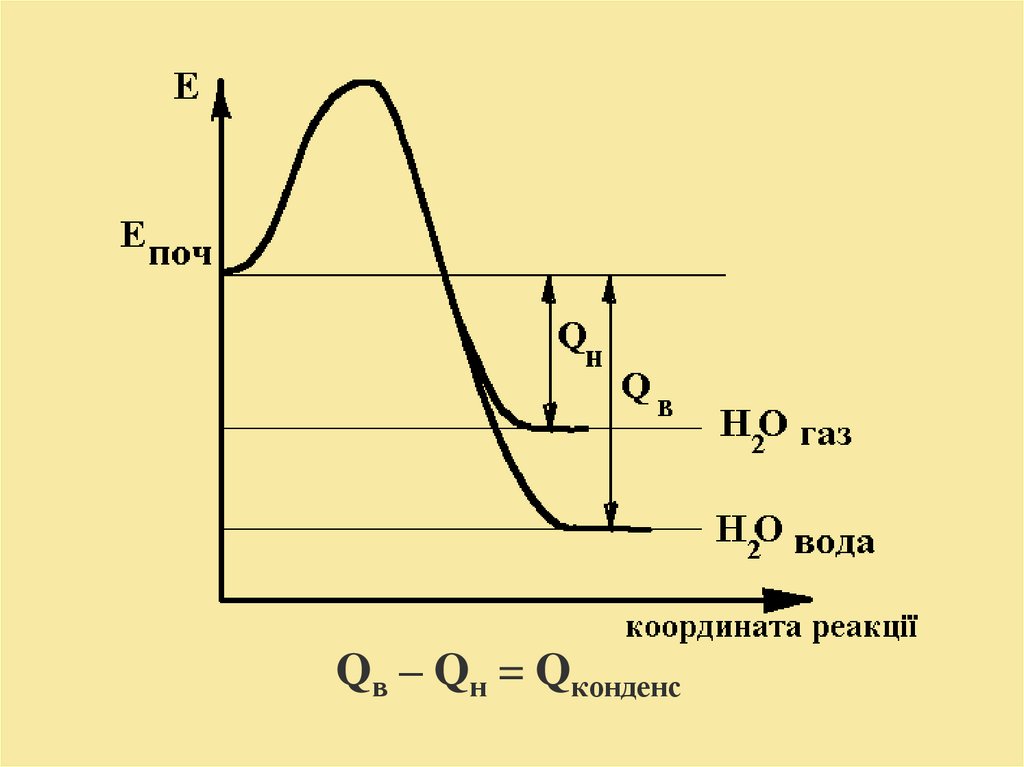
Залежно від агрегатного стану води, яка утворилася впроцесі горіння і знаходиться в продуктах горіння,
розрізняють вищу та нижчу теплоту згоряння.
Вища теплота згоряння Qв - кількість тепла, що
виділяється при повному згорянні одиниці кількості
горючої речовини при умові, що вода у продуктах
згоряння знаходиться у сконденсованому (рідкому)
стані.
Нижча теплота згоряння Qн - кількість тепла, що
виділяється при повному згорянні одиниці кількості
горючої речовини при умові, що вода в продуктах
горіння знаходяться в газоподібному стані.
9.
Qв – Qн = Qконденс10.
У разі урахуванні чинників, які впливаютьна теплоту згоряння речовини (повнота
згорання, вологість матеріалу, втрати на
теплове випромінювання), говорять про
практичну
або
робочу
теплоту
згоряння матеріалу Qнр.
11. 3. РОЗРАХУНОК ТЕПЛОТИ ЗГОРЯННЯ
Горюча речовина індивідуального хімічного складу – зазаконом Гесса
Складні горючі матеріали:
n
i
//
//
Q н в сум Q н в i
- суміш газів
100
i 1
ФОРМУЛА МЕНДЄЛЄЄВА
Вища теплота згоряння:
Qв/ = 339,4 С +1256,8 Н +108,9( S – O – N), кДж/ кг
де С, Н, S, O, N ,- вміст атомів у горючій речовині, % мас.
Нижча теплота згоряння:
Qн/ = Qв/ - 25,1(9 Н + W%), кДж/ кг
де W% - вміст вологи у горючій речовині, %.
12. Практичне значення теплоти згоряння
1). Розрахунок пожежної навантаги Рпож – це кількістьтепла, що виділяється при згорянні усіх речовин з
одиниці площі приміщення.
n
/
mi Qн
і
Р пож i 1
S підл
,
кДж
м
2
2). Визначення горючості речовини: негорючі - не
відносяться до вибухонебезпечних та їх нижча теплота
згоряння менша за 2100 кДж/кг для твердих речовин
або 1830 кДж/м3 для газів.
3). Розрахунок параметрів пожежної небезпеки
речовин: температура горіння, температура вибуху,
максимальний тиск вибуху, концентраційні межі
поширення полум’я.
13. 4. ТЕМПЕРАТУРА ГОРІННЯ РЕЧОВИНИ ТА ЇЇ ВИДИ
Температура горіння - температура, до якоїнагріваються продукти горіння за рахунок
теплоти згоряння.
За спрощеннями у розрахунку розрізняють такі
температури горіння:
калориметричну,
теоретичну,
адіабатичну,
дійсну.
14.
Калориметрична - виконуються наступніумови:
1) стандартні умови;
2) повне згоряння
(стехіометрична концентрація);
3) немає дисоціації продуктів горіння;
4) немає тепловтрат.
Все тепло реакції іде на нагрів продуктів
горіння, вода у продуктах горіння знаходиться
в газоподібному стані, тому враховують нижчу
теплоту згоряння.
Qнед = Qтвт = 0, Qнагрів пг = Qн
15.
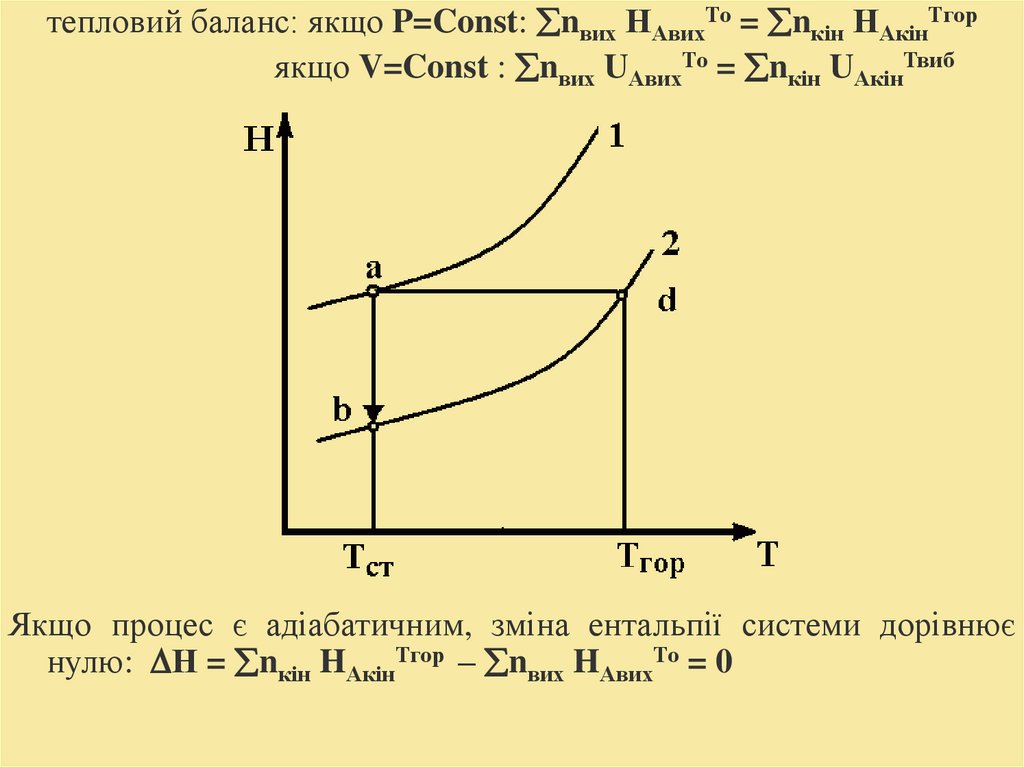
тепловий баланс: якщо P=Const: nвих НАвихТо = nкін НАкінТгорякщо V=Const : nвих UАвихТо = nкін UАкінТвиб
Якщо процес є адіабатичним, зміна ентальпії системи дорівнює
нулю: Н = nкін HАкінТгор – nвих HАвихТо = 0
16.
Залежність ентальпії від температури:Н(T) Нст Ср (T Tст )
де Нст – теплота реакції, за стандартних умов.
Тепло на розігрів ПГ передається
конвективним шляхом Qкон:
Qкон.= vпг Ср (Тгор – Т0)
Qн
Тгор кал Тст
nкін Ср
кін
17.
Якщо Тгор значна, то продукти горіннядисоціюють із витратою енергії на цей процес.
2СО2 = 2СО + О2 – 566 кДж
2Н2О = 2Н2 + О2 – 478 кДж
Теоретична температура горіння враховує
умови:
1) стандартні умови;
2) повне згоряння (стехіометрична концентрація);
3) дисоціація продуктів горіння;
4) немає тепловтрат.
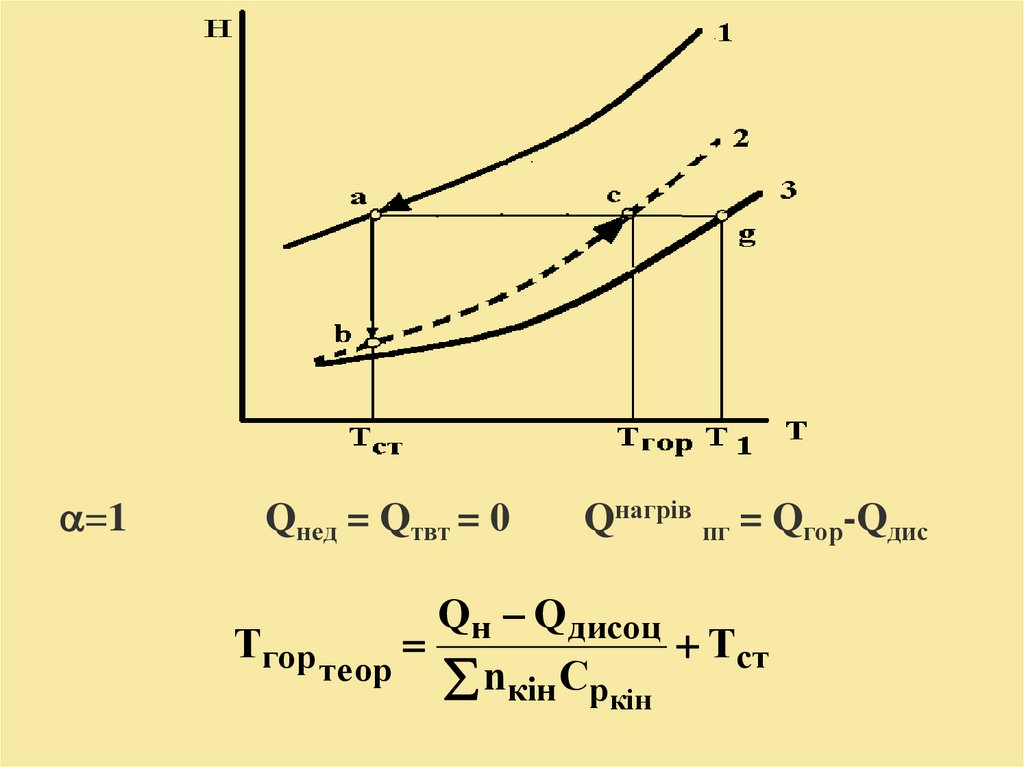
18.
=1Qнед = Qтвт = 0
Qнагрів пг = Qгор-Qдис
Qн Q дисоц
Тгор
Тст
теор n C
кін p кін
19.
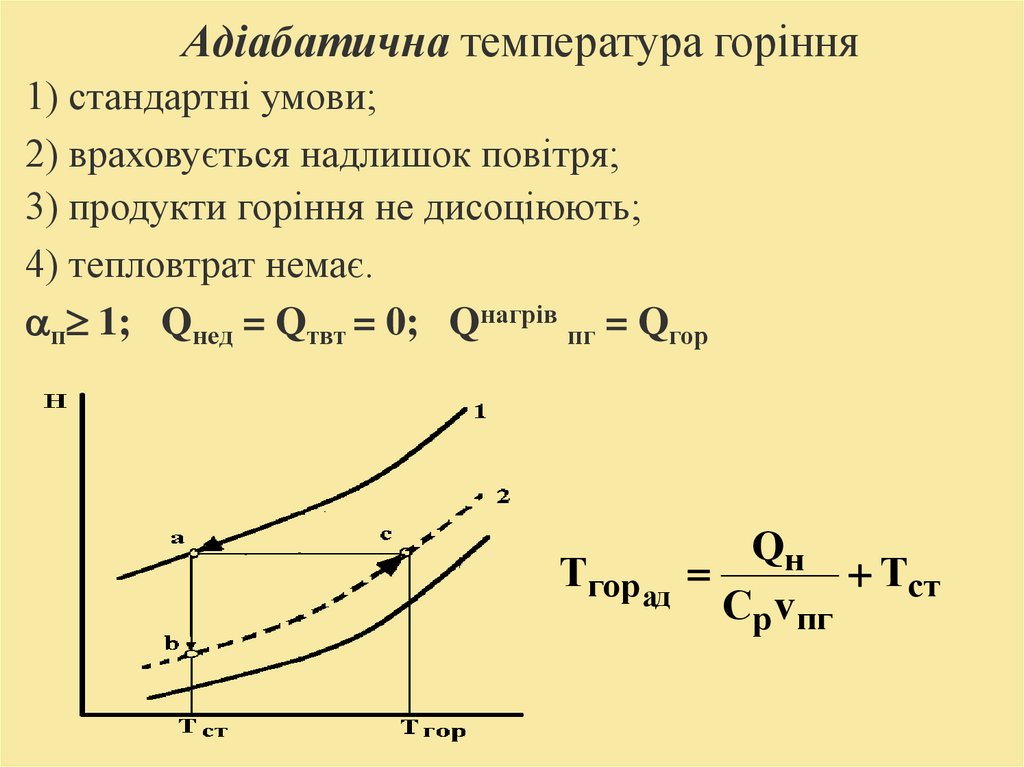
Адіабатична температура горіння1) стандартні умови;
2) враховується надлишок повітря;
3) продукти горіння не дисоціюють;
4) тепловтрат немає.
п 1; Qнед = Qтвт = 0; Qнагрів пг = Qгор
Qн
Тгор ад
Тст
Cp vпг
20.
Дійсна температура горіння враховуєнагрів продуктів горіння за реальних
умов:
1) є надлишок повітря,
2) враховують усі види тепловтрат,
3) фактичні початкові умови.
Qн Qтвт Qнедоп
Тгор
Тст
Cp vпг
4) Враховано недопал Qнедоп (неповне згоряння).
Qнед = (1- ) Qн,
де - коефіцієнт повноти згоряння = 0,95 0,75
21. 5. РОЗРАХУНОК АДІАБАТИЧНОЇ ТЕМПЕРАТУРИ ГОРІННЯ
5.1. Визначення температури горіння ізвикористанням ентальпії продуктів горіння
Індивідуальна речовина
Складна речовина
1. Скласти рівняння
реакції горіння.
2. Визначити питомий теоретичний об’єм повітря
vоп = 4,76 , (м3/ м3,
моль/моль)
S O 3
С
v оп 0,267 H
, м / кг
8
3
n
β i φ i φо 2
vп0 i 1
21
, м3/ м3
22.
3. Визначити vопгvопг = nопг Vμ/μ (м3/кг)
vопг = vПГi (за таблицею), (м3/кг)
4. Визначити питомий дійсний об’єм продуктів згоряння з
урахуванням Δvп ;
vпг = vопг + ( п - 1) vоп, (м3/кг, м3/ м3)
5. Визначити нижчу теплоту згоряння речовини
За законом Гесса
для суміші газів
//
//
3
Q
= r
Q
,
кДж/м
н
i
нi
Qн n i H ofппг- H ofгг для конд. речовин
,
і
/
Q
= 339,4 С + 1256,8 Н + 108,9
н
кДж/моль
( S – O – N) - 25,1(9 Н + W%),
кДж/ кг
6. Визначити середню ентальпію продуктів згоряння ср
Qн
Δ Hcp
vпг
7. Орієнтуючись на ентальпію азоту, визначити температуру
горіння Т1 у першому наближенні
23.
8. Визначити теплоту продук- Особливістю є те, що витів горіння Qпг T1 за темпера- значення теплоти продуктівтури горіння Т1
горіння ведеться за таблицями об’ємної ентальпії
QпгT1= i n пгi ,
продуктів горіння
9. Визначити температуру горіння в другому наближенні
Т2, виходячи з того, що Т2 < T1, якщо Qпг1> Qн, або Т2 > T1,
якщо Qпг1 < Qн;
10. Визначити теплоту продуктів горіння Qпг T2 за температури горіння Т2
QпгT2= i n пгi , кДж/моль;
11. Визначити температуру горіння методом лінійної інтерполяції
Тгор Т1
T2 T1 Qн Qпг1
Qпг 2 Qпг 1 ,
24. 5.2. Розрахунок температури горіння із використанням теплоємності продуктів горіння
QнТгор ад
Тст
vпгCр ПГ
Середня теплоємність продуктів горіння залежить від їх
температури:
де
Сор=асум+bсумtгор, кДж/(моль·К); кДж/(м3·К)
tгор - температура продуктів горіння, oC.
асум = аi vпгi ;
bсум = bі vпгi
Температура горіння розраховується за формулою:
2
асум асум
4bсумQн 103
t ад
2bсум
25. Завдання на самопідготовку
1. ЛітератураДемидов, Шандиба, Щеглов, Горіння та
властивості горючих речовин, стор. 29 – 33.
Демидов, Саушев, Горіння та властивості
горючих речовин, стор. 24-42.
2. Провести розрахунок теплоти згорання
та енергетичного балансу горіння
речовини
згідно
індивідуального
завдання.





















 Химия
Химия








