Похожие презентации:
Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння
1. МАТЕРІАЛЬНИЙ БАЛАНС ПРОЦЕСУ ГОРІННЯ
ОСНОВНІ ПОНЯТТЯМАТЕРІАЛЬНОГО БАЛАНСУ
ГОРІННЯ.
2. 1. Визначення матеріального балансу
Матеріальний баланс реакції горіння – рівність міжкількістю речовин, що вступають у реакцію, та
кількістю речовин, що утворюються внаслідок цієї
реакції.
Горюча речовина + Окислювач
Продукти горіння
mгс. = mпг
Узагальнений запис матеріального балансу реакції
горіння у повітрі:
ГР + · (О2 + 3,76 N2) = niПГi + ·3,76 N2
3.
Горюча суміш, склад якої відповідаєрівнянню реакції горіння, називається
стехіометричною.
Стехіометричний коефіцієнт показує
скільки молей кисню необхідно для
повного згоряння одного молю горючої
речовини.
С3Н8+β(О2+3,76N2)=3CO2+4H2O+ β 3,76N2
β =5
4. 2. Витрата повітря на горіння
Під час горіння розрізняють питому та повну,теоретичну та дійсну кількість повітря.
теоретична - мінімальна кількість повітря для
повного згоряння горючої речовини (noп, voп);
дійсна - кількість повітря, яка витрачається на
згоряння горючої речовини за даних умов (nп, vп);.
питома - кількість повітря для згоряння одиниці
кількості ГР (моль/моль, м3 /м3, кг/кг);
повна - кількість повітря для згоряння даної
кількості горючої речовини (nп,vп), моль, м3, кг.
5.
Різниця між дійсною кількістю повітря длягоріння і теоретично необхідною називається
надлишком повітря.
nп = nп - nоп
Коефіцієнт надлишку повітря ( п) показує у
скільки разів кількість повітря, що дійсно
надходить до зони горіння, відрізняється від
теоретично необхідної для повного згоряння
горючої речовини.
nп
о
nп
nп = nп - nоп = nоп( - 1)
6. кінетичне горіння
= 1 - суміш горючої речовини з повітрям єстехіометричною.
1 - суміш багата (нестача окисника і надлишок
горючої речовини), утворюються продукти неповного
згоряння.
1 - суміш бідна (нестача горючої речовини і
надлишок окисника), продукти горіння містять в собі
надлишок повітря vп.
Критичні значення відповідають сумішам з критичним
вмістом кисню та горючої речовини.
αmin (max)
100 в(н)
vп0 в(н)
7. дифузійне горіння
При дифузійному горінні кисень повітря повністю невитрачається.
Полум’яне горіння припиняється за зменшення
вмісту кисню у повітрі до 14%.
Гетерогенне горіння може існувати за зменшення
вмісту кисню в горючій суміші до 5%.
Коефіцієнт надлишку повітря визначається як
відношення відсоткового вмісту кисню у повітрі, яке
надійшло, до його залишкового відсоткового вмісту у
продуктах горіння (з врахуванням частки, яка
прореагувала).
21
α
21 %О2
8. 3. Продукти горіння. Дим та його властивості.
Продукти горіння – це газоподібні, тверді та рідкіречовини, що утворюються при взаємодії окисника з
горючою речовиною у процесі горіння.
Класифікація продуктів горіння:
за агрегатним станом
газоподібні
рідкі
тверді
за повнотою згоряння
продукти повного
продукти неповного
згоряння
згоряння
за хімічним складом
хімічно інертні
реакційноздатні.
9. Дим - дисперсна система, що складається з твердих і рідких часток (дисперсної фази), завислих у газовому дисперсійному
середовищі.Властивості диму:
непрозорість
густина задимлення
знижена концентрація кисню;
токсичність продуктів горіння
підвищена температура;
можливість
утворення
вибухонебезпечних
концентрацій продуктів неповного згоряння.
10. 4. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ
11. 4.1. Горіння ГОРЮЧОГО ГАЗУ індивідуального складу
1 кмоль газу за даних Р і Т займає об’єм V м3.PV
22,4 101,3
T
273
101,3 T
V 22,4
273 P
ВИЗНАЧЕННЯ ОБ’ЄМУ ПОВІТРЯ:
1 кмоль ГР — nоп = 4,76· ,
кмолів повітря або
V ГР м3 ГР — nоп · V п,
м3 повітря
1 м3 ГР
— vоп ,
м3 повітря
vоп = 4,76· · V п/ V ГР м3/м3
12.
Якщо ГР і повітря знаходяться за однаковихумов, то
VµГР = Vµ п.
питомі об’єми повітря
теоретичний: vоп = · 4,76, м3/м3;
дійсний:
vп = · 4,76 · п, м3/м3.
При горінні заданої кількості горючого газу
Vгг,м3 визначають
повні об’єми повітря
теоретичний:
Vоп = vоп ·Vг.г, м3;
дійсний:
Vп = vп ·Vг.г, м3
13.
ВИЗНАЧЕННЯ ОБ’ЄМУ ПРОДУКТІВ ГОРІННЯЯкщо ГР і ПГ знаходяться за однакових умов,
то V ГР = V ПГ . Тоді
питомі об’єми ПГ
теоретичний : vопг = nПГi, м3/м3;
дійсний :
vпг = vопг+( п -1)4,76 , м3/м3.
повні об’єми ПГ
теоретичний:
Vопг = vопг Vг.г., м3;
дійсний:
Vпг = vпг Vг.г , м3
Під час горіння ПГ мають температуру горіння,
тому відбувається їх температурне розширення
Тгор
Vп.г.
То
Vпг
Tгор
Tо
14.
4.2 Горюча речовина інд. складу у РІДКОМУ АБОТВЕРДОМУ агрегатному стані
1 кмоль ГР важить кг
ВИЗНАЧЕННЯ ОБ’ЄМУ ПОВІТРЯ:
1 кмоль ГР
—
nоп = 4,76· , кмолів повітря або
кг ГР
—
nоп · Vµ п, м3 повітря
1 кг ГР
—
vоп , м3 повітря
питомі об’єми повітря на 1 кг ГР:
п
V
v 4,76
п
V
,
дійсний : v п 4,76
теоретичний ,
0
п
м3/кг;
м3/кг.
повні об’єми повітря:
теоретичний :
Vоп = vоп · mГР, м3;
дійсний :
Vп = vп · mГР, м3
15.
ВИЗНАЧЕННЯ ОБ’ЄМУ ПРОДУКТІВ ГОРІННЯ1 кмоль ГР
кг ГР
— nоПГ = nПГi, кмолів ПГ
— nоПГ·V ПГ, м3 ПГ
1 кг ГР
— vоПГ ,
м3 ПГ
питомі об’єми ПГ на 1 кг ГР
теоретичний : vопг = nПГi V ПГ/ , м3/кг;
дійсний :
vпг = vопг +( - 1)4,76 V ПГ/ , м3/кг,
ПГ 22,4 101,3 Tгор
V
273 Р ПГ
повні об’єми ПГ
теоретичний:
дійсний:
Vопг = vопг· mГР., м3;
Vпг = vпг· mГР , м3
16. 4.3. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ СУМІШІ ГАЗІВ
ВИЗНАЧЕННЯ ОБ’ЄМУ ПОВІТРЯ:питомий теоретичний об’єм:
vоп суміші = vоп i·ri = 4,76· i· i/ 100, м3/м3
якщо присутній кисень
i о 2 ( i i о 2 ) м3
0
vп сум 4,76 i
,
3
100
100
21
м
i 1
n
питомий дійсний:
vп сум = vоп сум · , м3/м3
повний теоретичний: Vоп сум= vоп сум ·Vг.сум, м3
повний дійсний:
Vп сум= vп сум ·Vг.сум, м3
17. Визначення об’єму продуктів згоряння суміші газів
Питомий теоретичний об’єм:vопг сум = vопг i·ri , м3/м3
vопг = nПГi,
Так, наприклад, при горінні 1 м3 метану
CH4 +2(О2 + 3,76 N2)= CO2 + 2H2O +2·3,76N2
утворюються 1 м3 CO2, 2 м3 H2O та 7,52 м3 N2
18.
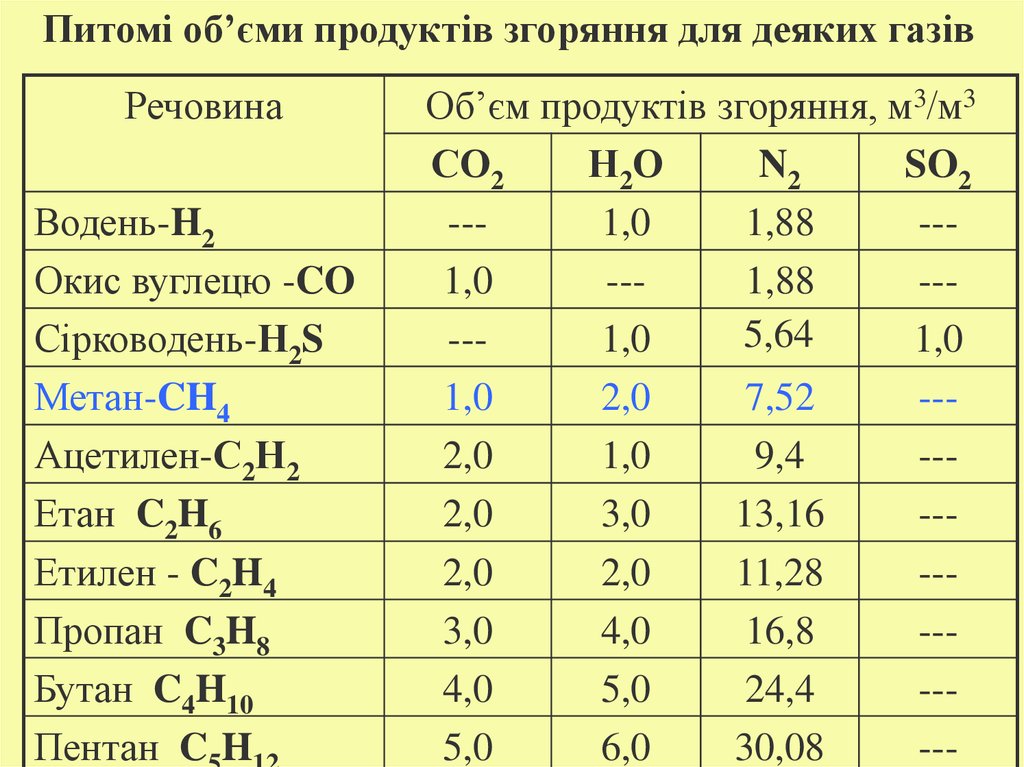
Питомі об’єми продуктів згоряння для деяких газівРечовина
Водень-H2
Окис вуглецю -CO
Сірководень-Н2S
Метан-CH4
Ацетилен-С2Н2
Етан C2H6
Етилен - C2H4
Пропан C3H8
Бутан C4H10
Пентан C H
Об’єм продуктів згоряння, м3/м3
СО2
Н2О
N2
SO2
--1,0
1,88
--1,0
--1,88
--5,64
--1,0
1,0
1,0
2,0
7,52
--2,0
1,0
9,4
--2,0
3,0
13,16
--2,0
2,0
11,28
--3,0
4,0
16,8
--4,0
5,0
24,4
--5,0
6,0
30,08
---
19. 4.4. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ СКЛАДНИХ РЕЧОВИН В КОНДЕНСОВАНОМУ СТАНІ
Визначення об’єму повітря:питомий теоретичний об’єм:
v оп v оп(С)
С
S
H
O
о
о
о
v п(S)
v п(Н)
v п(О)
100
100
100
100
Реакції горіння окремих елементів (С, Н, S).
С + (О2 + 3,76N2) = СО2 + 3,76N2
12 кг – 4,76 Vµ м3
1 кг – voп (C) м3
voп (C) = 4,76 Vµ /12, м3/ кг
20.
питомі об’єми повітря для водню і сульфуруvoп (Н) = 4,76·0,5·V /2, м3/ кг
voп (S) = 4,76 V /32, м3/ кг
Підставимо одержані значення voп (і) в рівняння:
4,76 V С
S O
о
vп
H
,
4 100 3
8
де C, O, S, H - масовий % вміст елементів
Якщо прийняти, що V = 22,4 м3/кмоль
S O
С
о
v п 0,267 H
,
3
8
21. Визначення об’єму продуктів горіння
питомий теоретичний об’ємn
0
vо
v
пгi g i
пг
i 1
С + О2 + 3,76N2 = СО2 + 3,76N2
12 кг
22,4 м3
3,76·22,4 м3
1 кг
voCO2
voN2
voCO2 = 22,4/12 = 1,87 м3/кг
voN2 = 3,76·22,4/12 = 7,0 м3/кг
22. Питомий об’єм продуктів згоряння для деяких елементів
Об’єм продуктів згоряння, м3/кгелемент
СО2
Н2О
N2
SO2
P2O5
Карбон -С
1,87
7,0
Гідроген- Н
11,2
21,0
Сульфур - S
2,63
0,7
Фосфор - P
4,7
0,36
Нітроген- N
0,8
Оксиген- О
-2,63
Волога -W
1,24
23. Завдання на самопідготовку:
1. Демидов, Шандыба, Щеглов:- Горение исвойства горючих веществ, стор. 18-29.
2.Демидов, Саушев. Горение и свойства
горючих веществ, стор. 24-42.






















 Химия
Химия








