Похожие презентации:
Карбоновые кислоты
1.
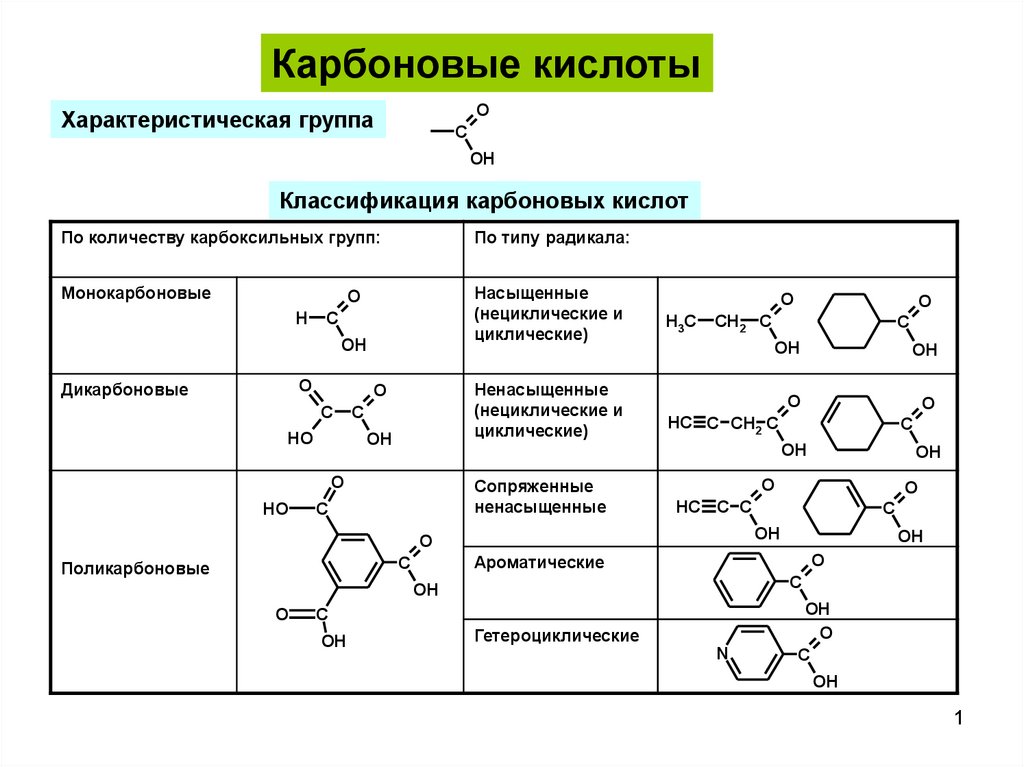
Карбоновые кислотыO
Характеристическая группа
C
OH
Классификация карбоновых кислот
По количеству карбоксильных групп:
По типу радикала:
Монокарбоновые
Насыщенные
(нециклические и
циклические)
O
H
C
OH
O
Дикарбоновые
Ненасыщенные
(нециклические и
циклические)
O
C
HO
C
OH
O
HO
Сопряженные
ненасыщенные
C
O
H3C
OH
O
O
C
OH
OH
O
O
HC C C
C
OH
OH
O
C
OH
C
OH
OH
Ароматические
C
O
C
HC C CH2 C
O
Поликарбоновые
O
CH2 C
Гетероциклические
N
OH
O
C
OH
1
2.
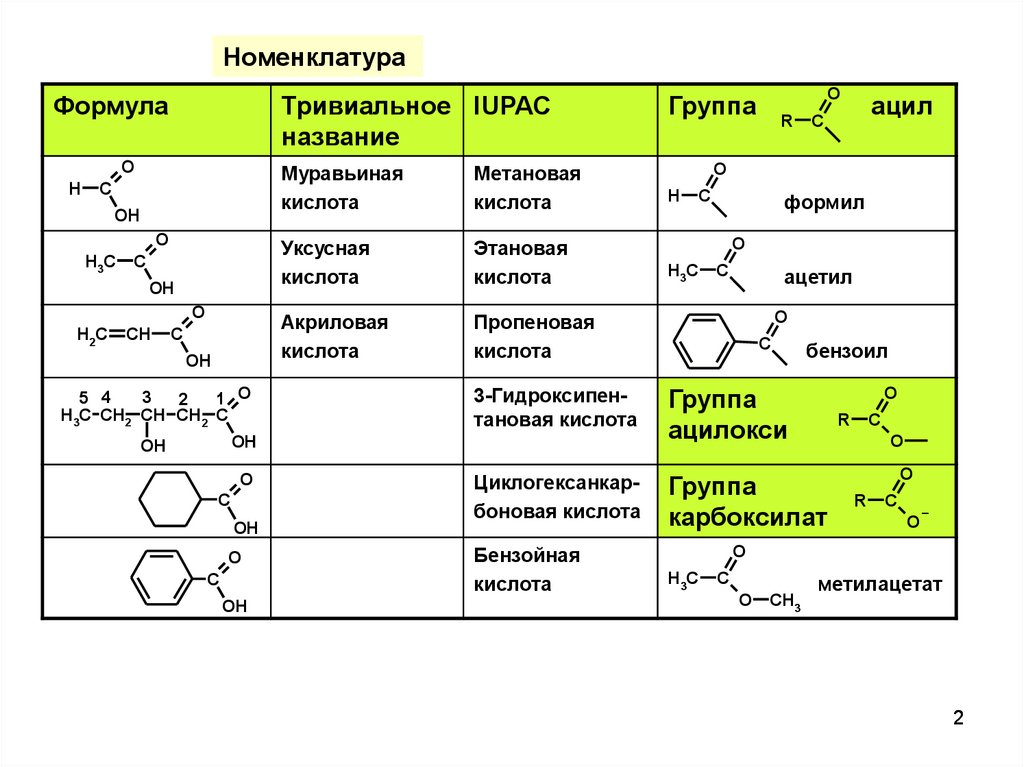
НоменклатураФормула
Тривиальное IUPAC
название
O
H
C
OH
O
H3C
C
OH
O
H2C
CH
C
OH
3
5 4
1 O
2
H3C CH2 CH CH2 C
Муравьиная
кислота
Метановая
кислота
Уксусная
кислота
Этановая
кислота
Акриловая
кислота
Пропеновая
кислота
3-Гидроксипентановая кислота
OH
OH
O
C
OH
O
C
OH
Циклогексанкарбоновая кислота
Бензойная
кислота
O
Группа
R
ацил
C
O
H
C
формил
O
H3C
C
ацетил
O
C
бензоил
O
Группа
ацилокси
R
C
O
Группа
карбоксилат
O
R
C
O
O
H3C
C
O
CH3
метилацетат
2
3.
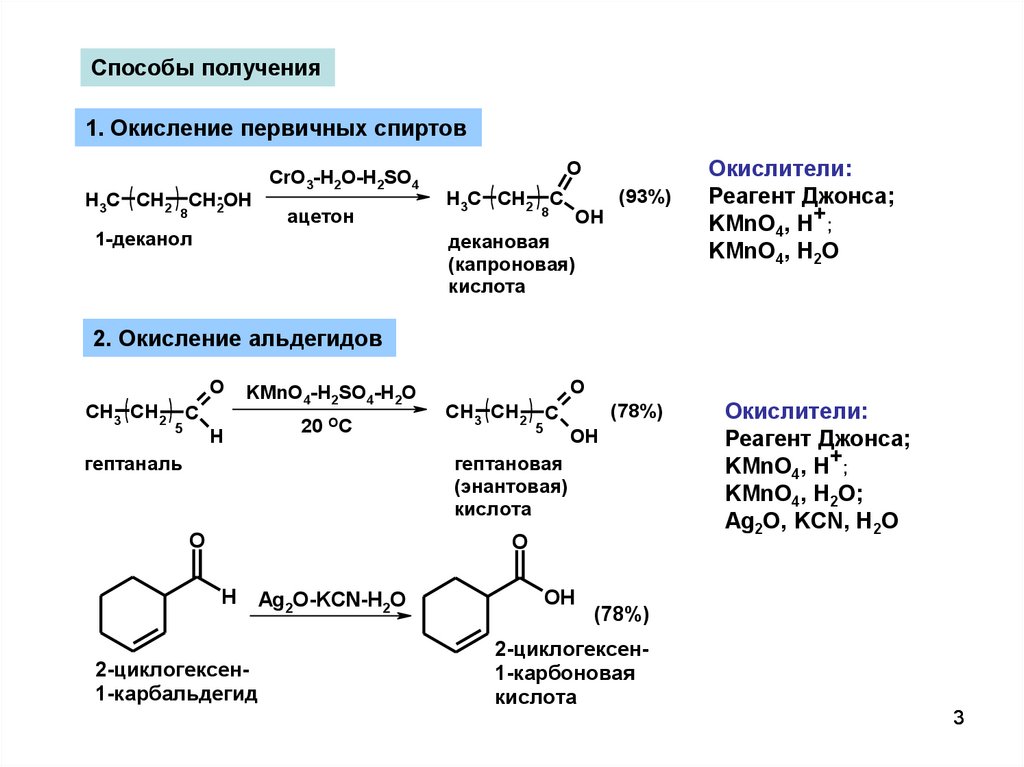
Способы получения1. Окисление первичных спиртов
CrO3-H2O-H2SO4
H3C CH2 CH2OH
ацетон
8
1-деканол
O
H3C CH2 C
8
OH
(93%)
декановая
(капроновая)
кислота
Окислители:
Реагент Джонса;
KMnO4, H+;
KMnO4, H2O
2. Окисление альдегидов
O
CH3 CH2 C
5
KMnO4-H2SO4-H2O
20 OC
H
гептаналь
O
CH3 CH2 C
5
(78%)
OH
гептановая
(энантовая)
кислота
O
O
H
Ag2O-KCN-H2O
2-циклогексен1-карбальдегид
OH
Окислители:
Реагент Джонса;
KMnO4, H+;
KMnO4, H2O;
Ag2O, KCN, H2O
(78%)
2-циклогексен1-карбоновая
кислота
3
4.
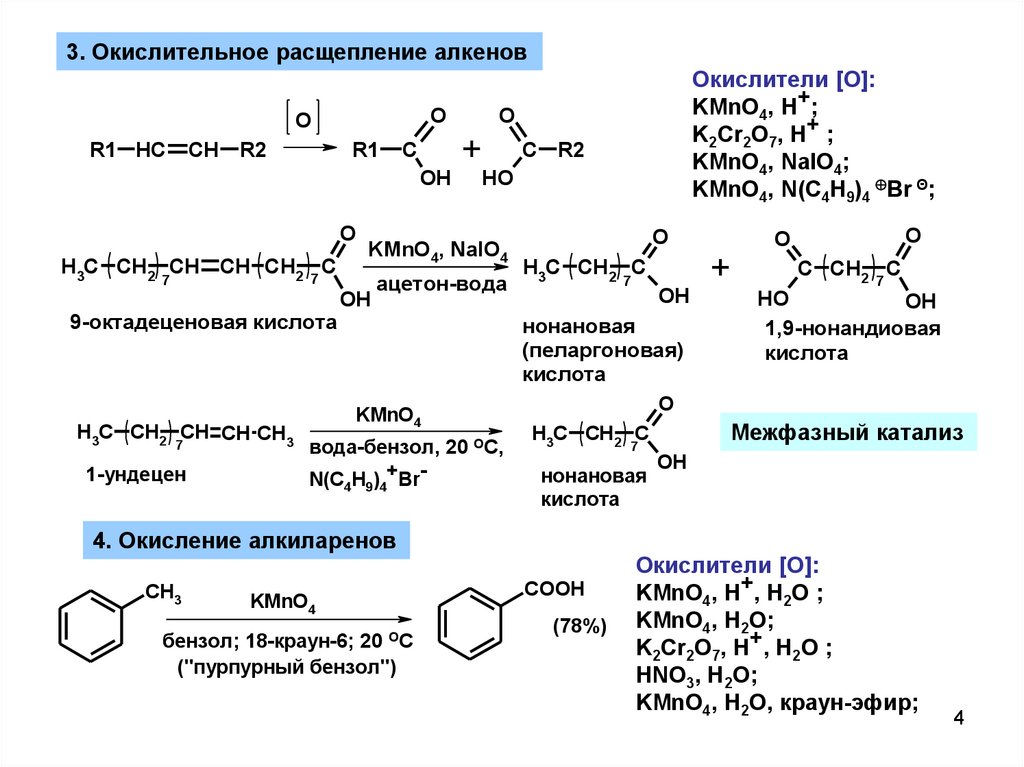
3. Окислительное расщепление алкеновO
O
R1 HC
CH
R2
R1
C
OH
O
H3C CH2 CH CH CH2 7 C
7
9-октадеценовая кислота
H3C CH2 CH CH CH3
7
1-ундецен
O
+
C R2
HO
KMnO4, NaIO4
OH
ацетон-вода
O
H3C CH2 C
7
OH
нонановая
(пеларгоновая)
кислота
KMnO4
вода-бензол, 20 ОС,
N(C H ) +Br4
9 4
KMnO4
бензол; 18-краун-6; 20 ОС
("пурпурный бензол")
+
O
O
C CH2 7 C
HO
OH
1,9-нонандиовая
кислота
O
Межфазный катализ
H3C CH2 C
7
нонановая
кислота
4. Окисление алкиларенов
CH3
Окислители [O]:
KMnO4, H+;
K2Cr2O7, H+ ;
KMnO4, NaIO4;
KMnO4, N(C4H9)4 Br Θ;
COOH
(78%)
OH
Окислители [O]:
KMnO4, H+, H2O ;
KMnO4, H2O;
K2Cr2O7, H+, H2O ;
HNO3, H2O;
KMnO4, H2O, краун-эфир;
4
5.
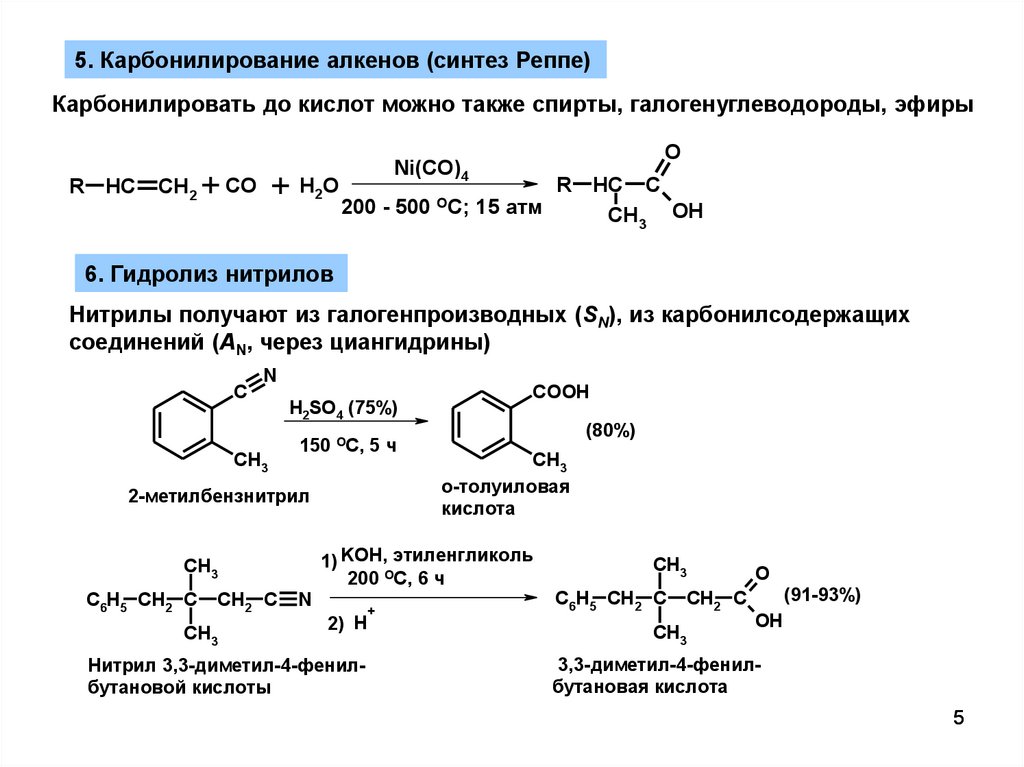
5. Карбонилирование алкенов (синтез Реппе)Карбонилировать до кислот можно также спирты, галогенуглеводороды, эфиры
R
HC
CH2
O
Ni(CO)4
+ CO + H2O
200 - 500 OC; 15 атм
R
HC C
CH3 OH
6. Гидролиз нитрилов
Нитрилы получают из галогенпроизводных (SN), из карбонилсодержащих
соединений (AN, через циангидрины)
C
N
CH3
H2SO4 (75%)
150 OC, 5 ч
2-метилбензнитрил
CH2 C
CH3
(80%)
CH3
о-толуиловая
кислота
1) KOH, этиленгликоль
200 ОС, 6 ч
CH3
C6H5 CH2 C
COOH
N
2) H
Нитрил 3,3-диметил-4-фенилбутановой кислоты
+
CH3
C6H5 CH2 C
CH2 C
CH3
O
(91-93%)
OH
3,3-диметил-4-фенилбутановая кислота
5
6.
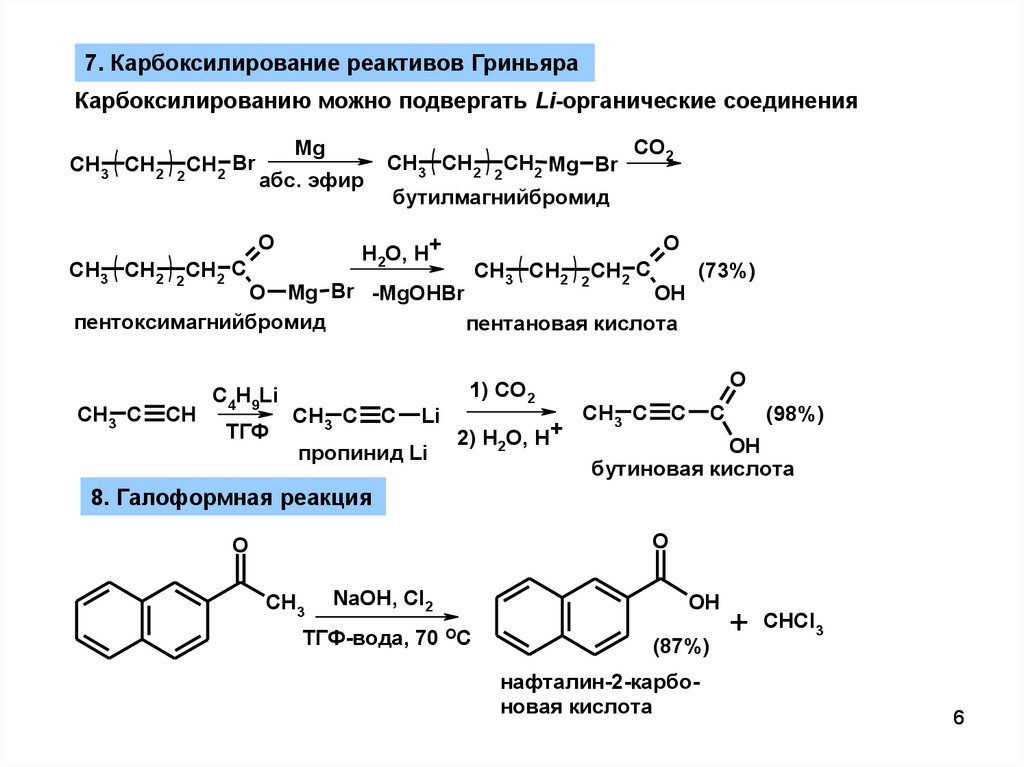
7. Карбоксилирование реактивов ГриньяраКарбоксилированию можно подвергать Li-органические соединения
CH3 CH2
CH2 Br
2
Mg
абс. эфир
O
CH3 CH2
2
CH3 CH2
CO2
бутилмагнийбромид
O
H2O, H+
CH2 C
CH2 Mg Br
2
CH3 CH2
2
CH2 C
O Mg Br -MgOHBr
OH
пентоксимагнийбромид
пентановая кислота
CH3 C
CH
C4H9Li
ТГФ
CH3 C
C
Li
пропинид Li
1) CO2
2) H2O, H+
(73%)
O
CH3 C
C
C
(98%)
OH
бутиновая кислота
8. Галоформная реакция
O
O
CH3
NaOH, Cl2
ТГФ-вода, 70 ОС
OH
(87%)
нафталин-2-карбоновая кислота
+
CHCl3
6
7.
Физические свойства и строение молекулы.Вещество
lOH, нм
lС−O, нм
...
...
lС=O, нм
0,972
0,1310
Спирт
0,960
0,1440
0,1245
H C+
O H
O H
....
O
124О
Альдегид
H
0,1203
C
0,1097 нм
Кетон
0,1220
125О
..
..
O
0,1343 нм
Ткип, ОС
R
Формальдегид
-21,0
H
O
111О
H
C
H
H3C
+
O H
H
sp2
C
H
..
.
O.
''
C
''
..
..
O
O
C
O
H C
0,1202 нм
0,0972 нм
Вещество
O
O
H C
Кислота
....
..
....
...
O
R
Водородные связи
O
0,267 нм
Метанол
64,5
Муравьиная кислота
101,0
7
'
H
8.
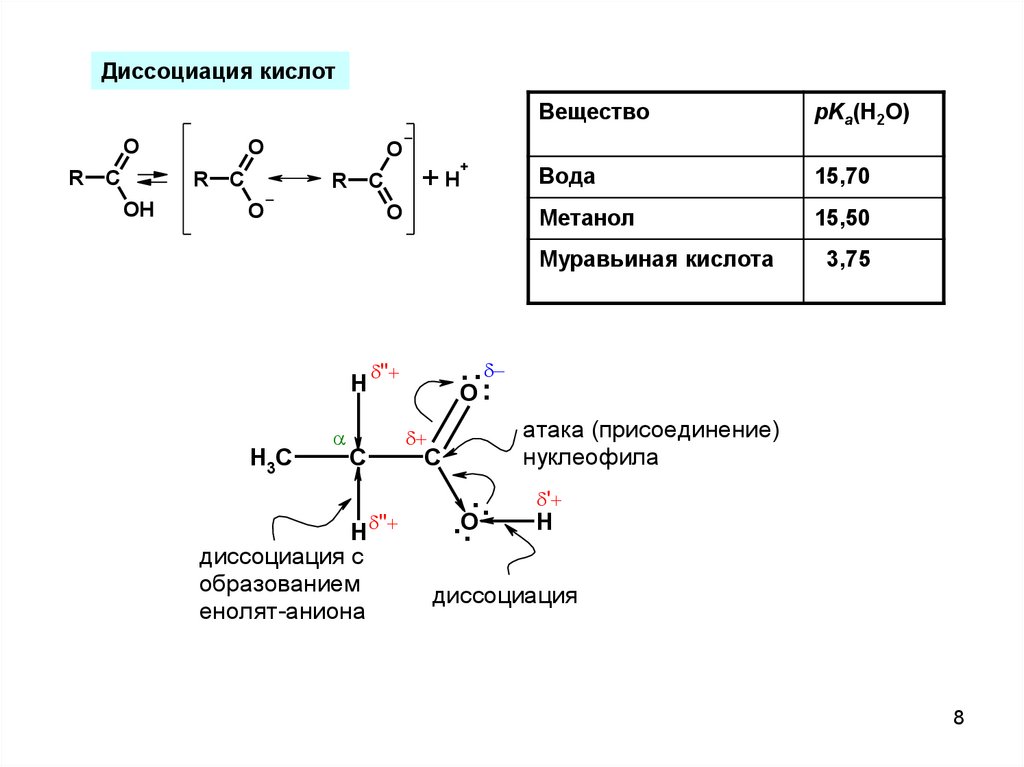
Диссоциация кислотO
R
C
O
R
OH
C
O
R
C
O
+H
+
O
Вещество
pKa(H2O)
Вода
15,70
Метанол
15,50
Муравьиная кислота
H
H3C
..
.
O.
''
C
H ''
диссоциация с
образованием
енолят-аниона
3,75
C
..
.O.
атака (присоединение)
нуклеофила
'
H
диссоциация
8
9.
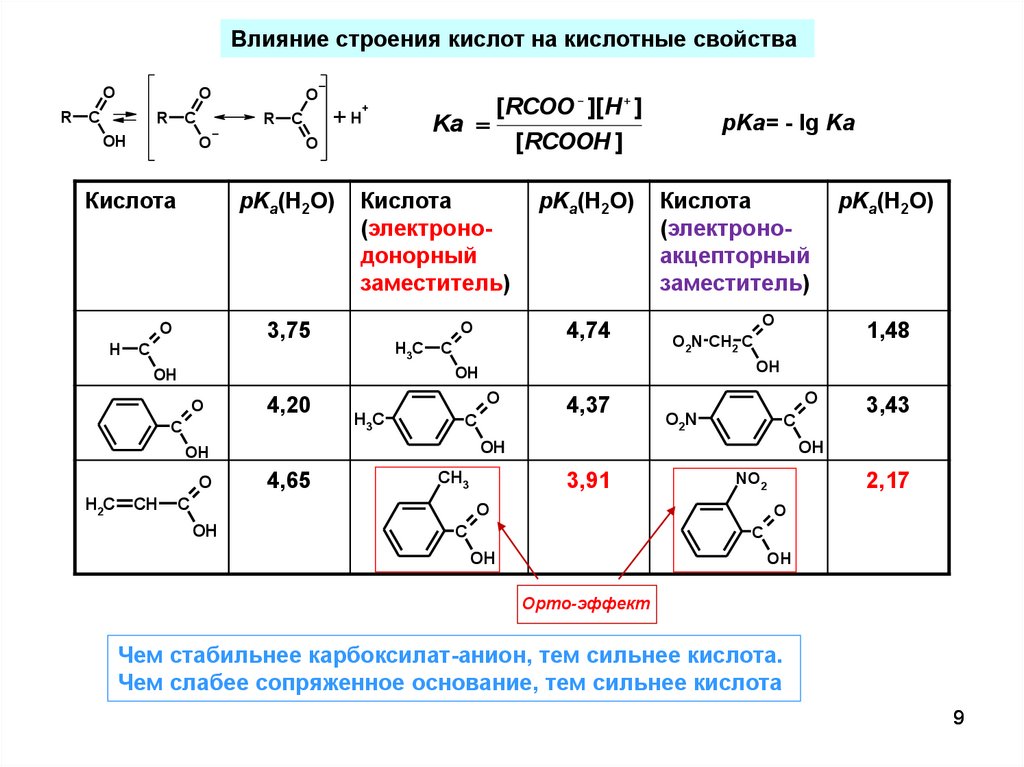
Влияние строения кислот на кислотные свойстваO
R
O
C
R
C
OH
R
O
Кислота
C
+
H
Кислота
(электронодонорный
заместитель)
O
3,75
C
[RCOO ][H ]
Ka
[RCOOH ]
+
O
pKa(H2O)
O
H
O
H3C
O
C
C
4,20
O
O
C
CH3
C
4,37
O
O2N
C
3,43
OH
3,91
NO2
O
OH
1,48
O2N CH2 C
OH
4,65
pKa(H2O)
OH
O
H3C
OH
CH
4,74
Кислота
(электроноакцепторный
заместитель)
OH
OH
H2C
pKa(H2O)
pKa= - lg Ka
2,17
O
C
C
OH
OH
Орто-эффект
Чем стабильнее карбоксилат-анион, тем сильнее кислота.
Чем слабее сопряженное основание, тем сильнее кислота
9
10.
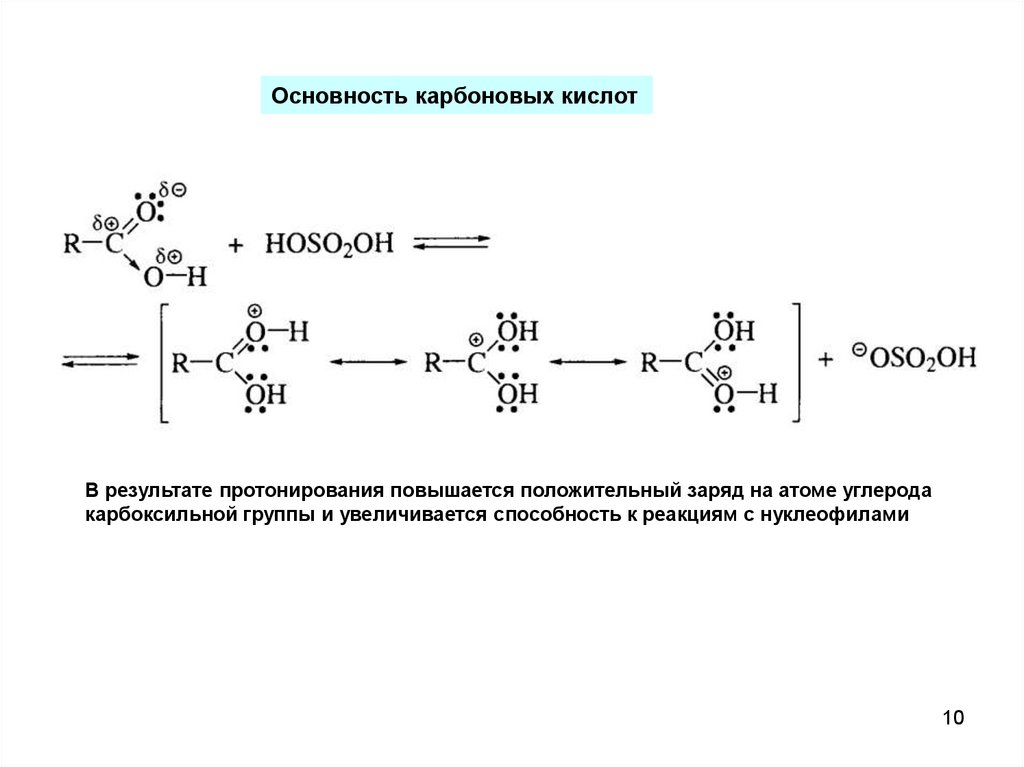
Основность карбоновых кислотВ результате протонирования повышается положительный заряд на атоме углерода
карбоксильной группы и увеличивается способность к реакциям с нуклеофилами
10
11.
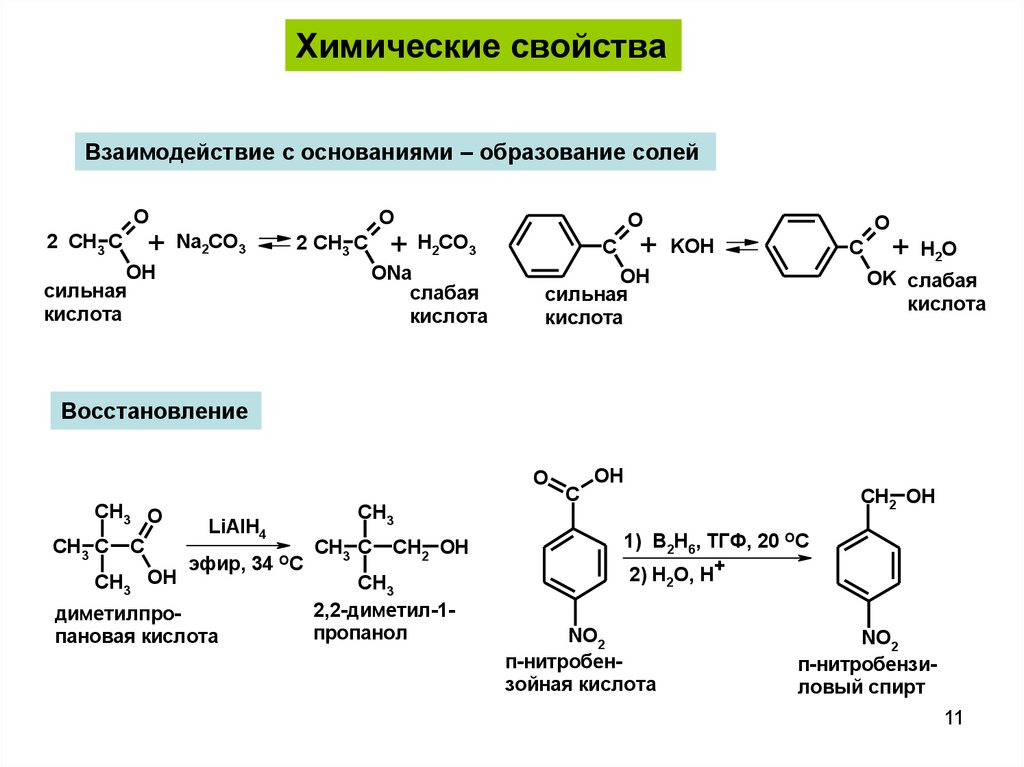
Химические свойстваВзаимодействие с основаниями – образование солей
O
+
2 CH3 C
O
Na2CO3
2 CH3 C
OH
сильная
кислота
+
O
H2CO3
ONa
слабая
кислота
C
+
O
KOH
C
OH
сильная
кислота
+ H2O
OK слабая
кислота
Восстановление
O
CH3 O
CH3 C
C
CH3
OH
LiAlH4
эфир, 34 ОС
диметилпропановая кислота
CH3
CH3 C
CH2 OH
CH3
2,2-диметил-1пропанол
C
OH
CH2 OH
1) B2H6, ТГФ, 20 ОС
2) H O, H+
2
NO2
п-нитробензойная кислота
NO2
п-нитробензиловый спирт
11
12.
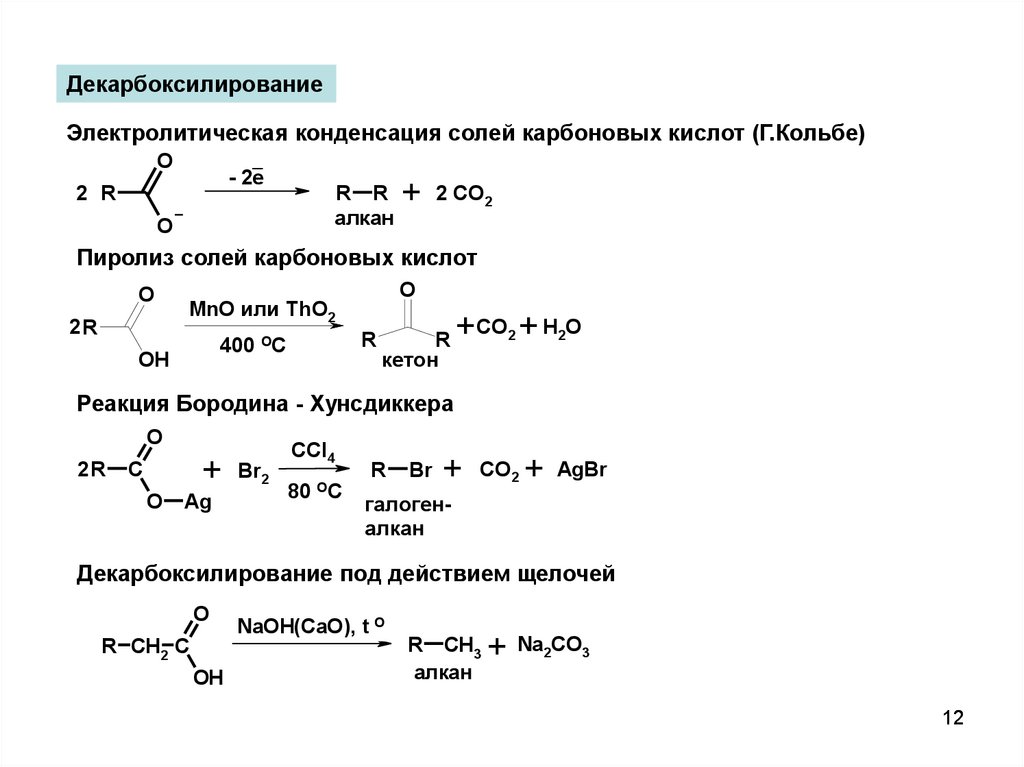
ДекарбоксилированиеЭлектролитическая конденсация солей карбоновых кислот (Г.Кольбе)
O
- 2e
2 R
R R
алкан
O
+
2 CO2
Пиролиз солей карбоновых кислот
O
2R
O
MnO или ThO2
400
OH
R
OC
R
кетон
+CO2 + H2O
Реакция Бородина - Хунсдиккера
O
2R
+
C
O
Ag
Br2
CCl4
80
OC
R
Br
+
CO2
+
AgBr
галогеналкан
Декарбоксилирование под действием щелочей
O
R CH2 C
OH
NaOH(CaO), t O
R CH3
алкан
+
Na2CO3
12
13.
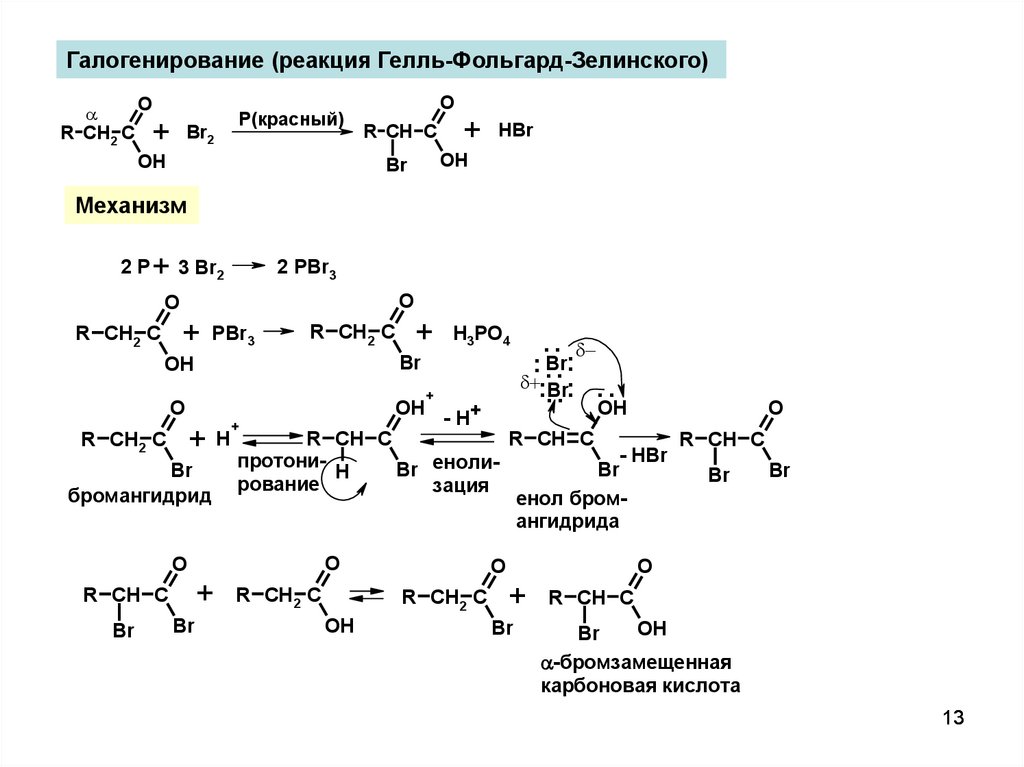
Галогенирование (реакция Гелль-Фольгард-Зелинского)R CH2 C
O
+
Br2
P(красный)
OH
O
R CH C
+
HBr
OH
Br
Механизм
2P
+ 3 Br2
2 PBr3
O
O
+
R CH2 C
PBr3
R CH2 C
OH
Br
O
OH
+H
R CH2 C
Br
бромангидрид
+
Br
- H+
O
+
R CH C
+
H3PO4
.
....
Br
.
.
...
..Br.. ..OH
O
R CH C
R CH C
R CH C
HBr
протониBr
Br енолиBr
H
Br
рование
зация
енол бромангидрида
O
Br
+
R CH2 C
O
R CH2 C
OH
O
+
Br
R CH C
OH
Br
-бромзамещенная
я
карбоновая кислота
13
14.
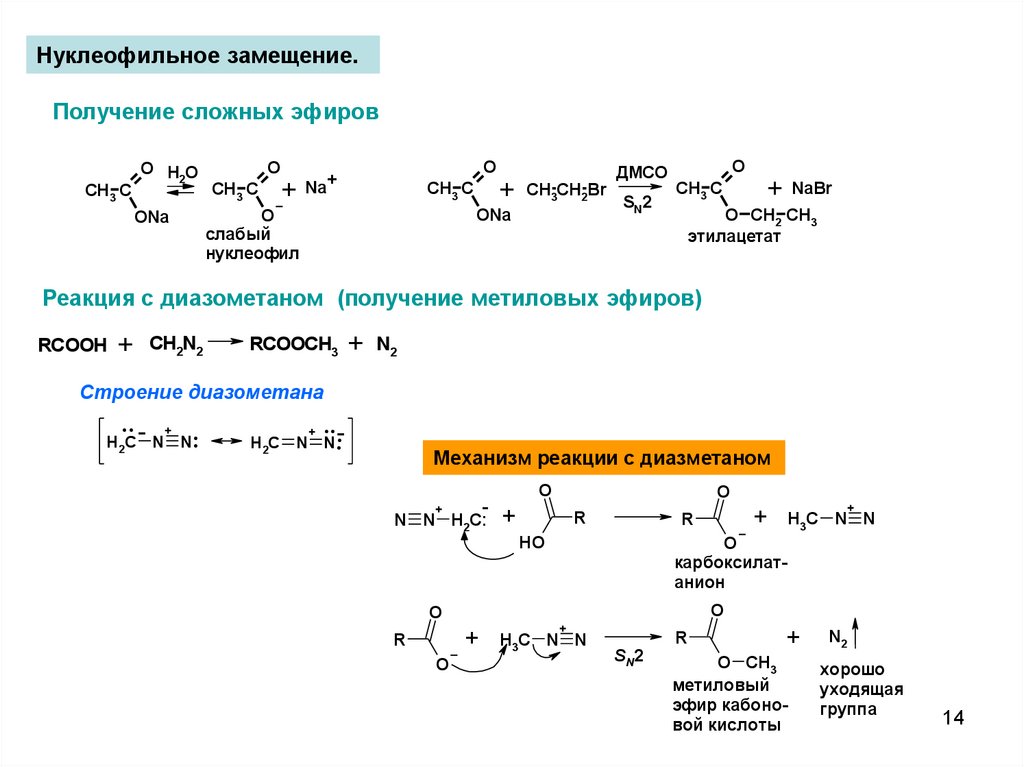
Нуклеофильное замещение.Получение сложных эфиров
O HO
2
CH3 C
ONa
O
CH3 C
+
O
Na+
CH3 C
+
CH3CH2Br
ONa
O
слабый
нуклеофил
ДМСО
SN2
O
CH3 C
+ NaBr
O CH2 CH3
этилацетат
Реакция с диазометаном (получение метиловых эфиров)
RCOOH
+
CH2N2
RCOOCH3
+
N2
Строение диазометана
..
H2C N N ..
+
..
H2C N N ..
+
Механизм реакции с диазметаном
N N H2C:
+
O
O
+
R
HO
O
+
O
H3C N N
O
карбоксилатанион
O
R
+
+
R
+
H3C N N
SN 2
R
+
O CH3
метиловый
эфир кабоновой кислоты
N2
хорошо
уходящая
группа
14
15.
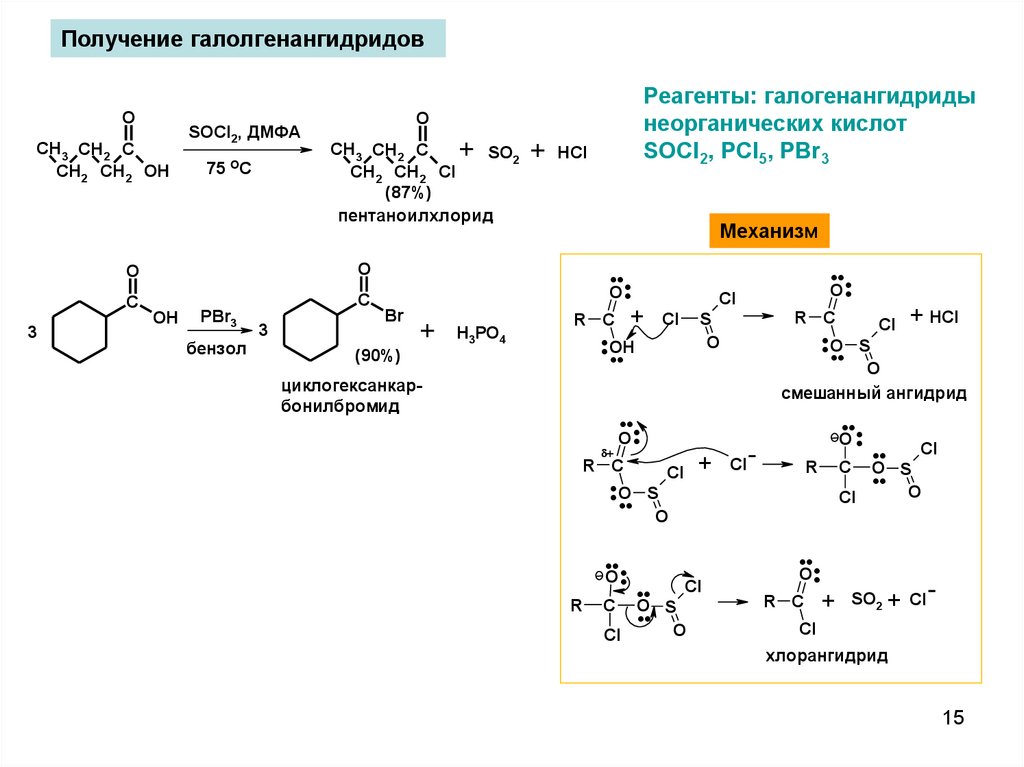
Получение галолгенангидридовO
CH3 CH2 C
CH2 CH2 OH
SOCl2, ДМФА
75 ОС
C
3
O
+
CH3 CH2 C
SO2
CH2 CH2 Cl
(87%)
пентаноилхлорид
+
HCl
Механизм
..O ..
O
O
OH
PBr3
бензол
C
3
Реагенты: галогенангидриды
неорганических кислот
SOCl2, PCl5, PBr3
Br
(90%)
+
H3PO4
Cl
+
R C
Cl
..OH
..
циклогексанкарбонилбромид
..O..
Cl
Cl
+
....
..
C O
..
R
Cl
S
O
Cl
S
O
+ HCl
S
O
смешанный ангидрид
O
..O ..
..
C O
..
Cl
R C
..O..
...
O.
R C
R
S
O
..O ..
Cl
..O.
.
R C
+
Cl
S
O
SO2 + Cl
Cl
хлорангидрид
15
16.
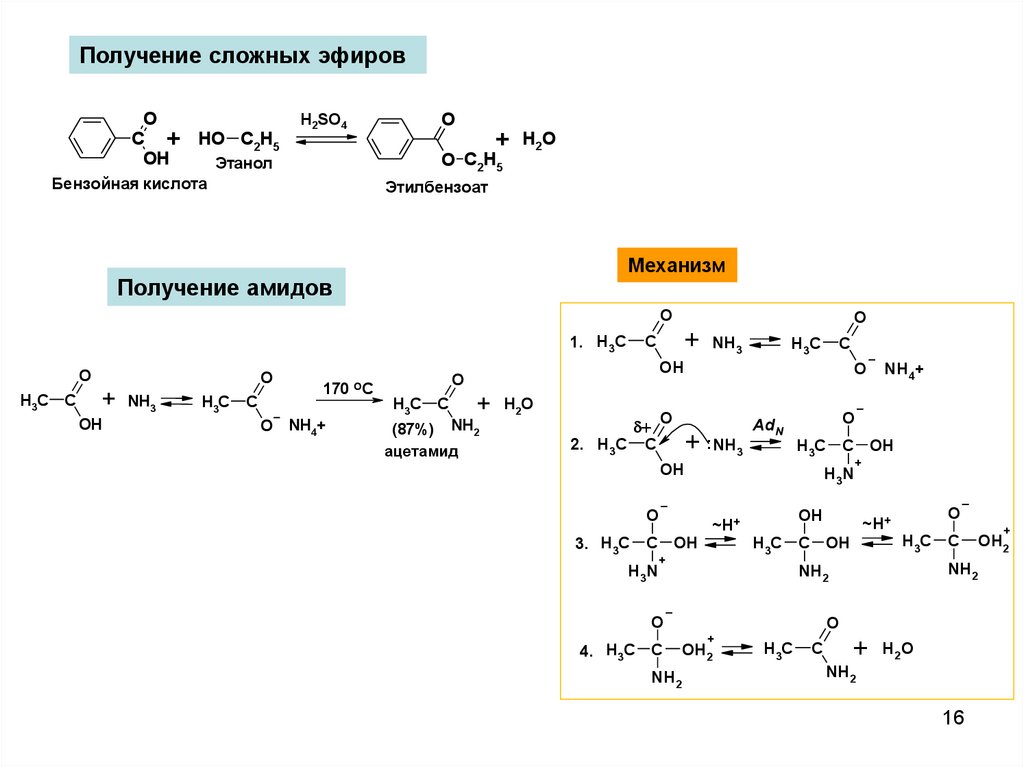
Получение сложных эфировO
C + HO C2H5
OH
Этанол
O
H2SO4
+
O C2H5
Бензойная кислота
H 2O
Этилбензоат
Механизм
Получение амидов
O
1. H3C
O
H3C
C
+
OH
O
NH3
H3C
C
O
170
NH4+
OC
+
C
C
+
NH2
(87%)
ацетамид
NH3
C
H3C
OH
O
H3C
O
H2 O
O
O
2. H3C C
+ :NH3
AdN
O
H3C C OH
OH
O
3. H3C C OH
H3N
H3N
~H+
+
NH2
+
OH
~H+
H3C C OH
O
H3C C
NH2
NH2
O
4. H3C C
NH4+
O
+
OH2
H3C
C
+
NH2
H2O
16
+
OH2
17.
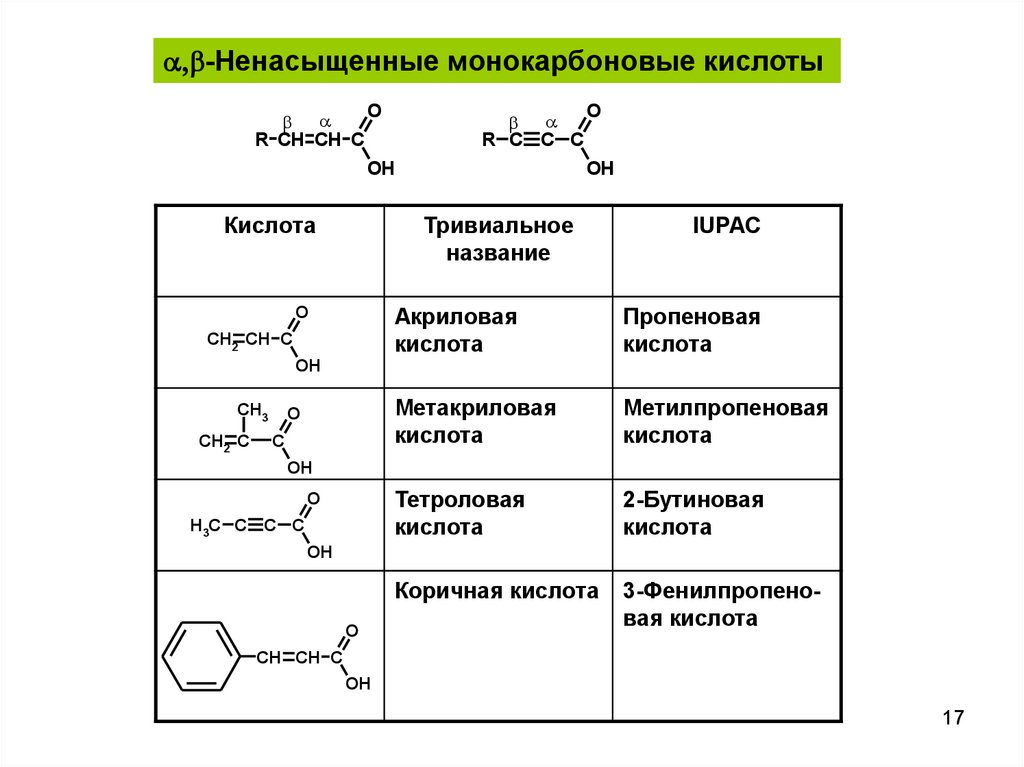
,b-Ненасыщенные монокарбоновые кислотыb
R CH CH C
O
b
R C C C
OH
Кислота
CH2 CH C
OH
CH2 C
OH
Тривиальное
название
O
CH3
O
O
C
IUPAC
Акриловая
кислота
Пропеновая
кислота
Метакриловая
кислота
Метилпропеновая
кислота
Тетроловая
кислота
2-Бутиновая
кислота
Коричная кислота
3-Фенилпропеновая кислота
OH
O
H3C C
C C
OH
O
CH CH C
OH
17
18.
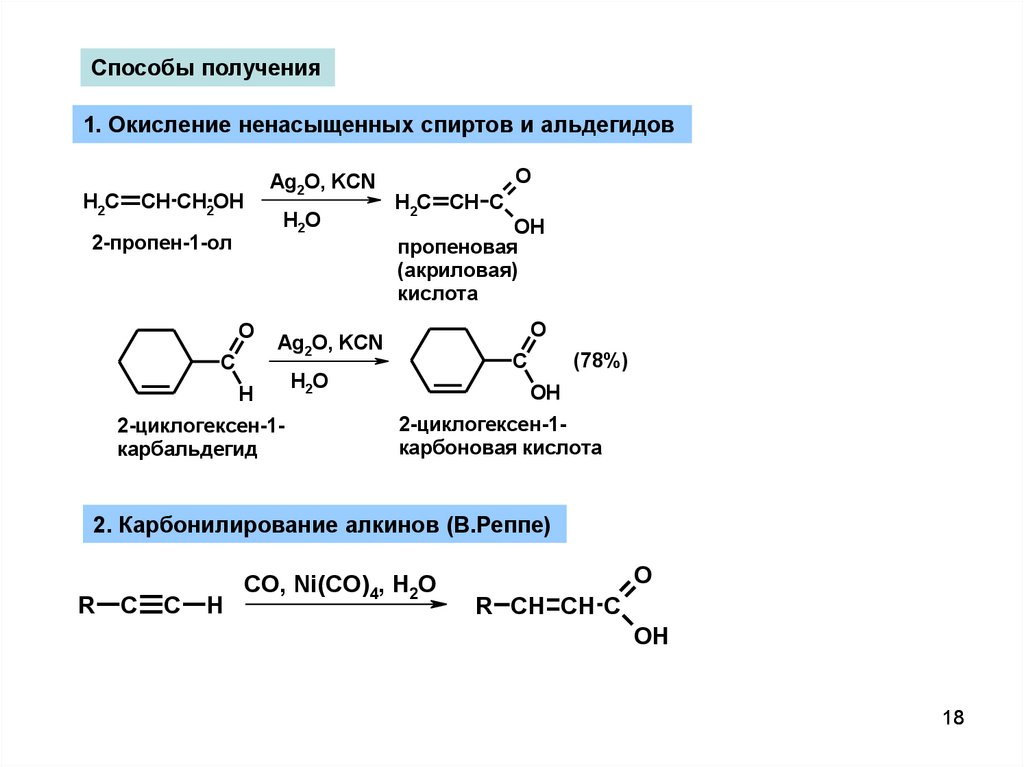
Способы получения1. Окисление ненасыщенных спиртов и альдегидов
H2C
Ag2O, KCN
CH CH2OH
H2O
2-пропен-1-ол
O
C
O
H2C CH C
OH
пропеновая
(акриловая)
кислота
O
Ag2O, KCN
H
2-циклогексен-1карбальдегид
(78%)
C
H2O
OH
2-циклогексен-1карбоновая кислота
2. Карбонилирование алкинов (В.Реппе)
R
C
C
H
CO, Ni(CO)4, H2O
O
R CH CH C
OH
18
19.
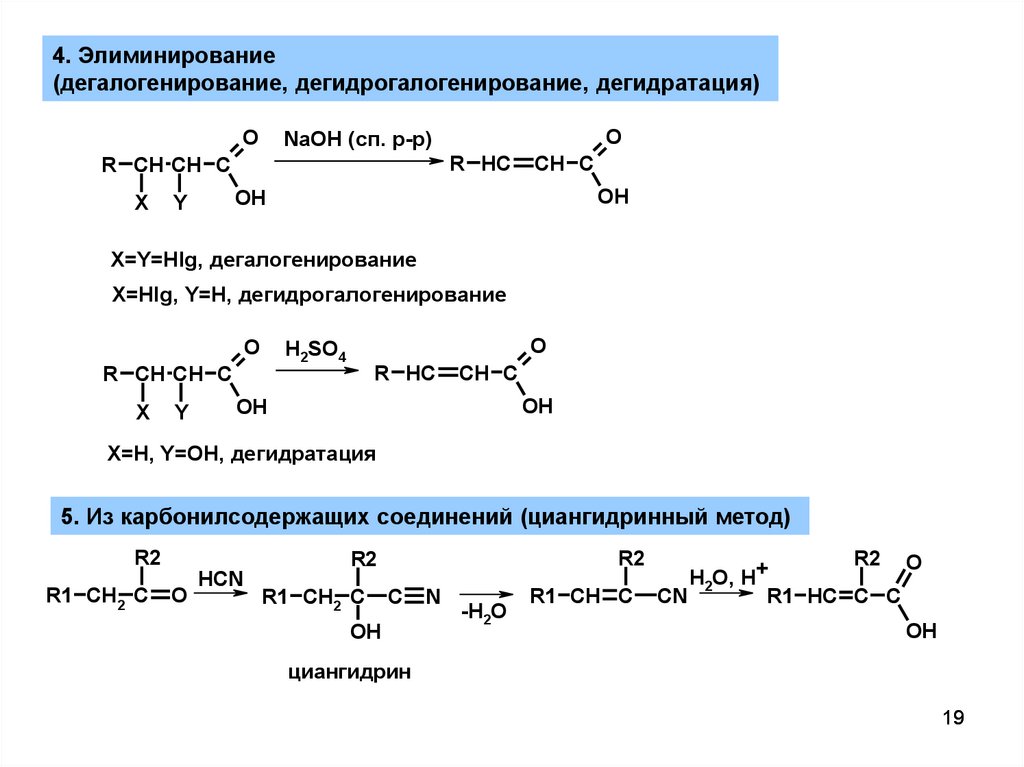
4. Элиминирование(дегалогенирование, дегидрогалогенирование, дегидратация)
O
R HC
R CH CH C
X
O
NaOH (сп. р-р)
CH C
OH
OH
Y
X=Y=Hlg, дегалогенирование
X=Hlg, Y=H, дегидрогалогенирование
O
R CH CH C
X
Y
O
H2SO4
R HC
CH C
OH
OH
X=H, Y=OH, дегидратация
5. Из карбонилсодержащих соединений (циангидринный метод)
R2
R1 CH2 C
O
HCN
R2
R2
R1 CH2 C
C
OH
N
-H2O
R1 CH C
R2 O
H2O, H+
CN
R1 HC C C
OH
циангидрин
19
20.
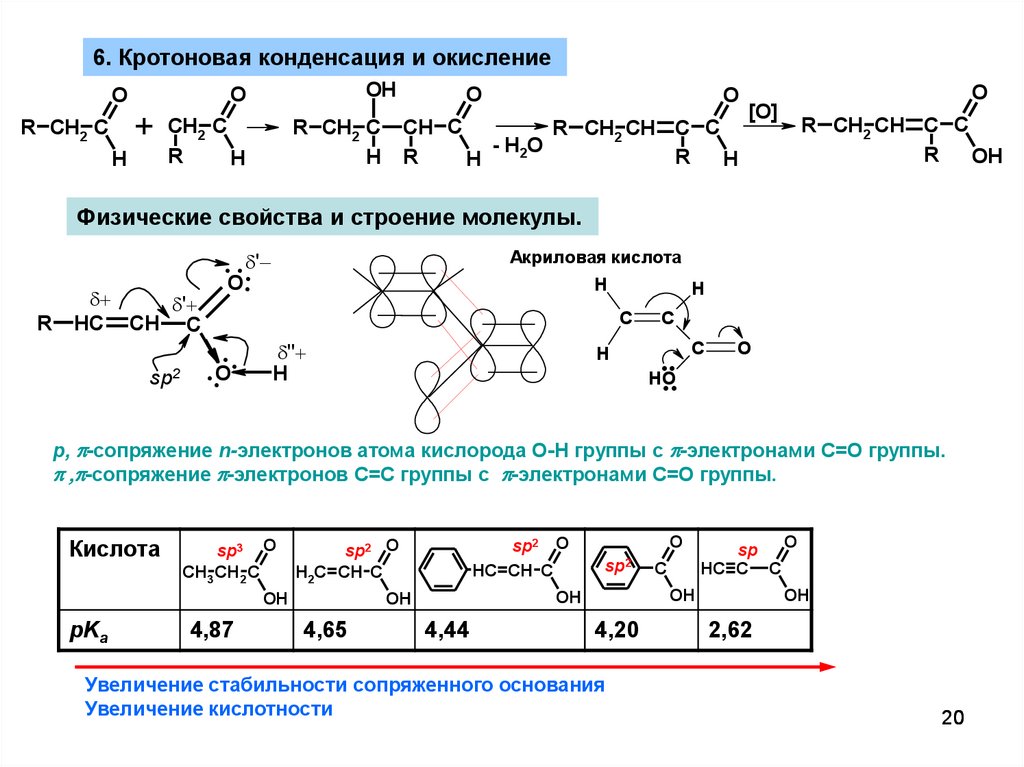
6. Кротоновая конденсация и окисление+
R CH2 C
OH
O
O
H
CH2 C
R
H
O
O
CH C
R CH2 CH C C
- H2O
R
R
H
H
R CH2 C
H
O
[O]
R CH2 CH C C
R
OH
Физические свойства и строение молекулы.
R
'
HC CH C
sp2
.O... '
..O..
Акриловая кислота
H
H
C
''
H
H
C
..
HO
..
C
O
p, p-сопряжение n-электронов атома кислорода O-H группы с p-электронами C=O группы.
p ,p-сопряжение p-электронов C=C группы c p-электронами C=O группы.
Кислота
sp3 O
CH3 CH2 C
4,87
4,65
O
sp2
4,44
C
O
sp
HC C C
OH
OH
OH
OH
pKa
sp2 O
HC CH C
sp2 O
H2C CH C
4,20
Увеличение стабильности сопряженного основания
Увеличение кислотности
OH
2,62
20
21.
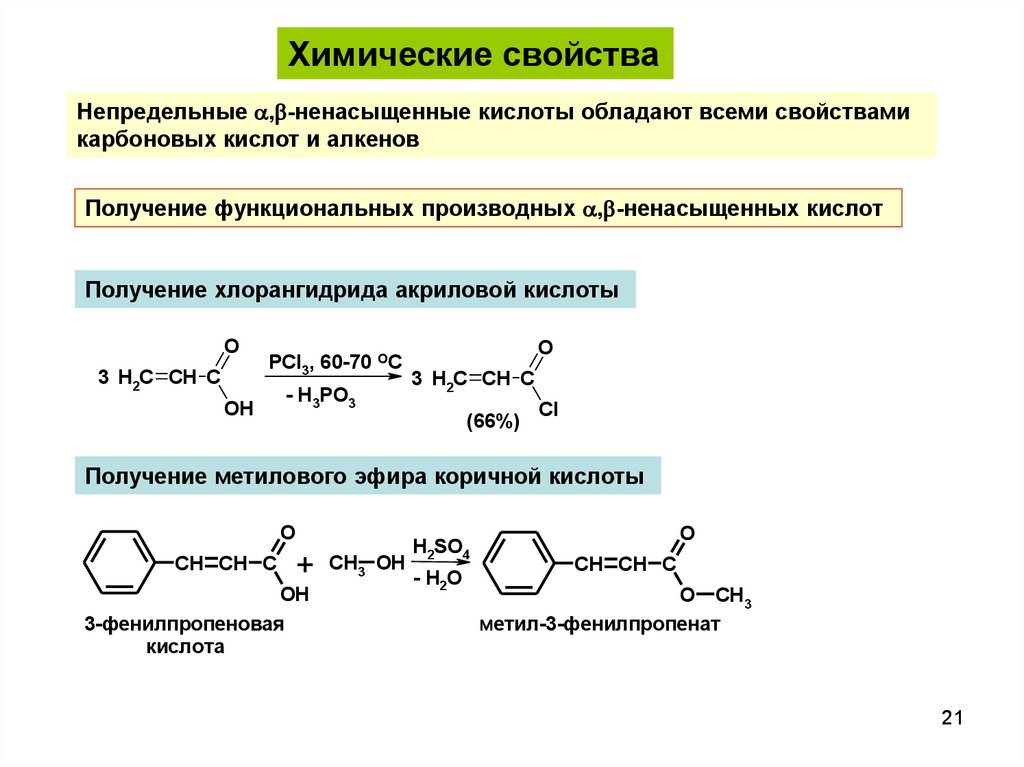
Химические свойстваНепредельные ,b-ненасыщенные кислоты обладают всеми свойствами
карбоновых кислот и алкенов
Получение функциональных производных ,b-ненасыщенных кислот
Получение хлорангидрида акриловой кислоты
O
3 H2C CH C
PCl3, 60-70 OС
OH
- H3PO3
O
3 H2C CH C
(66%)
Cl
Получение метилового эфира коричной кислоты
O
CH CH C
+
OH
3-фенилпропеновая
кислота
CH3 OH
H2SO4
- H2O
O
CH CH C
O CH3
метил-3-фенилпропенат
21
22.
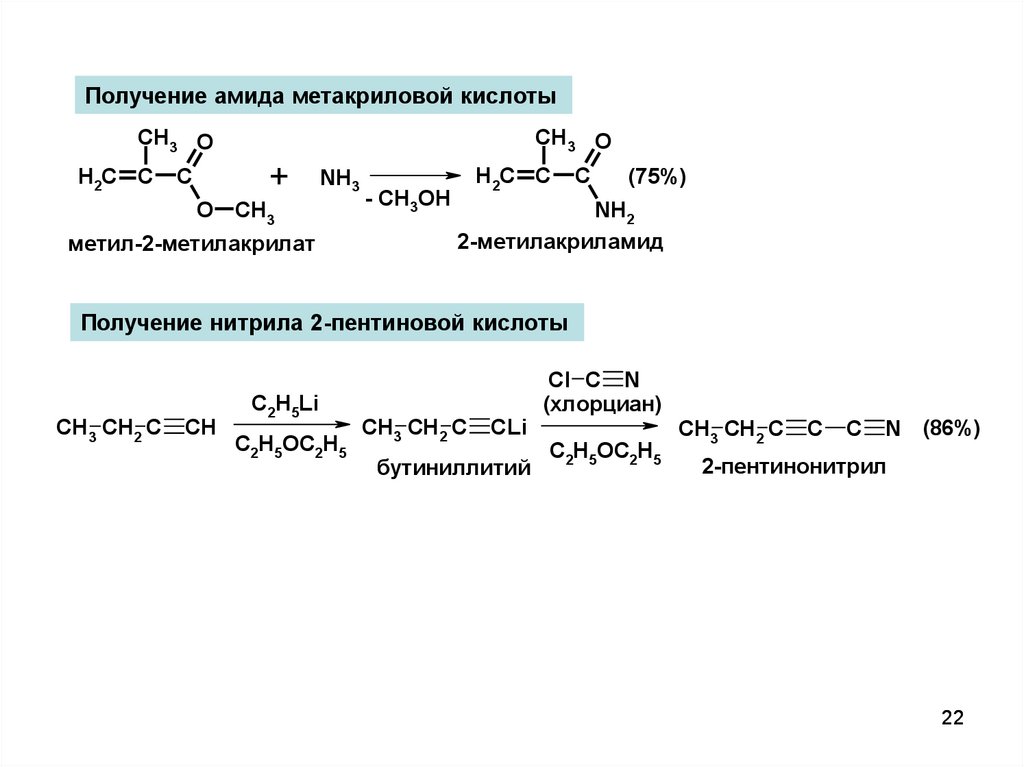
Получение амида метакриловой кислотыCH3 O
CH3 O
H2C C
+
C
NH3
O CH3
метил-2-метилакрилат
- CH3OH
H2C C
C
(75%)
NH2
2-метилакриламид
Получение нитрила 2-пентиновой кислоты
CH3 CH2 C
CH
C2H5Li
C2H5OC2H5
CH3 CH2 C
CLi
бутиниллитий
Cl C N
(хлорциан)
C2H5OC2H5
CH3 CH2 C
C
C
N (86%)
2-пентинонитрил
22
23.
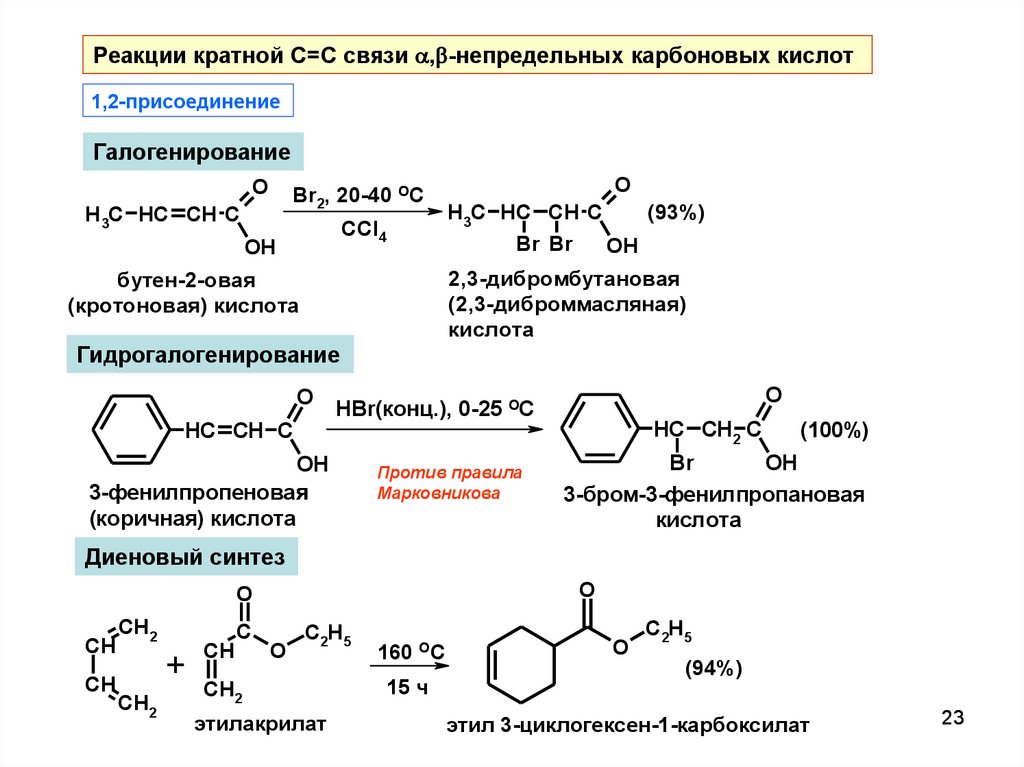
Реакции кратной C=C связи ,b-непредельных карбоновых кислот1,2-присоединение
Галогенирование
O
Br2, 20-40 OC
H3C HC CH C
CCl4
OH
O
H3C HC CH C
(93%)
Br Br
OH
2,3-дибромбутановая
(2,3-диброммасляная)
кислота
бутен-2-овая
(кротоновая) кислота
Гидрогалогенирование
O
HC CH C
O
HBr(конц.), 0-25 ОС
OH
3-фенилпропеновая
я
(коричная) кислота
Против правила
Марковникова
HC CH2 C
(100%)
OH
Br
3-бром-3-фенилпропановая
кислота
Диеновый синтез
O
O
CH
CH
CH2
+
CH2
CH
C
O
C2H5
CH2
этилакрилат
160
OC
15 ч
O
C2H5
(94%)
этил 3-циклогексен-1-карбоксилат
23
24.
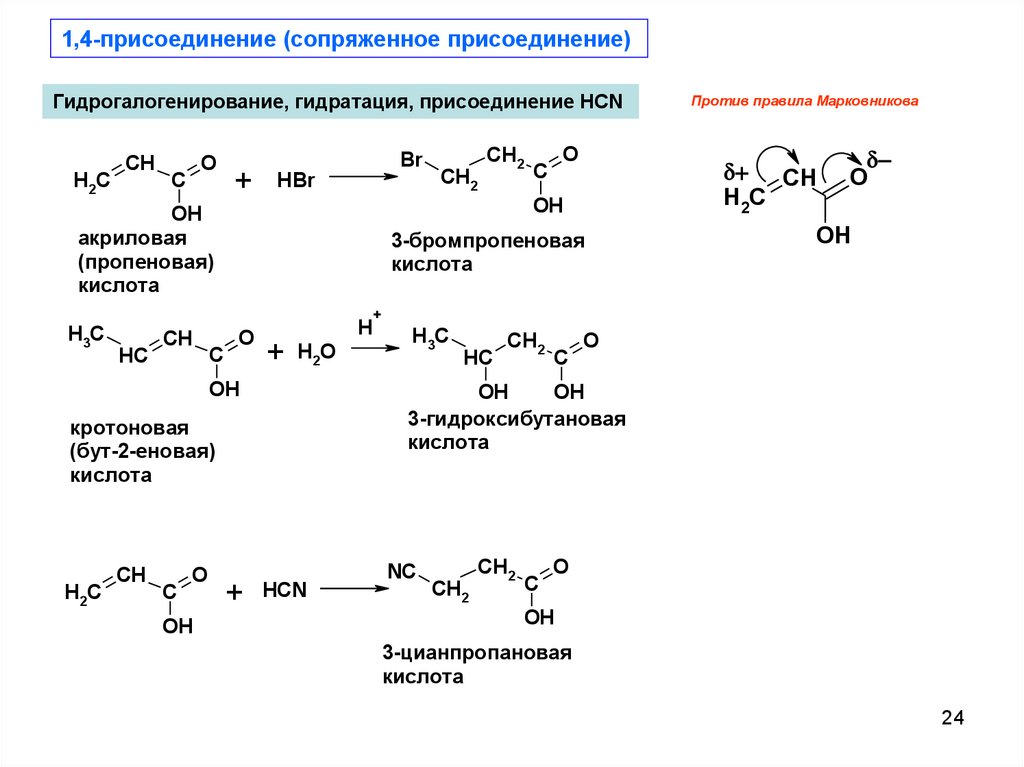
1,4-присоединение (сопряженное присоединение)Гидрогалогенирование, гидратация, присоединение HCN
H2C
CH
O
C
+
Br
HBr
HC
CH
C
O
+
H
H2O
H2C
C
OH
+
O
OH
+
H3C
HC
CH2
C
O
OH
OH
3-гидроксибутановая
кислота
кротоновая
(бут-2-еновая)
кислота
O
CH
H2C
3-бромпропеновая
кислота
OH
CH
O
C
OH
OH
акриловая
я
(пропеновая)
кислота
H3C
CH2
CH2
Против правила Марковникова
HCN
NC
CH2
CH2
C
O
OH
3-цианпропановая
кислота
24
25.
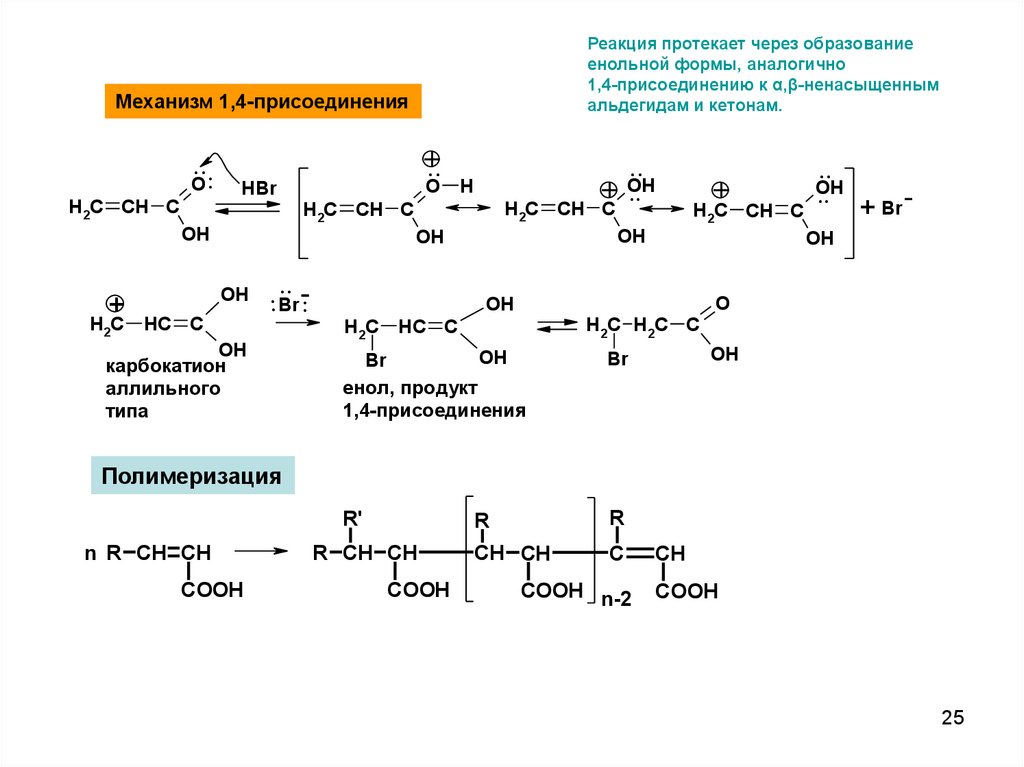
Реакция протекает через образованиеенольной формы, аналогично
1,4-присоединению к α,β-ненасыщенным
альдегидам и кетонам.
Механизм 1,4-присоединения
...
O.
H2C CH C
HBr
OH
+
H2C
+. .
O
+
H
H2C CH C
H2C CH C
HC C
..
.. Br ..
OH
карбокатион
аллильного
типа
..
OH
..
+ Br
OH
O
OH
H2C
+
H2C CH C
OH
OH
OH
..
OH
..
H2C H2C C
HC C
OH
Br
енол, продукт
1,4-присоединения
OH
Br
Полимеризация
R'
n R CH CH
COOH
R CH CH
COOH
R
R
CH CH
C
COOH n-2
CH
COOH
25
26.
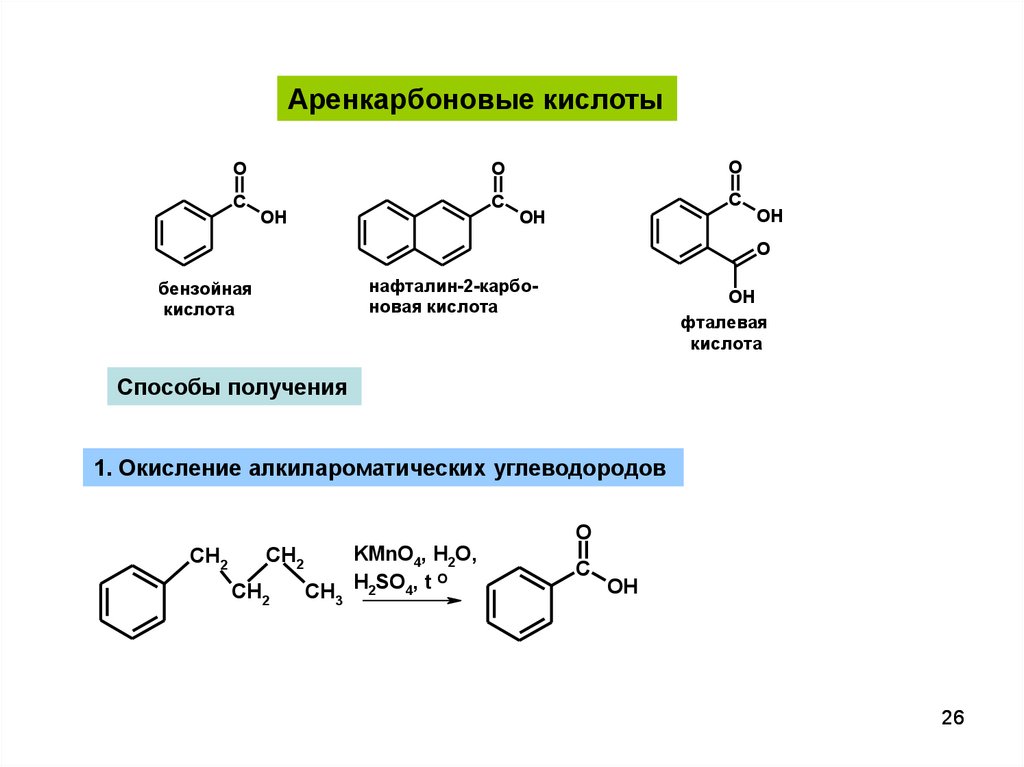
Аренкарбоновые кислотыC
O
O
O
C
OH
C
OH
OH
O
нафталин-2-карбоновая кислота
бензойная
кислота
OH
фталевая
кислота
Способы получения
1. Окисление алкилароматических углеводородов
CH2
CH2
CH2
KMnO4, H2O,
O
CH3 H2SO4, t
O
C
OH
26
27.
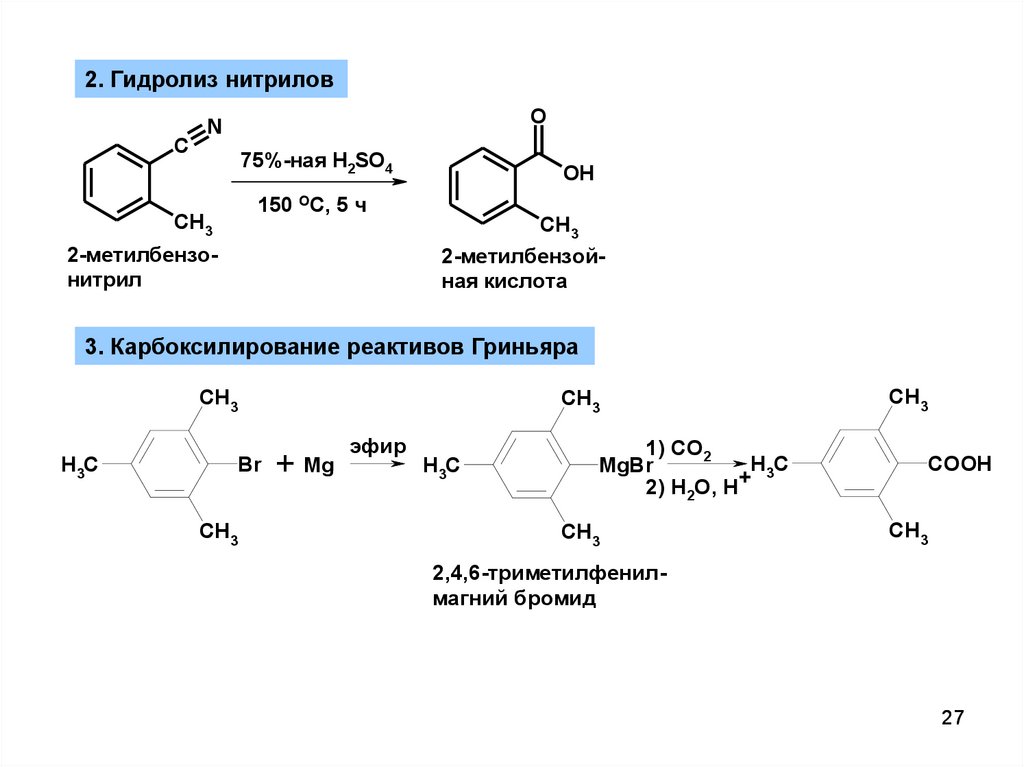
2. Гидролиз нитриловC
O
N
75%-ная H2SO4
OH
150 OC, 5 ч
CH3
2-метилбензонитрил
CH3
2-метилбензойная кислота
3. Карбоксилирование реактивов Гриньяра
CH3
H3C
Br
CH3
CH3
+ Mg
эфир
H3C
1) CO2
H3C
MgBr
+
2) H2O, H
CH3
CH3
COOH
CH3
2,4,6-триметилфенилмагний бромид
27
28.
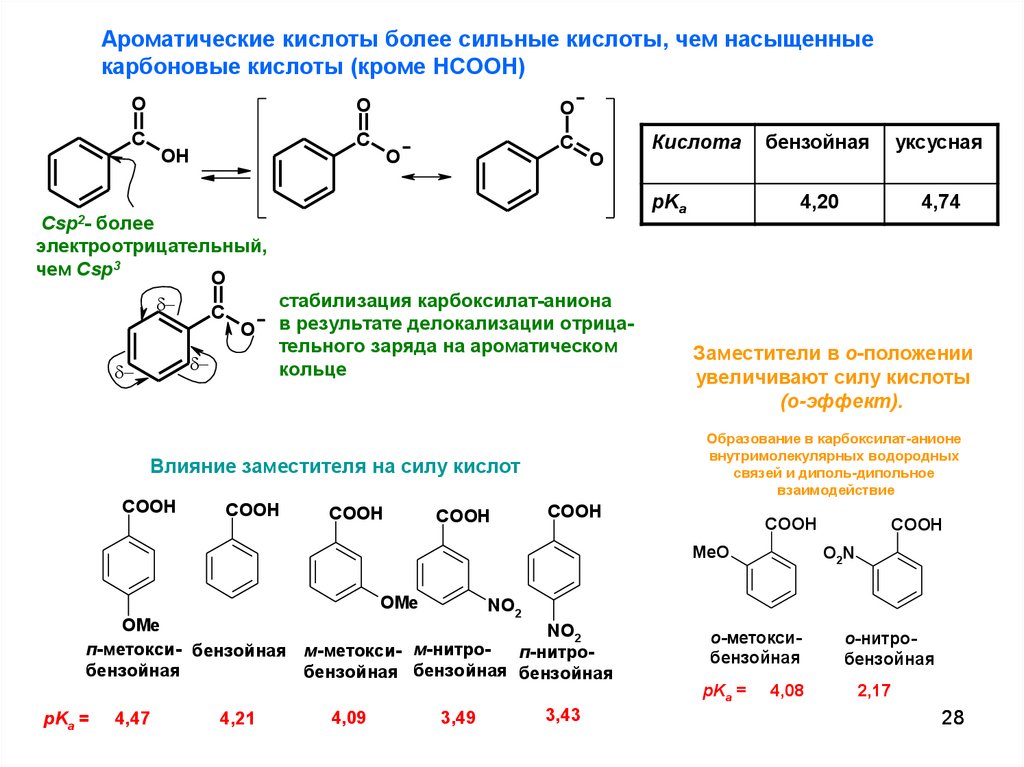
Ароматические кислоты более сильные кислоты, чем насыщенныекарбоновые кислоты (кроме HCOOH)
O
O
C
O
C
OH
C
O
O
pKa
Сsp2-
более
электроотрицательный,
чем Сsp3
O
C
O
стабилизация карбоксилат-аниона
в результате делокализации отрицательного заряда на ароматическом
кольце
COOH
COOH
COOH
бензойная
уксусная
4,20
4,74
Заместители в о-положении
увеличивают силу кислоты
(о-эффект).
Образование в карбоксилат-анионе
внутримолекулярных водородных
связей и диполь-дипольное
взаимодействие
Влияние заместителя на силу кислот
COOH
Кислота
COOH
COOH
MeO
COOH
O2N
OMe
NO2
OMe
NO2
п-метокси- бензойная м-метокси- м-нитроп-нитробензойная
бензойная
бензойная
бензойная
о-метоксибензойная
pKa =
pKa =
4,47
4,21
4,09
3,49
3,43
4,08
о-нитробензойная
2,17
28
29.
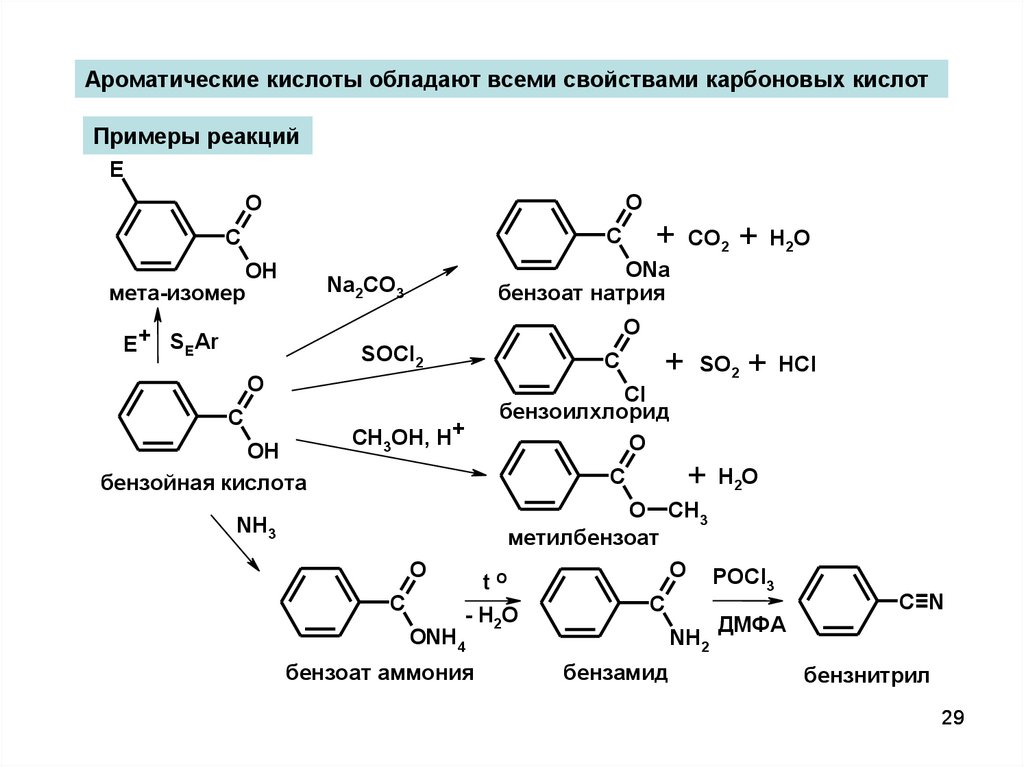
Ароматические кислоты обладают всеми свойствами карбоновых кислотПримеры реакций
E
O
C
OH
мета-изомер
O
+
C
CO2
+
H2O
ONa
бензоат натрия
Na2CO3
O
E+ SEAr
SOCl2
C
O
C
OH
бензойная кислота
CH3OH, H+
+
SO2
Cl
бензоилхлорид
O
+
C
+
HCl
H2O
O CH3
метилбензоат
NH3
O
C
tO
- H2O
O
C
ONH4
бензоат аммония
NH2
бензамид
POCl3
ДМФА
С N
бензнитрил
29
30.
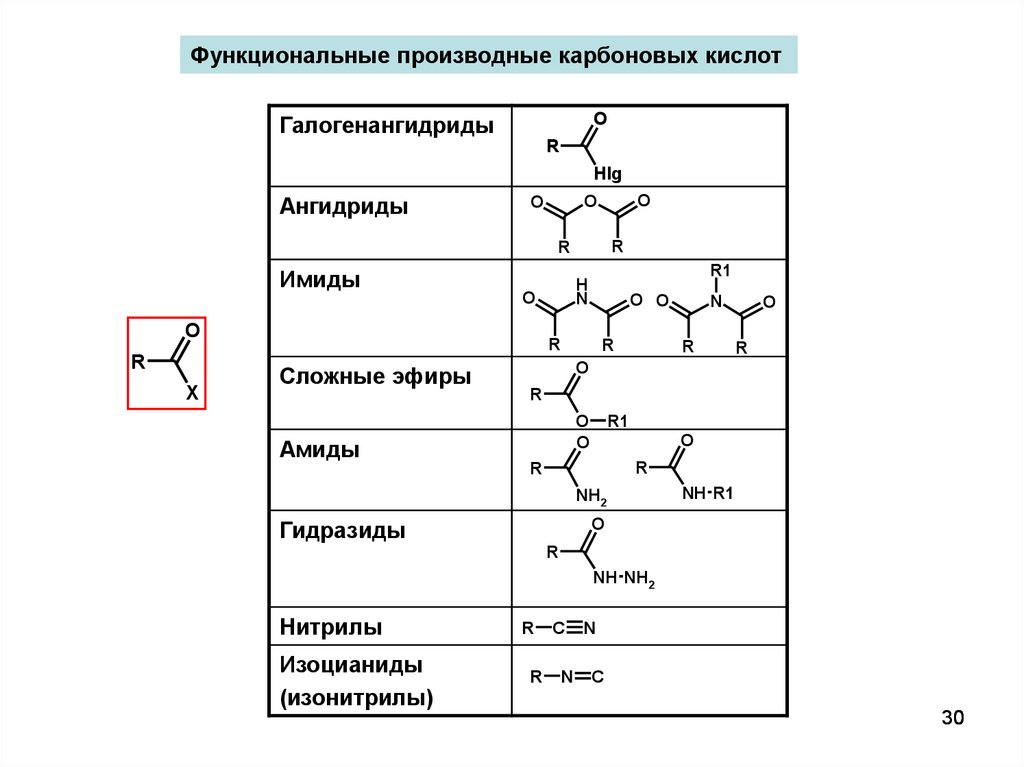
Функциональные производные карбоновых кислотO
Галогенангидриды
R
Hlg
Ангидриды
O
O
O
R
R
Имиды
O
O
R
X
R1
H
N
O O
R
Сложные эфиры
Амиды
R
N
R
O
R
O
R
O
O
R1
O
R
R
NH2
NH R1
O
Гидразиды
R
NH NH2
Нитрилы
Изоцианиды
(изонитрилы)
R
R
C
N
N
C
30
31.
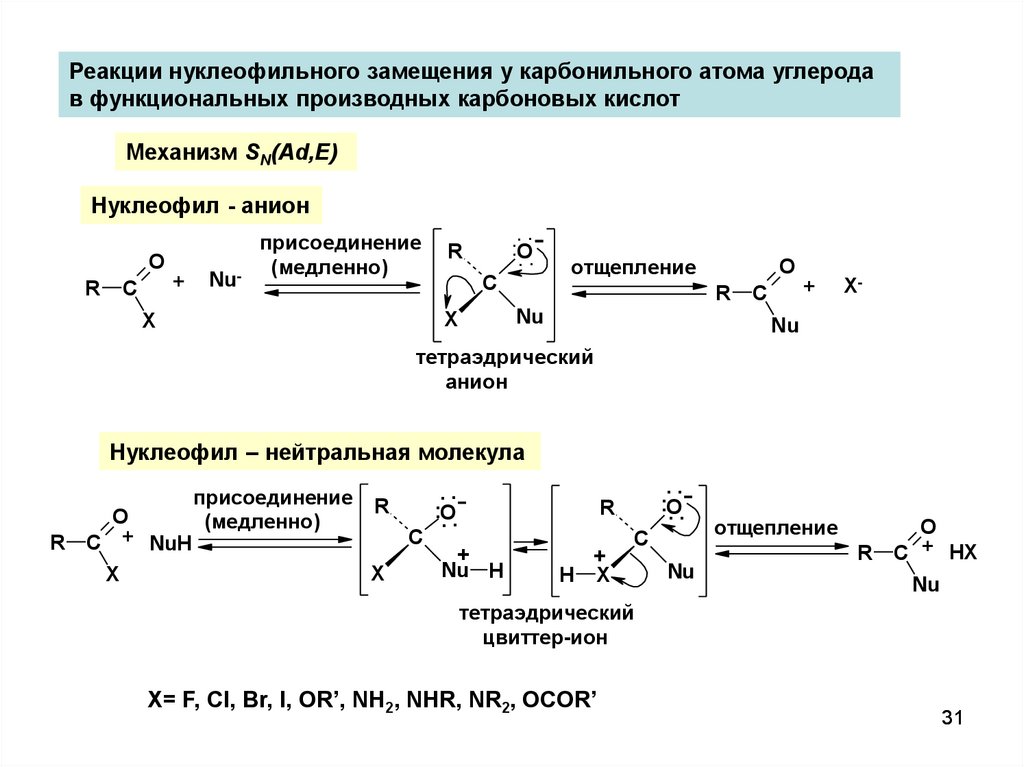
Реакции нуклеофильного замещения у карбонильного атома углеродав функциональных производных карбоновых кислот
Механизм SN(Ad,E)
Нуклеофил - анион
O
R
C
+
Nu-
присоединение
(медленно)
... .
O
..
R
C
R
Nu
X
X
O
отщепление
C
+
X-
Nu
тетраэдрический
анион
Нуклеофил – нейтральная молекула
R
O
C + NuH
X
присоединение
(медленно)
R
C
X
....
O
..
+
Nu H
....
O
..
R
+
H X
C
Nu
отщепление
R
O
C + HX
Nu
тетраэдрический
цвиттер-ион
X= F, Cl, Br, I, OR’, NH2, NHR, NR2, OCOR’
31
32.
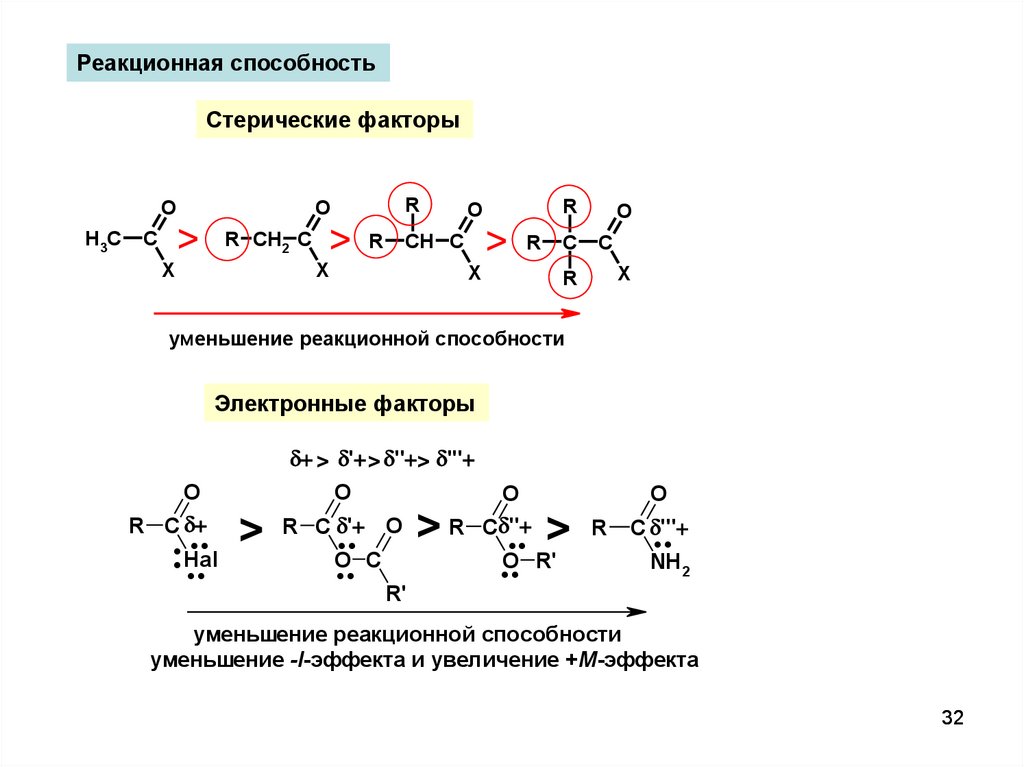
Реакционная способностьСтерические факторы
O
H3C
C
X
>
R
O
R CH2 C
>
R
O
CH C
X
X
R
>
R
C
O
C
X
R
уменьшение реакционной способности
Электронные факторы
O
R C
.. >
..Hal
..
> ' > '' > '''
O
>
..
O C
..
R C ' O
R'
O
R C ''
.. R'>
..O
O
R
..
C '''
NH2
уменьшение реакционной способности
уменьшение -I-эффекта и увеличение +M-эффекта
32
33.
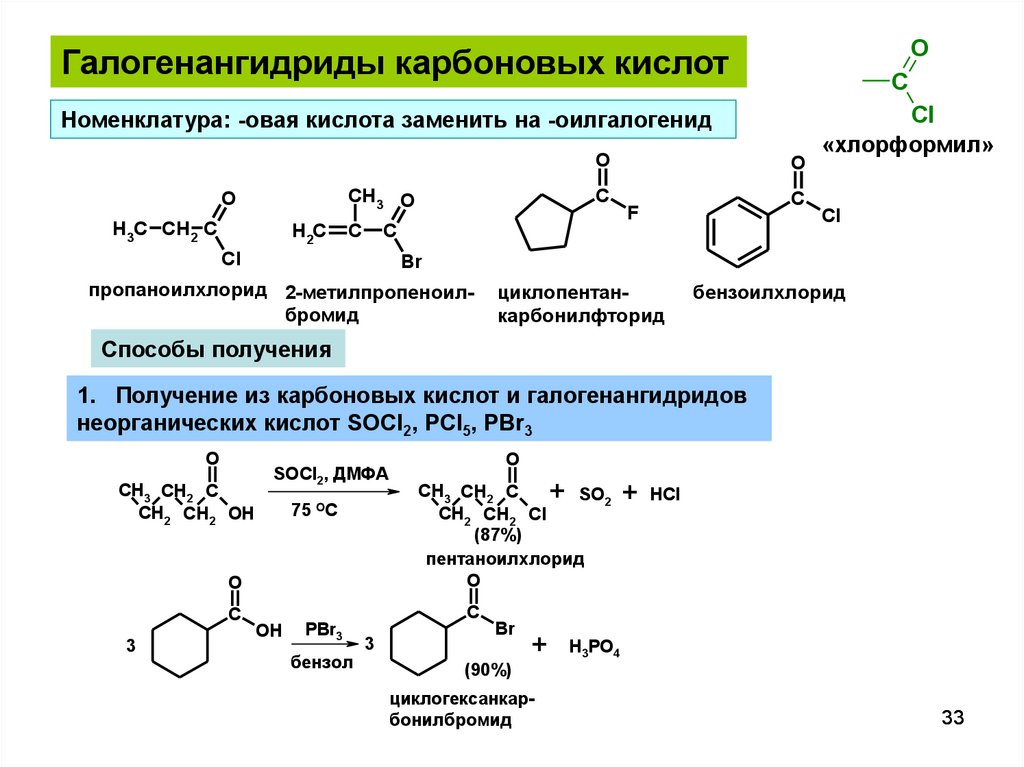
OГалогенангидриды карбоновых кислот
C
Номенклатура: -овая кислота заменить на -оилгалогенид
O
C
CH3 O
O
H3C CH2 C
H2C
C
C
Cl
O
C
F
Cl
«хлорформил»
Cl
Br
пропаноилхлорид 2-метилпропеноилбромид
циклопентанкарбонилфторид
бензоилхлорид
Способы получения
1. Получение из карбоновых кислот и галогенангидридов
неорганических кислот SOCl2, PCl5, PBr3
O
CH3 CH2 C
CH2 CH2 OH
SOCl2, ДМФА
75 ОС
O
C
3
OH
PBr3
бензол
O
+
CH3 CH2 C
SO2
CH2 CH2 Cl
(87%)
пентаноилхлорид
O
C
3
Br
(90%)
+
циклогексанкарбонилбромид
+
HCl
H3PO4
33
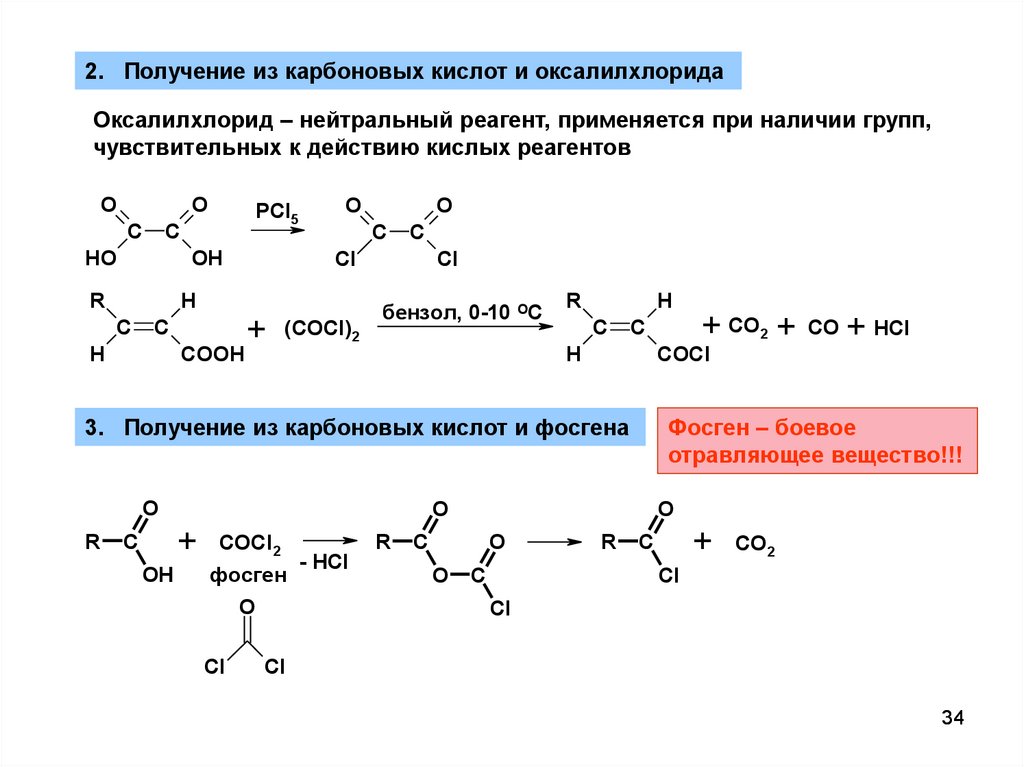
34.
2. Получение из карбоновых кислот и оксалилхлоридаОксалилхлорид – нейтральный реагент, применяется при наличии групп,
чувствительных к действию кислых реагентов
O
O
C
PCl5
C
HO
OH
R
C
COOH
H
C
C
Cl
H
C
O
O
+
(COCl)2
Cl
бензол, 0-10 ОС
R
H
C
C
COCl
H
3. Получение из карбоновых кислот и фосгена
O
R
OH
COCl2
фосген
R
O
C
O
O
+ HCl
C
R
+
C
CO2
Cl
Cl
O
Cl
- HCl
CO
Фосген – боевое
отравляющее вещество!!!
O
+
C
+ CO2 +
Cl
34
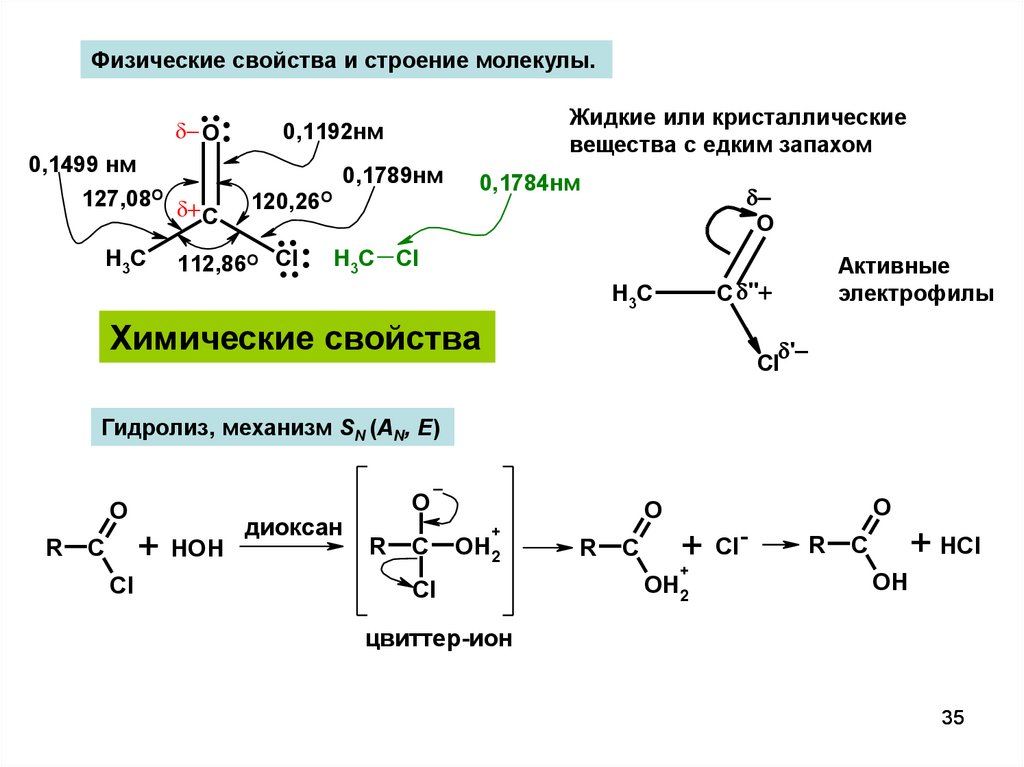
35.
Физические свойства и строение молекулы.....
O
0,1499 нм
127,08O
H3C
Жидкие или кристаллические
вещества с едким запахом
0,1192нм
0,1789нм
C
120,26O
112,86O
..Cl..
..
0,1784нм
O
H3C Cl
Активные
электрофилы
C ''
H3C
Химические свойства
'
Cl
Гидролиз, механизм SN (AN, E)
O
R
+
C
Cl
HOH
диоксан
O
R
C
+
OH2
Cl
O
R
C
O
Cl+
+
OH2
R
+ HCl
C
OH
цвиттер-ион
35
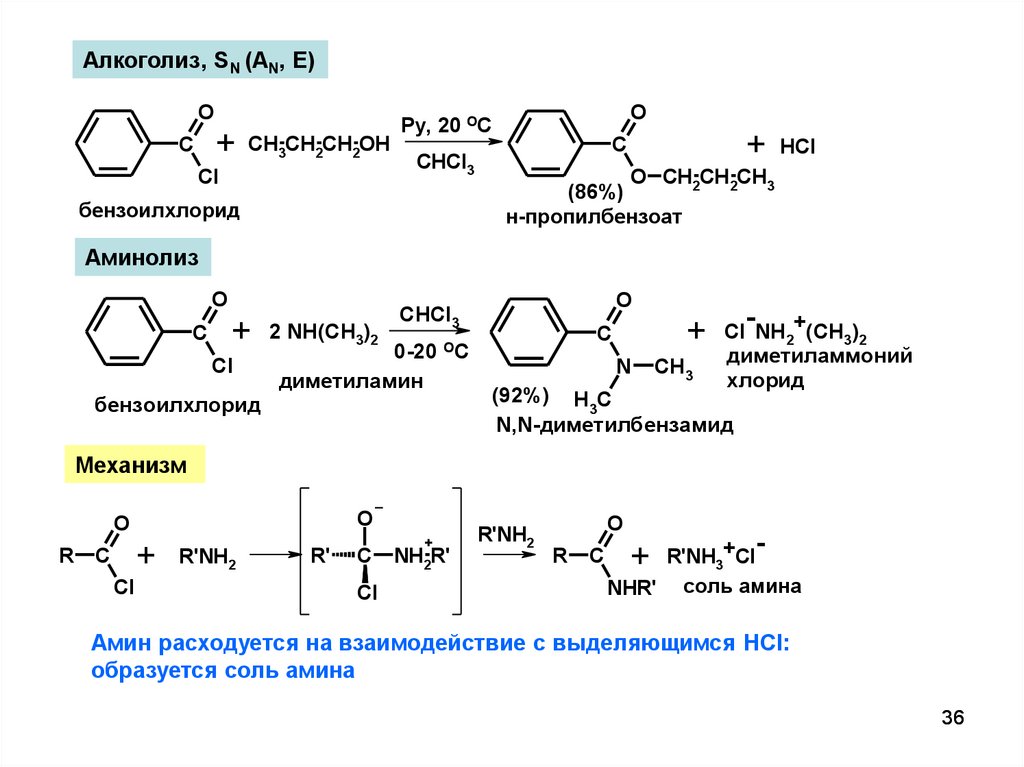
36.
Алкоголиз, SN (AN, E)O
+
C
CH3CH2CH2OH
Cl
O
Py, 20 OC
CHCl3
бензоилхлорид
+
C
HCl
O CH2CH2CH3
(86%)
н-пропилбензоат
Аминолиз
O
C
+
Cl
2 NH(CH3)2
O
CHCl3
0-20 OC
диметиламин
бензоилхлорид
C
N
+
CH3
-
Cl NH2+(CH3)2
диметиламмоний
хлорид
(92%) H C
3
N,N-диметилбензамид
Механизм
O
O
R
+
C
Cl
R'NH2
R'
C
Cl
+
NH2R'
R'NH2
O
R
C
-
R'NH3+Cl
NHR' соль амина
+
Амин расходуется на взаимодействие с выделяющимся HCl:
образуется соль амина
36
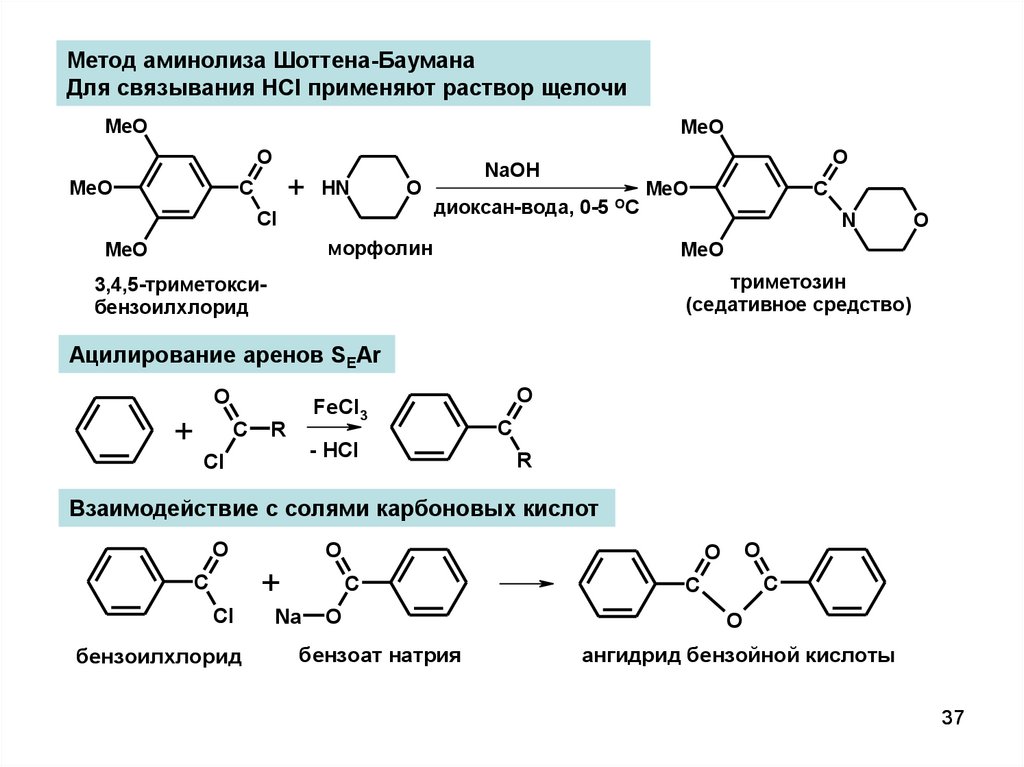
37.
Метод аминолиза Шоттена-БауманаДля связывания HCl применяют раствор щелочи
MeO
MeO
O
MeO
+
C
HN
O
Cl
O
NaOH
диоксан-вода, 0-5 ОС
морфолин
MeO
MeO
C
N
O
MeO
триметозин
(седативное средство)
3,4,5-триметоксибензоилхлорид
Ацилирование аренов SEAr
O
+
C
FeCl3
R
- HCl
Cl
O
C
R
Взаимодействие с солями карбоновых кислот
O
O
+
C
Cl
бензоилхлорид
C
Na
O
O
O
бензоат натрия
C
C
O
ангидрид бензойной кислоты
37
38.
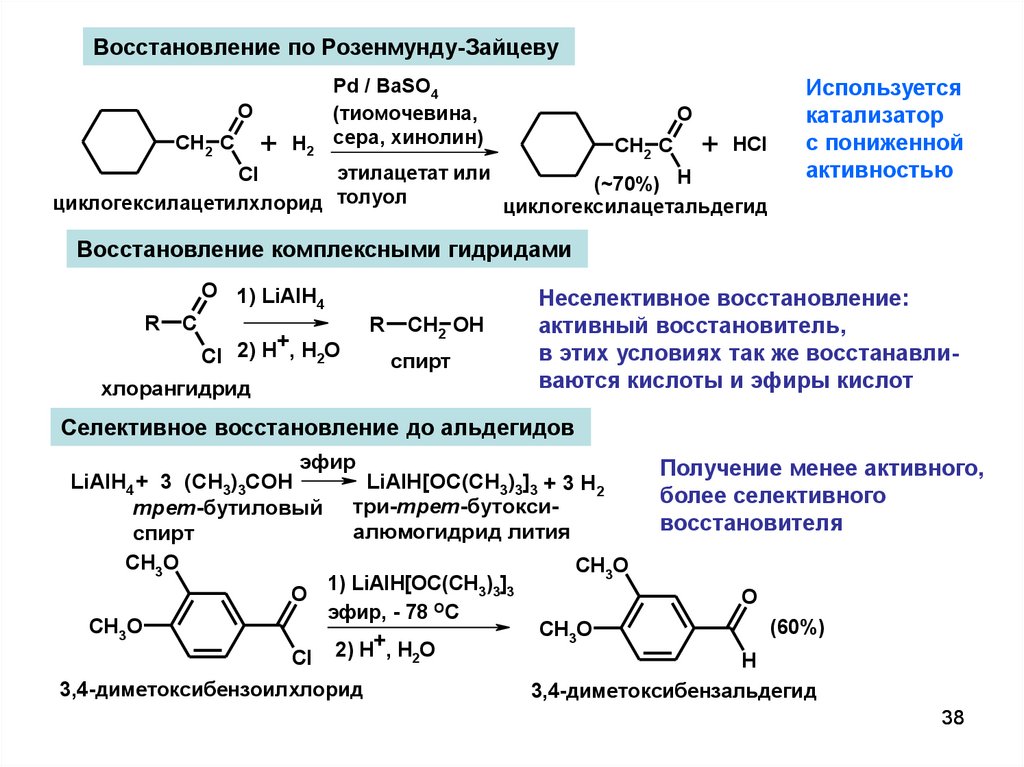
Восстановление по Розенмунду-ЗайцевуO
CH2 C
+
H2
Pd / BaSO4
(тиомочевина,
сера, хинолин)
O
CH2 C
+
HCl
этилацетат или
Cl
(~70%) H
циклогексилацетилхлорид толуол
циклогексилацетальдегид
Используется
катализатор
с пониженной
активностью
Восстановление комплексными гидридами
R
C
O 1) LiAlH
4
+
Cl 2) H , H2O
хлорангидрид
R
CH2 OH
спирт
Неселективное восстановление:
активный восстановитель,
в этих условиях так же восстанавливаются кислоты и эфиры кислот
Селективное восстановление до альдегидов
эфир
Получение менее активного,
LiAlH[OC(CH3)3]3 + 3 H2
LiAlH4 + 3 (CH3)3COH
более селективного
трет-бутиловый три-трет-бутоксивосстановителя
алюмогидрид лития
спирт
CH3O
CH3O
1) LiAlH[OC(CH3)3]3
O
O
эфир, - 78 ОС
CH3O
(60%)
CH3O
+
Cl 2) H , H2O
H
3,4-диметоксибензоилхлорид
3,4-диметоксибензальдегид
38
39.
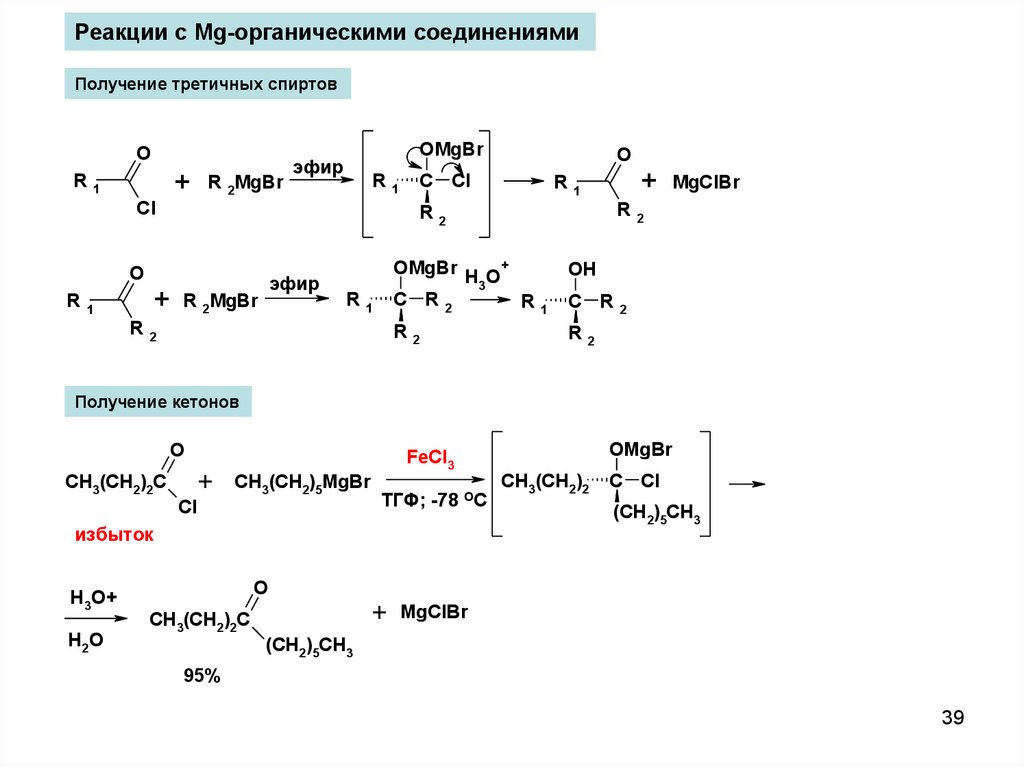
Реакции с Mg-органическими соединениямиПолучение третичных спиртов
O
+
R1
R 2MgBr
OMgBr
эфир
R1
Cl
C Cl
+
эфир
R 2MgBr
R1
R2
+
R1
MgClBr
R2
R2
O
R1
O
OMgBr H O+
3
C R2
R1
OH
R2
R2
C R2
Получение кетонов
O
+
CH3(CH2)2C
OMgBr
FeCl3
CH3(CH2)5MgBr
Cl
ТГФ; -78
ОС
избыток
H3O+
H2O
CH3(CH2)2
C Cl
(CH2)5CH3
O
+
CH3(CH2)2C
MgClBr
(CH2)5CH3
95%
39
40.
Ацилирование алкил-, арил-, алкенилкупратов литияСинтез несимметричных кетонов
CH3 O
H3C C C
CH Cl
3
хлорангидрид
диметипропановой кислоты
+
CH3 O
эфир, -78ОС
H3C C C
[((CH3)2(CH)2Cu]Li
CH3 HC CH3
изо-пропилкуп94%
CH3
рат лития
2,2,4-триметилпентанон-3
40
41.
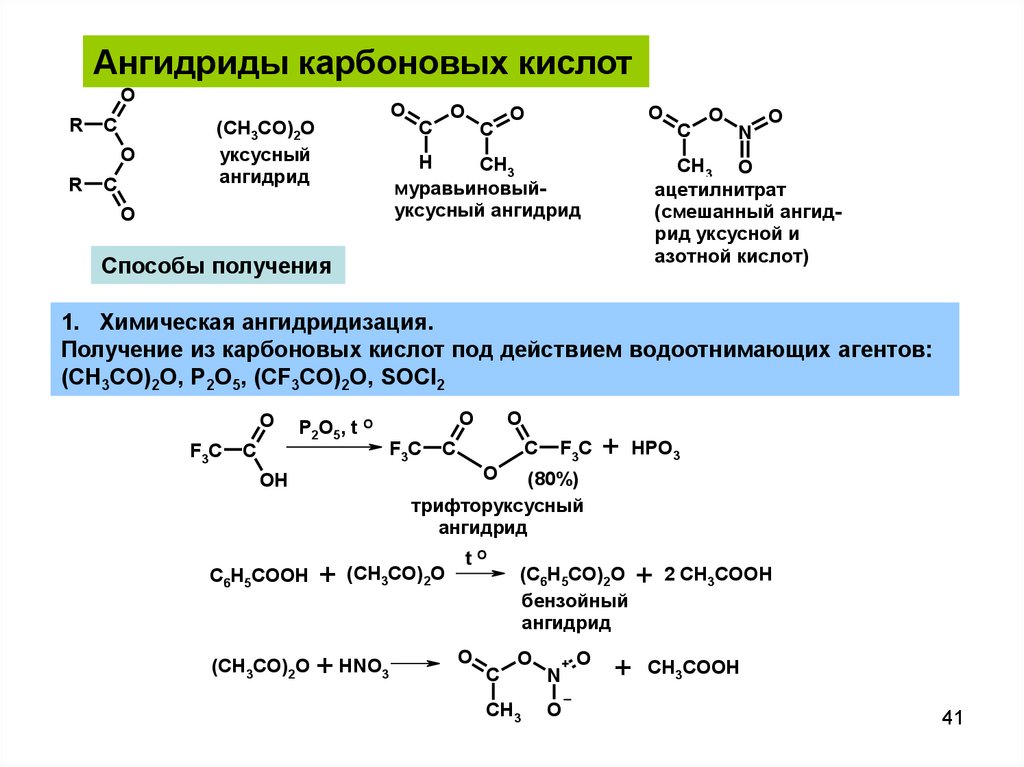
Ангидриды карбоновых кислотO
R
C
O
R
C
O
(CH3CO)2O
уксусный
ангидрид
O
C
C
O
O
H
CH3
муравьиновыйуксусный ангидрид
O
C
O
N
O
CH3 O
ацетилнитрат
(смешанный ангидрид уксусной и
азотной кислот)
Способы получения
1. Химическая ангидридизация.
Получение из карбоновых кислот под действием водоотнимающих агентов:
(CH3CO)2O, P2O5, (CF3CO)2O, SOCl2
O
F3C
C
P2O5, t O
O
O
F3C
C
C
O
F3C
+
HPO3
(80%)
трифторуксусный
ангидрид
OH
C6H5COOH
+
(CH3CO)2O
+ HNO3
(CH3CO)2O
tO
O
C
(C6H5CO)2O
бензойный
ангидрид
O
CH3
N
+
O
O
+
+
2 CH3COOH
CH3COOH
41
42.
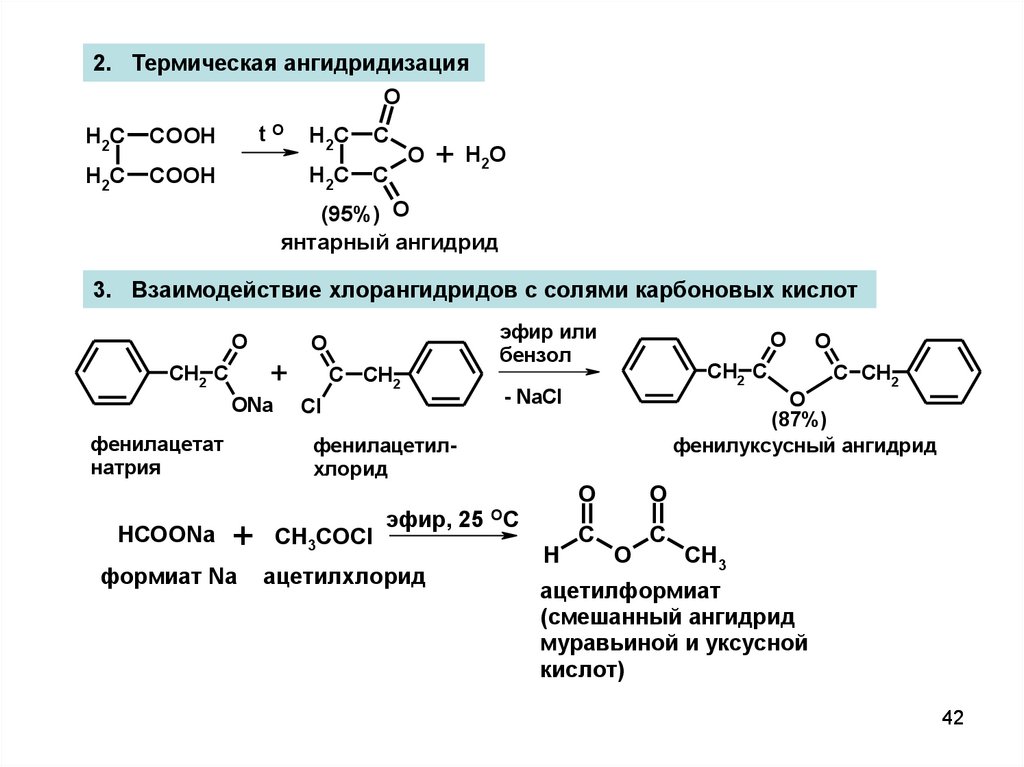
2. Термическая ангидридизацияO
H2C
СOOH
H2C
COOH
tO
H2C
C
H2C
C
O
+ H2O
(95%) O
янтарный ангидрид
3. Взаимодействие хлорангидридов с солями карбоновых кислот
O
+
CH2 C
ONa
фенилацетат
натрия
HCOONa
O
C CH2
Cl
эфир или
бензол
O
CH2 C
- NaCl
+
формиат Na
CH3COCl
эфир, 25
ацетилхлорид
O
O
H
C CH2
O
(87%)
фенилуксусный ангидрид
фенилацетилхлорид
ОС
O
C
O
C
CH3
ацетилформиат
(смешанный ангидрид
муравьиной и уксусной
кислот)
42
43.
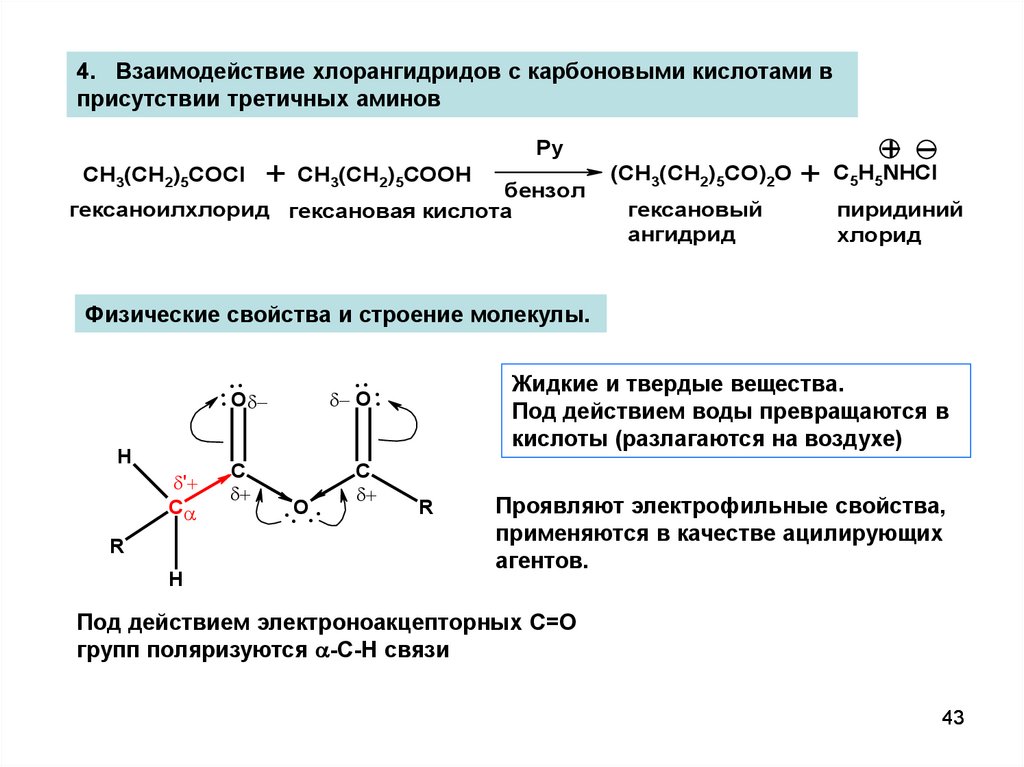
4. Взаимодействие хлорангидридов с карбоновыми кислотами вприсутствии третичных аминов
CH3(CH2)5COCl
+
Py
CH3(CH2)5COOH
бензол
гексаноилхлорид гексановая кислота
(CH3(CH2)5CO)2O
гексановый
ангидрид
+
+
C5H5NHCl
пиридиний
хлорид
Физические свойства и строение молекулы.
....
....O
H
'
C
R
H
C
Жидкие и твердые вещества.
Под действием воды превращаются в
кислоты (разлагаются на воздухе)
O
..O..
C
R
Проявляют электрофильные свойства,
применяются в качестве ацилирующих
агентов.
Под действием электроноакцепторных С=О
групп поляризуются -С-Н связи
43
44.
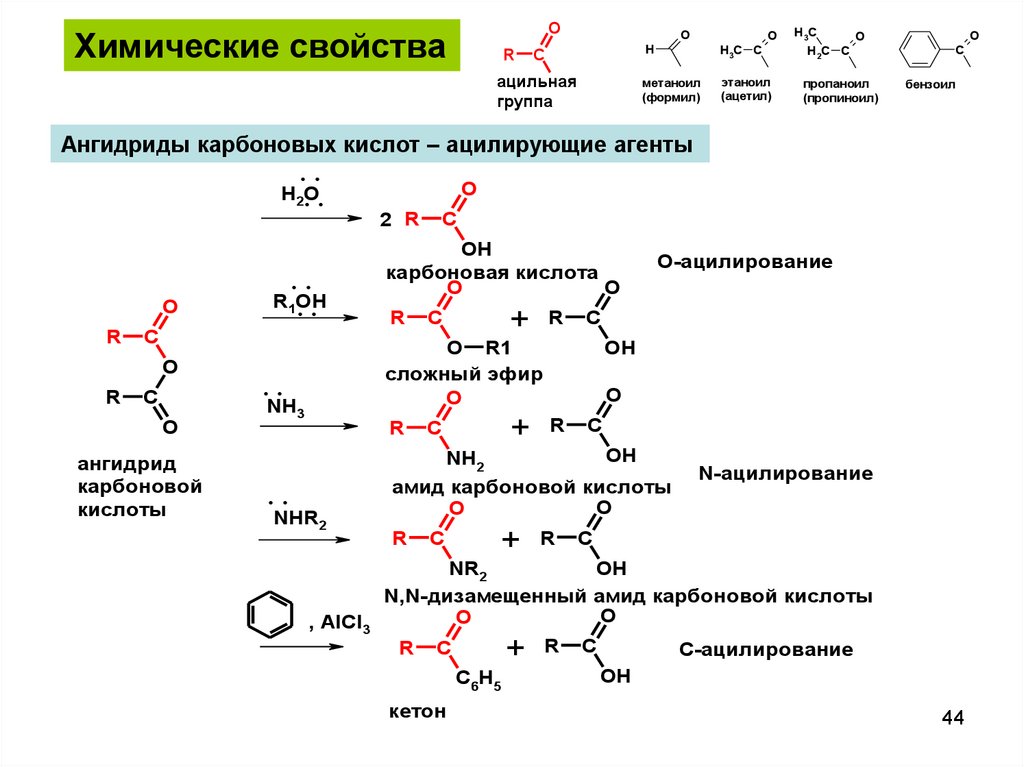
OХимические свойства
R
O
C
ацильная
группа
O
H
H3C C
метаноил
(формил)
этаноил
(ацетил)
H3C
O
H2C C
пропаноил
(пропиноил)
O
C
бензоил
Ангидриды карбоновых кислот – ацилирующие агенты
..
H ..
O
2
O
R
1
C
O
R
..
R ..
OH
C
O
ангидрид
карбоновой
кислоты
O
2 R
C
OH
карбоновая кислота
O
O
R
C
+
R
C
O R1
сложный эфир
O
..NH
3
R
..NHR
2
, AlCl3
C
+
О-ацилирование
OH
O
R
C
OH
NH2
амид карбоновой кислоты
O
O
R
C
+
R
N-ацилирование
C
OH
NR2
N,N-дизамещенный амид карбоновой кислоты
O
O
R C
R C
С-ацилирование
OH
C6H5
+
кетон
44
45.
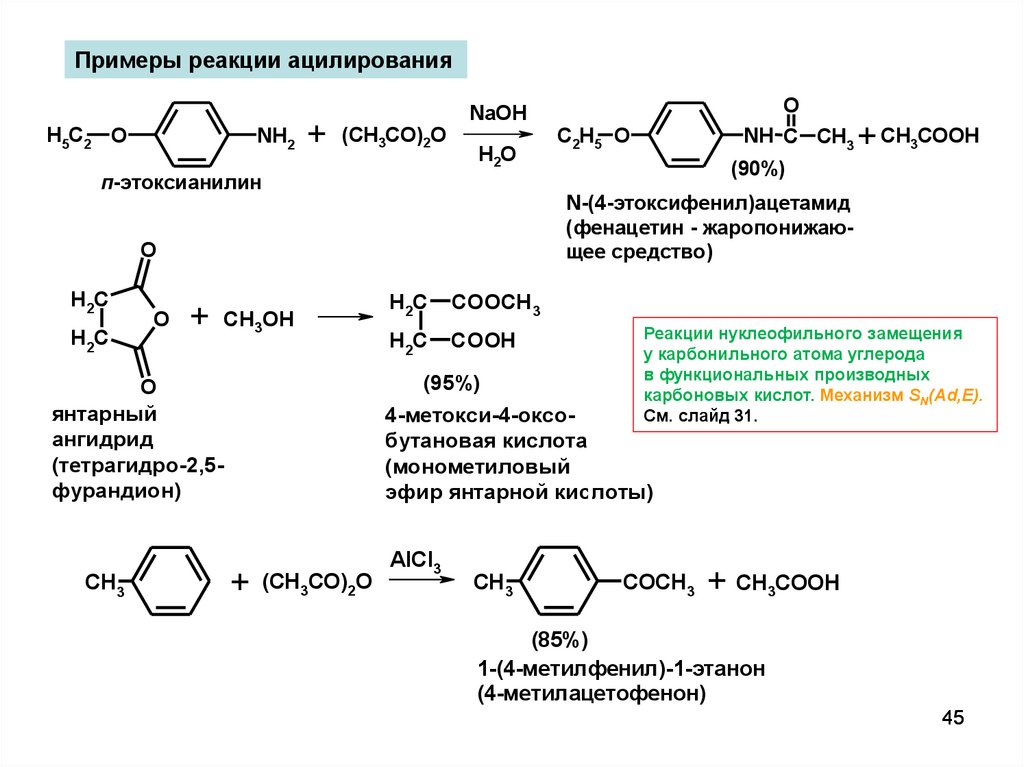
Примеры реакции ацилированияH5C2 O
NH2
+
(CH3CO)2O
NaOH
H2O
п-этоксианилин
H2C
O
+
CH3OH
CH3
H2C
COOCH3
H2C
COOH
(95%)
O
янтарный
ангидрид
(тетрагидро-2,5фурандион)
C2H5 O
NH C CH3
+ CH3COOH
(90%)
N-(4-этоксифенил)ацетамид
(фенацетин - жаропонижающее средство)
O
H2C
O
Реакции нуклеофильного замещения
у карбонильного атома углерода
в функциональных производных
карбоновых кислот. Механизм SN(Ad,E).
См. слайд 31.
4-метокси-4-оксобутановая кислота
(монометиловый
эфир янтарной кислоты)
+
(CH3CO)2O
AlCl3
CH3
COCH3
+ CH3COOH
(85%)
1-(4-метилфенил)-1-этанон
(4-метилацетофенон)
45
46.
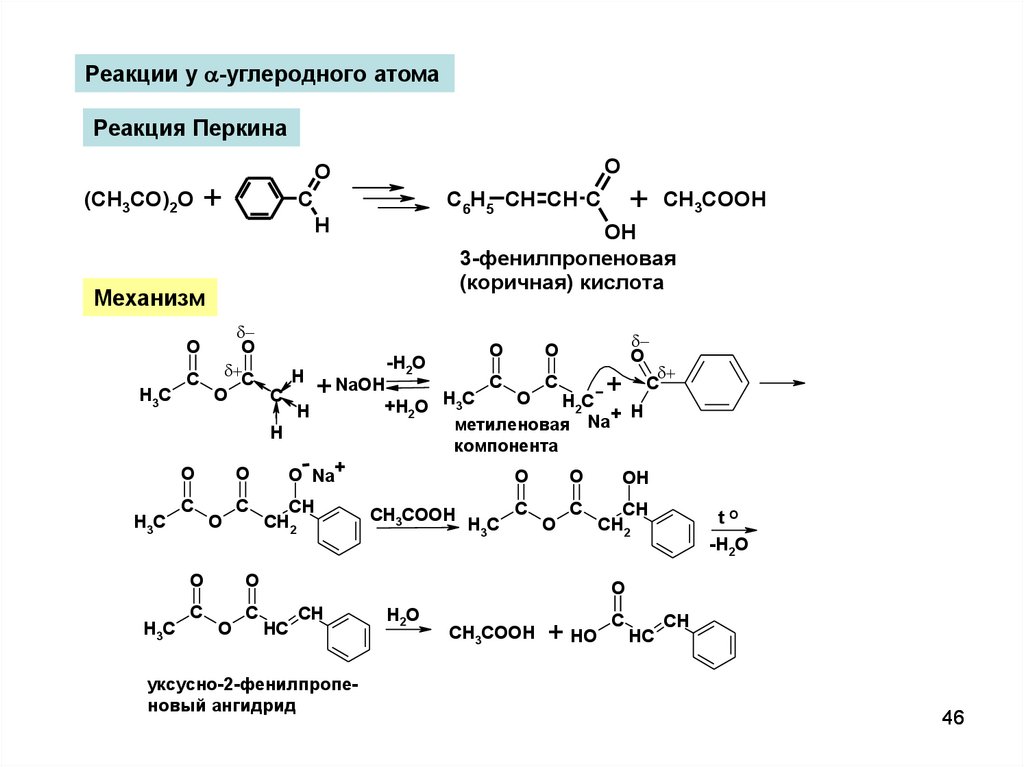
Реакции у -углеродного атомаРеакция Перкина
(CH3CO)2O
O
O
+
H
O
O
H3C
C
O
O
O
H3C
C
C
+ NaOH
-H2O
O
O
C
C
O
+
O
H2C
+H2O H3C
+ H
метиленовая Na
компонента
O Na+
CH
CH2
O
CH3COOH
H3C
C
O
C
C
O
OH
C
CH
CH2
O
O
CH3COOH
OH
3-фенилпропеновая
(коричная) кислота
Механизм
O
H
C
C
H3C
O
C
H
H
+
C6H5 CH CH C
C
tO
-H2O
O
HC
CH
уксусно-2-фенилпропеновый ангидрид
H2O
CH3COOH
+ HO
C
HC
CH
46
47.
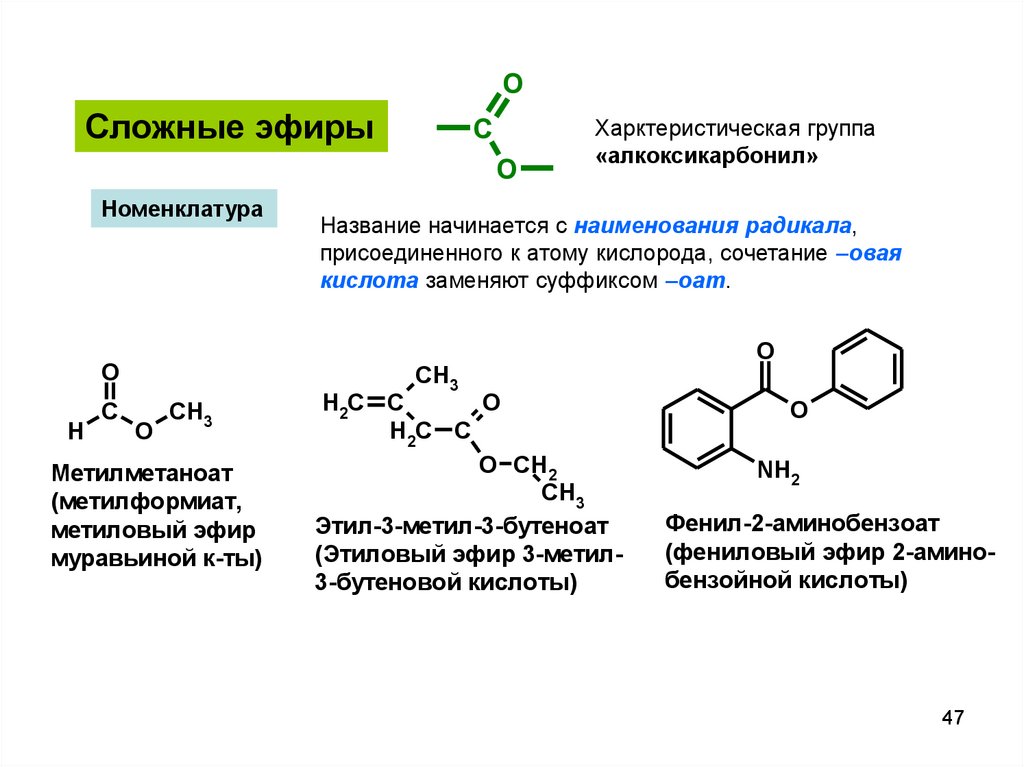
OСложные эфиры
C
O
Номенклатура
O
H
C
Название начинается с наименования радикала,
присоединенного к атому кислорода, сочетание –овая
кислота заменяют суффиксом –оат.
CH3
O
CH3
Метилметаноат
(метилформиат,
метиловый эфир
муравьиной к-ты)
Харктеристическая группа
«алкоксикарбонил»
O
H2C C
H2C C
O CH2
CH3
Этил-3-метил-3-бутеноат
(Этиловый эфир 3-метил3-бутеновой кислоты)
O
O
NH2
Фенил-2-аминобензоат
(фениловый эфир 2-аминобензойной кислоты)
47
48.
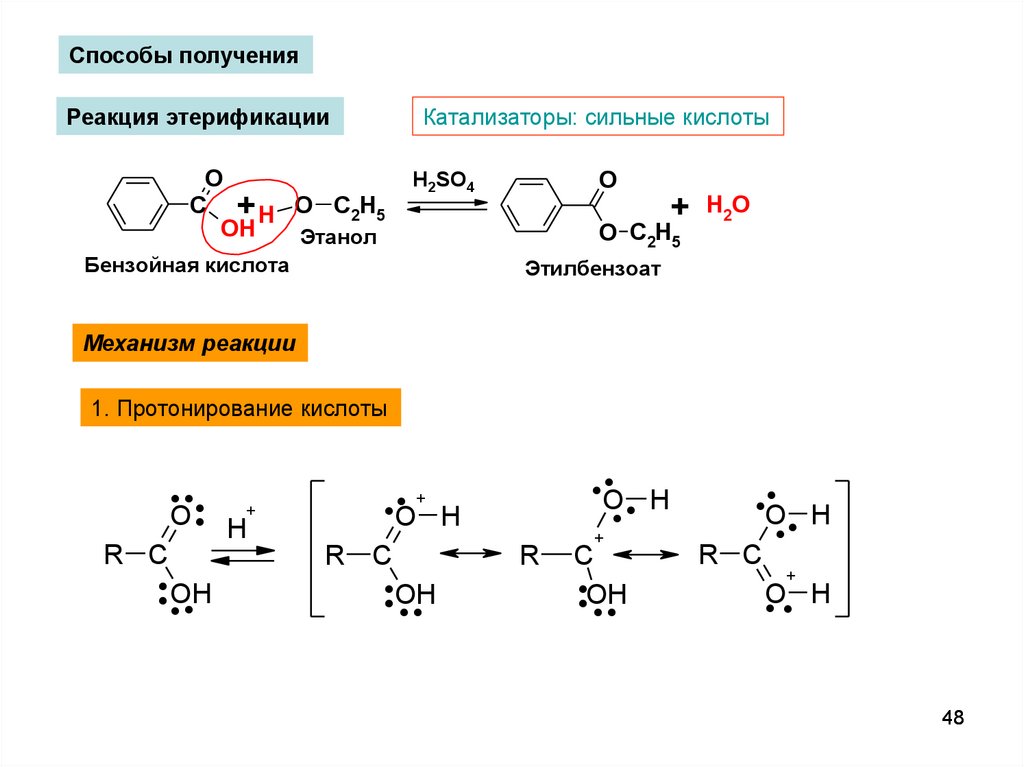
Способы полученияРеакция этерификации
Катализаторы: сильные кислоты
O
C +H O C2H5
OH
Этанол
O
H2SO4
+
O C2H5
Бензойная кислота
H 2O
Этилбензоат
Механизм реакции
1. Протонирование кислоты
..
O ..
R C
..OH
..
.O.
+
+
H
R
C
..OH
..
.O. . H
.
H
R
+
C
OH
.. ..
.O. . H
.
R C
+
..
O H
48
49.
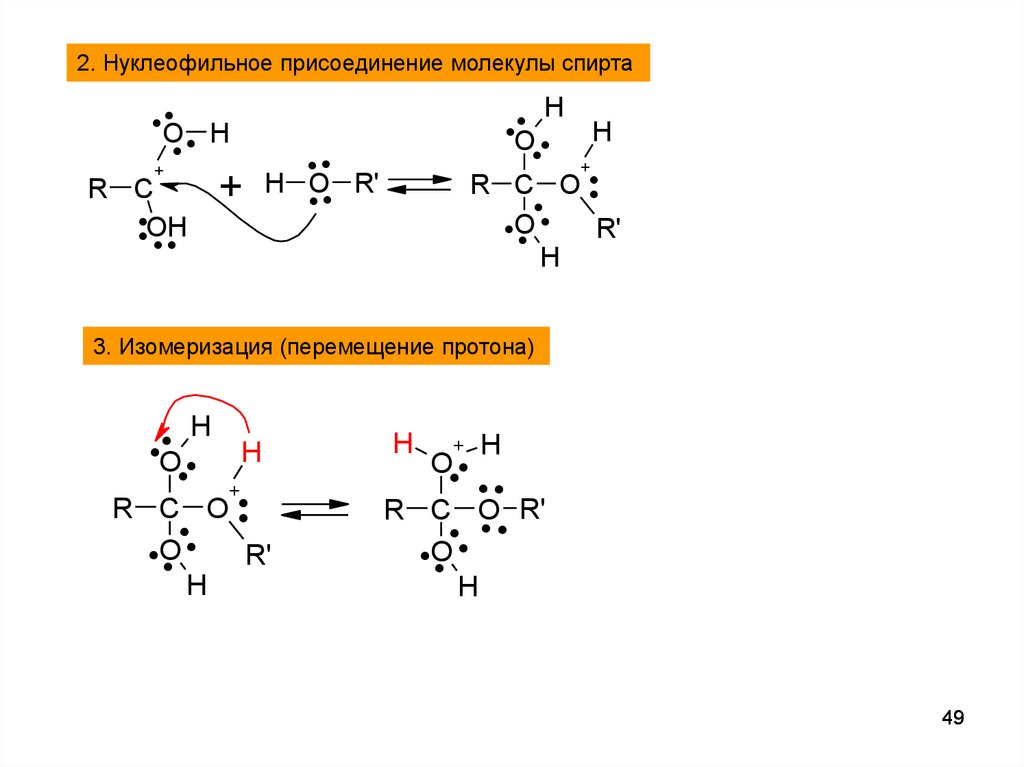
2. Нуклеофильное присоединение молекулы спирта.O. . H
.
+
R C
OH
.. ..
+
H
..
.O.
.. H
O..
H
..
. . ..
R'
+
R C O
O
R'
H
3. Изомеризация (перемещение протона)
.. H
O..
H
..
.
.. .
+
R C O
O
R'
H
H
.
O.
..
R'
R C O
.
.
.
.O. .
H
H
+
49
50.
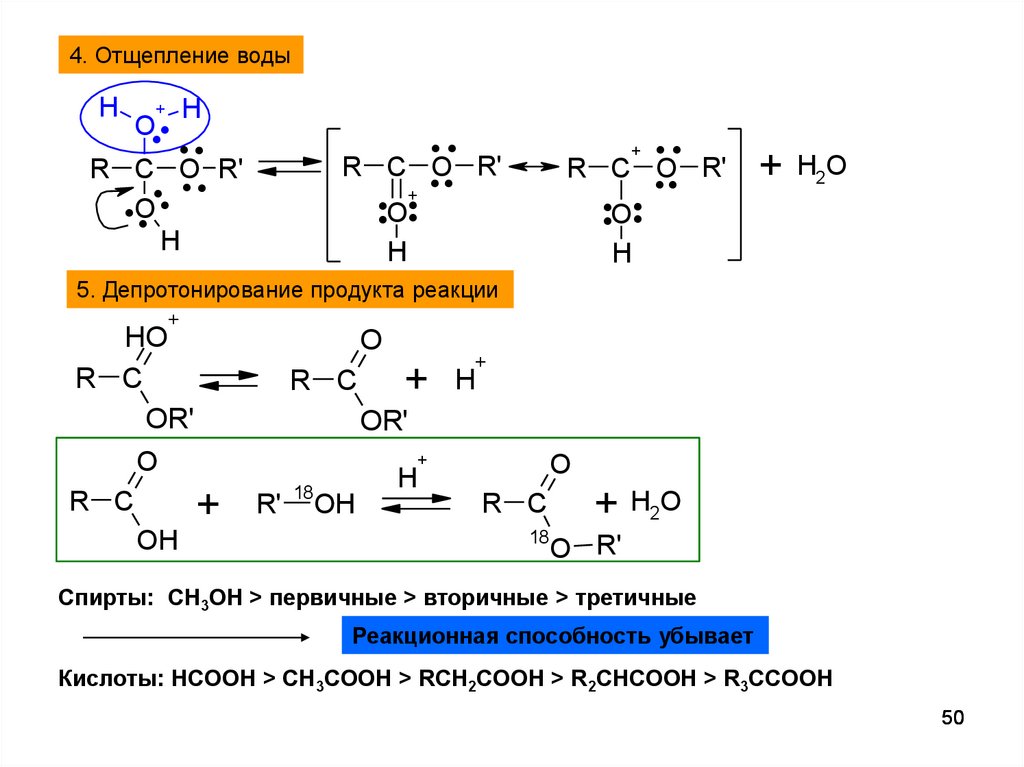
4. Отщепление воды.. .H.
R'
R C O
.
.
.
.O. .
H
H
+
O
R
..
C .O.
..O..
R'
R
+
H
..
C .O.
..O..
+
R'
+
H2O
H
5. Депротонирование продукта реакции
+
HO
R C
OR'
O
R C
OH
H
OR'
O
R C
+
+
O
+
+
R'
18
OH
H
R C
18
+ H2O
O R'
Спирты: CH3OH > первичные > вторичные > третичные
Реакционная способность убывает
Кислоты: HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
50
51.
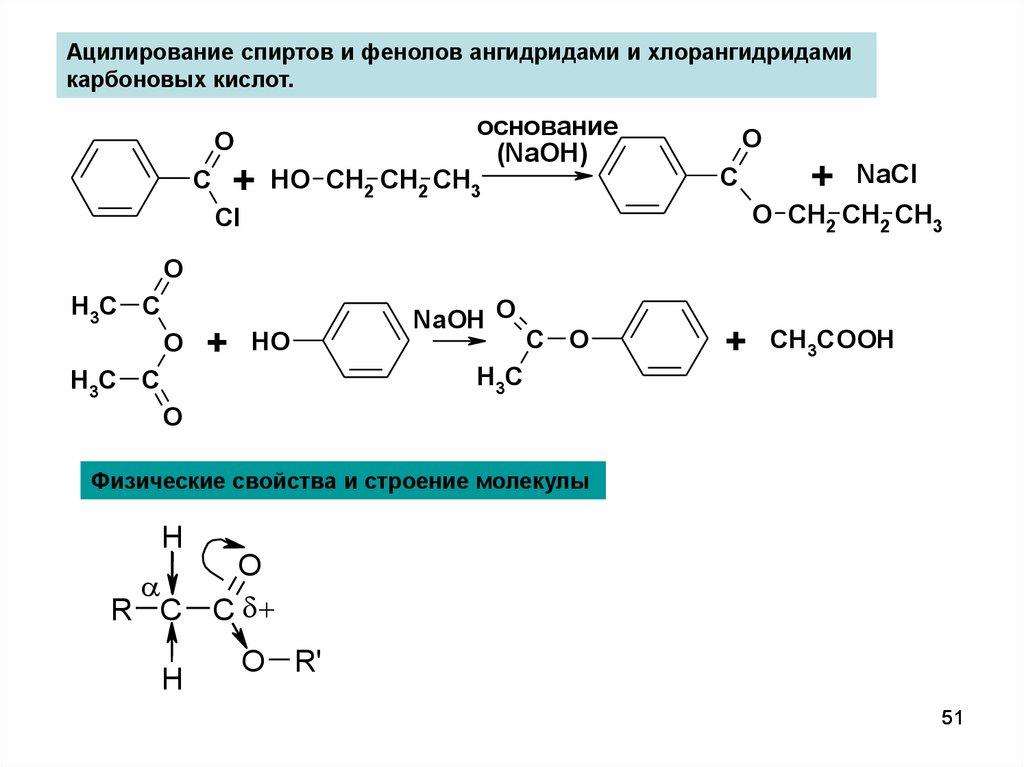
Ацилирование спиртов и фенолов ангидридами и хлорангидридамикарбоновых кислот.
O
+
C
основание
(NaOH)
HO CH2 CH2 CH3
O
C
+
NaCl
O CH2 CH2 CH3
Cl
O
H3C C
O
+
HO
NaOH O
C O
H3C
H3C C
+
CH3COOH
O
Физические свойства и строение молекулы
H
O
R C C
H
O R'
51
52.
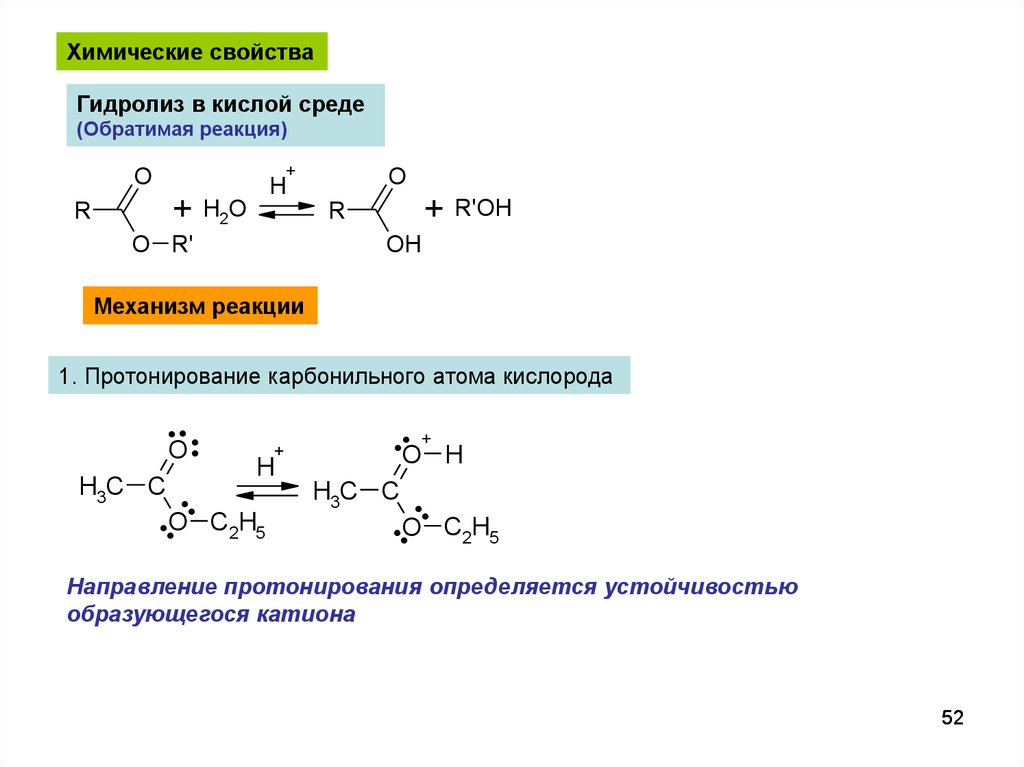
Химические свойстваГидролиз в кислой среде
(Обратимая реакция)
+
O
+ H2O
R
H
O R'
O
+ R'OH
R
OH
Механизм реакции
1. Протонирование карбонильного атома кислорода
H3C
.. .
+
O.
H
C .
..O. C2H5
..O+
H
H3C C
..
..O
C2H5
Направление протонирования определяется устойчивостью
образующегося катиона
52
53.
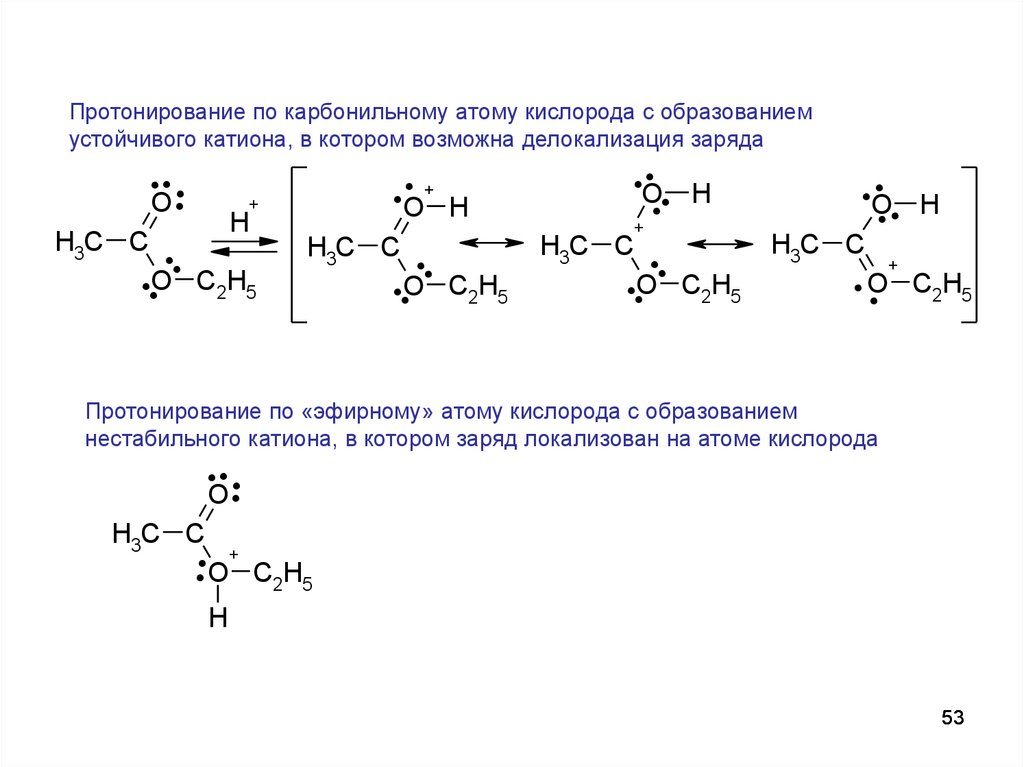
Протонирование по карбонильному атому кислорода с образованиемустойчивого катиона, в котором возможна делокализация заряда
H3C
.. .
+
O.
H
C .
.
..O C2H5
.. +
O H
H3C
H3C C
..
..O
C2H5
.O. . H
.
+
C .
..O. C2H5
.O. .
.
H
H3C C
. O. +
C2H5
Протонирование по «эфирному» атому кислорода с образованием
нестабильного катиона, в котором заряд локализован на атоме кислорода
.. .
O.
H3C C
..O+
C2H5
H
53
54.
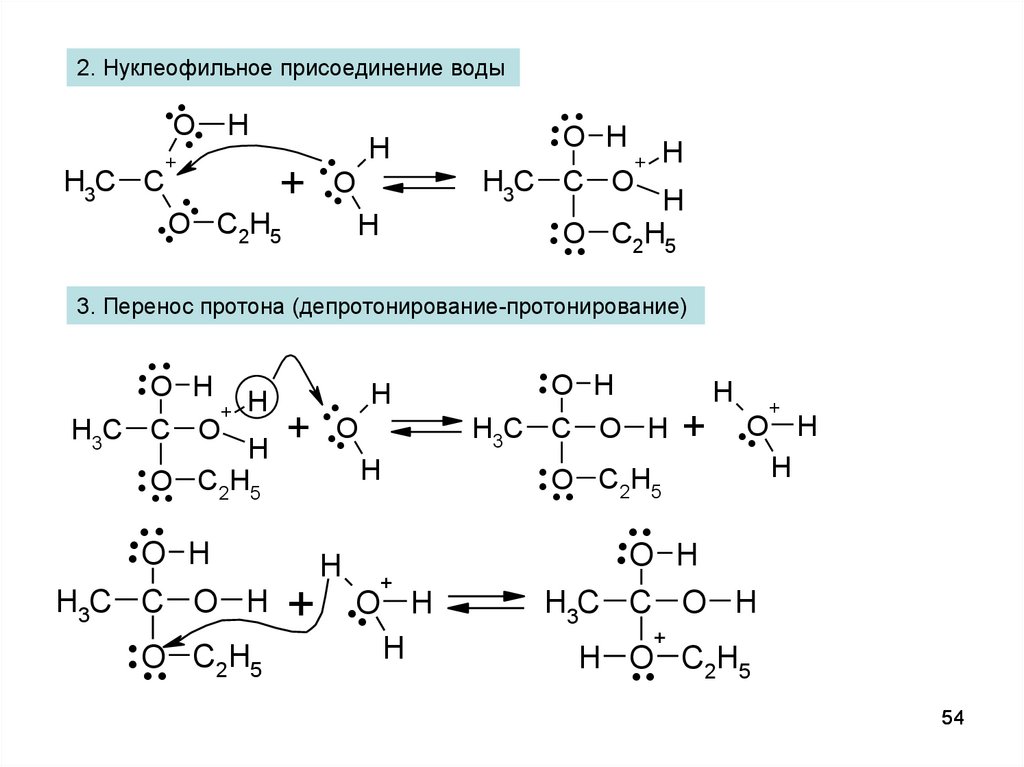
2. Нуклеофильное присоединение водыH3C
.O. . H
.
. H
+
.
C .
+ .O
.
.
..O C2H5
H
....
O
H
H
+
H3C C O
.. O
..
H
C2H5
3. Перенос протона (депротонирование-протонирование)
....
O
H
+
H3C C O
.. O
..
...O.
H
H
C2H5
H
H3C C O H
.. O
..
C2H5
..O
..O H
+ ..
+
+ .O
.
H
H
H3C C O H
.. O
..
H
H
H
H
+ .O
.
C2H5
....O
+
H
H
H
H3C C O H
+
H O
. . C2H5
54
55.
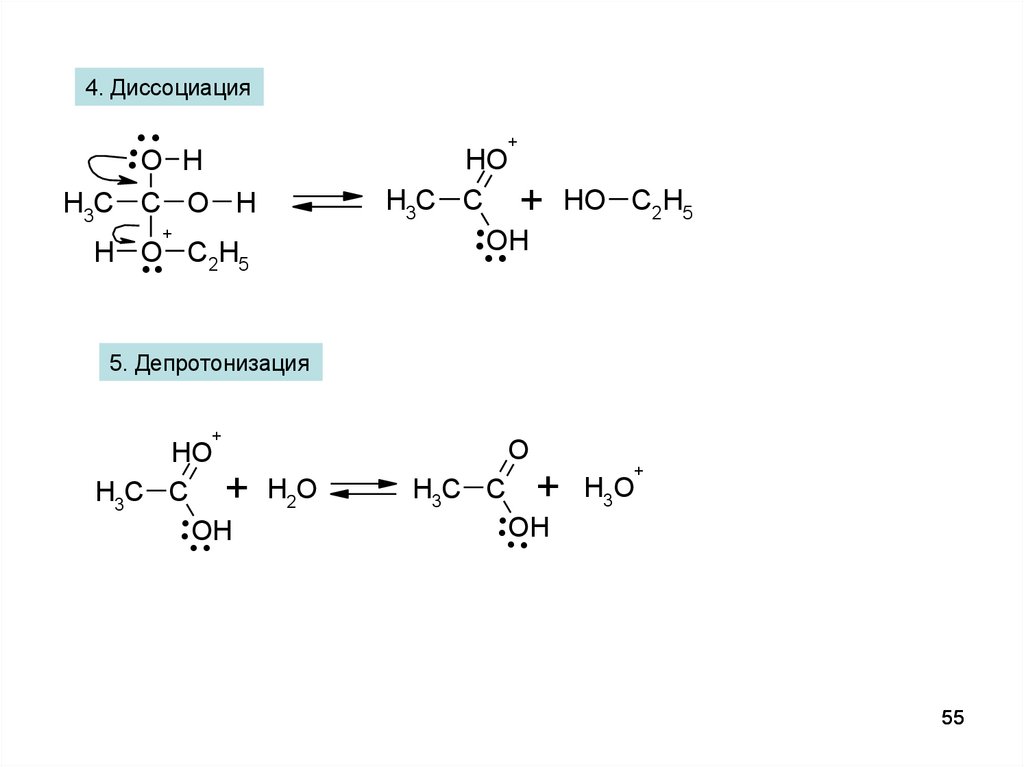
4. Диссоциация....
O
+
H
H3C C O H
+
H O
. . C2H5
HO
H3C C + HO C2H5
...OH
.
5. Депротонизация
+
HO
H3C C + H2O
...OH
.
O
H3C C
+
...OH
.
+
H3O
55
56.
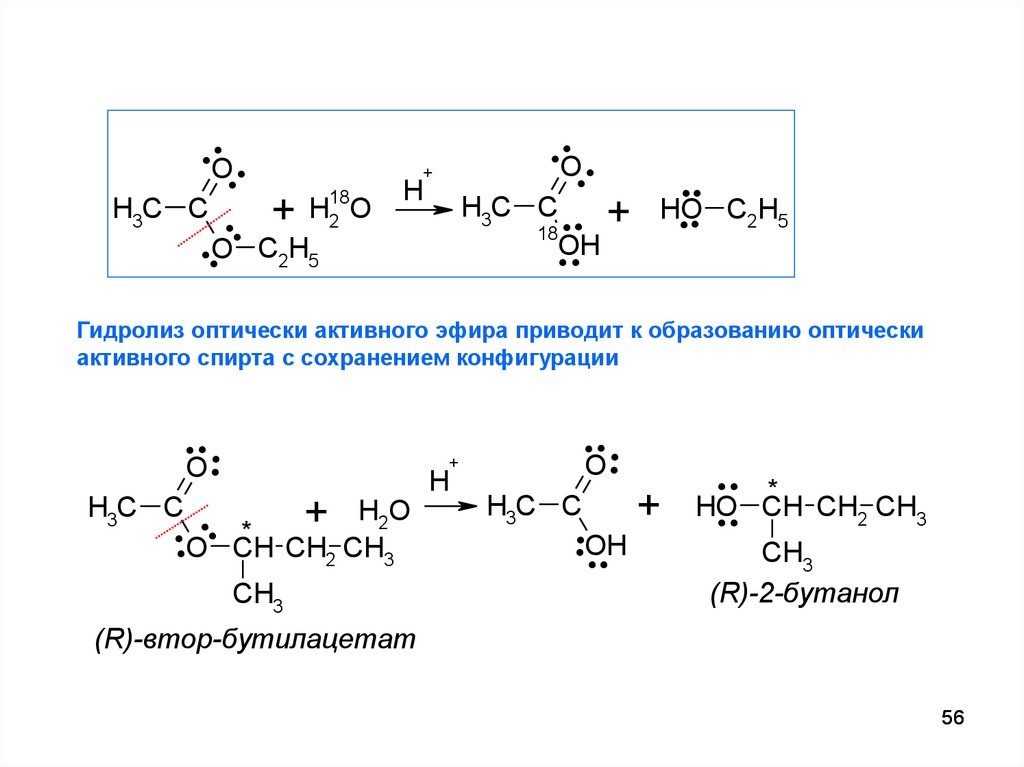
H3C.O. .
.
18
C . + H2 O
..O. C2H5
+
H
H3C
.O. .
.
C .. +
18
OH
..
..
H..
O
C2H5
Гидролиз оптически активного эфира приводит к образованию оптически
активного спирта с сохранением конфигурации
H3C
.. .
O.
C .
H2O
+
.
..O CH
*
CH2 CH3
CH3
.. .
O.
+
H
H3C C
..OH
..
..
+ HO..
*
CH CH2 CH3
CH3
(R)-2-бутанол
(R)-втор-бутилацетат
56
57.
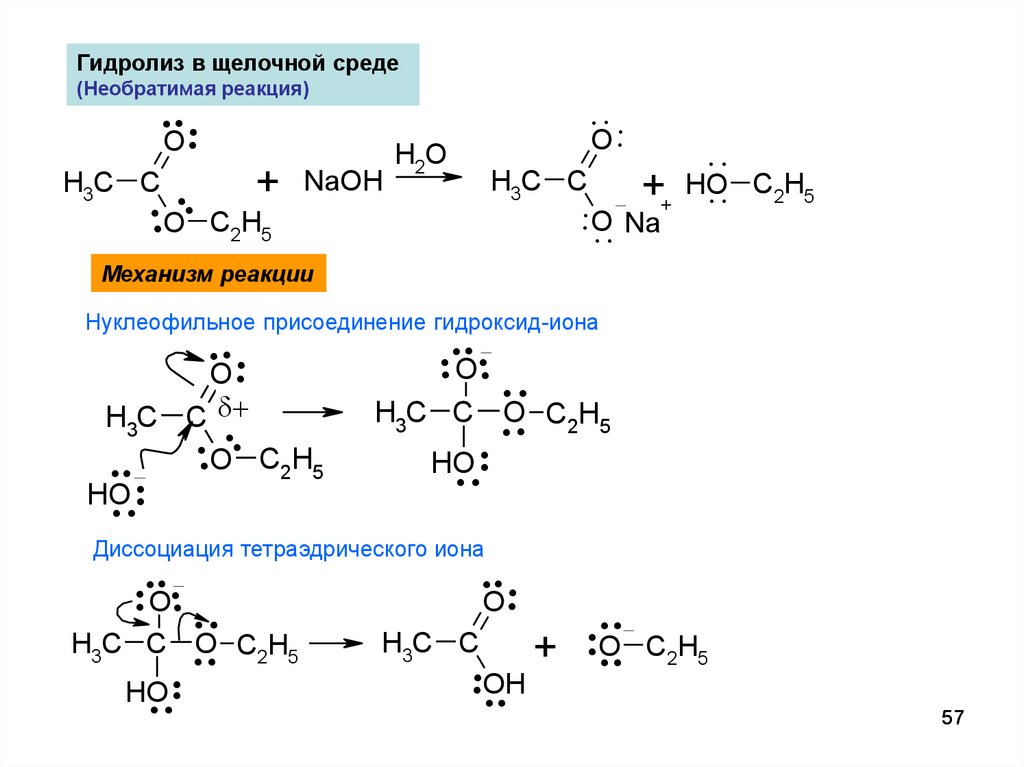
Гидролиз в щелочной среде(Необратимая реакция)
H3C
.. .
O.
C .
+
.
..O C H
2 5
NaOH
.. .
O.
H2O
H3C C
..
++ HO..
..O. . Na
C2H5
Механизм реакции
Нуклеофильное присоединение гидроксид-иона
H3C
.. .
HO
...
.. .
O.
C
..O.. C H
2 5
...O. ..
..
H3C C ..
O
..
HO
..
C2H5
Диссоциация тетраэдрического иона
....O..
..
H3C C ..
O
..
HO
..
.. .
O.
C2H5
H3C C
..OH
..
..
..O
+ ..
C2H5
57
58.
Кислотно-основное взаимодействие.. .
O.
..
..O
+ ..
H3C C
..OH
..
C2H5
.. .
O.
H3C
этоксид-анион
..
C + HO
..
..O ..
..
C2H5
ацетат-анион
O
O
+
H3C CH2 C
18
NaOH
H3C CH2 C
O CH2 CH3
O
CH3 CH2 C
+
NaOH
H2O
O *CH CH2 CH3
CH3
(S)-втор-бутилпропанат
ONa
O
CH3 CH2 C
+ H18O
+
ONa
CH2 CH3
*
HO CH CH2 CH3
CH3
(S)-2-бутанол
58
59.
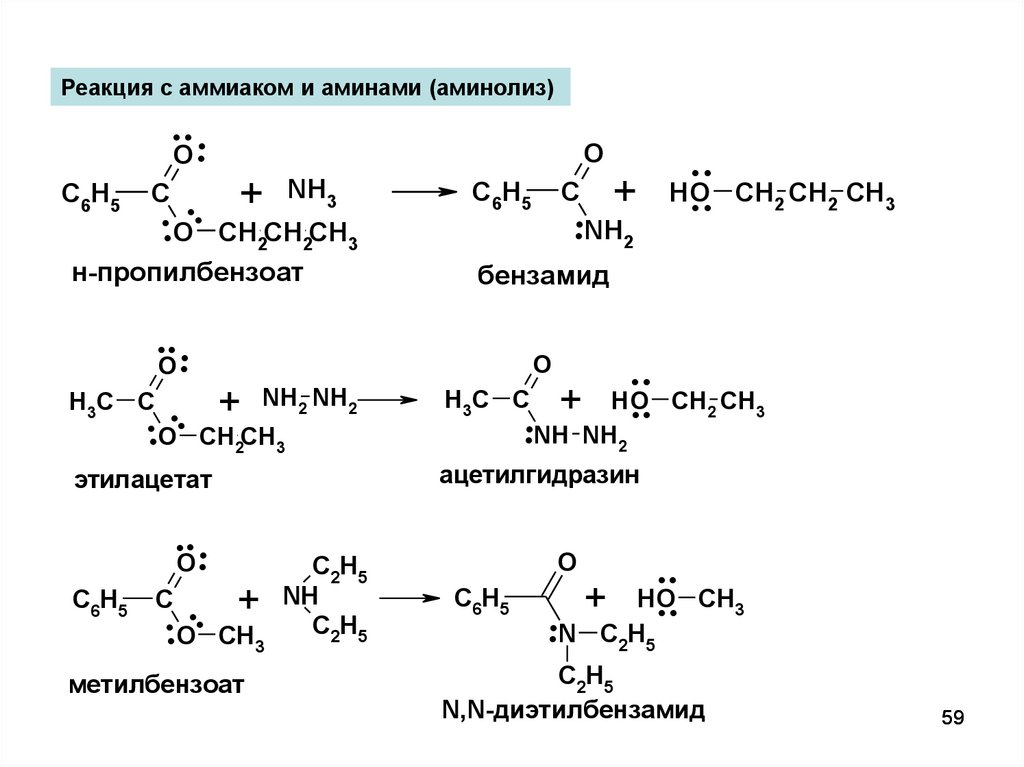
Реакция с аммиаком и аминами (аминолиз)C6H5
.. .
O.
NH3
C .
+
..O. CH CH CH
2
2
3
н-пропилбензоат
H3C
.. .
O.
NH2 NH2
C .
+
..O. CH CH
2
3
C6H5
метилбензоат
..
C + HO
..
..NH
2
C6H5
CH2 CH2 CH3
бензамид
O
H3C
..
C + HO
..NH NH ..
2
CH2 CH3
ацетилгидразин
этилацетат
.. .
O.
C .
..O. CH+
3
O
C2H5
NH
C2H5
O
C6H5
..
+ HO..
..N C2H5
CH3
C2H5
N,N-диэтилбензамид
59
60.
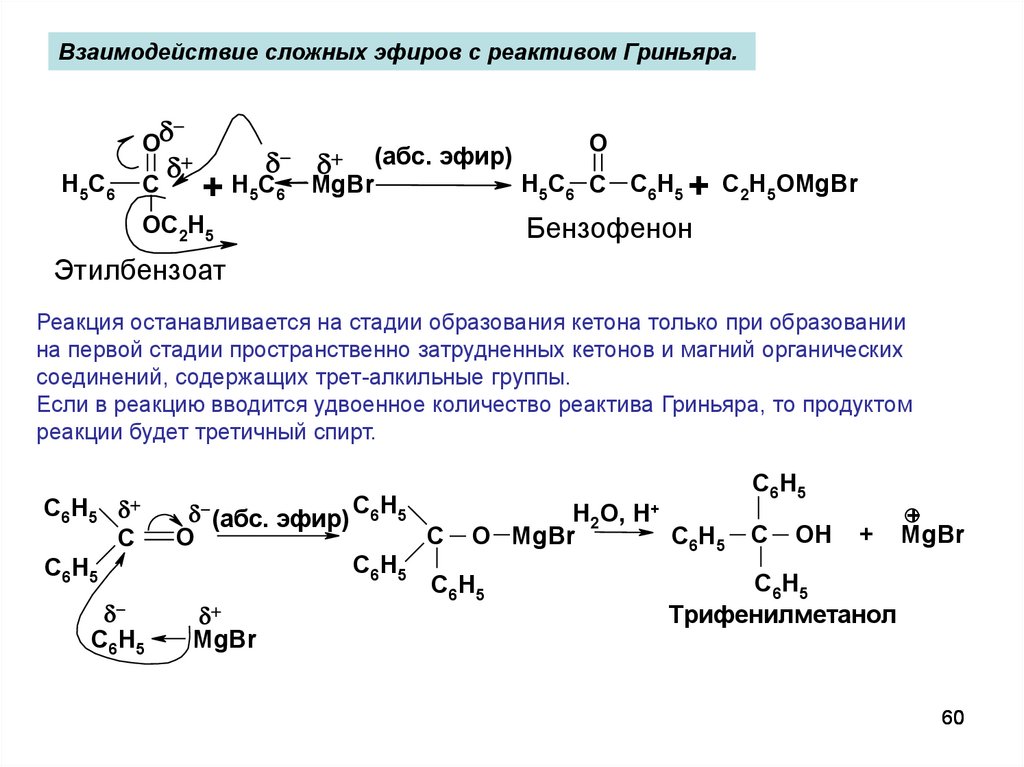
Взаимодействие сложных эфиров с реактивом Гриньяра.O
H5C6
C
+ H5C6
OC2H5
MgBr
(абс. эфир)
O
H5C6 C C6H5 + C2H5OMgBr
Бензофенон
Этилбензоат
Реакция останавливается на стадии образования кетона только при образовании
на первой стадии пространственно затрудненных кетонов и магний органических
соединений, содержащих трет-алкильные группы.
Если в реакцию вводится удвоенное количество реактива Гриньяра, то продуктом
реакции будет третичный спирт.
C6Н5
С
C6Н5
C6H5
C6Н5
H2O, H+
(абс. эфир) C6Н5
+
С О MgBr
C6Н5 С ОH + MgBr
O
C6Н5
С6Н5
С6Н5
Трифенилметанол
MgBr
60
61.
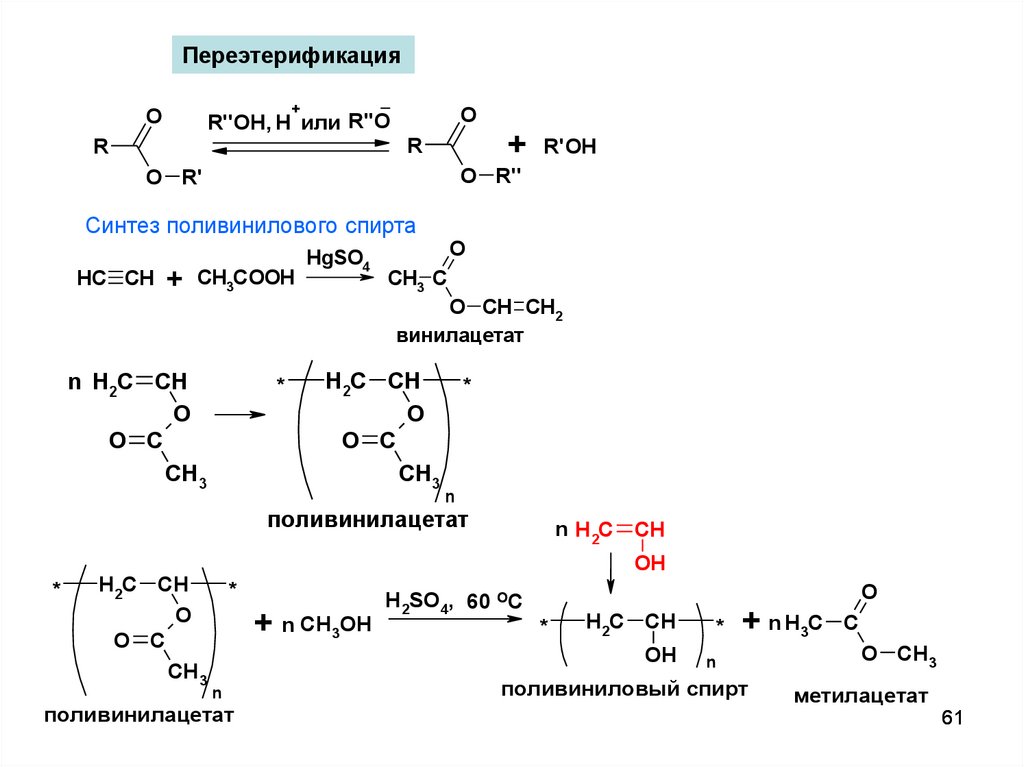
Переэтерификация+
O
R''OH, H или R''O
R
O
+
R
O R''
O R'
Синтез поливинилового спирта
HC CH
+
R'OH
CH3COOH
HgSO4
O
CH3 C
O CH CH2
винилацетат
n H2C CH
O
O C
CH3
*
H2C CH
*
O
O C
CH3
n
поливинилацетат
*
H2C CH
*
O
O C
CH3
n
поливинилацетат
n H2C CH
OH
+ n CH3OH
H2SO4, 60 OC
*
H2C CH
OH
*
+ n H3C
n
поливиниловый спирт
O
C
O CH3
метилацетат
61
62.
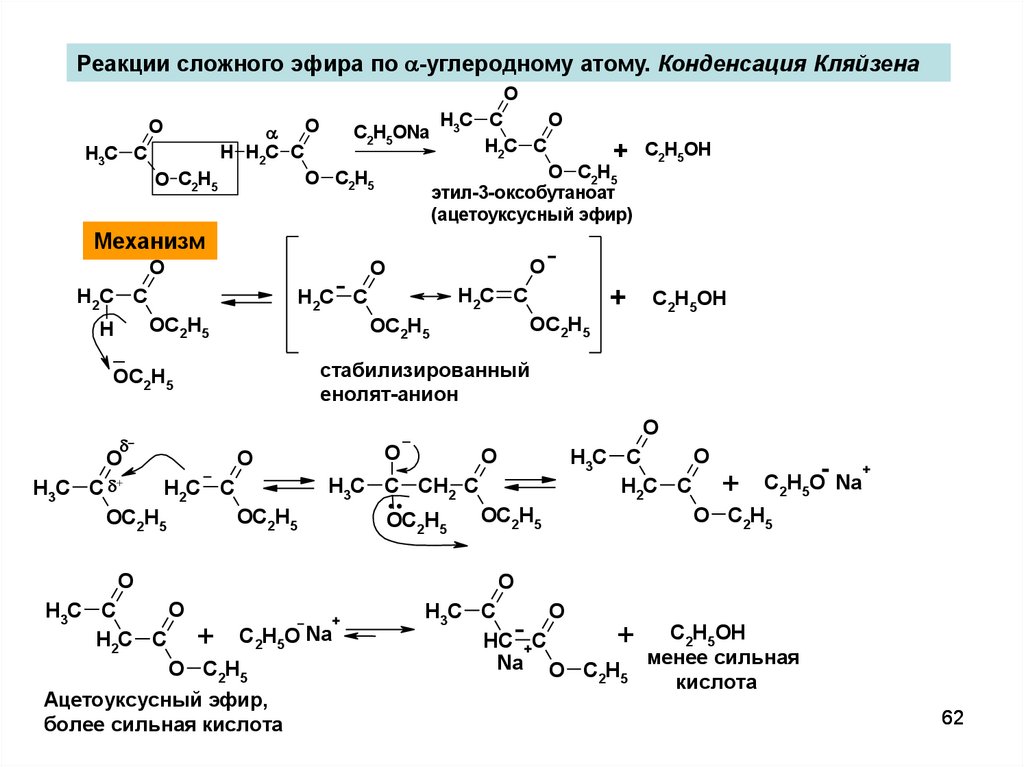
Реакции сложного эфира по -углеродному атому. Конденсация КляйзенаO
O
C2H5ONa
H H2C C
H3C C
O C2H5
O C2H5
O
O
H3C C
H2C C
+ C2H5OH
O C2H5
этил-3-оксобутаноат
(ацетоуксусный эфир)
Механизм
O
H2C C
O
OC2H5
OC2H5
+
C2H5OH
стабилизированный
енолят-анион
OC2H5
H2C C
H2C C
OC2H5
H
O
O
O
O
O
H2C C
H3C C +
OC2H5
OC2H5
O
H3C C CH2 C
O
O
H3C C
+
Na
C
H
O
H2C C +
2 5
O C2H5
Ацетоуксусный эфир,
более сильная кислота
..
OC2H5
OC2H5
O
H3C C
+
H2C C + C2H5O Na
O C2H5
O
O
H3C C
+ C2H5OH
HC + C
Na O C H менее сильная
2 5
кислота
62
63.
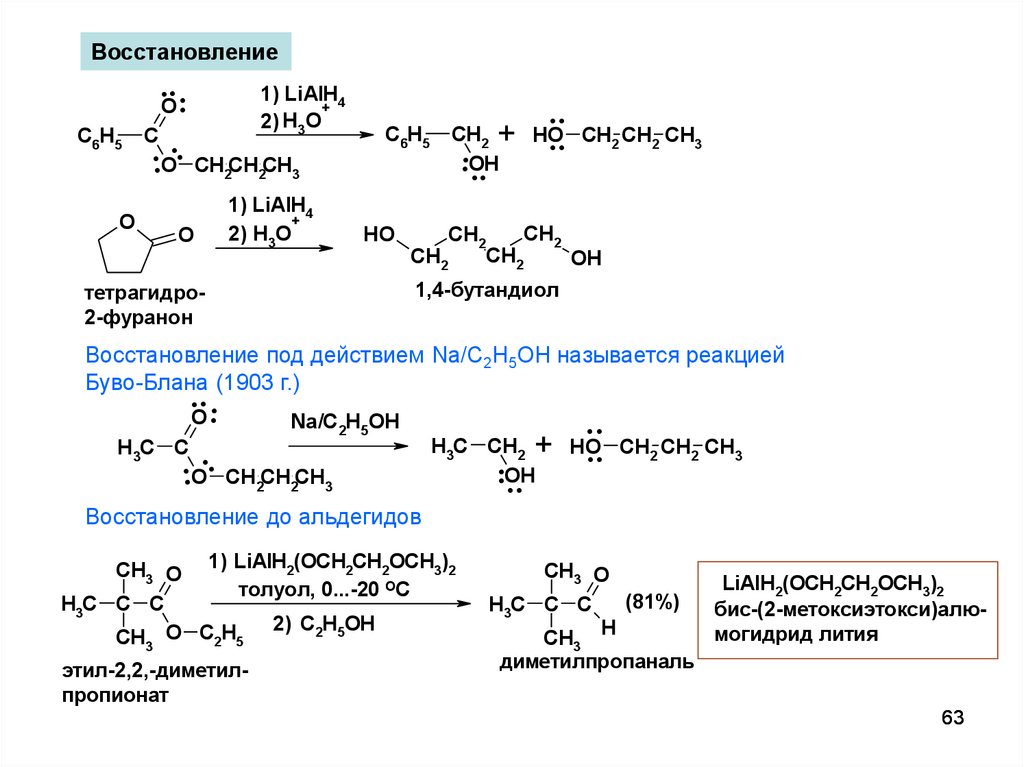
ВосстановлениеC6H5
.. .
1) LiAlH4
+
O.
2) H3O
C .
..O. CH CH CH
2
2
3
O
O
1) LiAlH4
+
2) H3O
..
CH2 + HO
..
..OH
..
C6H5
HO
тетрагидро2-фуранон
CH2
CH2
CH2
CH2
CH2 CH2 CH3
OH
1,4-бутандиол
Восстановление под действием Na/C2H5OH называется реакцией
Буво-Блана (1903 г.)
H3C
.. .
O.
Na/C2H5OH
C .
..O. CH CH CH
2
2
3
..
H3C CH2 + HO
CH2 CH2 CH3
..
..OH
..
Восстановление до альдегидов
CH3 O 1) LiAlH2(OCH2CH2OCH3)2
толуол, 0...-20 ОС
H3C C C
2) C2H5OH
CH O C2H5
3
этил-2,2,-диметилпропионат
CH3 O
(81%)
H3C C C
CH H
3
LiAlH2(OCH2CH2OCH3)2
бис-(2-метоксиэтокси)алюмогидрид лития
диметилпропаналь
63
64.
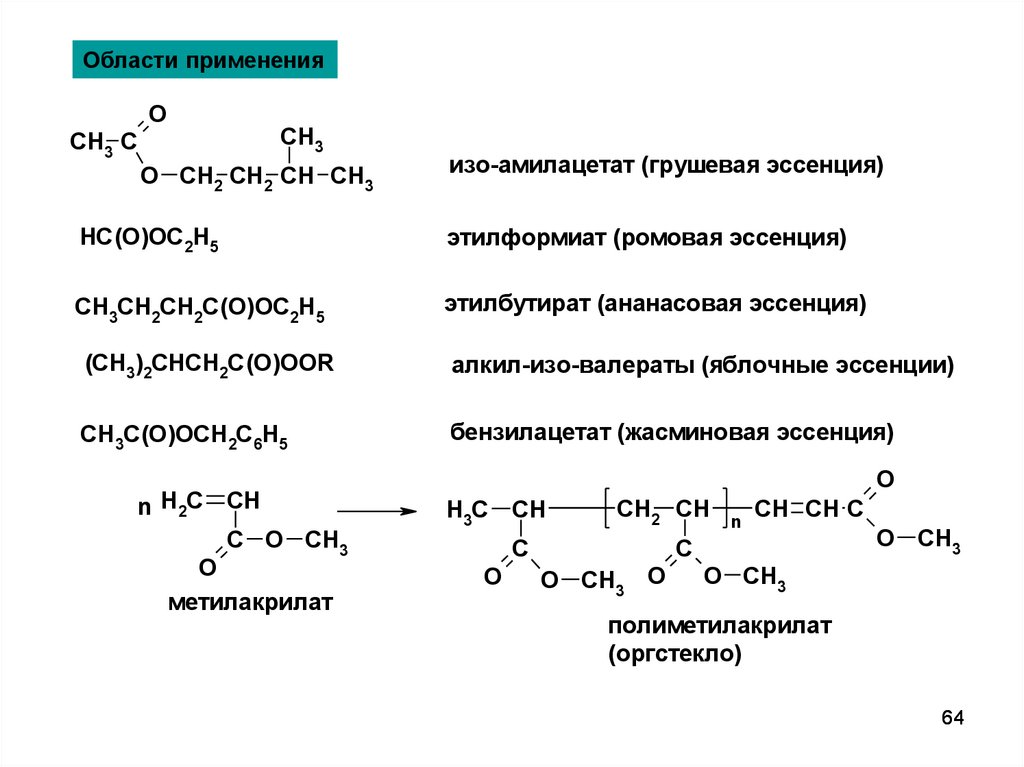
Области примененияO
CH3
CH3 C
O CH2 CH2 CH CH3
изо-амилацетат (грушевая эсcенция)
HC(O)OC2H5
этилформиат (ромовая эссенция)
CH3CH2CH2C(O)OC2H5
этилбутират (ананасовая эссенция)
(CH3)2CHCH2C(O)OOR
алкил-изо-валераты (яблочные эссенции)
CH3C(O)OCH2C6H5
бензилацетат (жасминовая эссенция)
n H2C CH
C O CH3
O
метилакрилат
O
H3C CH
CH2 CH
CH CH C
C
C
O
n
O CH3 O
O CH3
O CH3
полиметилакрилат
(оргстекло)
64
65.
6566.
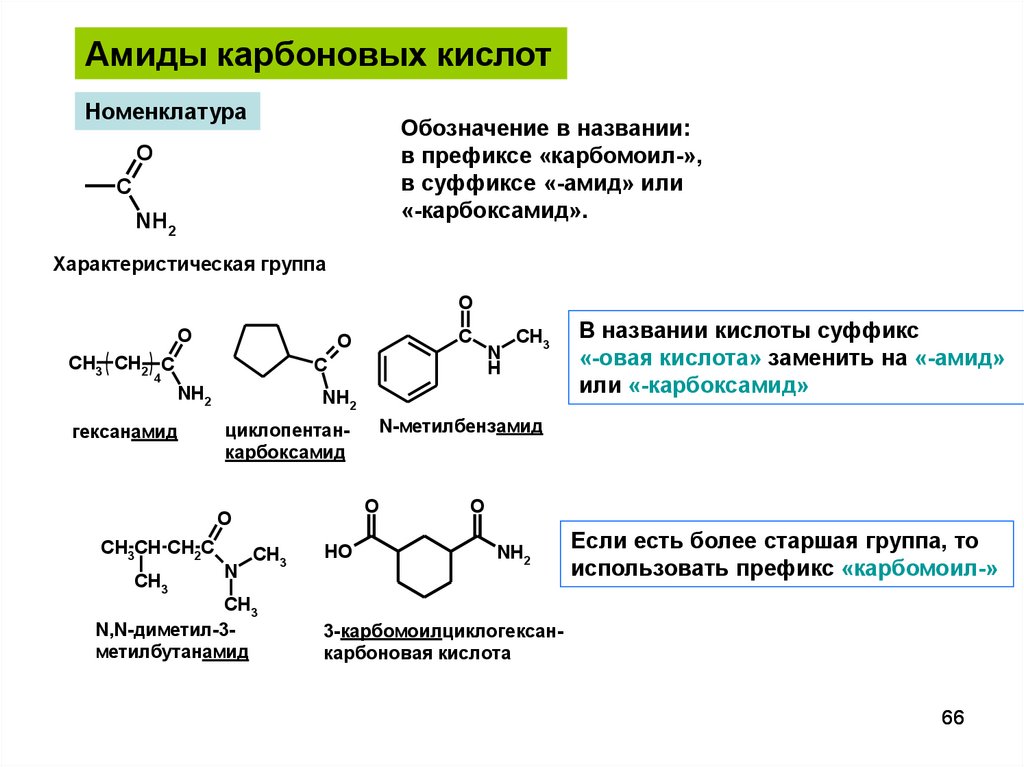
Амиды карбоновых кислотНоменклатура
Обозначение в названии:
в префиксе «карбомоил-»,
в суффиксе «-амид» или
«-карбоксамид».
O
C
NH2
Характеристическая группа
O
O
CH3 CH2 C
4
C
NH2
гексанамид
CH3CH CH2C
N
H
CH3
NH2
O
N
CH3
CH3
N,N-диметил-3метилбутанамид
HO
В названии кислоты суффикс
«-овая кислота» заменить на «-амид»
или «-карбоксамид»
N-метилбензамид
циклопентанкарбоксамид
O
CH3
C
O
O
NH2
Если есть более старшая группа, то
использовать префикс «карбомоил-»
3-карбомоилциклогексанкарбоновая кислота
66
67.
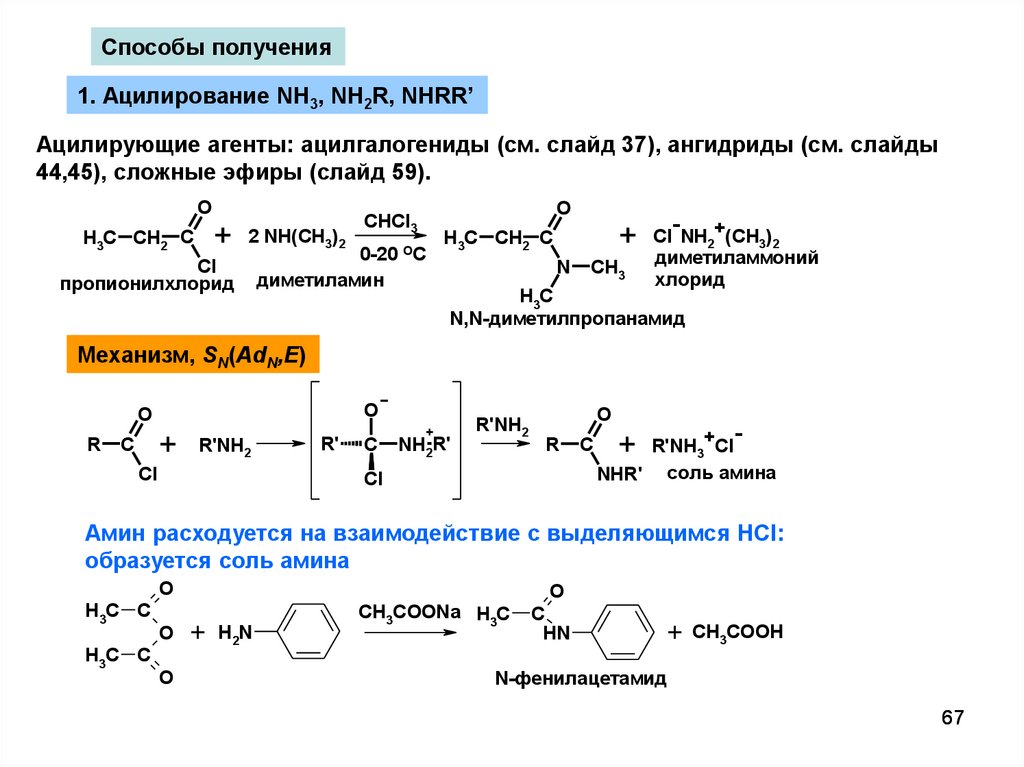
Способы получения1. Ацилирование NH3, NH2R, NHRR’
Ацилирующие агенты: ацилгалогениды (см. слайд 37), ангидриды (см. слайды
44,45), сложные эфиры (слайд 59).
O
+
H3C CH2 C
2 NH(CH3)2
Cl
пропионилхлорид
O
CHCl3
0-20 OC
диметиламин
+
H3C CH2 C
N
CH3
-
Cl NH2+(CH3)2
диметиламмоний
хлорид
H3C
N,N-диметилпропанамид
Механизм, SN(AdN,E)
O
O
R
+
C
R'NH2
Cl
R'
C
+
NH2R'
R'NH2
O
R
Cl
C
-
R'NH3+Cl
NHR' соль амина
+
Амин расходуется на взаимодействие с выделяющимся HCl:
образуется соль амина
O
H3C C
H3C C
O
O
+
H2N
CH3COONa H3C
O
C
HN
+
CH3COOH
N-фенилацетамид
67
68.
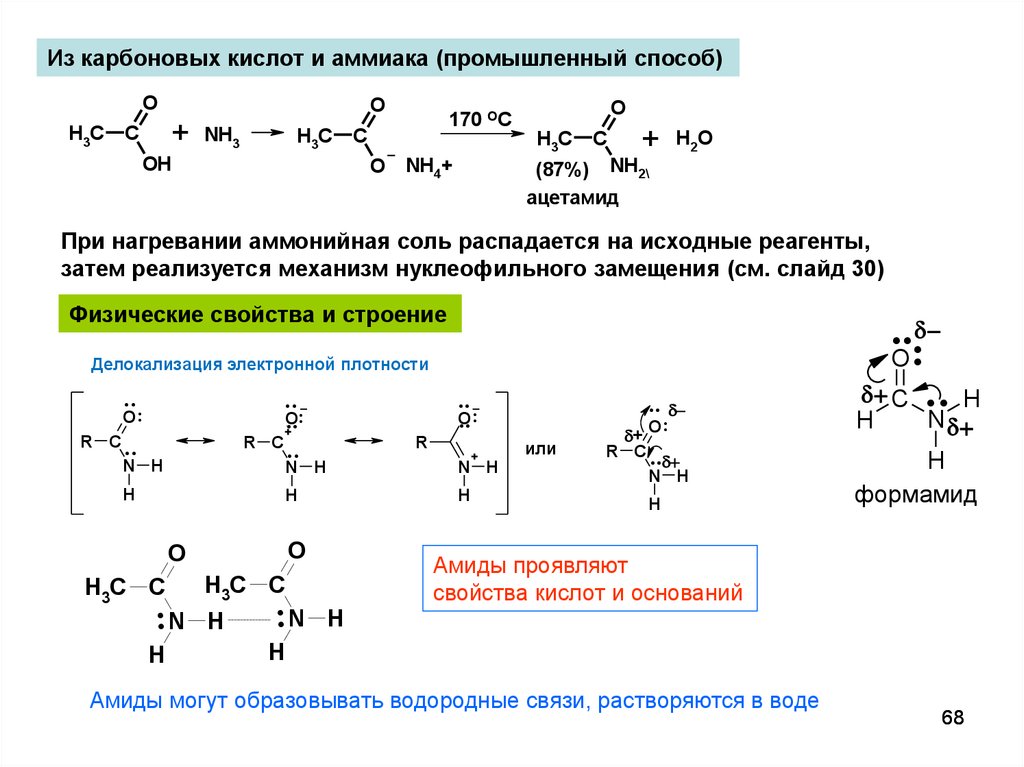
Из карбоновых кислот и аммиака (промышленный способ)O
H3C
+
C
O
NH3
H3C
OH
170 OC
C
O
NH4+
O
H3C
C
+
(87%) NH2\
ацетамид
H2 O
При нагревании аммонийная соль распадается на исходные реагенты,
затем реализуется механизм нуклеофильного замещения (см. слайд 30)
Физические свойства и строение
Делокализация электронной плотности
..
O:
R C ..
N H
R
H
..
O
..:
+
C
..
.. N
H
R
N H
H
H
O
H3C C
H
+
N H
O
H3C C
..
.. N
..
O
..:
H
или
O:
+
R C ..
N H
H
..O..
C .. H
N
H
H
формамид
Амиды проявляют
свойства кислот и оснований
H
Амиды могут образовывать водородные связи, растворяются в воде
68
69.
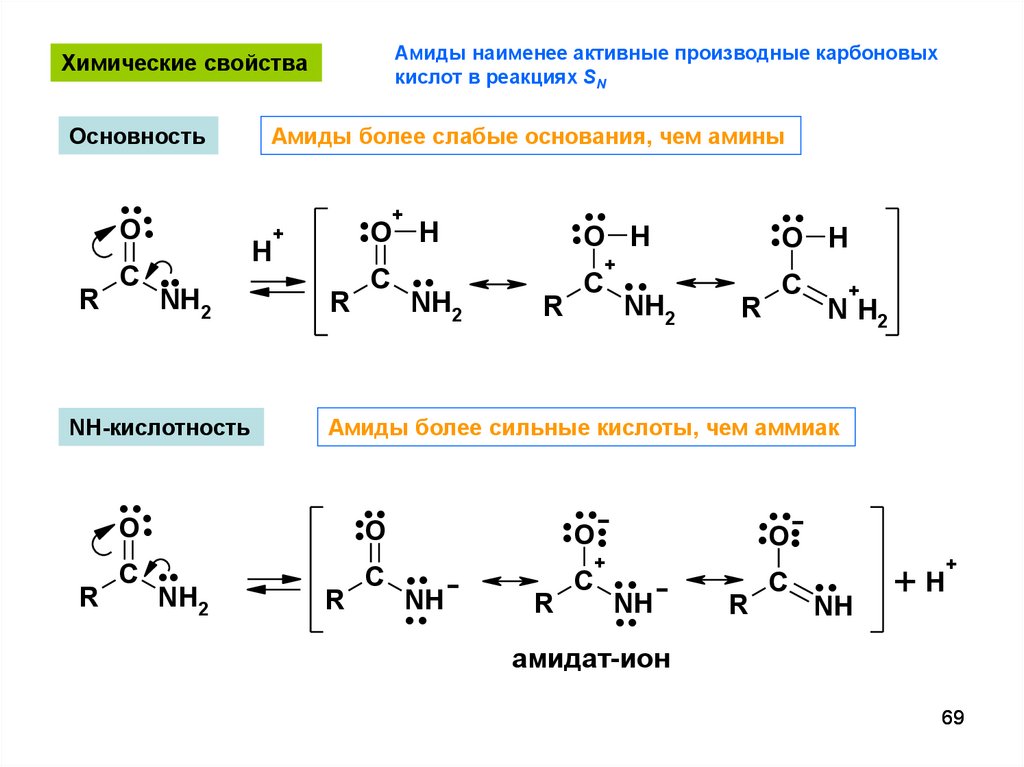
Амиды наименее активные производные карбоновыхкислот в реакциях SN
Химические свойства
Основность
..O..
C ..
NH
R
H
2
NH-кислотность
R
....
..
Амиды более слабые основания, чем амины
.O
+
R
C
H
..NH
...O H
C ..
NH
R
....O H
+
2
2
R
C
+
N H2
Амиды более сильные кислоты, чем аммиак
O
...
C
C
NH2
+
O
R
..
..
NH
....
..
..
....
O
R
C
O
+
NH
R
C
..
NH
+H
+
амидат-ион
69
70.
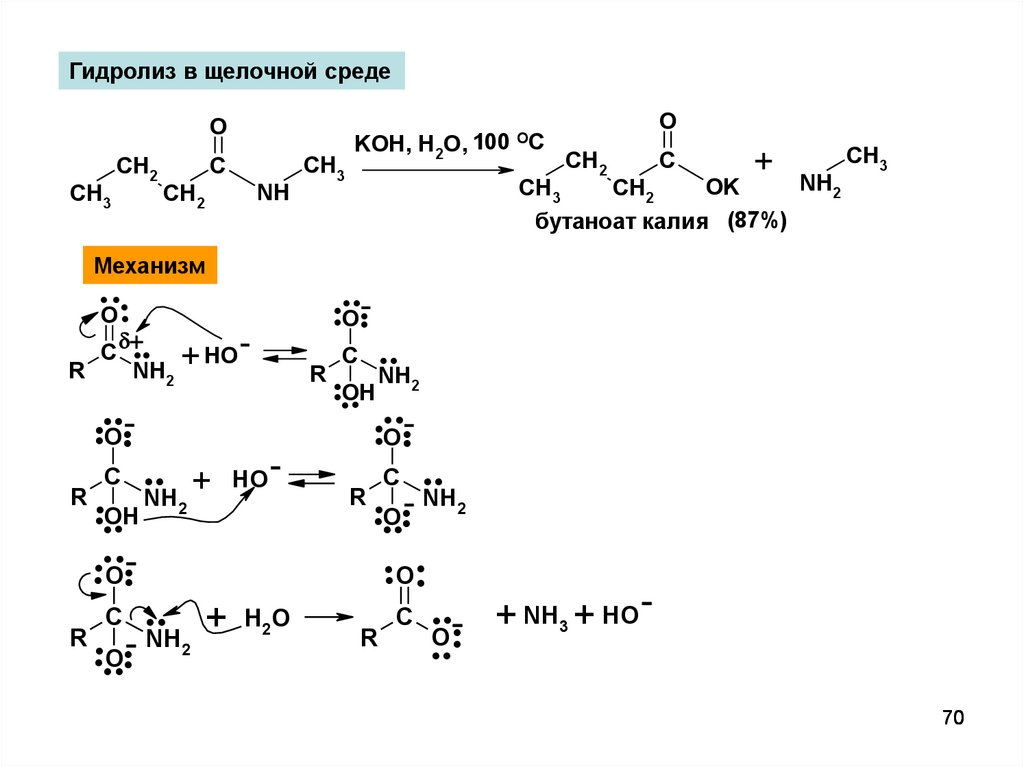
Гидролиз в щелочной средеO
CH3
CH2
C
NH
CH2
..O..
C .. + HO
NH
R
Механизм
....
..
+
...
....O.
C .. + H O
R . . NH
.O.
2
O
R
C
OH
NH2
HO
2
2
CH3
KOH, H2O, 100
OC
O
CH2
C
+
NH2
OK
CH2
CH3
бутаноат калия (87%)
....O.
C ..
R.
NH
OH
..
.....
..
....
.O..
C ...
R
..O
CH3
2
O
R
C
O
NH2
+ NH3 + HO
70
71.
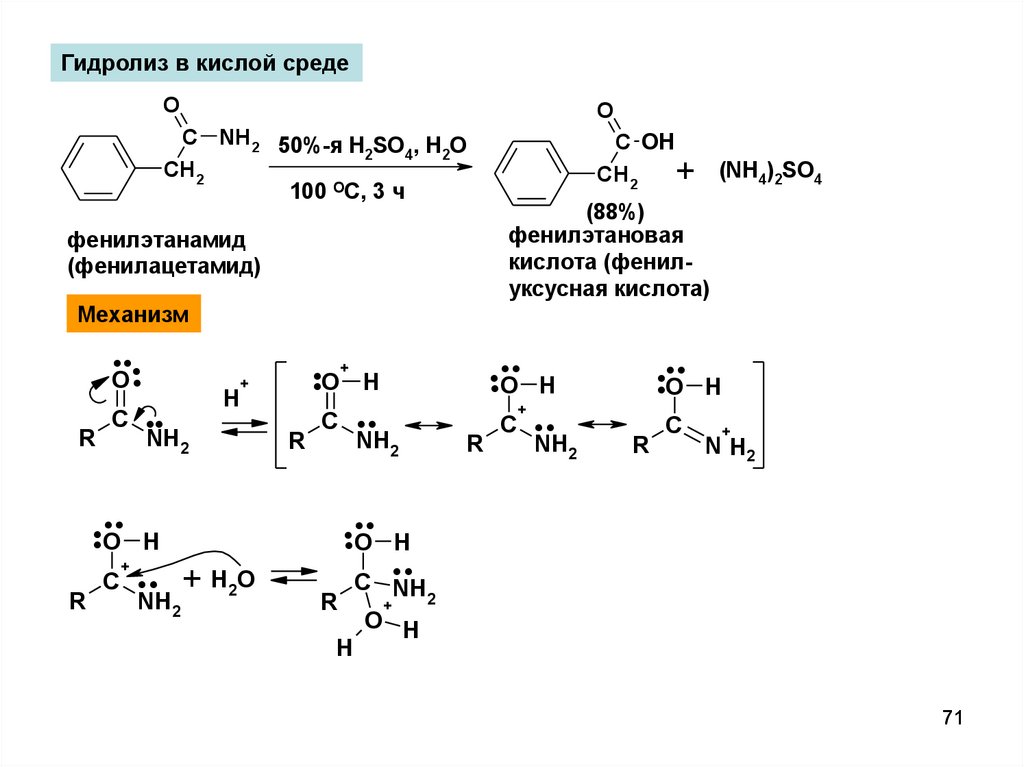
Гидролиз в кислой средеO
O
C NH2 50%-я H SO , H O
2
4
2
CH2
100 OC, 3 ч
C OH
CH2
+
фенилэтанамид
(фенилацетамид)
Механизм
..O..
C ..
NH
R
...
H
2
O H
R
C
+
..
NH2
.O
+
R
C
+
H
..NH
(88%)
фенилэтановая
кислота (фенилуксусная кислота)
...O H
C ..
NH
R
....O H
+
2
(NH4)2SO4
2
R
C
+
N H2
...
..
O H
+ H 2O
C NH
2
R
+
O H
H
71
72.
.....
O H
C NH
2
R
+
O H
H
...
..
...
-H
+H
...
..
...
O H
+
C NH
2
R
OH
+
.
O H
+
O H
C NH+
3
R
OH
R
C
..
..
OH
.
.
+
H
NH3
+
...
..
...
. ..
....
O H
C NH+
3
R
OH
O
R
C
OH
+
+
NH4
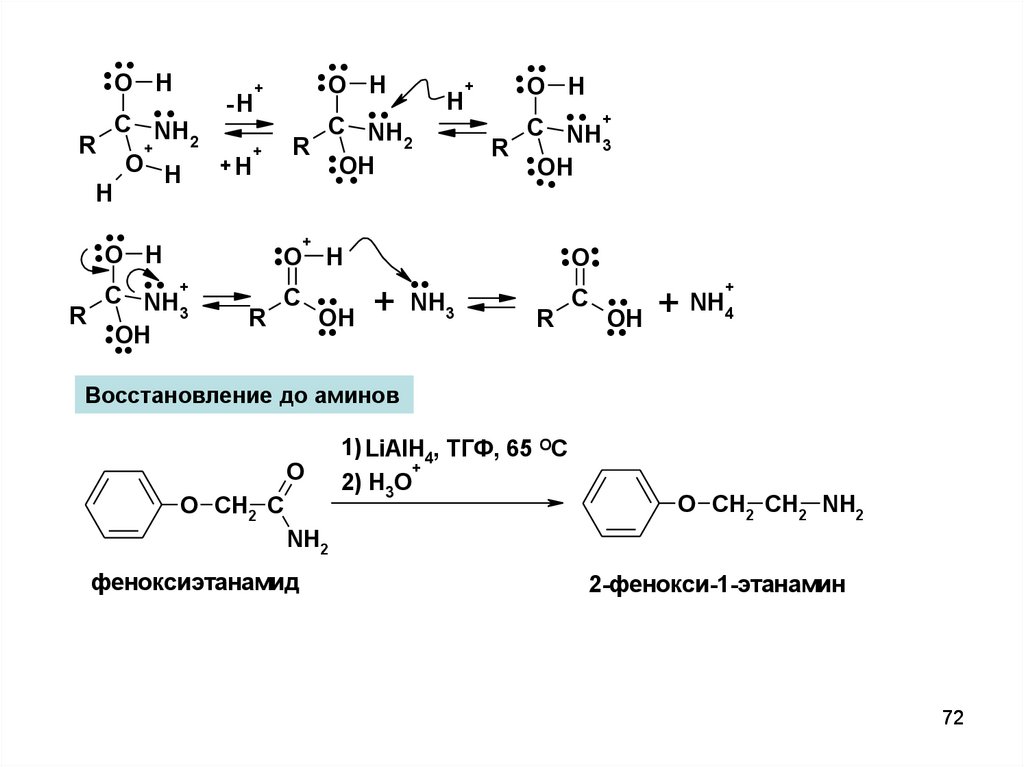
Восстановление до аминов
O
O CH2 C
1) LiAlH4, ТГФ, 65 OC
+
2) H3O
O CH2 CH2 NH2
NH2
феноксиэтанамид
2-фенокси-1-этанамин
72
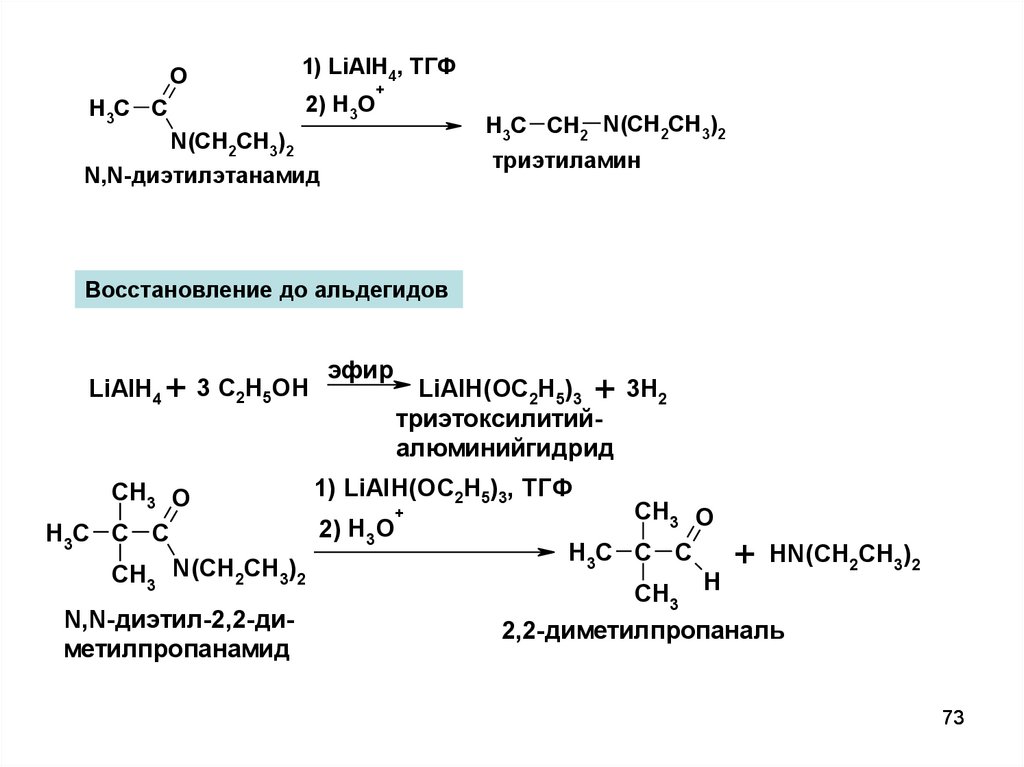
73.
O1) LiAlH4, ТГФ
+
2) H3O
H3C C
H3C CH2 N(CH2CH3)2
N(CH2CH3)2
триэтиламин
N,N-диэтилэтанамид
Восстановление до альдегидов
LiAlH4 + 3 C2H5OH
эфир
LiAlH(OC2H5)3 + 3H2
триэтоксилитийалюминийгидрид
1) LiAlH(OC2H5)3, ТГФ
CH3 O
+
CH3 O
H
O
2)
H3C C C
3
H3C C C
HN(CH2CH3)2
+
N(CH
CH
)
CH3
2
3 2
CH3 H
N,N-диэтил-2,2-ди2,2-диметилпропаналь
метилпропанамид
73
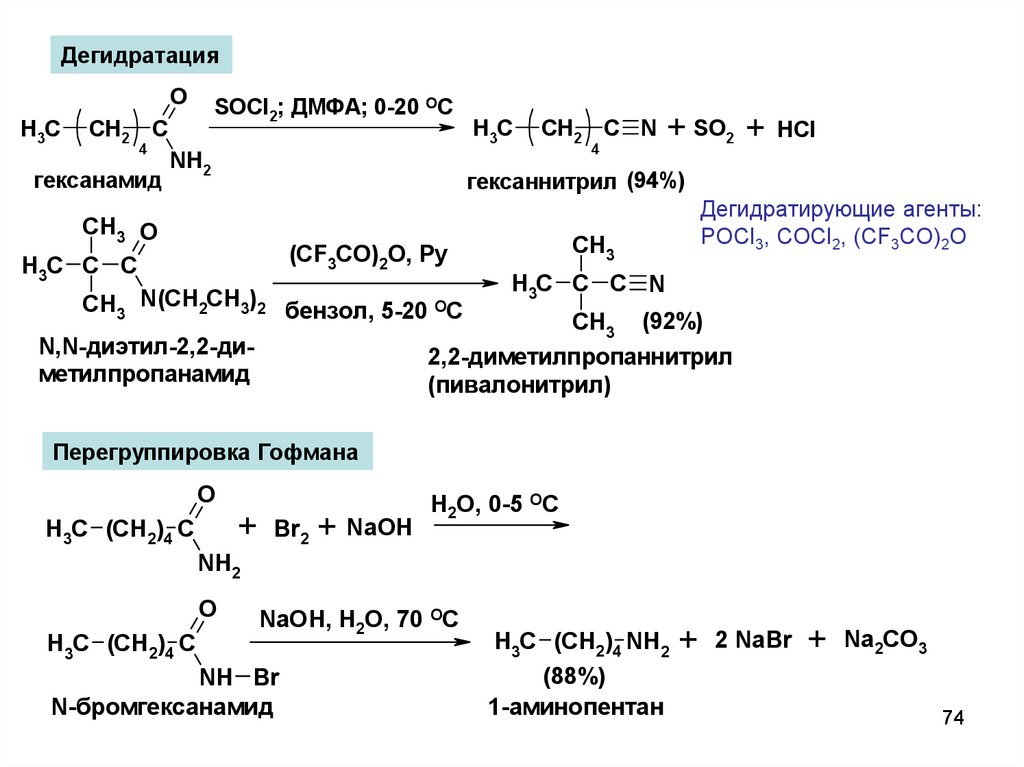
74.
ДегидратацияO
H3C
SOCl2; ДМФА; 0-20 OC
CH2 C
4
гексанамид
NH2
H3C
CH2 C N
4
+ SO2 +
HCl
гексаннитрил (94%)
CH3 O
H3C C C
CH N(CH2CH3)2
(CF3CO)2O, Py
бензол, 5-20
3
ОС
Дегидратирующие агенты:
POCl3, COCl2, (CF3CO)2O
CH3
H3C C C N
CH3 (92%)
2,2-диметилпропаннитрил
(пивалонитрил)
N,N-диэтил-2,2-диметилпропанамид
Перегруппировка Гофмана
O
H3C (CH2)4 C
+
Br2
+ NaOH
H2O, 0-5 OC
NH2
O
H3C (CH2)4 C
NaOH, H2O, 70 OC
NH Br
N-бромгексанамид
H3C (CH2)4 NH2
(88%)
1-аминопентан
+
2 NaBr
+
Na2CO3
74
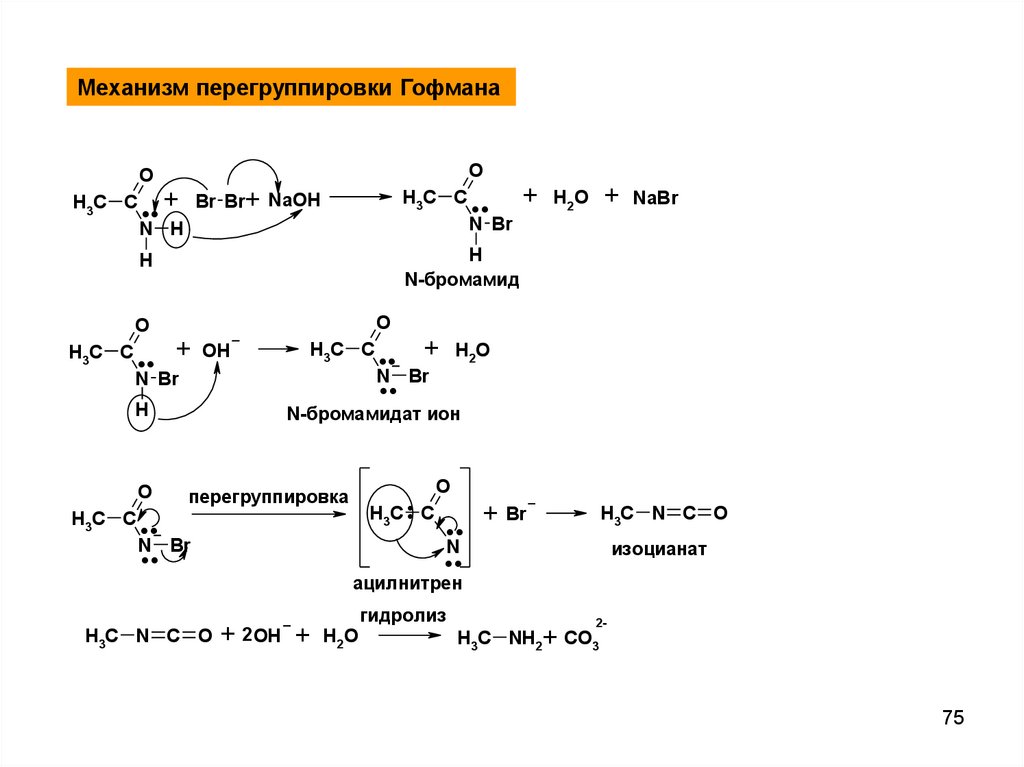
75.
Механизм перегруппировки ГофманаO
O
H3C C
+
..
N H
Br Br+ NaOH
H3C C
+ OH
..
N Br
H3C C
H
H3C C
NaBr
O
O
O
+
H2O
H
N-бромамид
H
H3C C
+
..
N Br
+
..
N Br
..
H2O
N-бромамидат ион
перегруппировка
H3C : C
..
N Br
..
O
..N
..
+ Br
H3C N C O
изоцианат
ацилнитрен
H3C N C O
+
2 OH
+
гидролиз
H2O
2-
H3C NH2+ CO3
75
76.
Обозначение в префиксе:«циано-».
Обозначение в суффиксе:
«-нитрил» или «-карбонитрил»
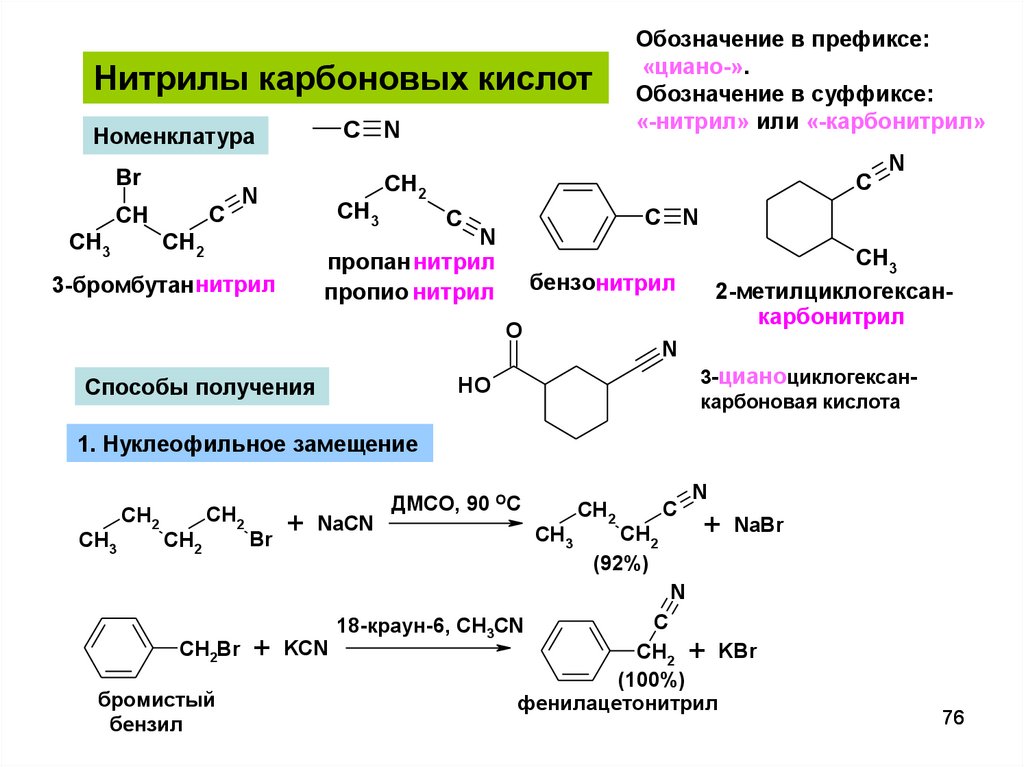
Нитрилы карбоновых кислот
C N
Номенклатура
Br
C
CH
N
CH3
3-бромбутаннитрил
CH3
2-метилциклогексанкарбонитрил
бензонитрил
O
Способы получения
N
C N
C
N
пропан нитрил
пропио нитрил
CH2
CH3
C
CH2
N
3-цианоциклогексанкарбоновая кислота
HO
1. Нуклеофильное замещение
CH3
CH2
CH2
CH2
Br
+
NaCN
ДМСО, 90 ОС
CH3
CH2
C
CH2
(92%)
N
+
NaBr
N
CH2Br
бромистый
бензил
+
KCN
C
CH2 + KBr
(100%)
фенилацетонитрил
18-краун-6, CH3CN
76
77.
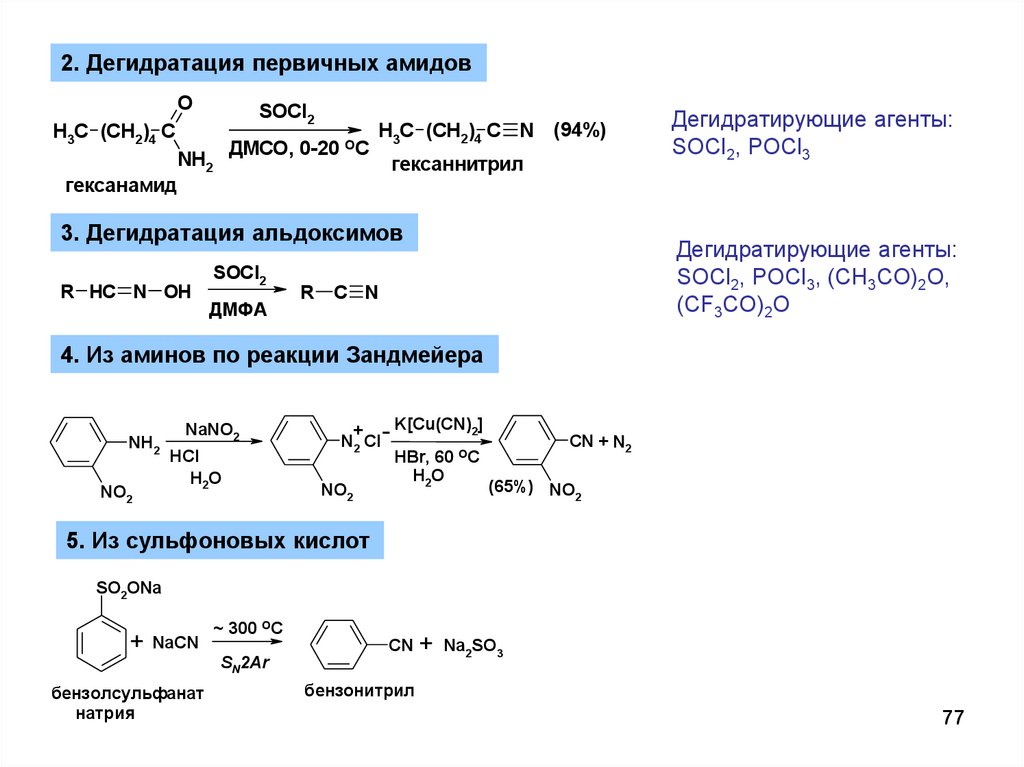
2. Дегидратация первичных амидовO
SOCl2
H3C (CH2)4 C
ДМСО, 0-20 ОС
NH2
гексанамид
H3C (CH2)4 C N
(94%)
гексаннитрил
3. Дегидратация альдоксимов
R HC N OH
SOCl2
ДМФА
R
Дегидратирующие агенты:
SOCl2, POCl3
Дегидратирующие агенты:
SOCl2, POCl3, (CH3CO)2O,
(CF3CO)2O
C N
4. Из аминов по реакции Зандмейера
NH2
NO2
NaNO2
HCl
H2O
K[Cu(CN)2]
+
CN + N2
N2 Cl
HBr, 60 OC
H2O
(65%) NO
NO2
2
5. Из сульфоновых кислот
SO2ONa
+
NaCN
бензолсульфанат
натрия
~ 300 OC
SN2Ar
CN
+
Na2SO3
бензонитрил
77
78.
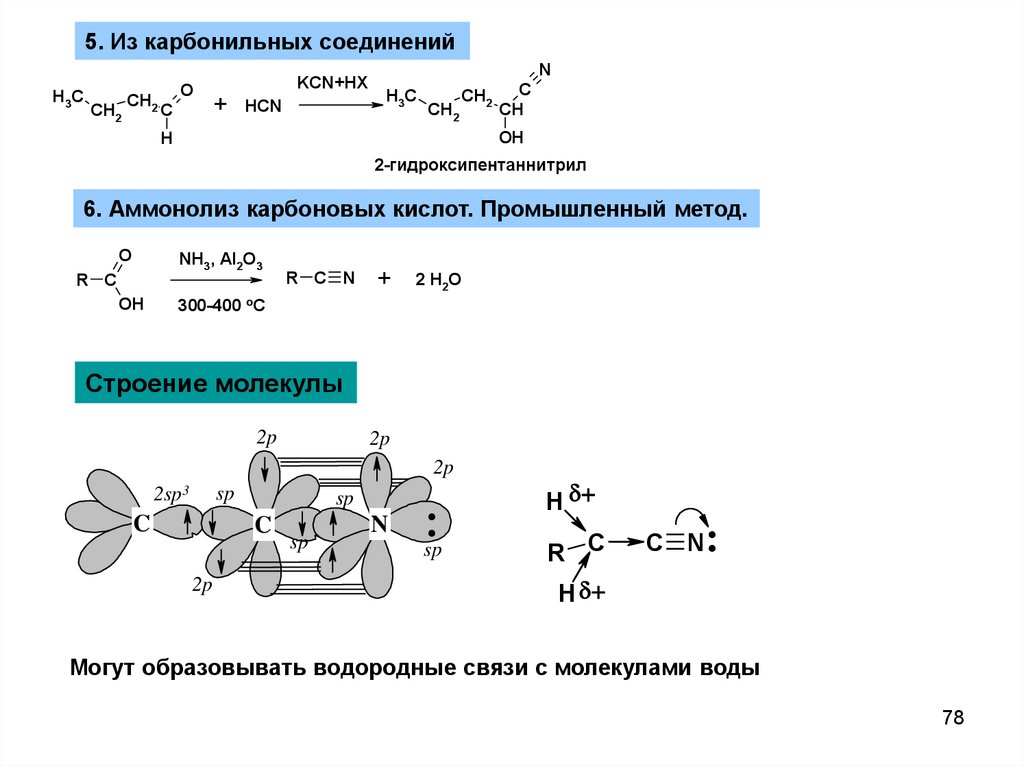
5. Из карбонильных соединенийH3C
CH2
CH2
O
C
+
KCN+HX
HCN
N
H3C
CH2
CH2
C
CH
OH
H
2-гидроксипентаннитрил
6. Аммонолиз карбоновых кислот. Промышленный метод.
O
NH3, Al2O3
R C
OH
300-400
R C N
+
2 H2O
oC
Строение молекулы
2p
2p
2p
2sp3
sp
C
sp
C
2p
sp
N
..
sp
H
R C
H
C N
..
Могут образовывать водородные связи с молекулами воды
78
79.
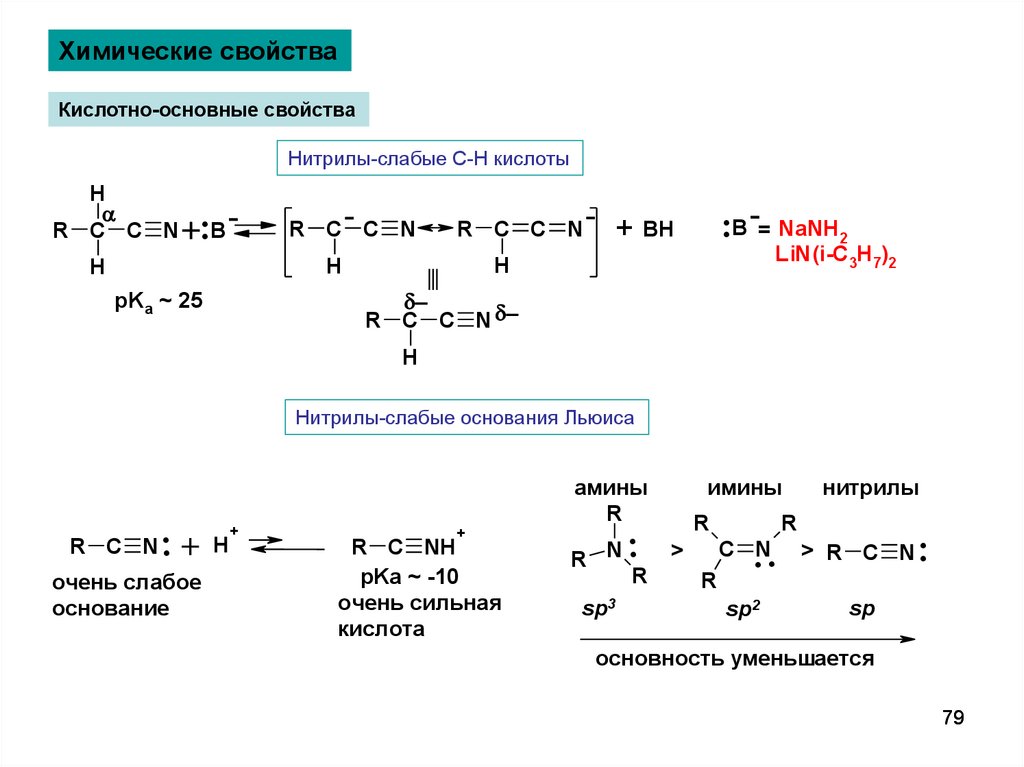
Химические свойстваКислотно-основные свойства
Нитрилы-слабые С-Н кислоты
H
.
R C C N . B
R C C N
R C C N
LiN(i-C3H7)2
H
H
H
.. B = NaNH
2
+ BH
R C C N
pKa ~ 25
H
Нитрилы-слабые основания Льюиса
R C
.
N. +
очень слабое
основание
H
+
+
R C NH
pKa ~ -10
очень сильная
кислота
амины
R
R
.
N.
R
sp3
имины
R
>
R
C .N.
sp2
R
нитрилы
> R C N ..
sp
основность уменьшается
79
80.
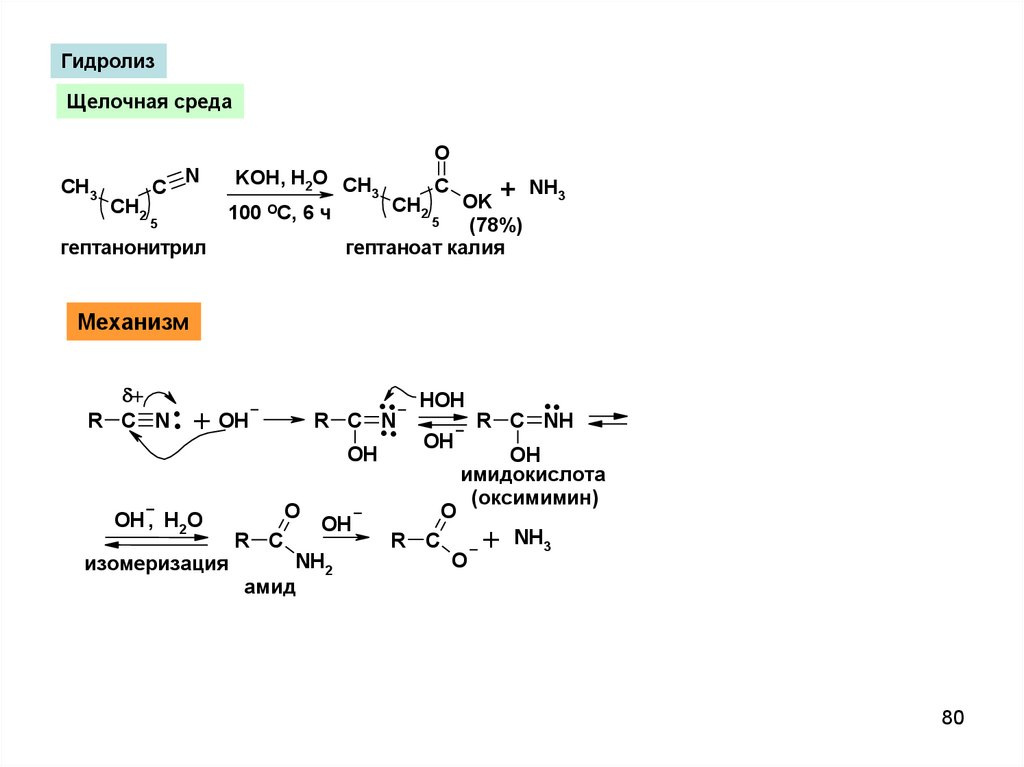
ГидролизЩелочная среда
O
CH3
CH2
C
N
5
гептанонитрил
KOH, H2O CH
C
3
+ NH3
OK
CH
O
2
100 C, 6 ч
5
(78%)
гептаноат калия
Механизм
.
R C N.
+ OH
R C
OH
OH , H2O
изомеризация
O
R C
OH
NH2
амид
..
..N
HOH
OH
O
R C
..
R C NH
OH
имидокислота
(оксимимин)
O
+
NH3
80
81.
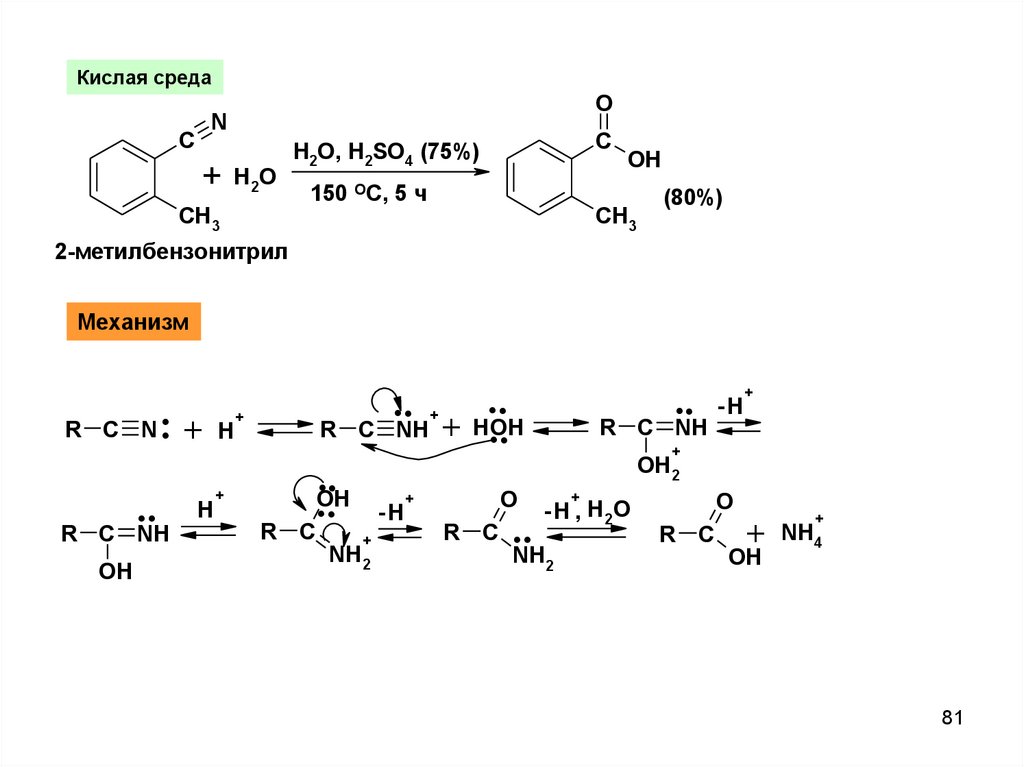
Кислая средаO
N
C
+
H 2O
CH3
C
H2O, H2SO4 (75%)
150 OC, 5 ч
OH
CH3
(80%)
2-метилбензонитрил
Механизм
.+
R C N.
..
R C NH
OH
H
H
+
R C
.. + ..
NH + HOH
..
R C
R C NH
-H
+
+
OH2
..
+
..
OH
..
-H
+
NH2
O
+
R C
..
NH2
O
+
- H , H2O
R C
+
OH
+
NH4
81
82.
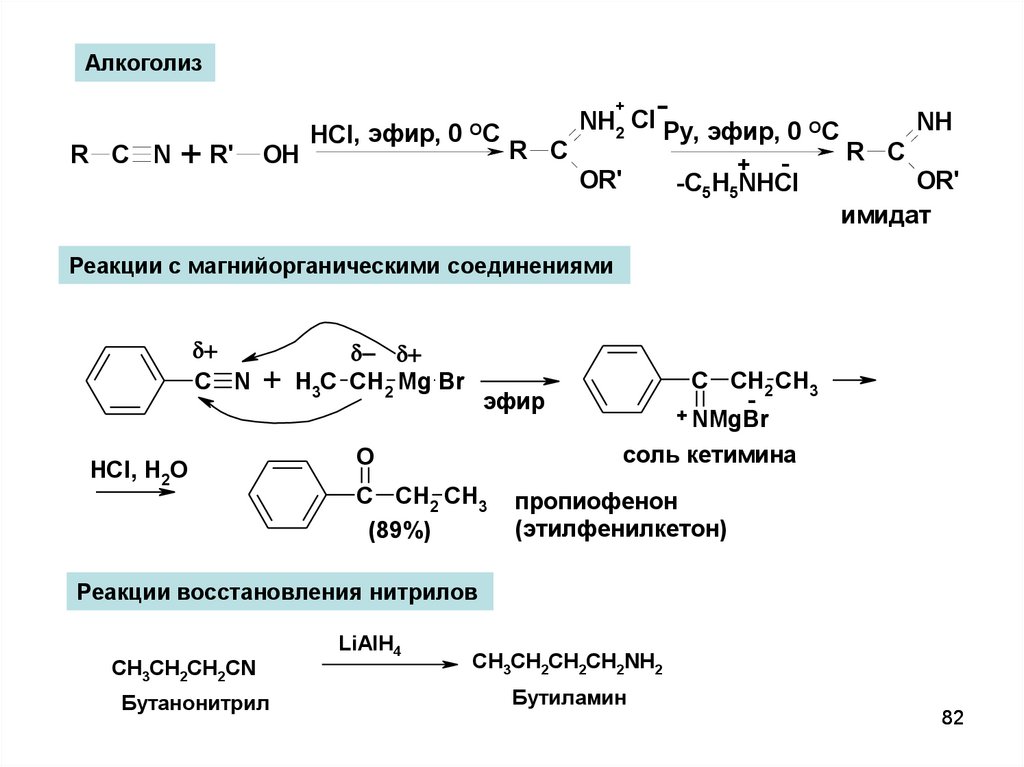
Алкоголиз+
R C N
+ R'
OH
HCl , эфир, 0 ОС
NH2 Cl Py, эфир, 0 ОС
NH
R C
R C
+ OR'
OR'
-C5H5NHCl
имидат
Реакции с магнийорганическими соединениями
C N
+
HCl, H2O
H3C CH2 Mg Br
C CH2 CH3
+ NMgBr
эфир
соль кетимина
O
C CH2 CH3
(89%)
пропиофенон
(этилфенилкетон)
Реакции восстановления нитрилов
СH3CH2CH2CN
Бутанонитрил
LiAlH4
СH3CH2CH2СН2NH2
Бутиламин
82
83.
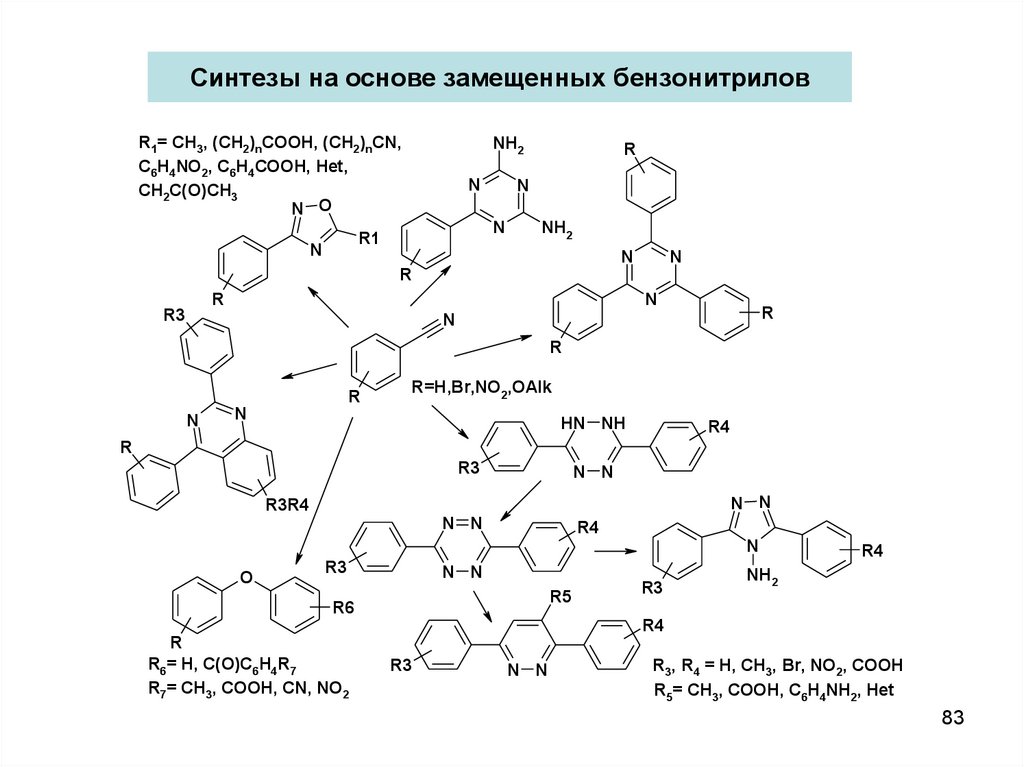
Синтезы на основе замещенных бензонитриловR1= CH3, (CH2)nCOOH, (CH2)nCN,
C6H4NO2, C6H4COOH, Het,
CH2C(O)CH3
N O
NH2
N
N
N
N
R1
R
NH2
N
R
R
R3
N
N
R
N
R
N
R
N
R=H,Br,NO2,OAlk
HN NH
R4
R
R3
N N
R3R4
O
N N
N N
R3
R4
N N
R5
R6
R
R6= H, C(O)C6H4R7
R7= CH3, COOH, CN, NO2
N
R3
R4
NH2
R4
R3
N N
R3, R4 = H, CH3, Br, NO2, COOH
R5= CH3, COOH, C6H4NH2, Het
83



 Химия
Химия








