Похожие презентации:
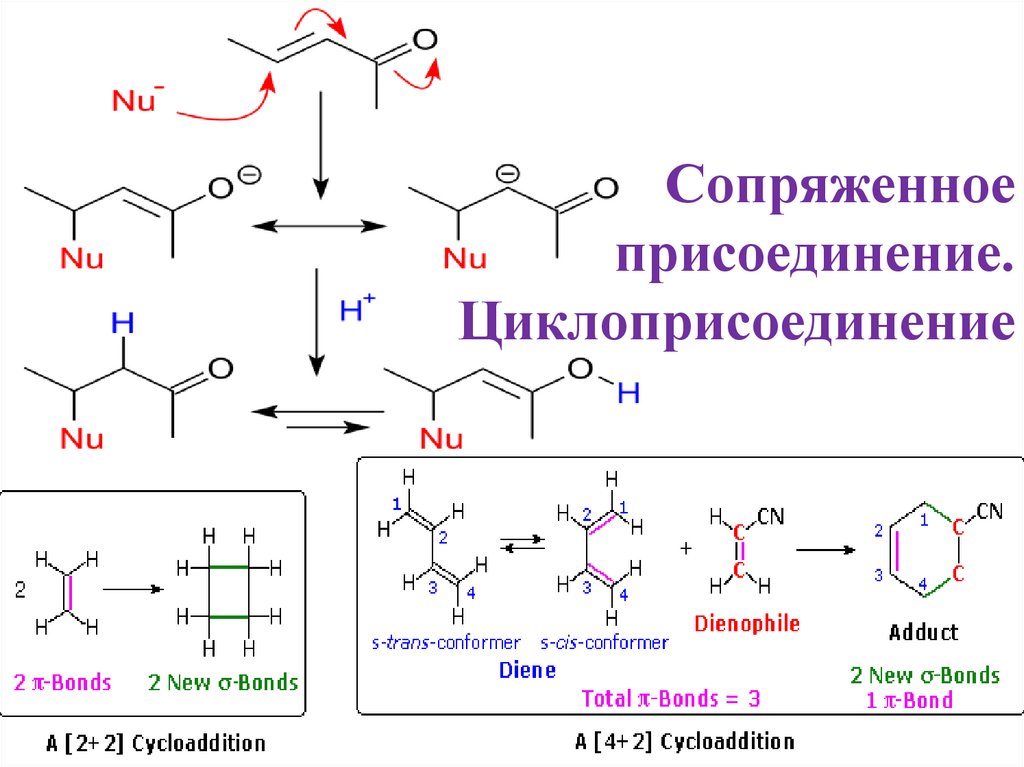
Сопряженное присоединение. Циклоприсоединениеie
1. Сопряженное присоединение. Циклоприсоединение
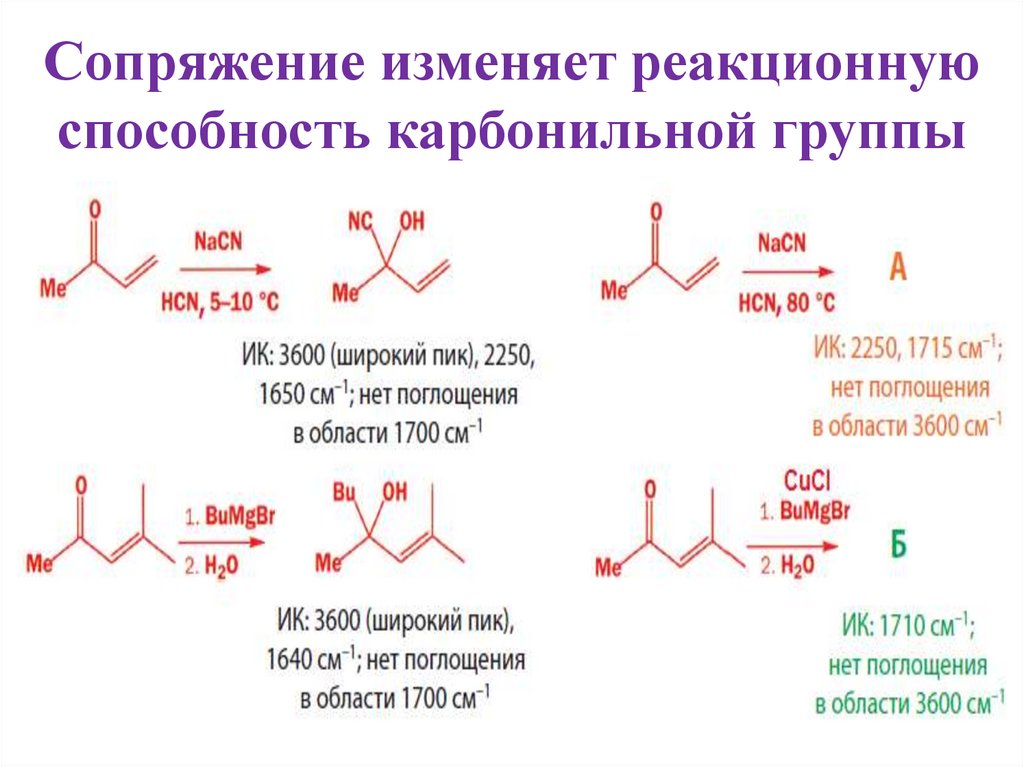
2. Сопряжение изменяет реакционную способность карбонильной группы
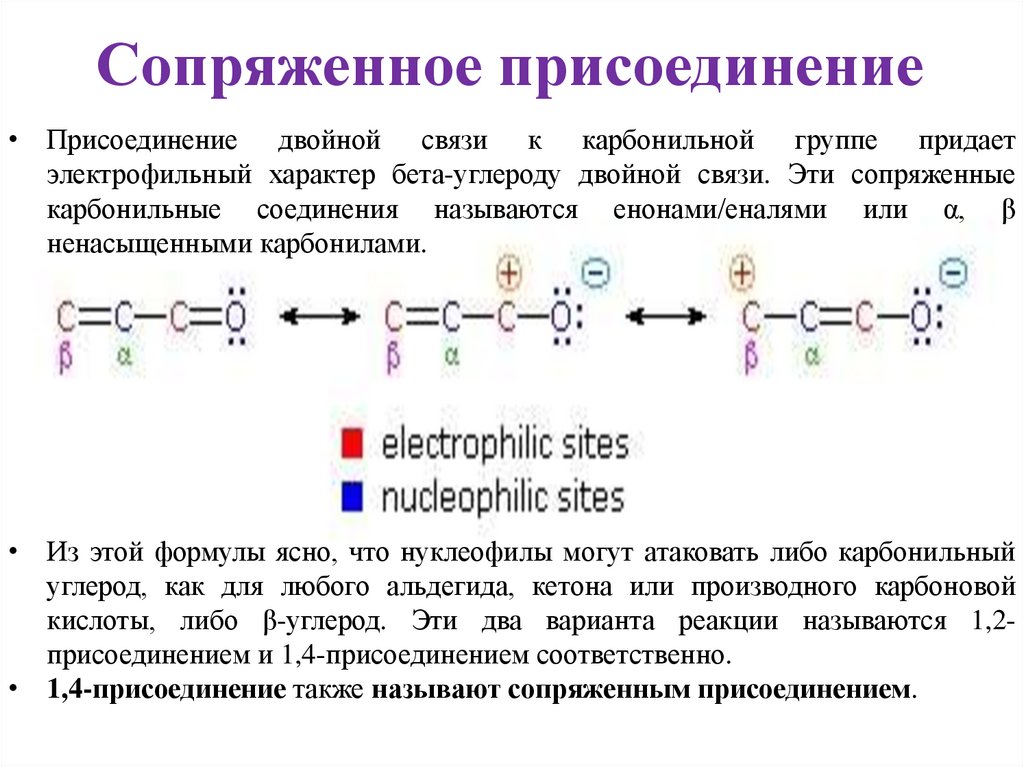
3. Сопряженное присоединение
• Присоединение двойной связи к карбонильной группе придаетэлектрофильный характер бета-углероду двойной связи. Эти сопряженные
карбонильные соединения называются енонами/еналями или α, β
ненасыщенными карбонилами.
• Из этой формулы ясно, что нуклеофилы могут атаковать либо карбонильный
углерод, как для любого альдегида, кетона или производного карбоновой
кислоты, либо β-углерод. Эти два варианта реакции называются 1,2присоединением и 1,4-присоединением соответственно.
• 1,4-присоединение также называют сопряженным присоединением.
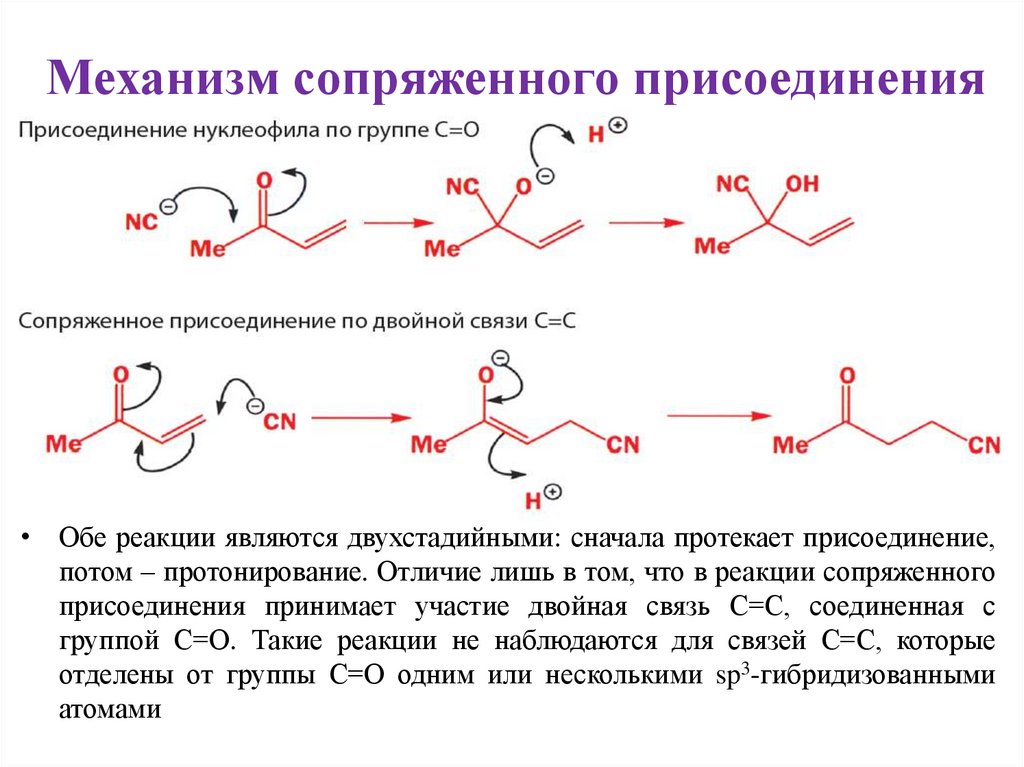
4. Механизм сопряженного присоединения
• Обе реакции являются двухстадийными: сначала протекает присоединение,потом – протонирование. Отличие лишь в том, что в реакции сопряженного
присоединения принимает участие двойная связь С=С, соединенная с
группой С=О. Такие реакции не наблюдаются для связей С=С, которые
отделены от группы С=О одним или несколькими sp3-гибридизованными
атомами
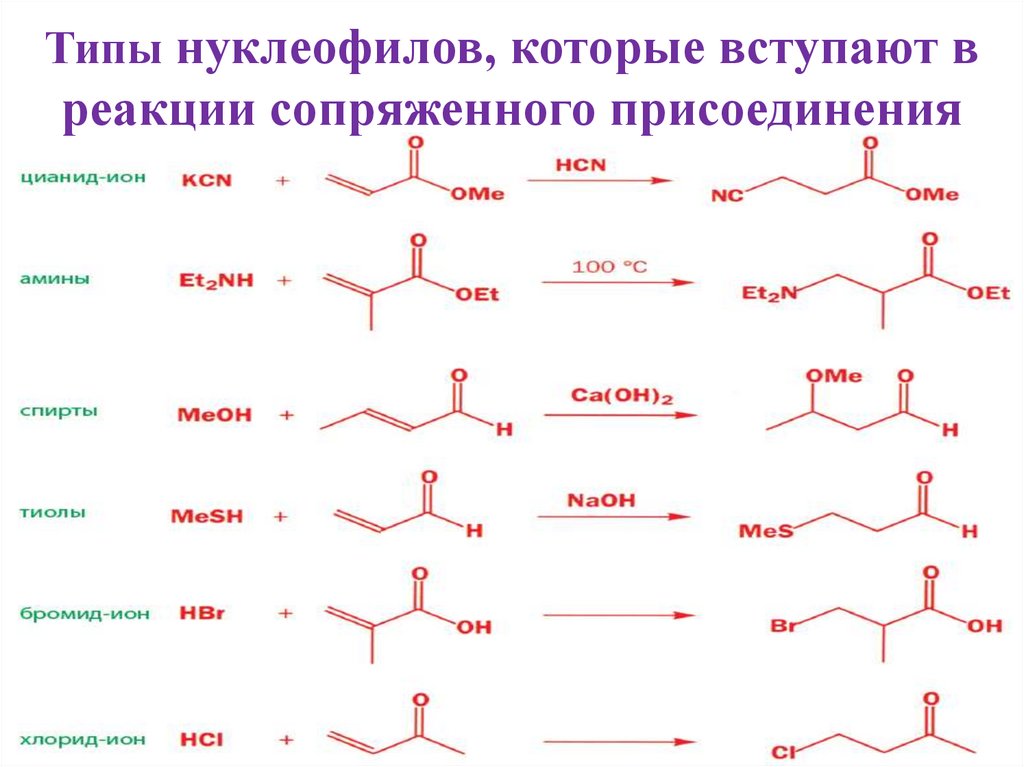
5. Типы нуклеофилов, которые вступают в реакции сопряженного присоединения
6. Молекулярные орбитали контролируют направление реакций сопряженного присоединения
• На стадии образованиясвязи
электроны
перемещаются с ВЗМО
нуклеофила на НСМО
ненасыщенного
карбонильного соединения.
• Наибольший коэффициент
в НСМО имеет β-атом
углерода α,β-ненасыщенной
системы.
• Второй
по
величине
коэффициент в НСМО
имеет атом углерода группы
С=О.
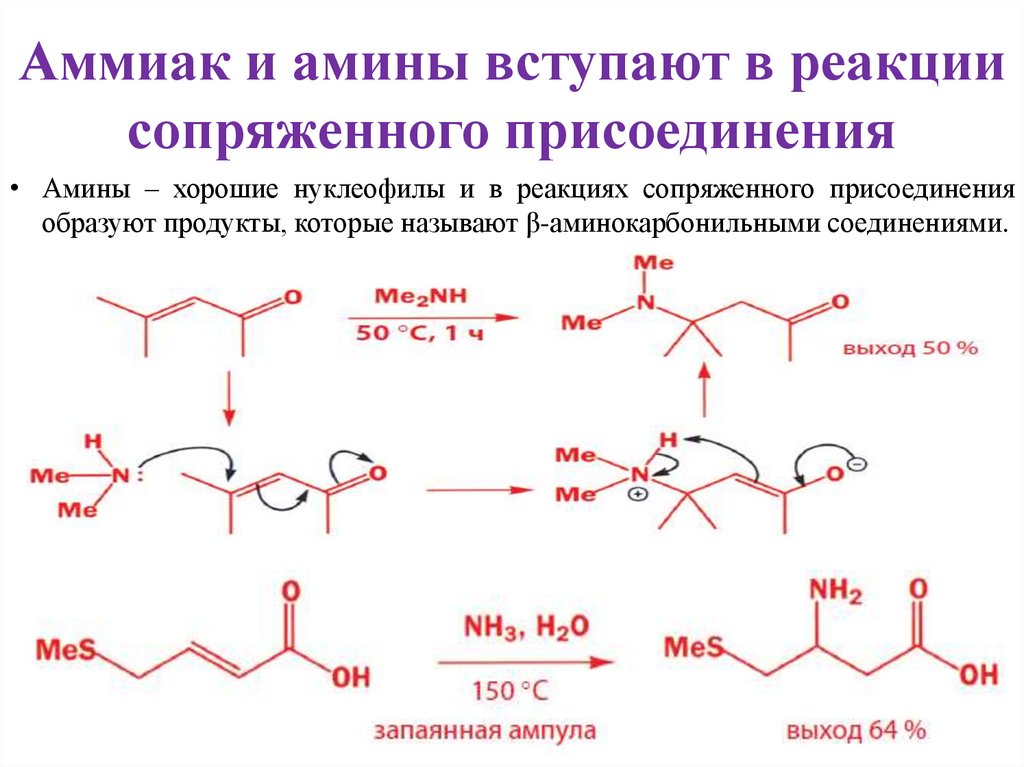
7. Аммиак и амины вступают в реакции сопряженного присоединения
• Амины – хорошие нуклеофилы и в реакциях сопряженного присоединенияобразуют продукты, которые называют β-аминокарбонильными соединениями.
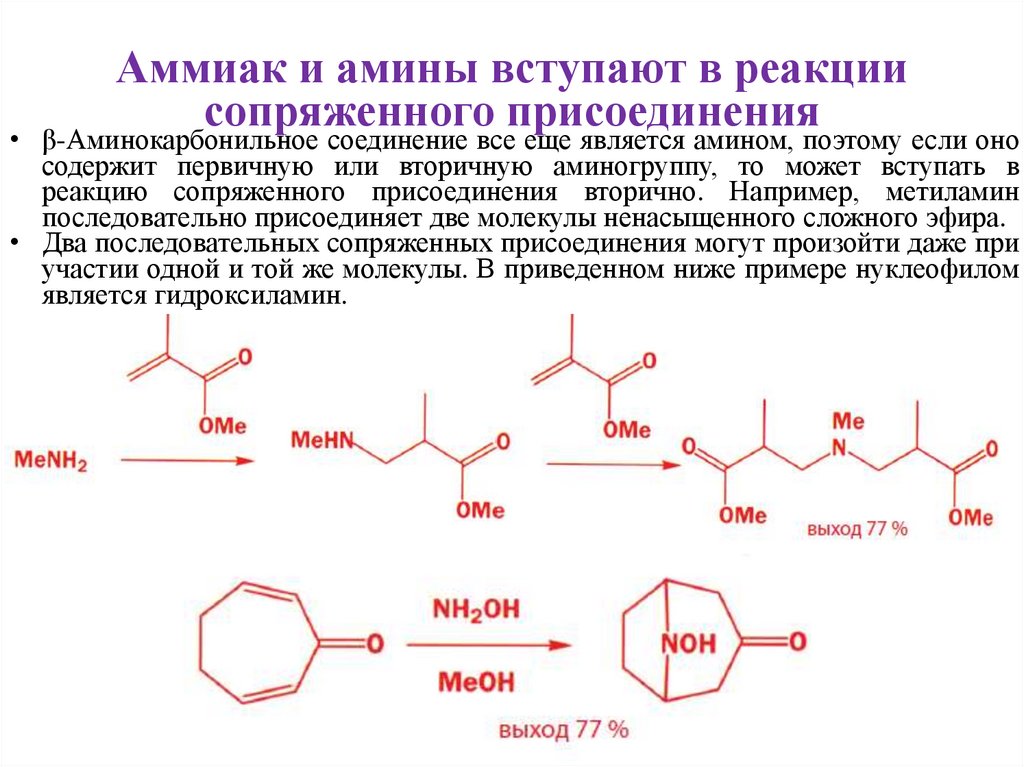
8. Аммиак и амины вступают в реакции сопряженного присоединения
• β-Аминокарбонильное соединение все еще является амином, поэтому если оносодержит первичную или вторичную аминогруппу, то может вступать в
реакцию сопряженного присоединения вторично. Например, метиламин
последовательно присоединяет две молекулы ненасыщенного сложного эфира.
• Два последовательных сопряженных присоединения могут произойти даже при
участии одной и той же молекулы. В приведенном ниже примере нуклеофилом
является гидроксиламин.
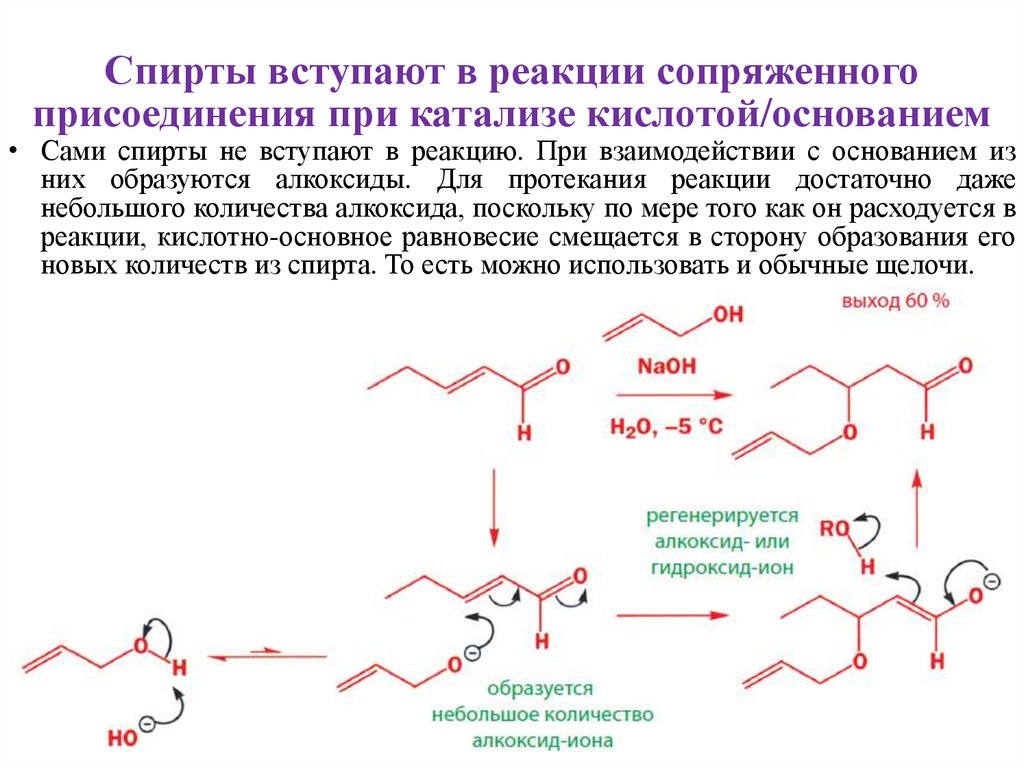
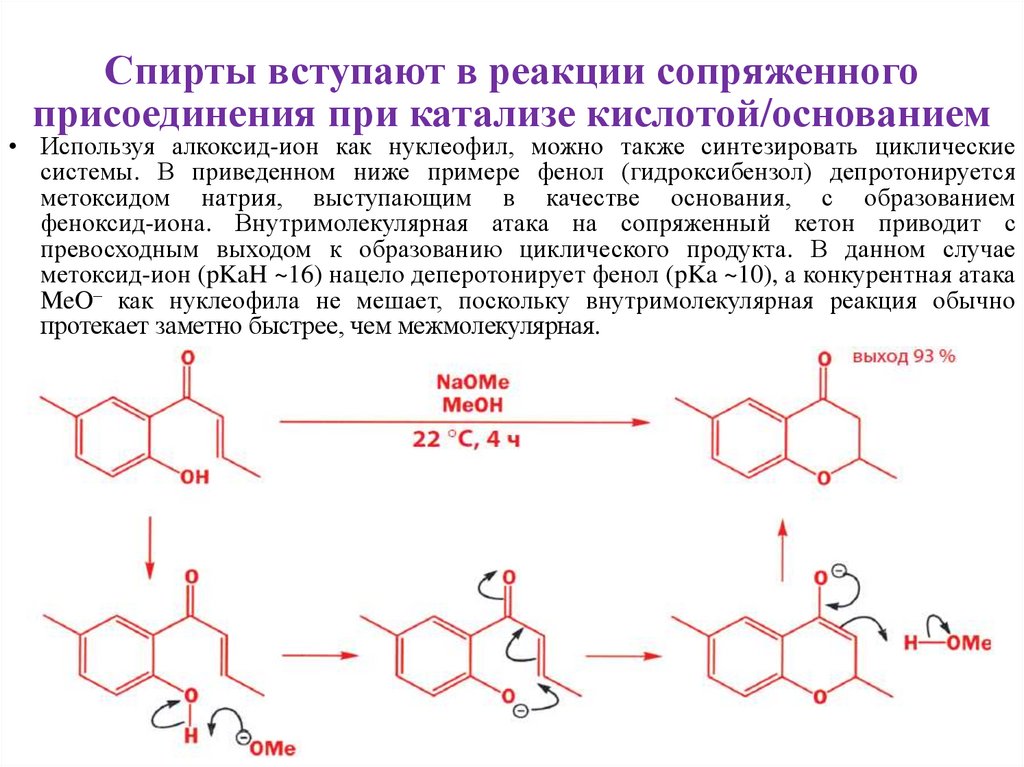
9. Спирты вступают в реакции сопряженного присоединения при катализе кислотой/основанием
• Сами спирты не вступают в реакцию. При взаимодействии с основанием изних образуются алкоксиды. Для протекания реакции достаточно даже
небольшого количества алкоксида, поскольку по мере того как он расходуется в
реакции, кислотно-основное равновесие смещается в сторону образования его
новых количеств из спирта. То есть можно использовать и обычные щелочи.
10. Спирты вступают в реакции сопряженного присоединения при катализе кислотой/основанием
• Используя алкоксид-ион как нуклеофил, можно также синтезировать циклическиесистемы. В приведенном ниже примере фенол (гидроксибензол) депротонируется
метоксидом натрия, выступающим в качестве основания, с образованием
феноксид-иона. Внутримолекулярная атака на сопряженный кетон приводит с
превосходным выходом к образованию циклического продукта. В данном случае
метоксид-ион (pKaH ~16) нацело деперотонирует фенол (pKa ~10), а конкурентная атака
MeO– как нуклеофила не мешает, поскольку внутримолекулярная реакция обычно
протекает заметно быстрее, чем межмолекулярная.
11. Сопряженное присоединение или прямая атака по карбонильной группе?
Направление атаки нуклеофила зависит от:• условий реакции,
• природы α,β-ненасыщенного карбонильного соединения,
• типа нуклеофила.
Условия реакции
• Продукт, который образуется быстрее, называют кинетическим продуктом.
• Более стабильный продукт называют термодинамическим продуктом.
Аналогично
• Условия реакции, при которых образуется кинетический продукт, называют
условиями кинетического контроля.
• Условия реакции, при которых образуется термодинамический продукт,
называют условиями термодинамического контроля.
• Прямая атака по карбонильной группе идет быстрее, чем сопряженное
присоединение. Хотя атом углерода, находящийся в β-положении по
отношению к карбонильной группе, и несет частичный положительный заряд,
на карбонильном атоме углерода положительный заряд больше, и
электростатическое притяжение заряженного нуклеофила ускоряет атаку по
карбонильному атому углерода.
• Продукт сопряженного присоединения более стабилен. В продукте
сопряженного присоединения образуется σ-связь С–С, разрывается π-связь
С=С, но сохраняется π-связь С=О.
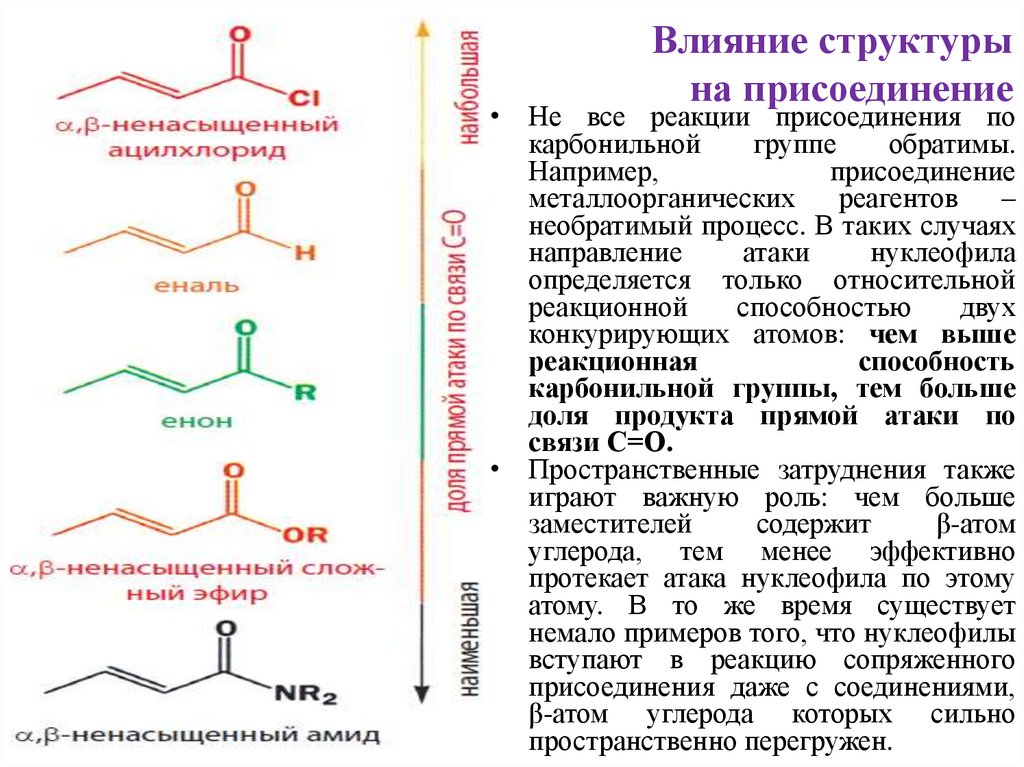
12. Влияние структуры на присоединение
• Не все реакции присоединения покарбонильной
группе
обратимы.
Например,
присоединение
металлоорганических
реагентов
–
необратимый процесс. В таких случаях
направление
атаки
нуклеофила
определяется только относительной
реакционной
способностью
двух
конкурирующих атомов: чем выше
реакционная
способность
карбонильной группы, тем больше
доля продукта прямой атаки по
связи С=О.
• Пространственные затруднения также
играют важную роль: чем больше
заместителей
содержит
β-атом
углерода, тем менее эффективно
протекает атака нуклеофила по этому
атому. В то же время существует
немало примеров того, что нуклеофилы
вступают в реакцию сопряженного
присоединения даже с соединениями,
β-атом углерода которых сильно
пространственно перегружен.
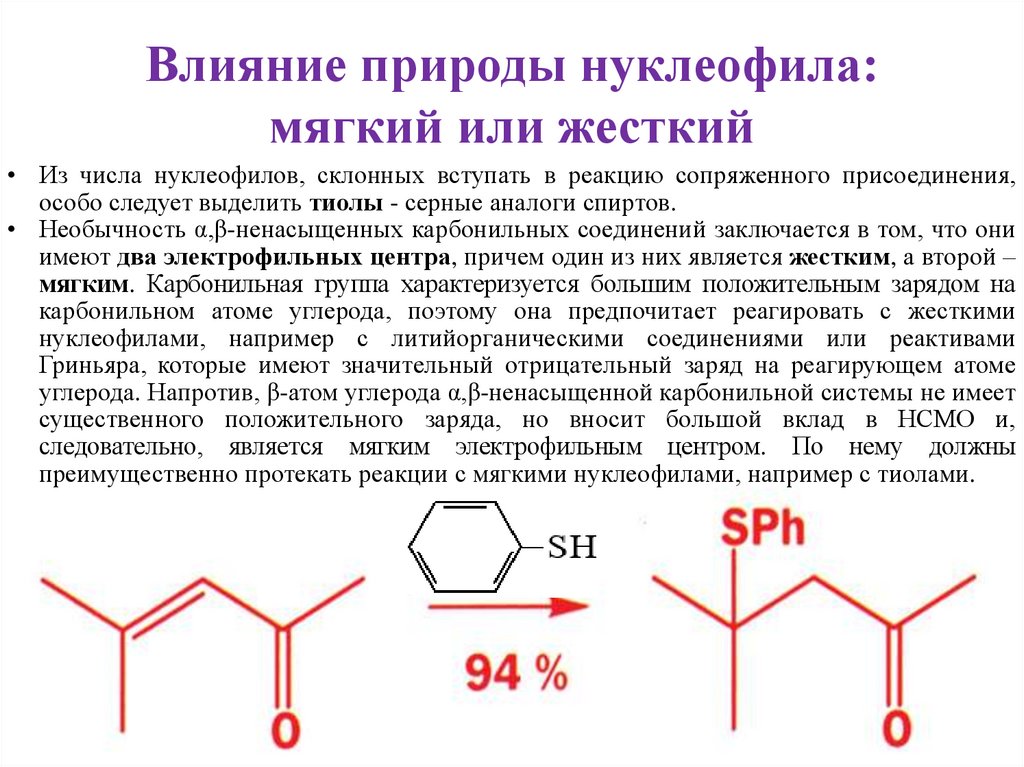
13. Влияние природы нуклеофила: мягкий или жесткий
• Из числа нуклеофилов, склонных вступать в реакцию сопряженного присоединения,особо следует выделить тиолы - серные аналоги спиртов.
• Необычность α,β-ненасыщенных карбонильных соединений заключается в том, что они
имеют два электрофильных центра, причем один из них является жестким, а второй –
мягким. Карбонильная группа характеризуется большим положительным зарядом на
карбонильном атоме углерода, поэтому она предпочитает реагировать с жесткими
нуклеофилами, например с литийорганическими соединениями или реактивами
Гриньяра, которые имеют значительный отрицательный заряд на реагирующем атоме
углерода. Напротив, β-атом углерода α,β-ненасыщенной карбонильной системы не имеет
существенного положительного заряда, но вносит большой вклад в НСМО и,
следовательно, является мягким электрофильным центром. По нему должны
преимущественно протекать реакции с мягкими нуклеофилами, например с тиолами.
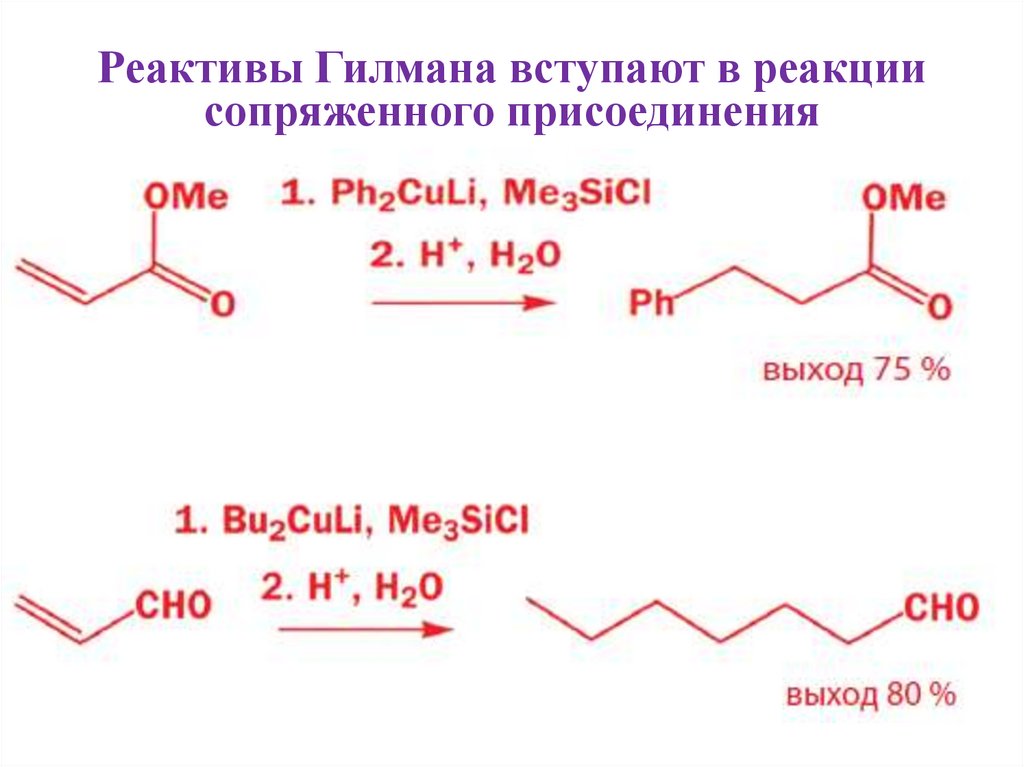
14. Соли меди(I) меняют место присоединения металлоорганических реагентов
• Действие соли меди основано на реакции трансметаллирования, в которую она вступаетс реактивом Гриньяра, образуя в результате медьорганическое соединение.
Медьорганические соединения – более мягкие нуклеофилы, чем реактивы Гриньяра,
поэтому они вступают в реакцию сопряженного присоединения по более мягкому
электрофильному центру – β-углероду двойной связи С=С. После того как
медьорганическое соединение прореагировало, выделившаяся при этом соль меди вновь
вступает в реакцию трансметаллирования с реактивом Гриньяра, и этот цикл
повторяется многократно.
15. Реактивы Гилмана вступают в реакции сопряженного присоединения
16.
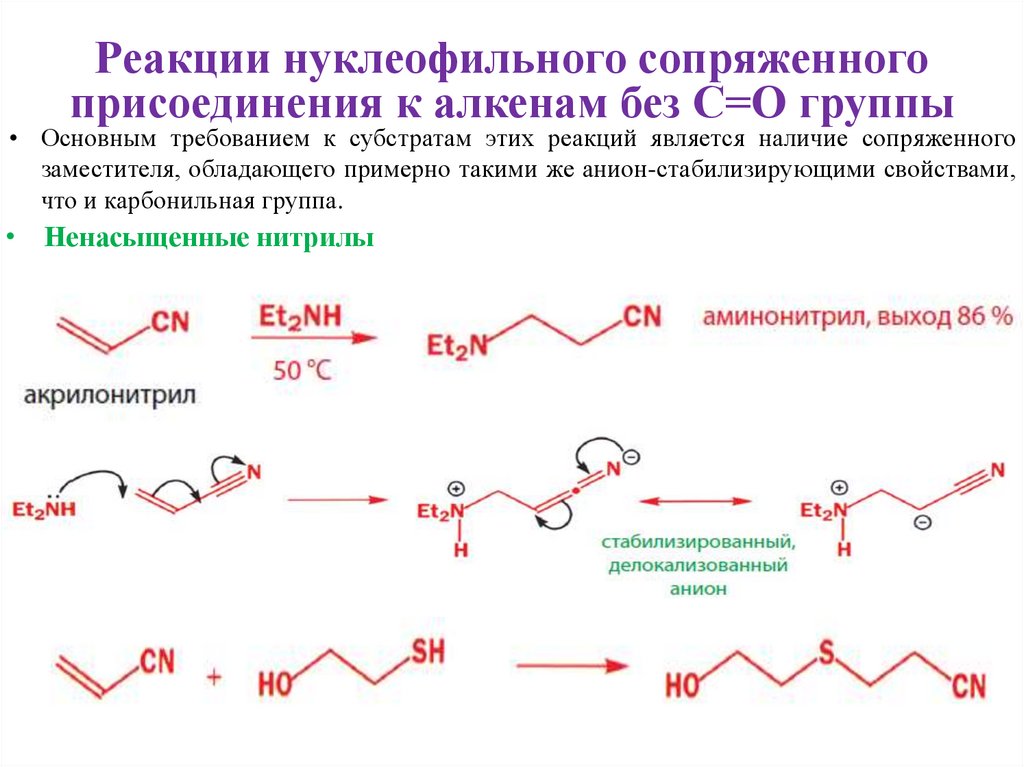
1,2 и 1,4-нуклеофильное присоединение17. Реакции нуклеофильного сопряженного присоединения к алкенам без С=O группы
• Основным требованием к субстратам этих реакций является наличие сопряженногозаместителя, обладающего примерно такими же анион-стабилизирующими свойствами,
что и карбонильная группа.
• Ненасыщенные нитрилы
18.
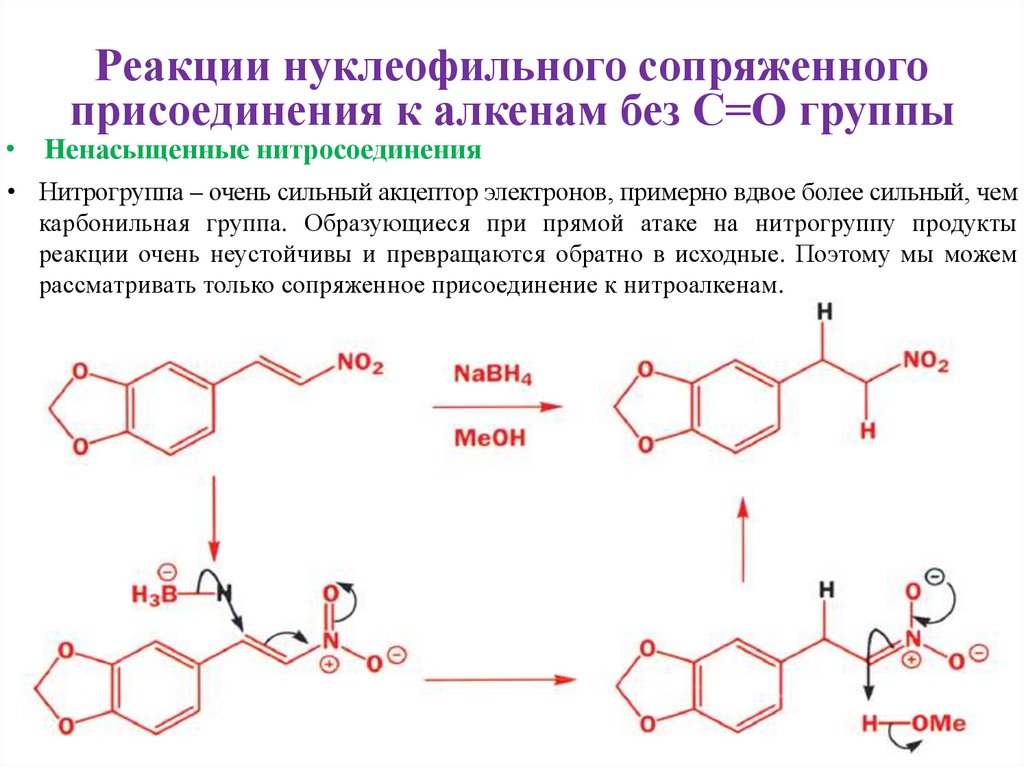
Реакции нуклеофильного сопряженногоприсоединения к алкенам без С=O группы
• Ненасыщенные нитросоединения
• Нитрогруппа – очень сильный акцептор электронов, примерно вдвое более сильный, чем
карбонильная группа. Образующиеся при прямой атаке на нитрогруппу продукты
реакции очень неустойчивы и превращаются обратно в исходные. Поэтому мы можем
рассматривать только сопряженное присоединение к нитроалкенам.
19.
Перициклические реакции• Тип реакций, при протекании которых электроны перемещаются по циклу, и
при этом не возникает никаких интермедиатов. Наиболее известный пример
перициклических реакций – реакция Дильса–Альдера.
• Эта реакция протекает в одну стадию просто при нагревании. Мы можем
изобразить механизм, в котором электроны перемещаются по периметру
шестичленного цикла.
• В действительности электроны по кругу не перемещаются. Две π-связи
разрываются, и две σ-связи образуются вместо них за счет перемещения
электронов с π-орбиталей на σ-орбитали. Такая реакция называется
циклоприсоединением.
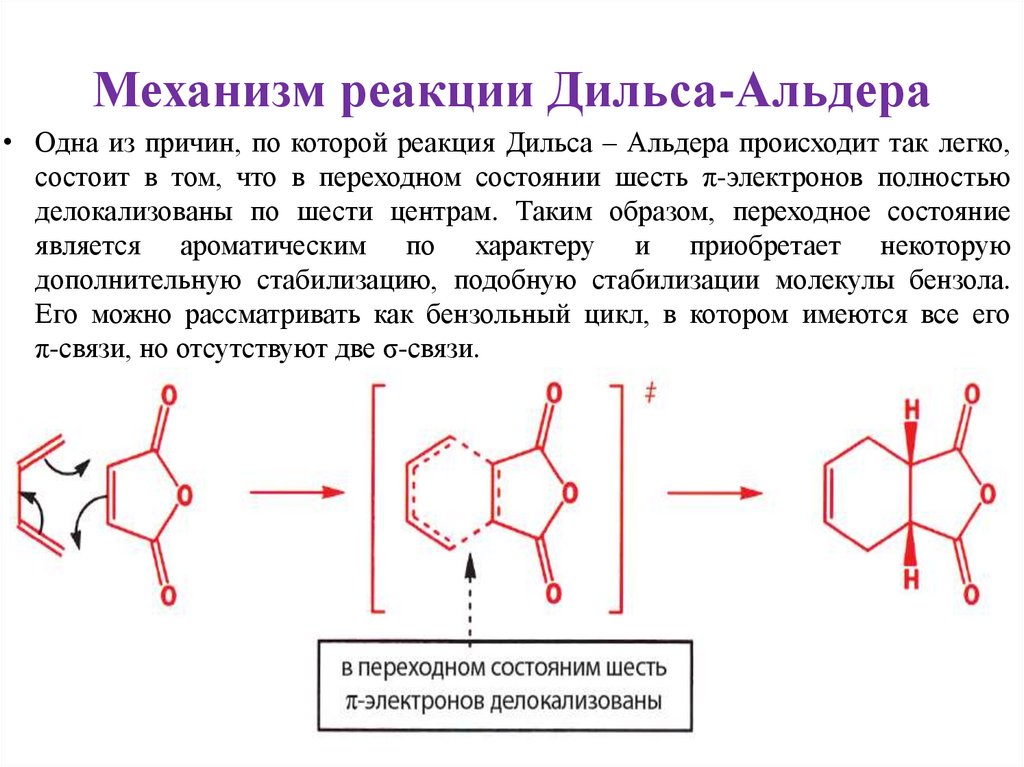
20.
Механизм реакции Дильса-Альдера• Одна из причин, по которой реакция Дильса – Альдера происходит так легко,
состоит в том, что в переходном состоянии шесть π-электронов полностью
делокализованы по шести центрам. Таким образом, переходное состояние
является ароматическим по характеру и приобретает некоторую
дополнительную стабилизацию, подобную стабилизации молекулы бензола.
Его можно рассматривать как бензольный цикл, в котором имеются все его
π-связи, но отсутствуют две σ-связи.
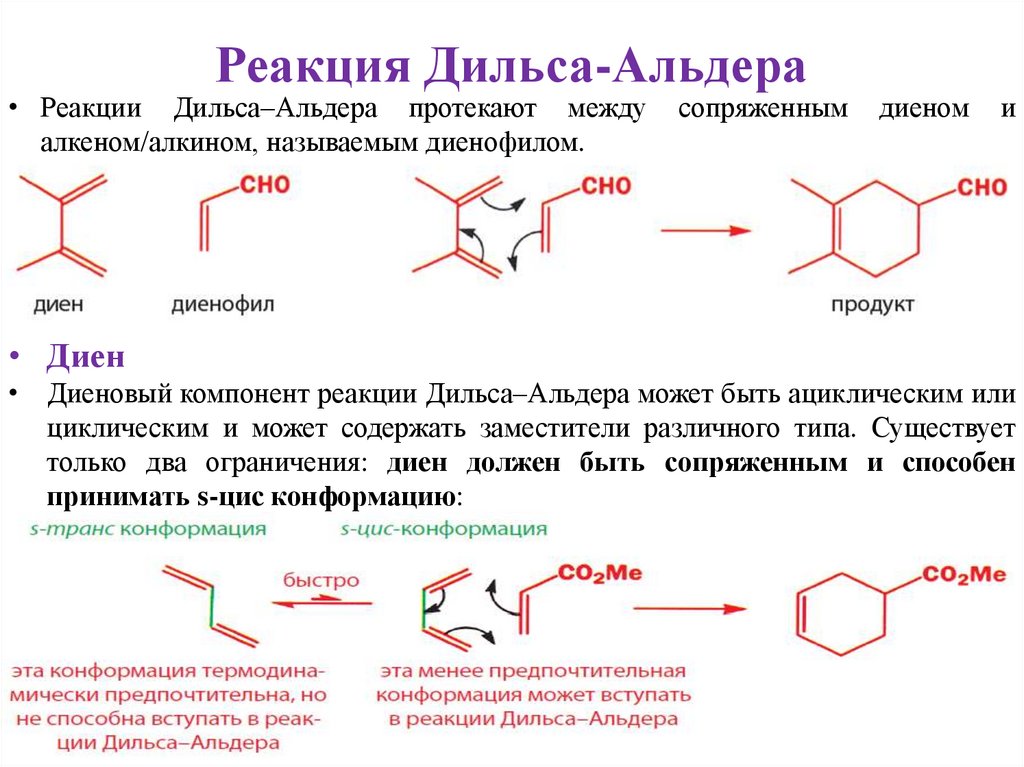
21.
Реакция Дильса-Альдера• Реакции Дильса–Альдера протекают между
алкеном/алкином, называемым диенофилом.
сопряженным
диеном
и
• Диен
• Диеновый компонент реакции Дильса–Альдера может быть ациклическим или
циклическим и может содержать заместители различного типа. Существует
только два ограничения: диен должен быть сопряженным и способен
принимать s-цис конформацию:
22.
Реакция Дильса-Альдера• Циклические диены, которые постоянно находятся в s-цис-конформации,
исключительно хороши для реакций Дильса–Альдера:
23.
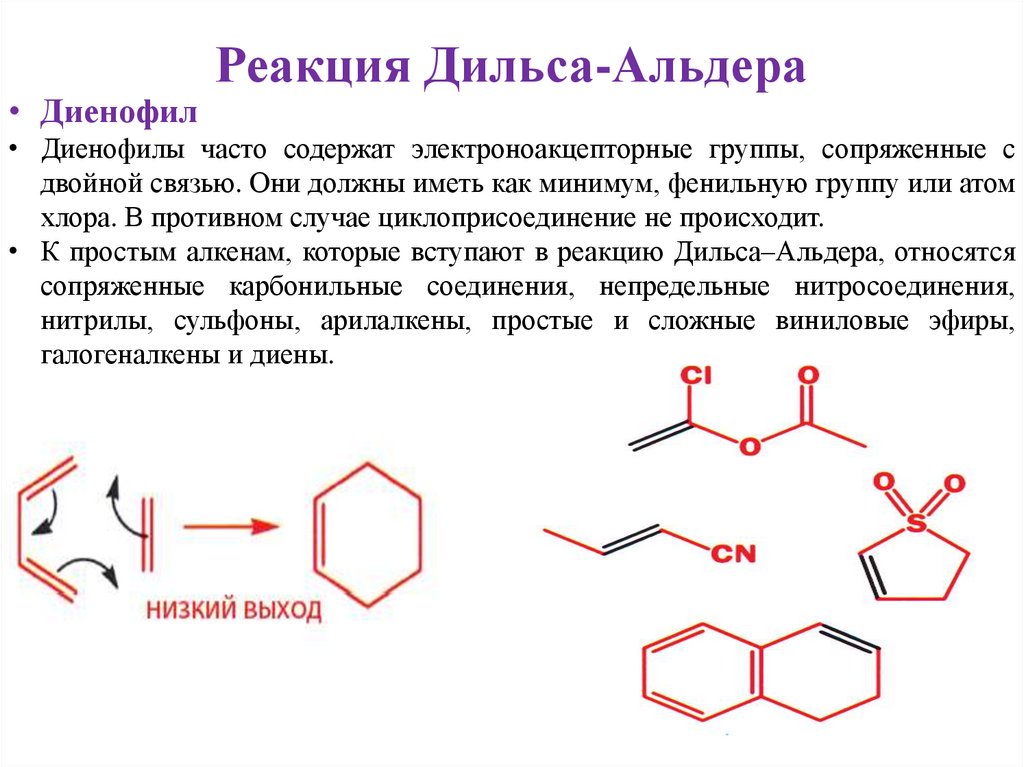
• ДиенофилРеакция Дильса-Альдера
• Диенофилы часто содержат электроноакцепторные группы, сопряженные с
двойной связью. Они должны иметь как минимум, фенильную группу или атом
хлора. В противном случае циклоприсоединение не происходит.
• К простым алкенам, которые вступают в реакцию Дильса–Альдера, относятся
сопряженные карбонильные соединения, непредельные нитросоединения,
нитрилы, сульфоны, арилалкены, простые и сложные виниловые эфиры,
галогеналкены и диены.
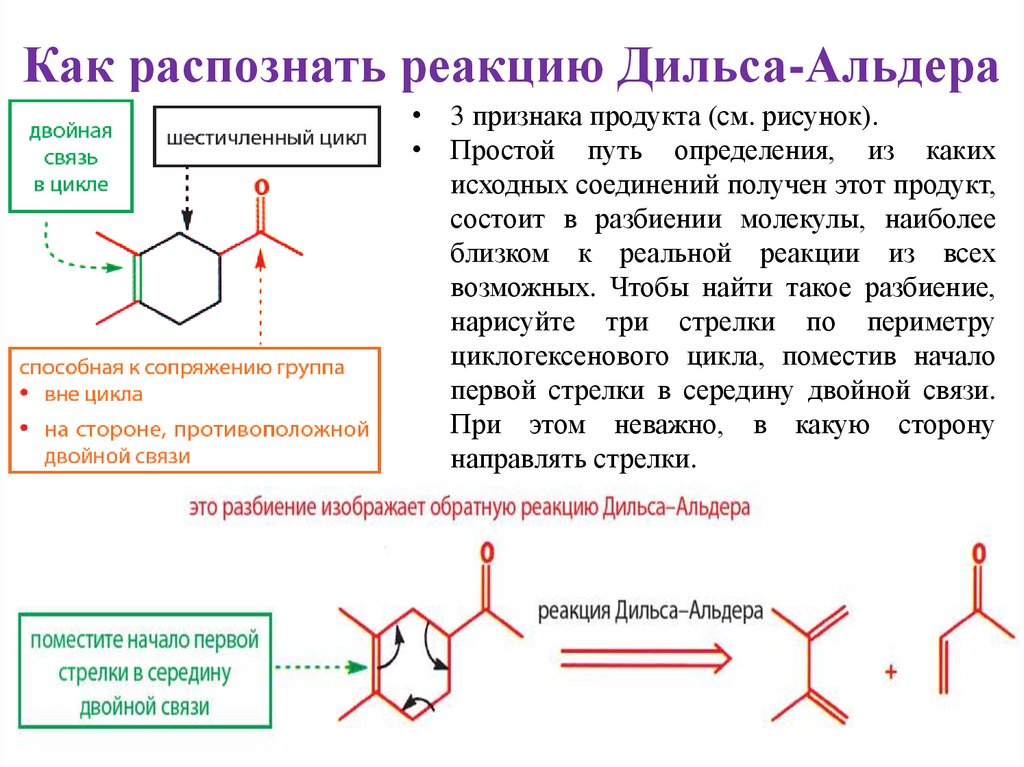
24.
Как распознать реакцию Дильса-Альдера• 3 признака продукта (см. рисунок).
• Простой путь определения, из каких
исходных соединений получен этот продукт,
состоит в разбиении молекулы, наиболее
близком к реальной реакции из всех
возможных. Чтобы найти такое разбиение,
нарисуйте три стрелки по периметру
циклогексенового цикла, поместив начало
первой стрелки в середину двойной связи.
При этом неважно, в какую сторону
направлять стрелки.
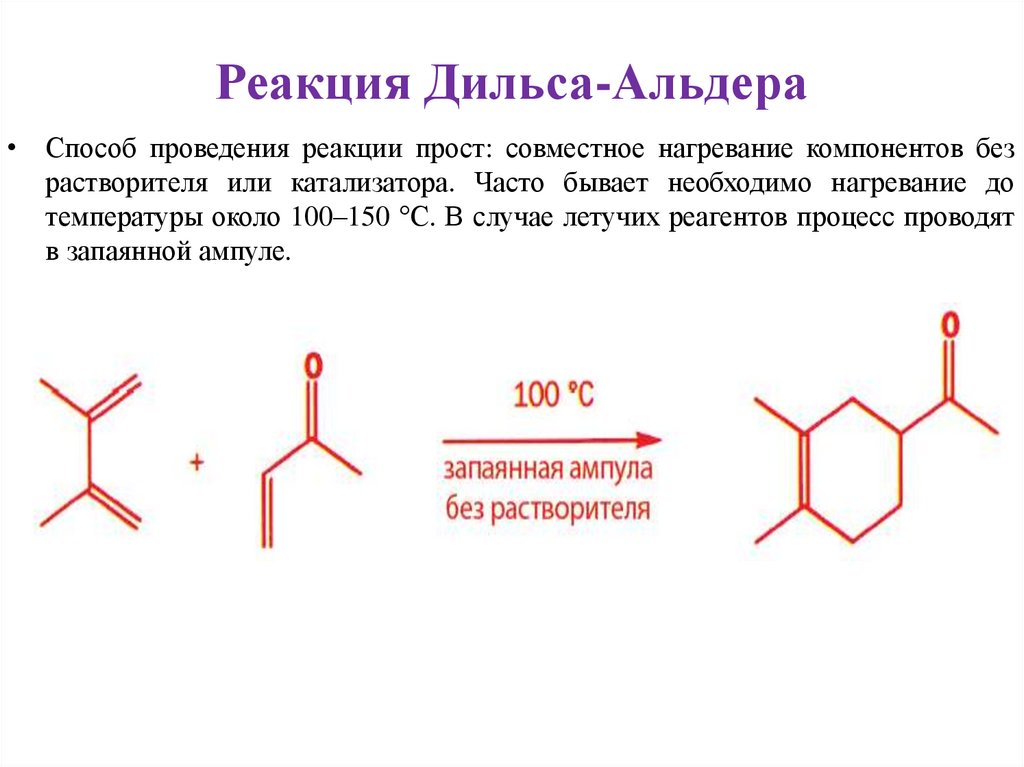
25.
Реакция Дильса-Альдера• Способ проведения реакции прост: совместное нагревание компонентов без
растворителя или катализатора. Часто бывает необходимо нагревание до
температуры около 100–150 °С. В случае летучих реагентов процесс проводят
в запаянной ампуле.
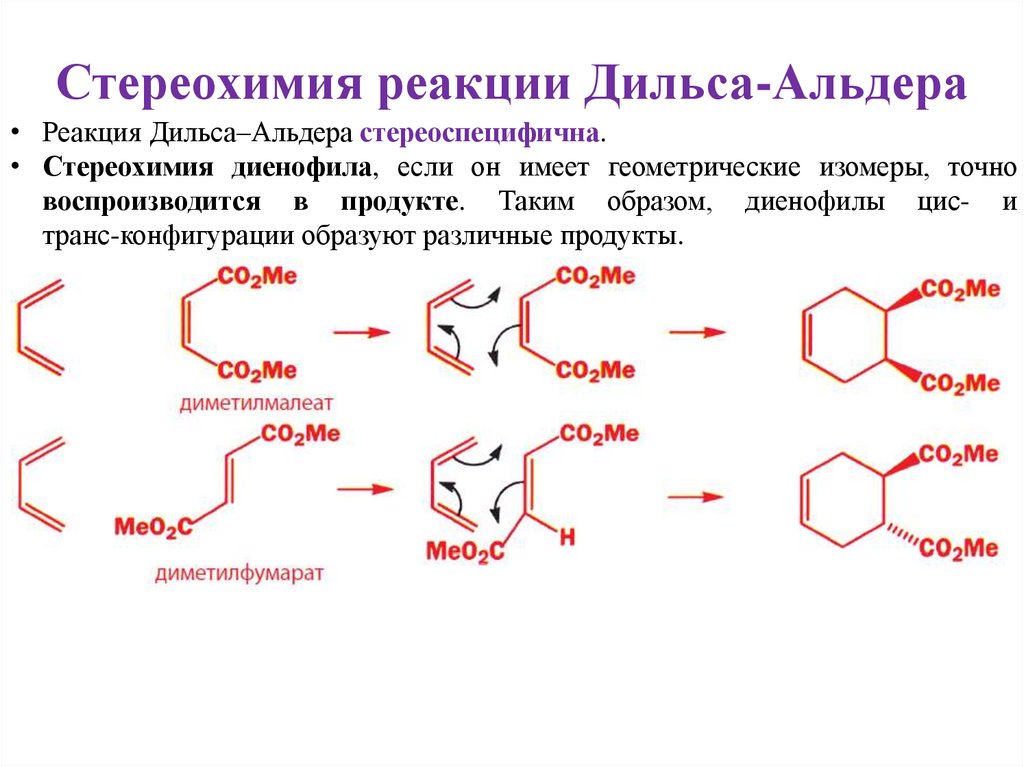
26.
Стереохимия реакции Дильса-Альдера• Реакция Дильса–Альдера стереоспецифична.
• Стереохимия диенофила, если он имеет геометрические изомеры, точно
воспроизводится в продукте. Таким образом, диенофилы цис- и
транс-конфигурации образуют различные продукты.
27.
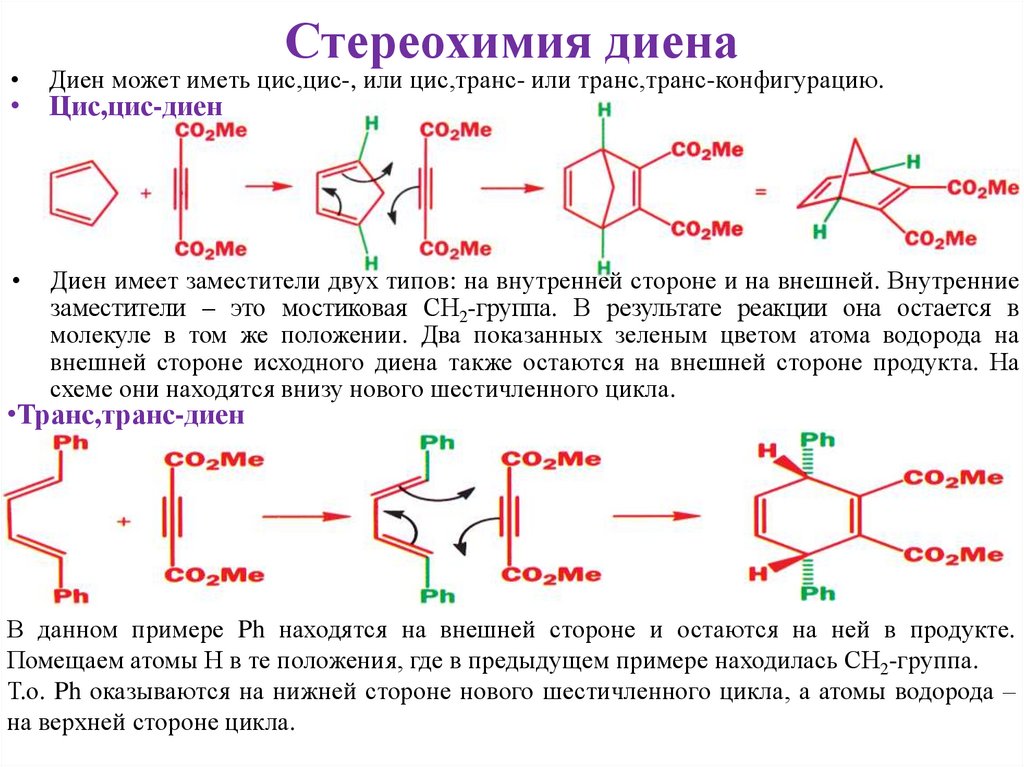
Стереохимия диенаДиен может иметь цис,цис-, или цис,транс- или транс,транс-конфигурацию.
Диен имеет заместители двух типов: на внутренней стороне и на внешней. Внутренние
заместители – это мостиковая СН2-группа. В результате реакции она остается в
молекуле в том же положении. Два показанных зеленым цветом атома водорода на
внешней стороне исходного диена также остаются на внешней стороне продукта. На
схеме они находятся внизу нового шестичленного цикла.
• Цис,цис-диен
•Транс,транс-диен
В данном примере Ph находятся на внешней стороне и остаются на ней в продукте.
Помещаем атомы Н в те положения, где в предыдущем примере находилась СН2-группа.
Т.о. Ph оказываются на нижней стороне нового шестичленного цикла, а атомы водорода –
на верхней стороне цикла.
28.
Стереохимия диенаДиен может иметь цис,цис-, или цис,транс- или транс,транс-конфигурацию.
Как и в двух предыдущих случаях внутренние заместители в продукте оказываются
сверху, а внешние - снизу. Два заместителя в результате реакции оказываются
расположенными с противоположных сторон нового шестичленного цикла.
• Цис,транс-диен
29.
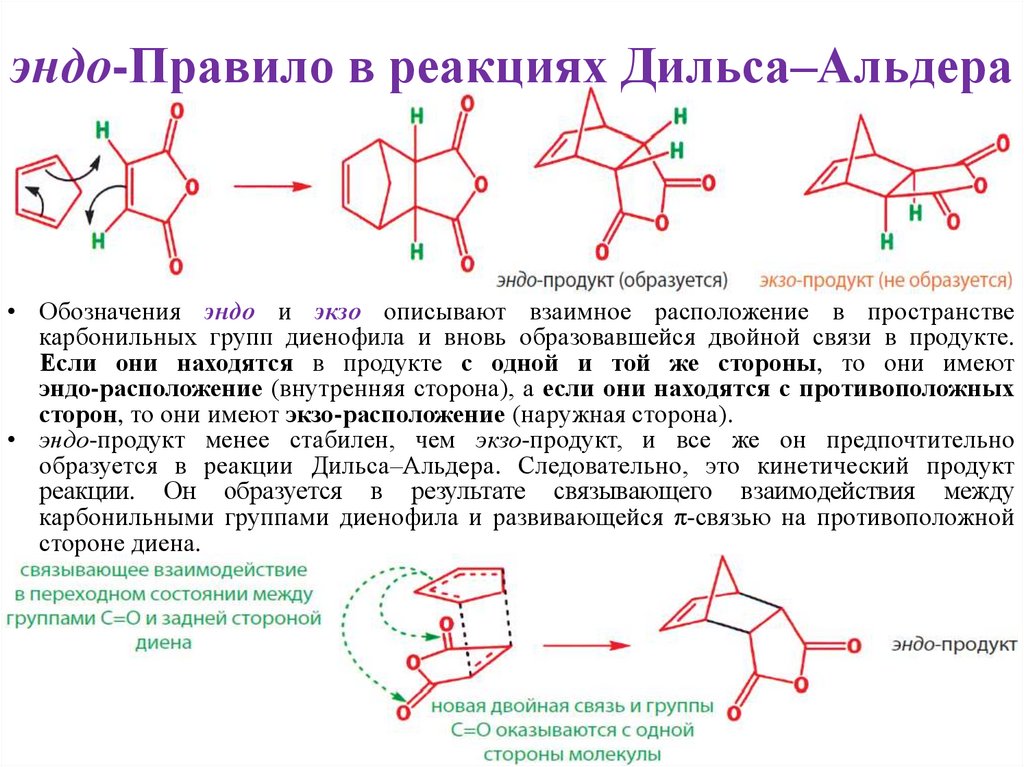
эндо-Правило в реакциях Дильса–Альдера• Обозначения эндо и экзо описывают взаимное расположение в пространстве
карбонильных групп диенофила и вновь образовавшейся двойной связи в продукте.
Если они находятся в продукте с одной и той же стороны, то они имеют
эндо-расположение (внутренняя сторона), а если они находятся с противоположных
сторон, то они имеют экзо-расположение (наружная сторона).
• эндо-продукт менее стабилен, чем экзо-продукт, и все же он предпочтительно
образуется в реакции Дильса–Альдера. Следовательно, это кинетический продукт
реакции. Он образуется в результате связывающего взаимодействия между
карбонильными группами диенофила и развивающейся π-связью на противоположной
стороне диена.
30.
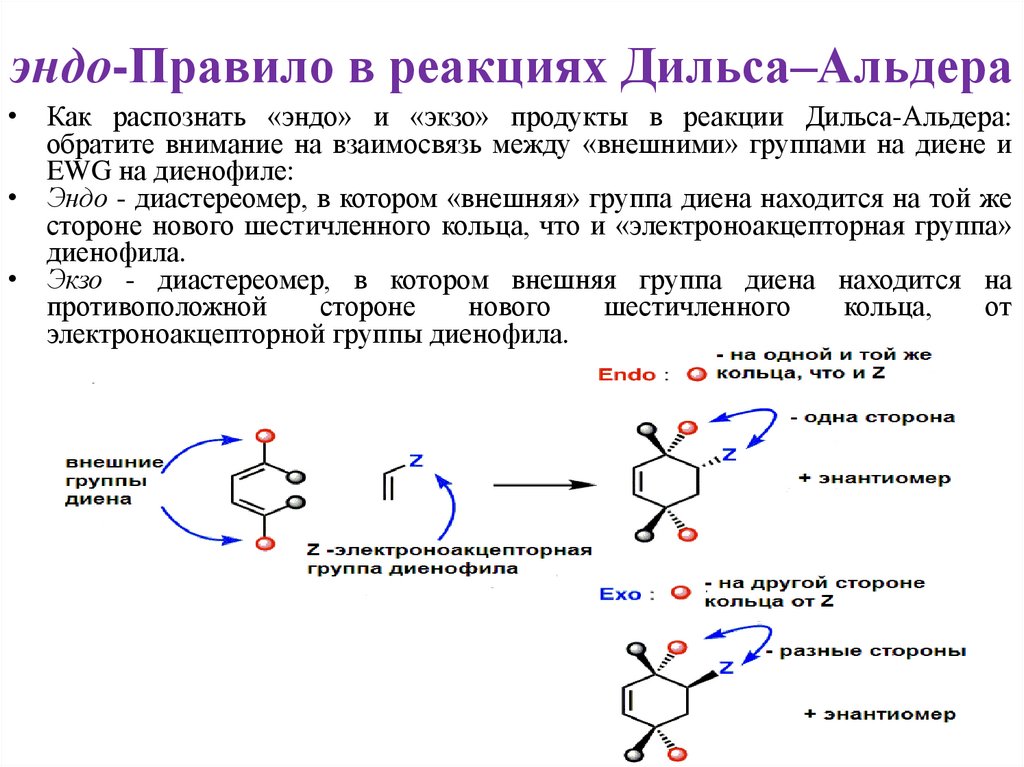
эндо-Правило в реакциях Дильса–Альдера• Как распознать «эндо» и «экзо» продукты в реакции Дильса-Альдера:
обратите внимание на взаимосвязь между «внешними» группами на диене и
EWG на диенофиле:
• Эндо - диастереомер, в котором «внешняя» группа диена находится на той же
стороне нового шестичленного кольца, что и «электроноакцепторная группа»
диенофила.
• Экзо - диастереомер, в котором внешняя группа диена находится на
противоположной
стороне
нового
шестичленного
кольца,
от
электроноакцепторной группы диенофила.
31.
Описание циклоприсоединения теориейграничных орбиталей
• В циклоприсоединении две новые связи образуются одновременно.
Необходимо расположить две заполненные р-орбитали и две свободные
р-орбитали таким образом, чтобы они могли взаимодействовать и
соответствовали друг другу по симметрии.
• В реакции участвуют НСМО диенофила или
диена и ВЗМО диена или диенофила. Любая
из этих комбинаций подходит для протекания
реакции.
• В большинстве реакций Дильса–Альдера
реагируют электронодефицитный диенофил и
электроноизбыточный
диен.
Электронодефицитный
диенофил
имеет
низкую
по
энергии
НСМО,
а
электроноизбыточный диен – высокую по
энергии ВЗМО. Эти орбитали могут
наилучшим образом взаимодействовать в
переходном состоянии.
32.
Внутримолекулярные реакции Дильса–Альдера• Когда диен и диенофил представляют собой части одной молекулы часто
оказывается предпочтительным образование экзо-продукта. Обычно
селективность внутримолекулярний реакции Дильса–Альдера определяется не
эндо-правилом, а пространственными требованиями:
• Внутримолекулярная реакция Дильса–Альдера может приводить, а может и не
приводить к образованию эндо-продукта! Получается или экзо-, или
эндо-продукт, или их смесь.
33.
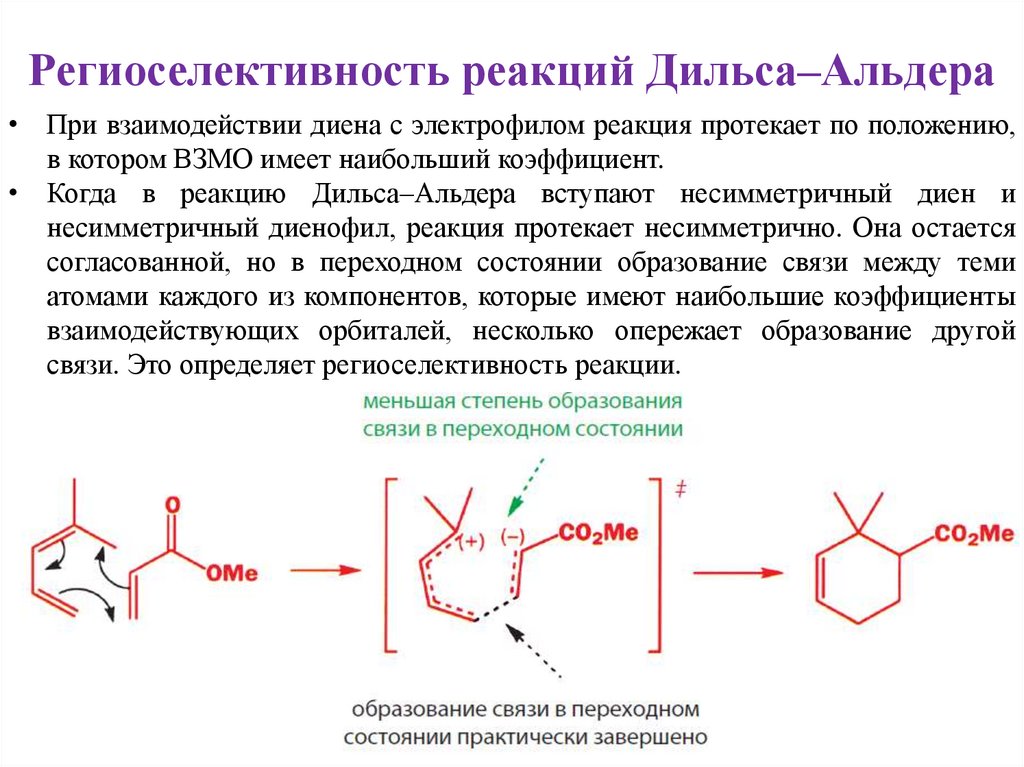
Региоселективность реакций Дильса–Альдера• При взаимодействии диена с электрофилом реакция протекает по положению,
в котором ВЗМО имеет наибольший коэффициент.
• Когда в реакцию Дильса–Альдера вступают несимметричный диен и
несимметричный диенофил, реакция протекает несимметрично. Она остается
согласованной, но в переходном состоянии образование связи между теми
атомами каждого из компонентов, которые имеют наибольшие коэффициенты
взаимодействующих орбиталей, несколько опережает образование другой
связи. Это определяет региоселективность реакции.
34.
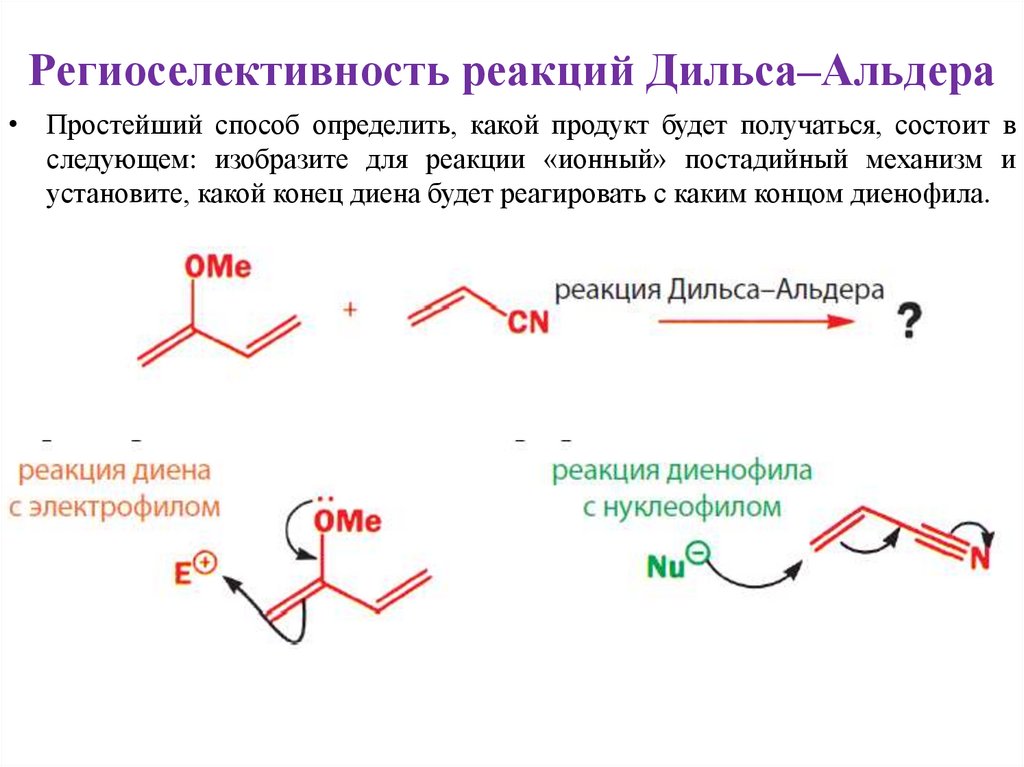
Региоселективность реакций Дильса–Альдера• Простейший способ определить, какой продукт будет получаться, состоит в
следующем: изобразите для реакции «ионный» постадийный механизм и
установите, какой конец диена будет реагировать с каким концом диенофила.
35.
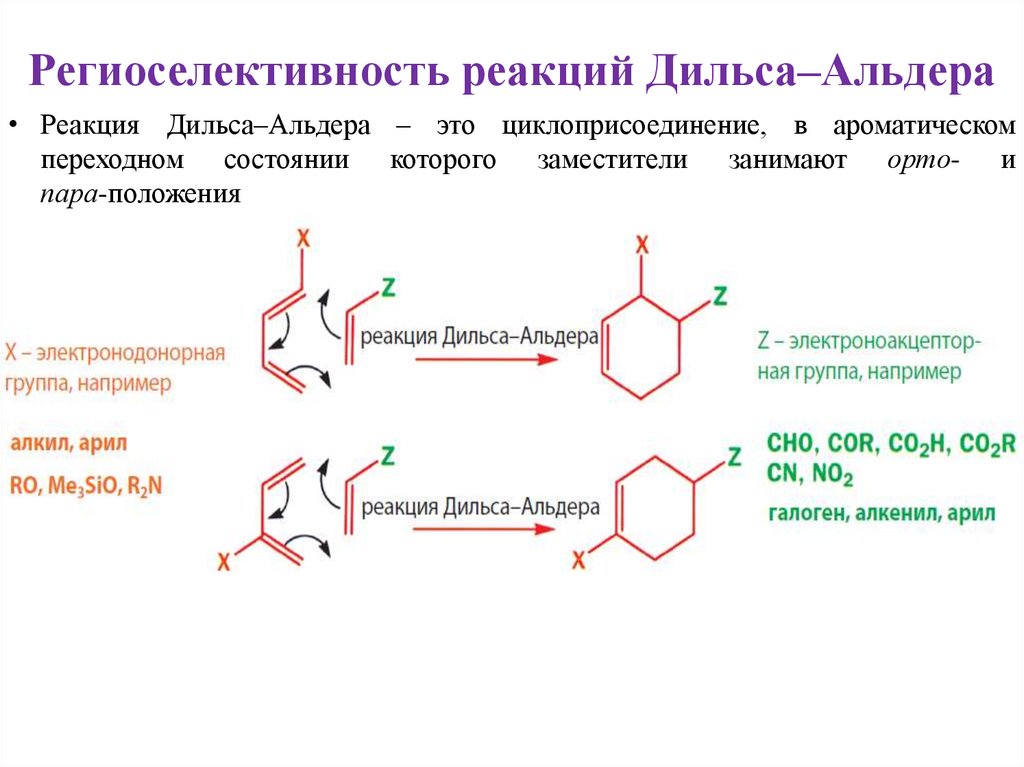
Региоселективность реакций Дильса–Альдера• Реакция Дильса–Альдера – это циклоприсоединение, в ароматическом
переходном состоянии которого заместители занимают орто- и
пара-положения
36.
Региоселективность внутримолекулярныхреакций Дильса–Альдера
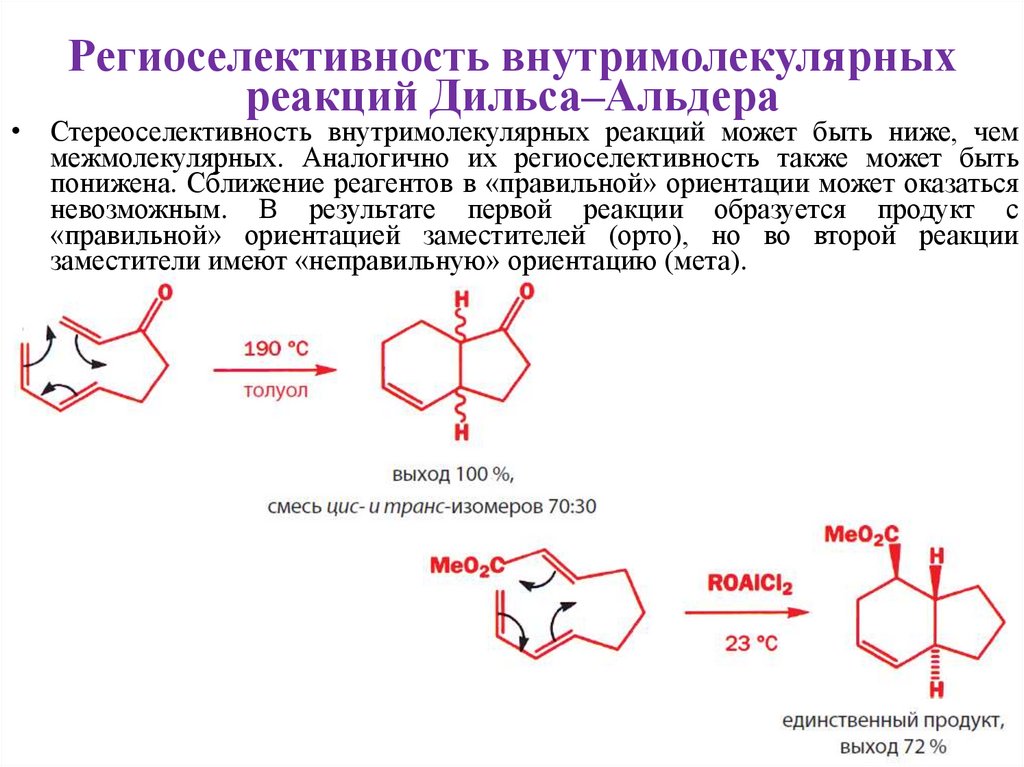
• Стереоселективность внутримолекулярных реакций может быть ниже, чем
межмолекулярных. Аналогично их региоселективность также может быть
понижена. Сближение реагентов в «правильной» ориентации может оказаться
невозможным. В результате первой реакции образуется продукт с
«правильной» ориентацией заместителей (орто), но во второй реакции
заместители имеют «неправильную» ориентацию (мета).
37.
Правила Вудворда–Хоффмана для описания реакцииДильса–Альдера
• Это другое, альтернативное методу граничных орбиталей описание
перециклических реакций.
• В термических перициклических реакциях общее число (4q + 2)s и
(4r)a - компонентов должно быть нечетным.
• Компонентом называется связь или орбиталь, принимающая участие в
перициклической реакции. Компонент может иметь любое число электронов,
но не может содержать смесь π- и σ-электронов. Обозначения (4q+2) и (4r)
определяют число электронов в компонентах, а q и r – это целые числа. Алкен
представляет собой π2-компонент, относящийся к (4q+2)-типу, а диен – это
π4-компонент, относящийся к (4r)-типу.
• Индекс s обозначает супраповерхностное взаимодействие, а индекс а –
антараповерхностное. Супраповерхностно реагирующий компонент образует
новые связи на обоих концах молекулы с одной и той же стороны, а
антараповерхностно реагирующий компонент образует новые связи с
противоположных сторон плоскости молекулы.
38.
Правила Вудворда–Хоффмана для описания реакцииДильса–Альдера
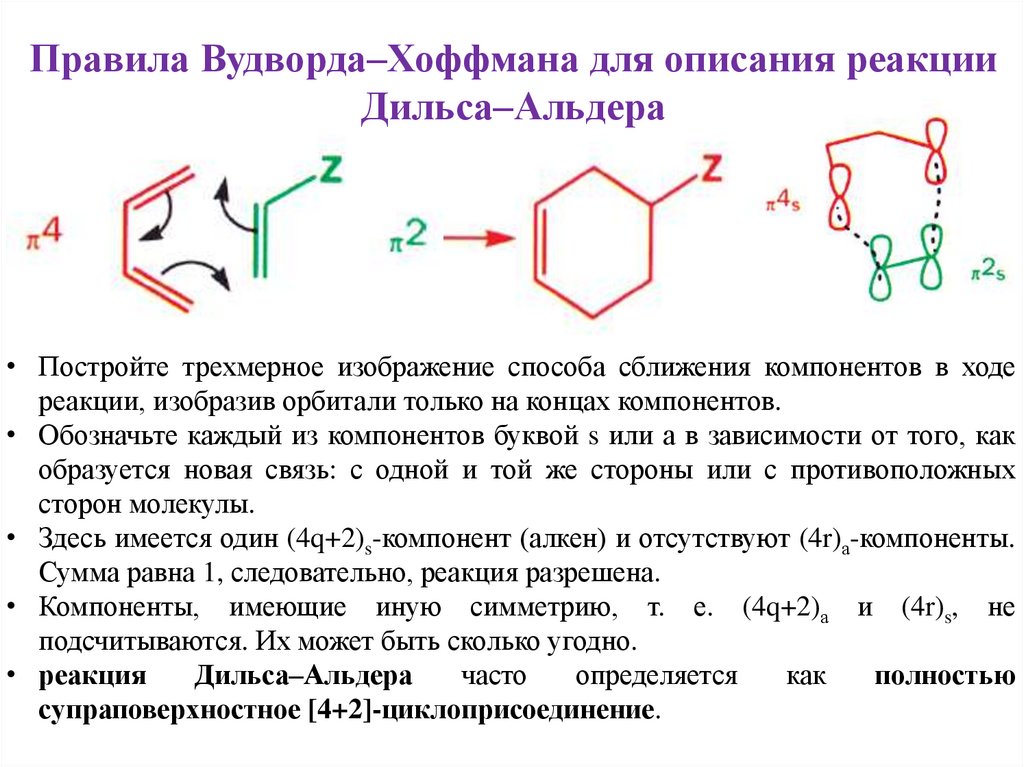
• Постройте трехмерное изображение способа сближения компонентов в ходе
реакции, изобразив орбитали только на концах компонентов.
• Обозначьте каждый из компонентов буквой s или а в зависимости от того, как
образуется новая связь: с одной и той же стороны или с противоположных
сторон молекулы.
• Здесь имеется один (4q+2)s-компонент (алкен) и отсутствуют (4r)а-компоненты.
Сумма равна 1, следовательно, реакция разрешена.
• Компоненты, имеющие иную симметрию, т. е. (4q+2)а и (4r)s, не
подсчитываются. Их может быть сколько угодно.
• реакция
Дильса–Альдера
часто
определяется
как
полностью
супраповерхностное [4+2]-циклоприсоединение.
39.
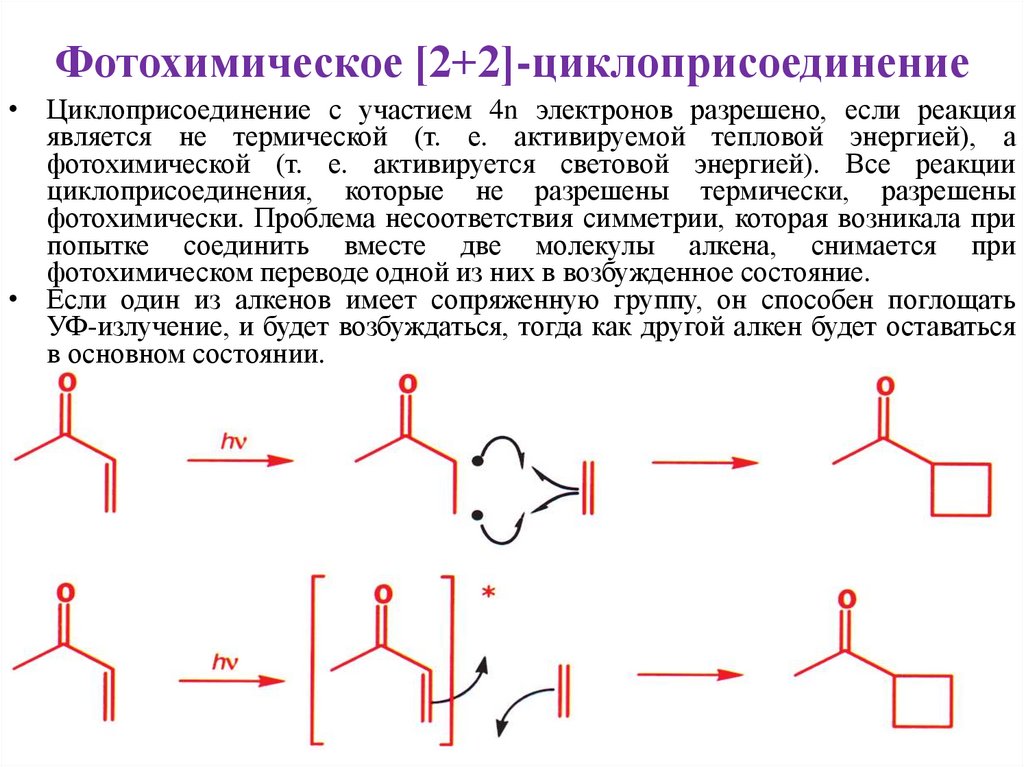
Фотохимическое [2+2]-циклоприсоединение• Циклоприсоединение с участием 4n электронов разрешено, если реакция
является не термической (т. е. активируемой тепловой энергией), а
фотохимической (т. е. активируется световой энергией). Все реакции
циклоприсоединения, которые не разрешены термически, разрешены
фотохимически. Проблема несоответствия симметрии, которая возникала при
попытке соединить вместе две молекулы алкена, снимается при
фотохимическом переводе одной из них в возбужденное состояние.
• Если один из алкенов имеет сопряженную группу, он способен поглощать
УФ-излучение, и будет возбуждаться, тогда как другой алкен будет оставаться
в основном состоянии.
40.
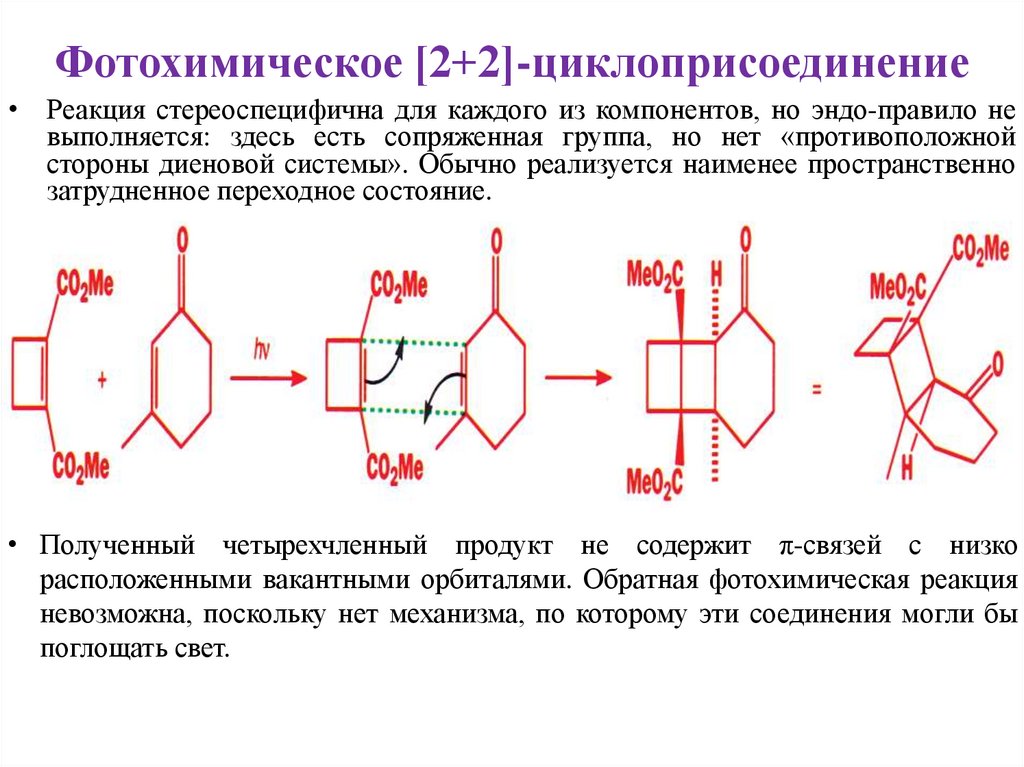
Фотохимическое [2+2]-циклоприсоединение• Реакция стереоспецифична для каждого из компонентов, но эндо-правило не
выполняется: здесь есть сопряженная группа, но нет «противоположной
стороны диеновой системы». Обычно реализуется наименее пространственно
затрудненное переходное состояние.
• Полученный четырехчленный продукт не содержит π-связей с низко
расположенными вакантными орбиталями. Обратная фотохимическая реакция
невозможна, поскольку нет механизма, по которому эти соединения могли бы
поглощать свет.
41.
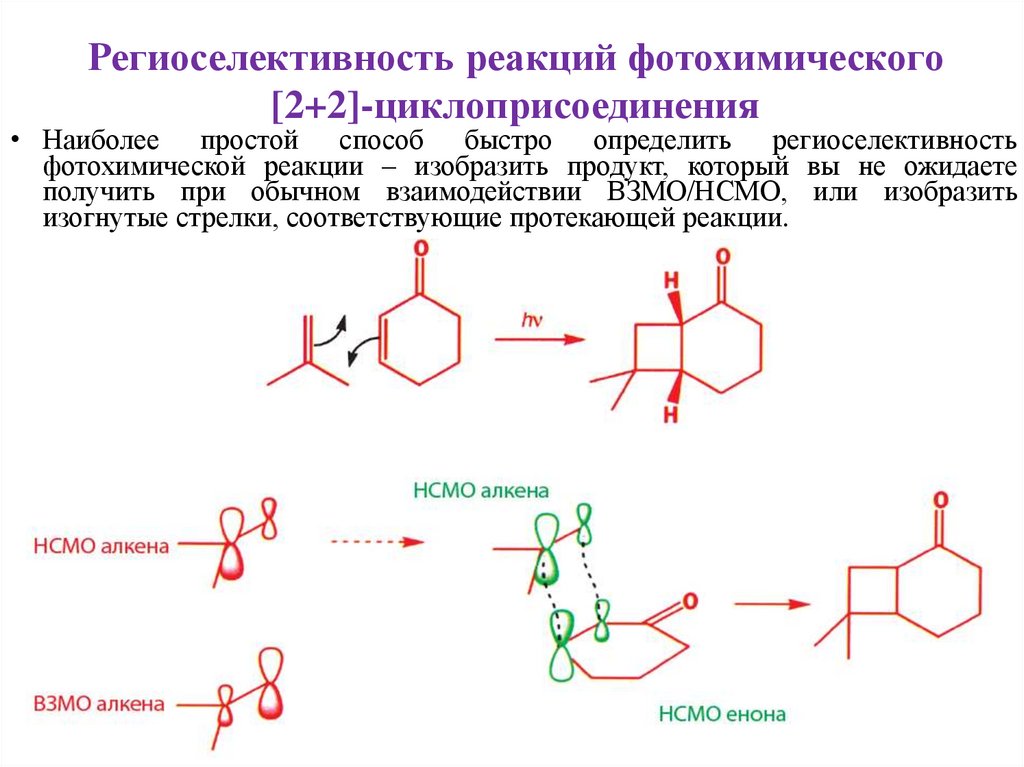
Региоселективность реакций фотохимического[2+2]-циклоприсоединения
• Наиболее простой способ быстро определить региоселективность
фотохимической реакции – изобразить продукт, который вы не ожидаете
получить при обычном взаимодействии ВЗМО/НСМО, или изобразить
изогнутые стрелки, соответствующие протекающей реакции.
42.
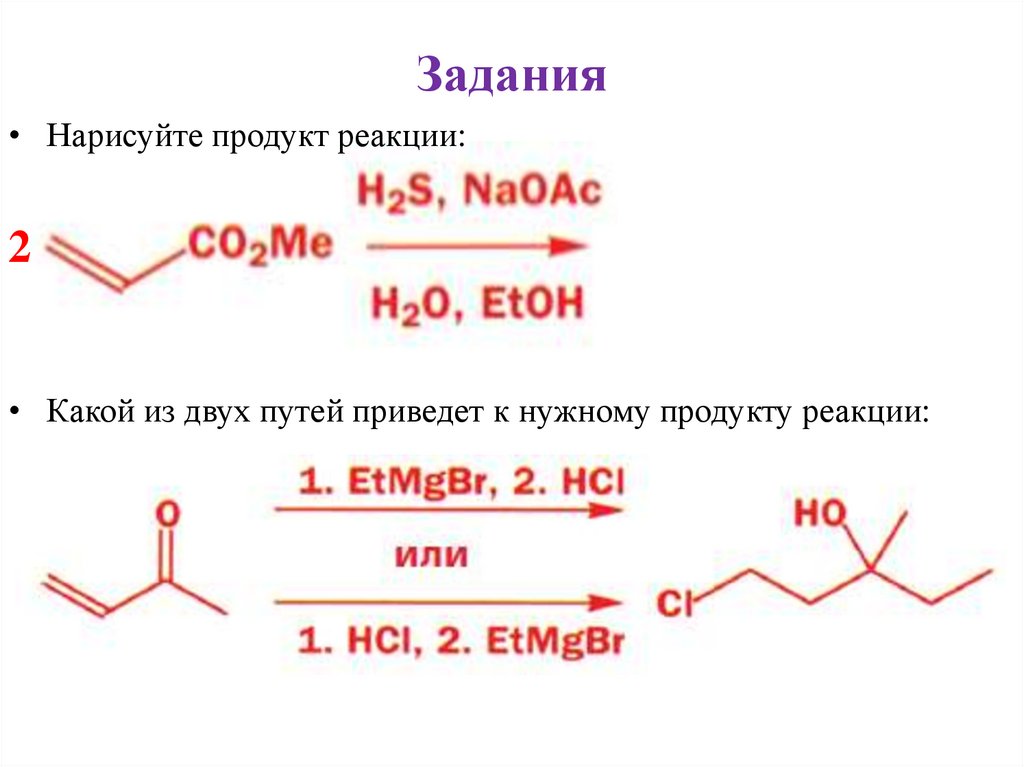
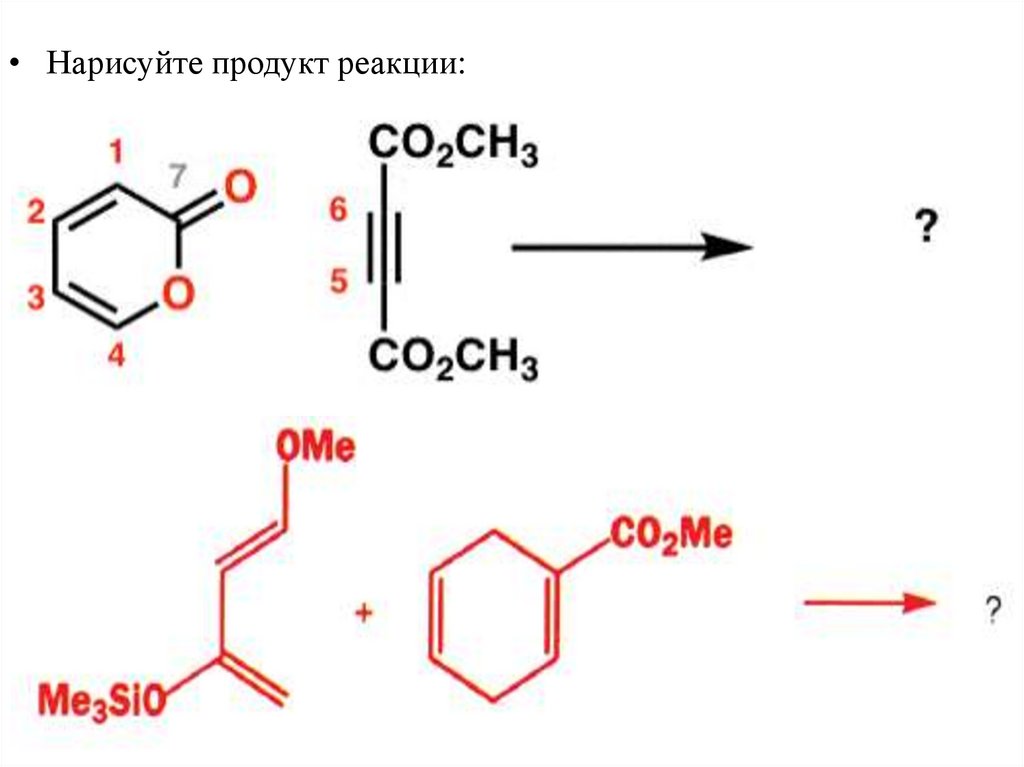
Задания• Нарисуйте продукт реакции:
2
• Какой из двух путей приведет к нужному продукту реакции:
43.
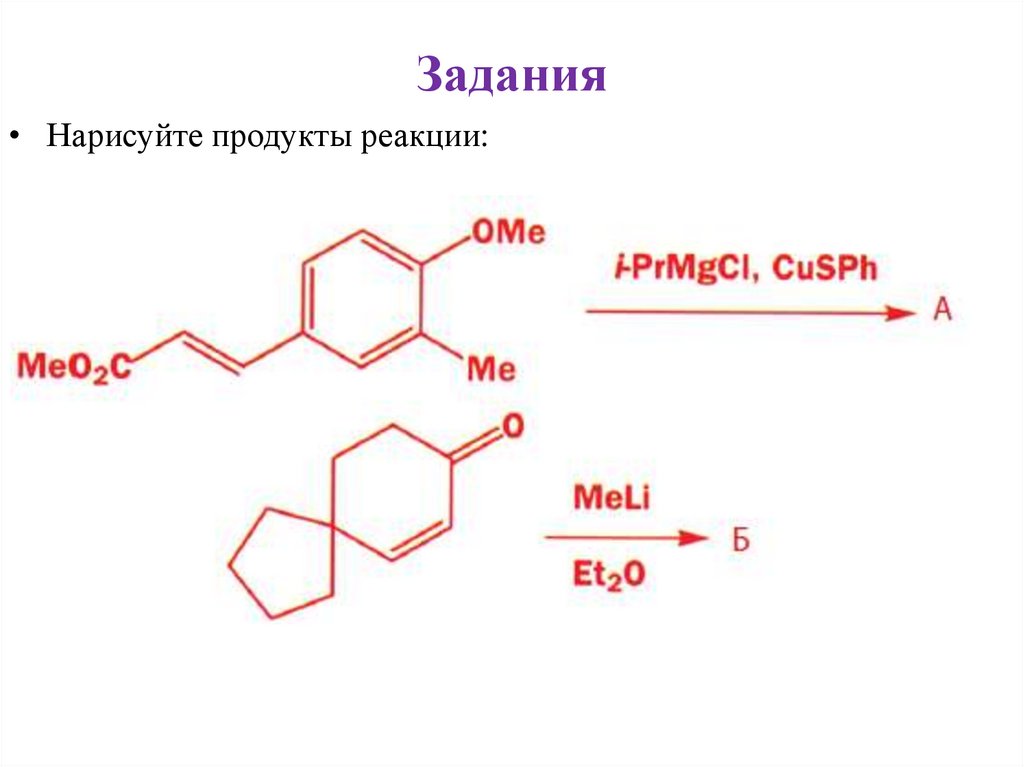
Задания• Нарисуйте продукты реакции:
44.
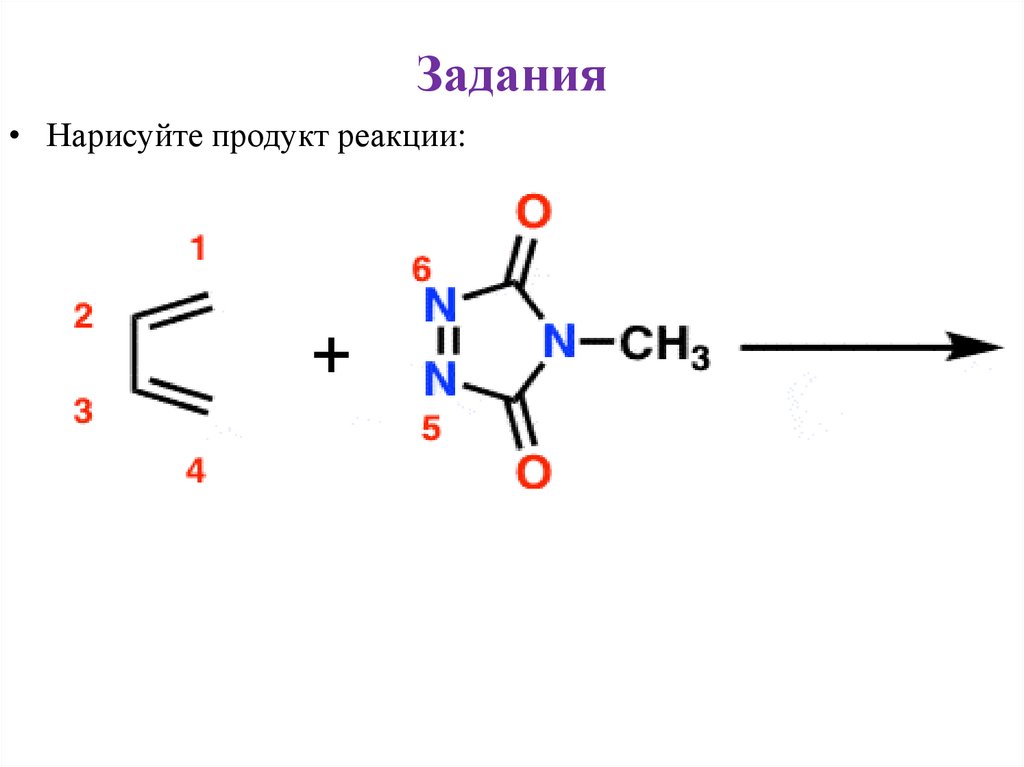
Задания• Нарисуйте продукт реакции:
+
45.
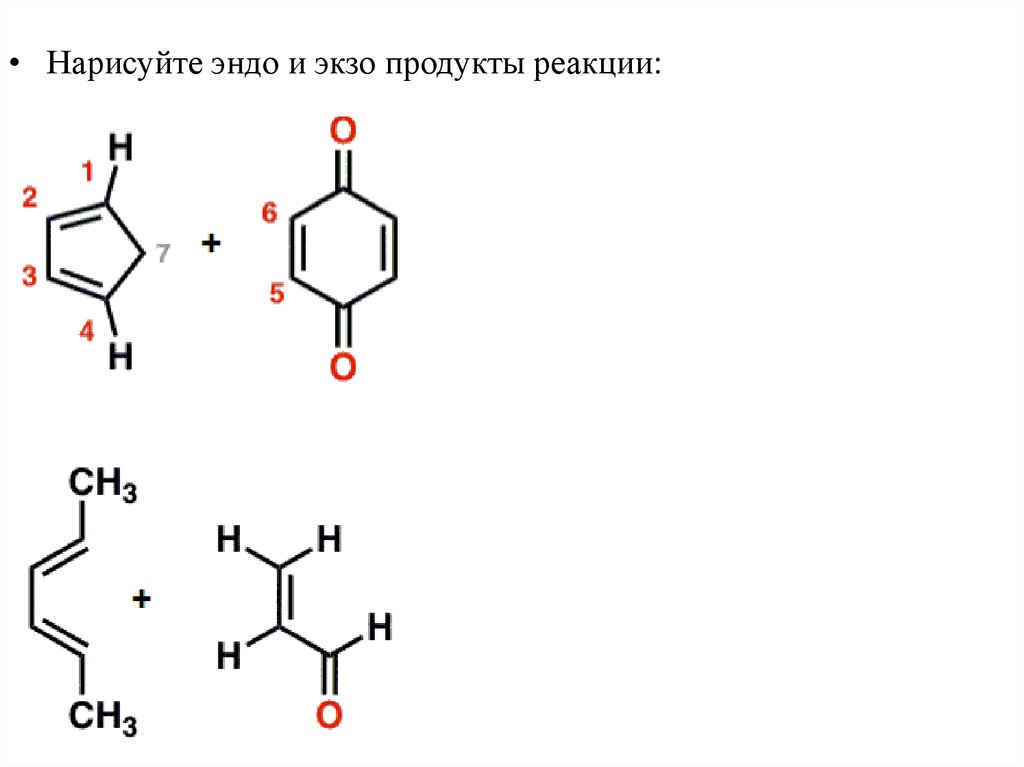
• Нарисуйтепродукты реакции:












 Химия
Химия








