Похожие презентации:
Строение атома
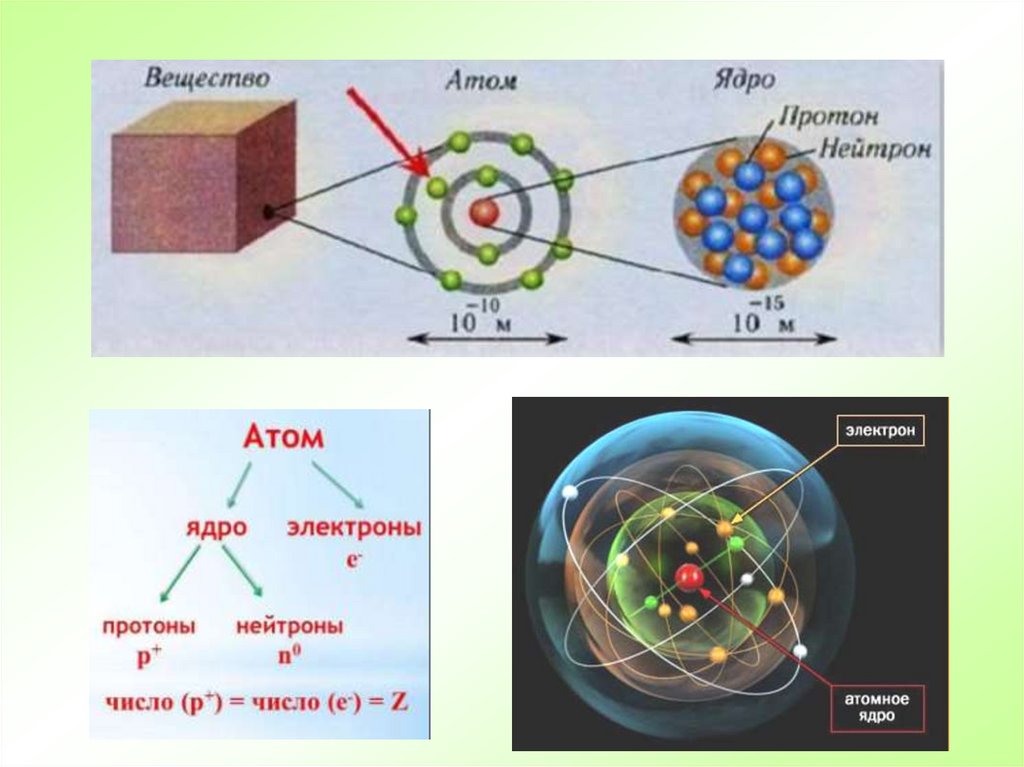
1.
2. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !
3.
4.
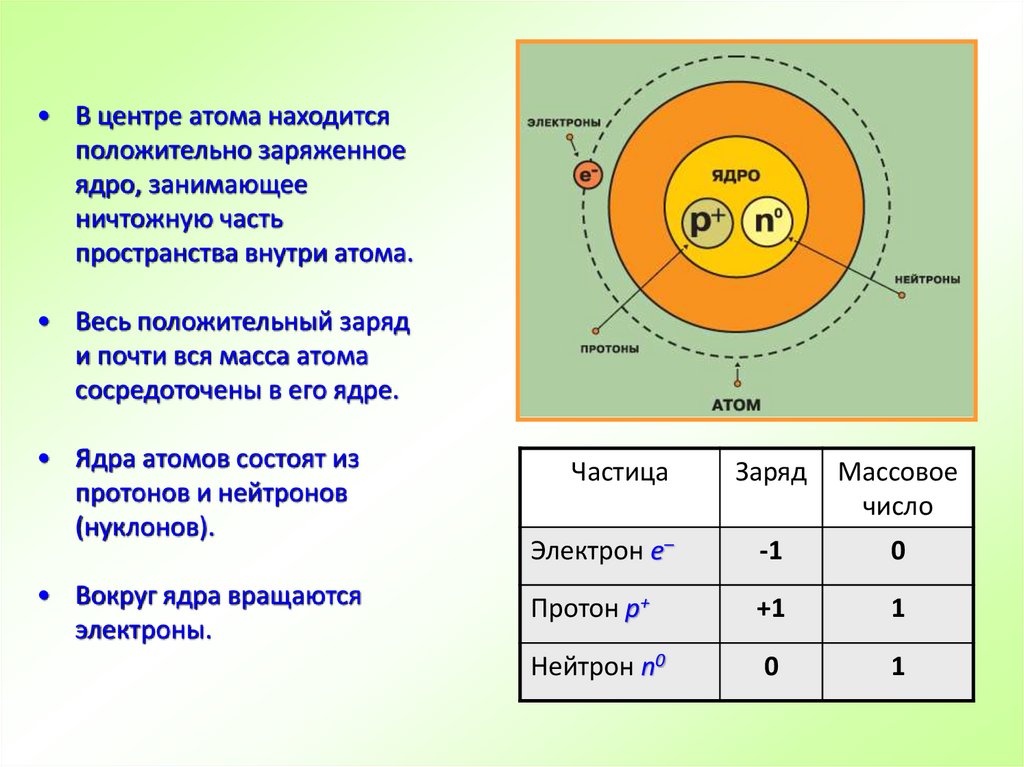
• В центре атома находитсяположительно заряженное
ядро, занимающее
ничтожную часть
пространства внутри атома.
• Весь положительный заряд
и почти вся масса атома
сосредоточены в его ядре.
• Ядра атомов состоят из
протонов и нейтронов
(нуклонов).
• Вокруг ядра вращаются
электроны.
Частица
Заряд
Массовое
число
Электрон е–
-1
0
Протон р+
+1
1
Нейтрон n0
0
1
5.
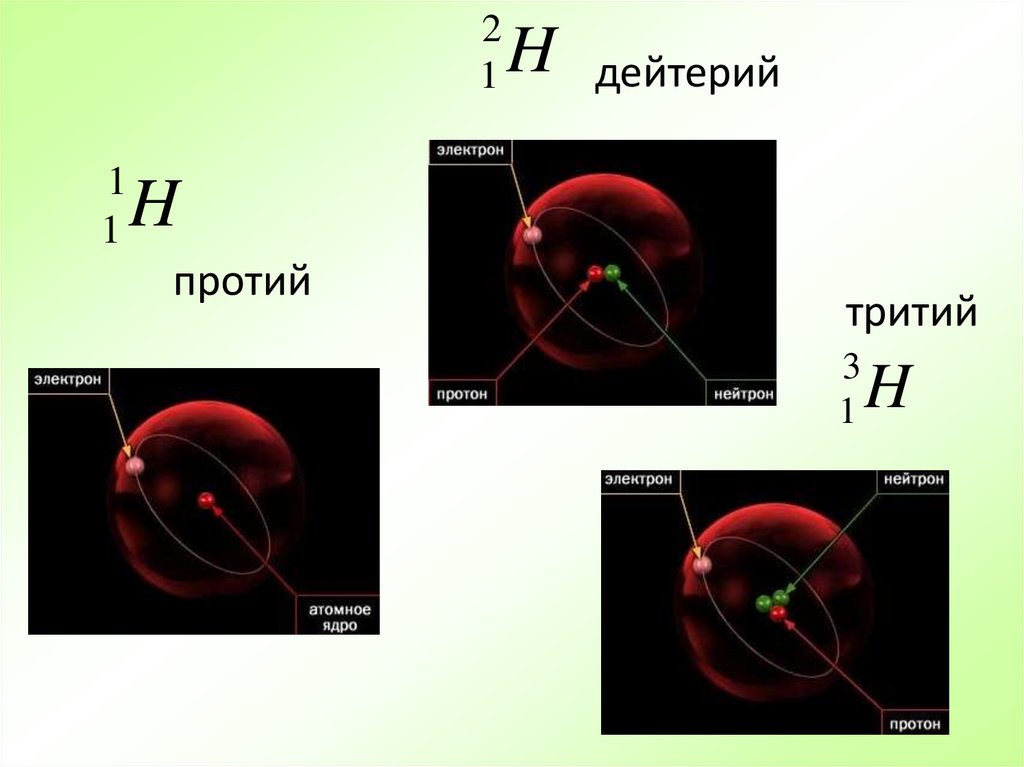
Атомы элемента, имеющие один и тот же заряд ядра, но разныемассы, называются изотопами.
е–
-
е–
-
е–
р+
n
+ n
р
+
р
-
n
Изотопы водорода
Число протонов
N(p+)
Число нейтронов
N(n0)
Массовое число
А
одинаковое
1
1
1
разное
0
1
2
разное
1
2
3
6.
21
1
1
H
дейтерий
H
протий
тритий
3
1
H
7.
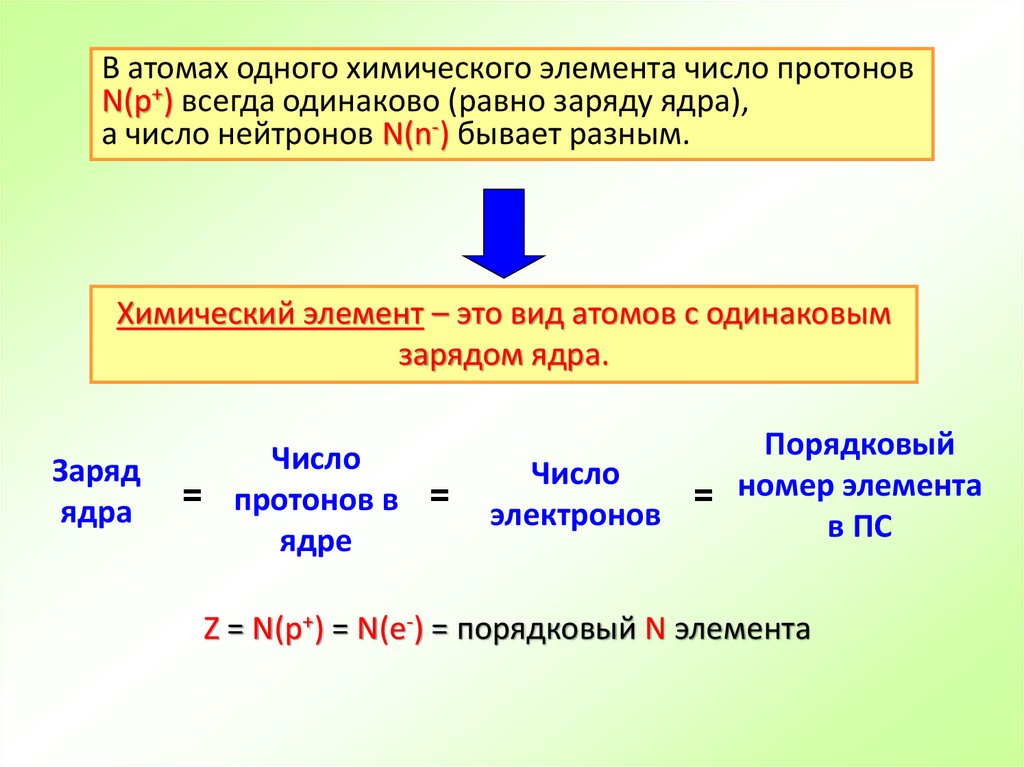
В атомах одного химического элемента число протоновN(p+) всегда одинаково (равно заряду ядра),
а число нейтронов N(n-) бывает разным.
Химический элемент – это вид атомов с одинаковым
зарядом ядра.
Заряд
ядра
Число
= протонов в =
ядре
Порядковый
Число
= номер элемента
электронов
в ПС
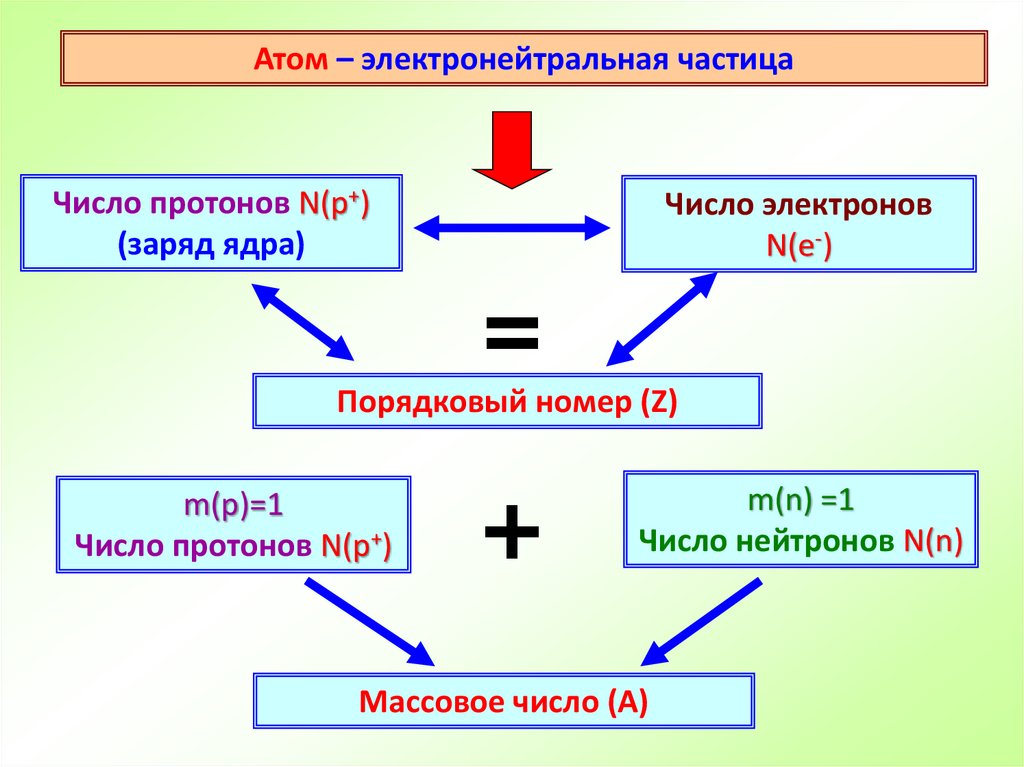
Z = N(p+) = N(e-) = порядковый N элемента
8.
Атом – электронейтральная частицаЧисло протонов N(p+)
(заряд ядра)
Число электронов
N(е-)
=
Порядковый номер (Z)
m(p)=1
Число протонов N(p+)
+
m(n) =1
Число нейтронов N(n)
Массовое число (А)
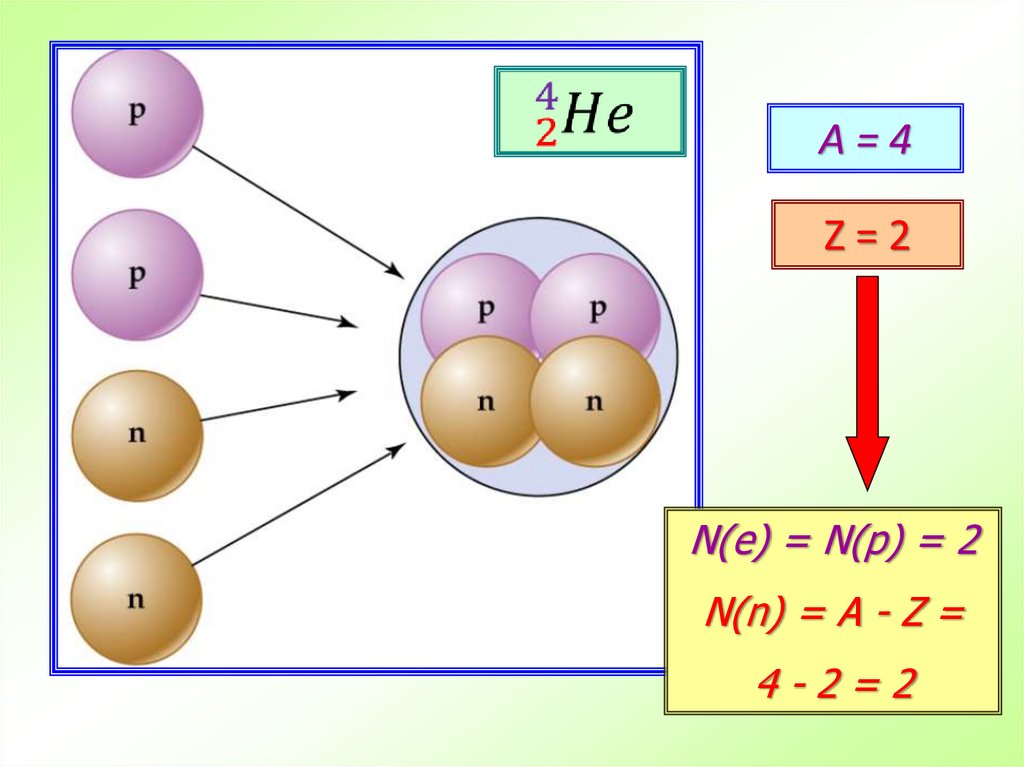
9.
A=4Z=2
N(е) = N(p) = 2
N(n) = A - Z =
4-2=2
10.
АзотКислород
11.
ВодородАзот
Углерод
Кислород
12. Периодическая система и строение атома
Порядковыйномер
элемента
Число протонов N(p)
Число электронов N(e)
Число нейтронов
N(n) = A - Z
Заряд ядра Z
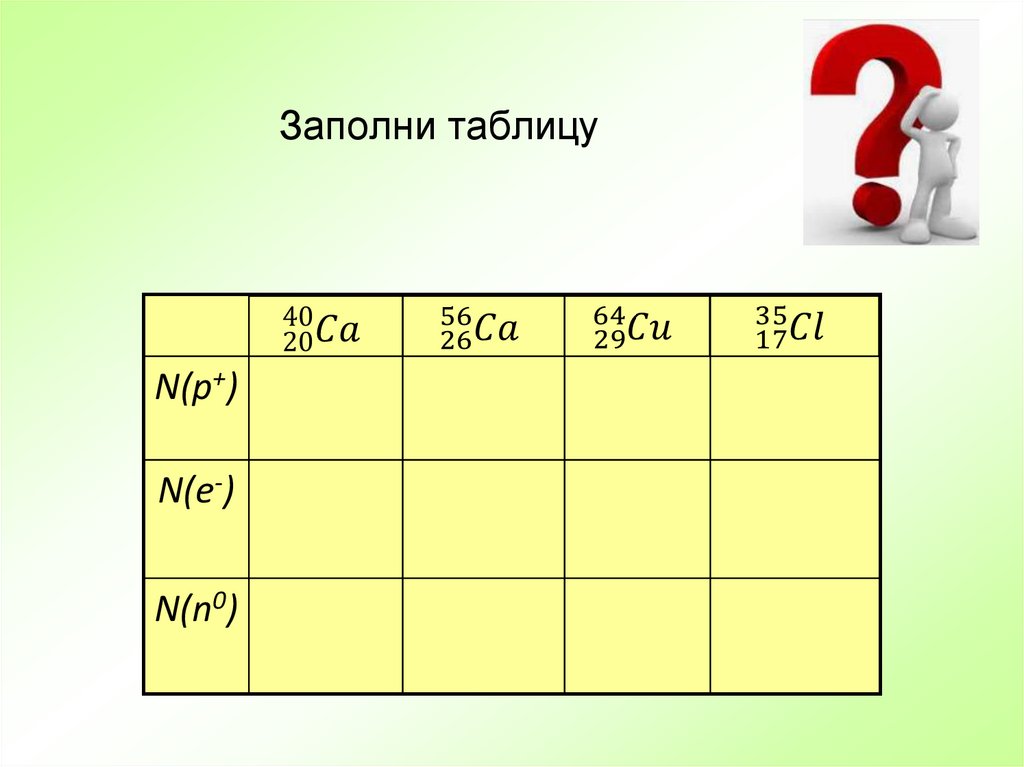
13. Заполни таблицу
N(p+)N(e-)
N(n0)
14.
Установите соответствие,соединив стрелками
N
p+=7
n0=7
Li
e-=3
n0=4
e-=34
p+=34
Se
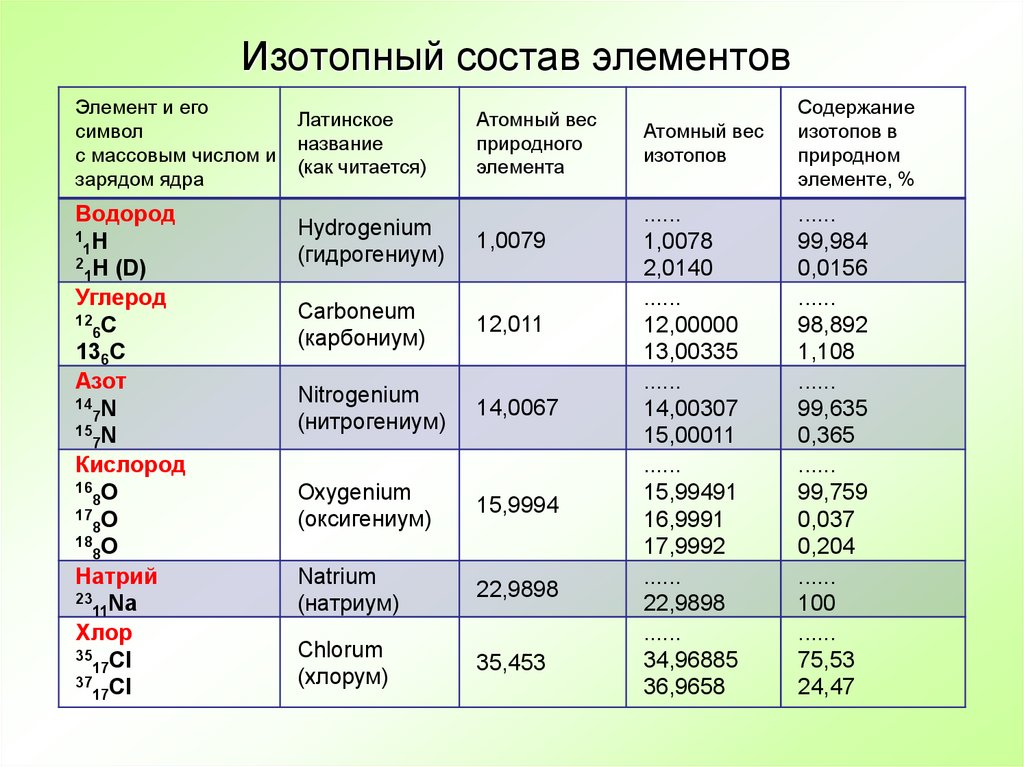
15. Изотопный состав элементов
Элемент и егосимвол
с массовым числом и
зарядом ядра
Водород
1 H
1
2 H (D)
1
Углерод
12 C
6
136C
Азот
14 N
7
15 N
7
Кислород
16 O
8
17 O
8
18 O
8
Натрий
23 Na
11
Хлор
35 Cl
17
37 Cl
17
Латинское
название
(как читается)
Атомный вес
природного
элемента
Hydrogenium
(гидрогениум)
1,0079
Carboneum
(карбониум)
12,011
Nitrogenium
(нитрогениум)
14,0067
Oxygenium
(оксигениум)
15,9994
Natrium
(натриум)
22,9898
Chlorum
(хлорум)
35,453
Атомный вес
изотопов
Содержание
изотопов в
природном
элементе, %
......
1,0078
2,0140
......
12,00000
13,00335
......
14,00307
15,00011
......
15,99491
16,9991
17,9992
......
22,9898
......
34,96885
36,9658
......
99,984
0,0156
......
98,892
1,108
......
99,635
0,365
......
99,759
0,037
0,204
......
100
......
75,53
24,47
16. Тестовые задания
Заряд ядра атома азота равен :
а) 7 б) 13 в) 4 г) 29 д) 11
Число протонов в ядре атома криптона :
а ) 36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка :
а) 8
б) 35 в)11 г)30 д)4
Число электронов в атоме железа :
а) 11 б)8 в)56 г)26 д)30
Изотопы водорода отличаются друг от друга :
а)числом eв) массовым числом
б)числом n
г) числом протонов
В ядре атома отсутствуют частицы:
а) протоны
б) нейтроны
в) электроны
Какой из атомов не содержит нейтронов в ядре:
а) 24Не б) 12Н в) 80201Hg
г) 11Н
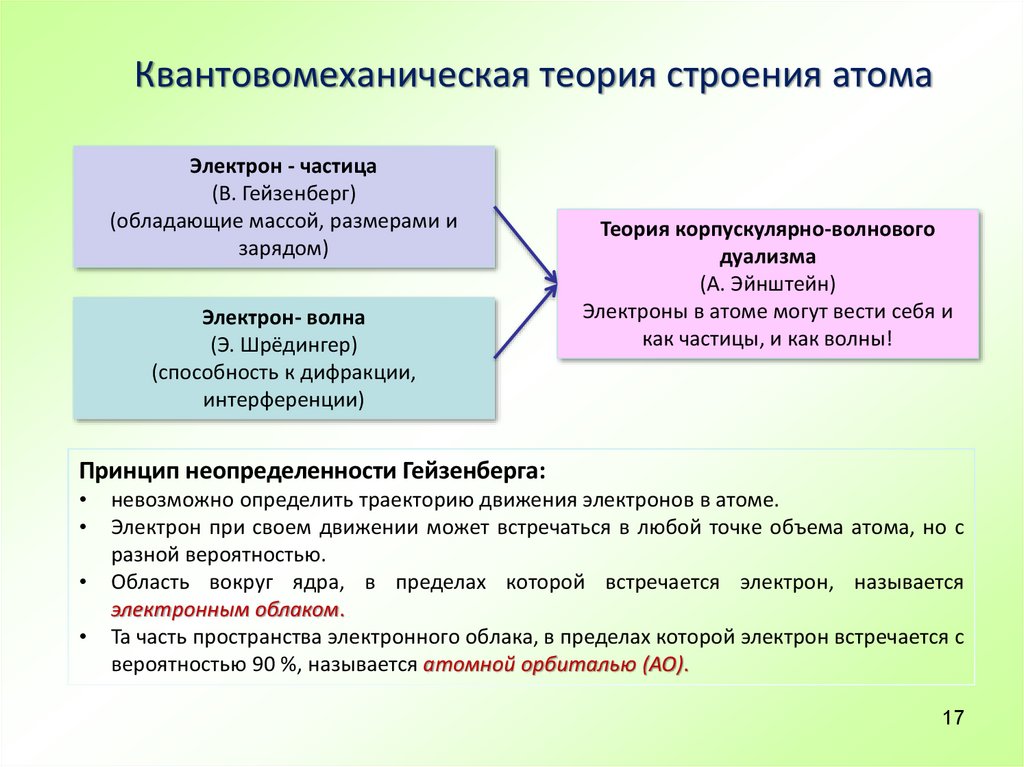
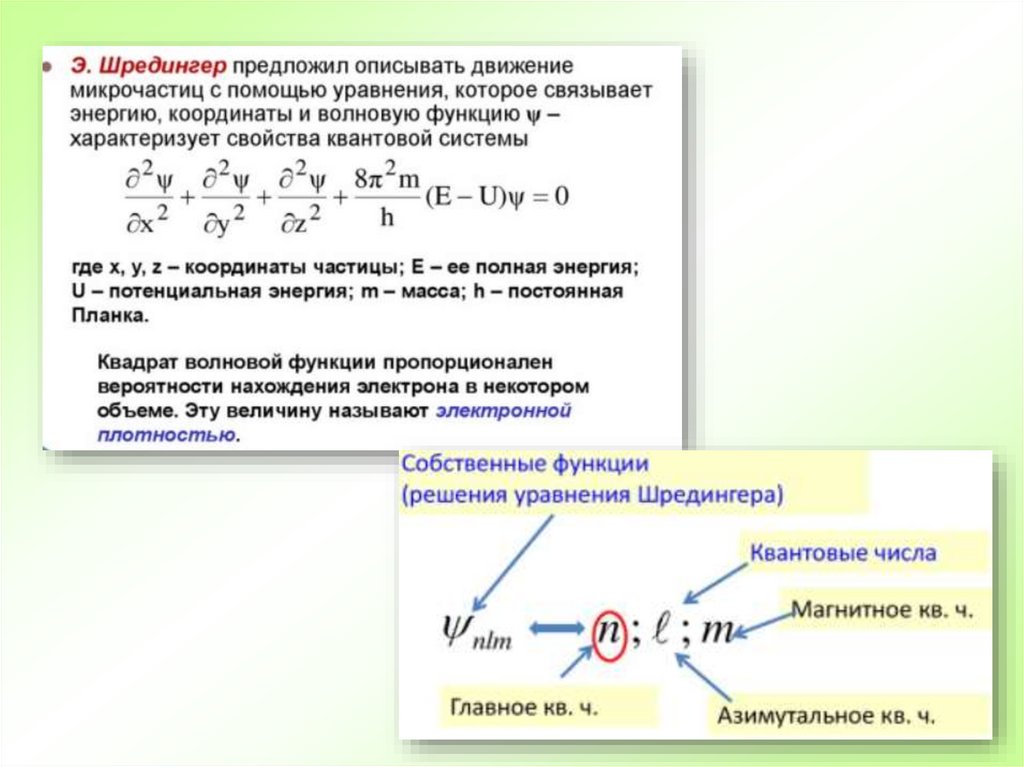
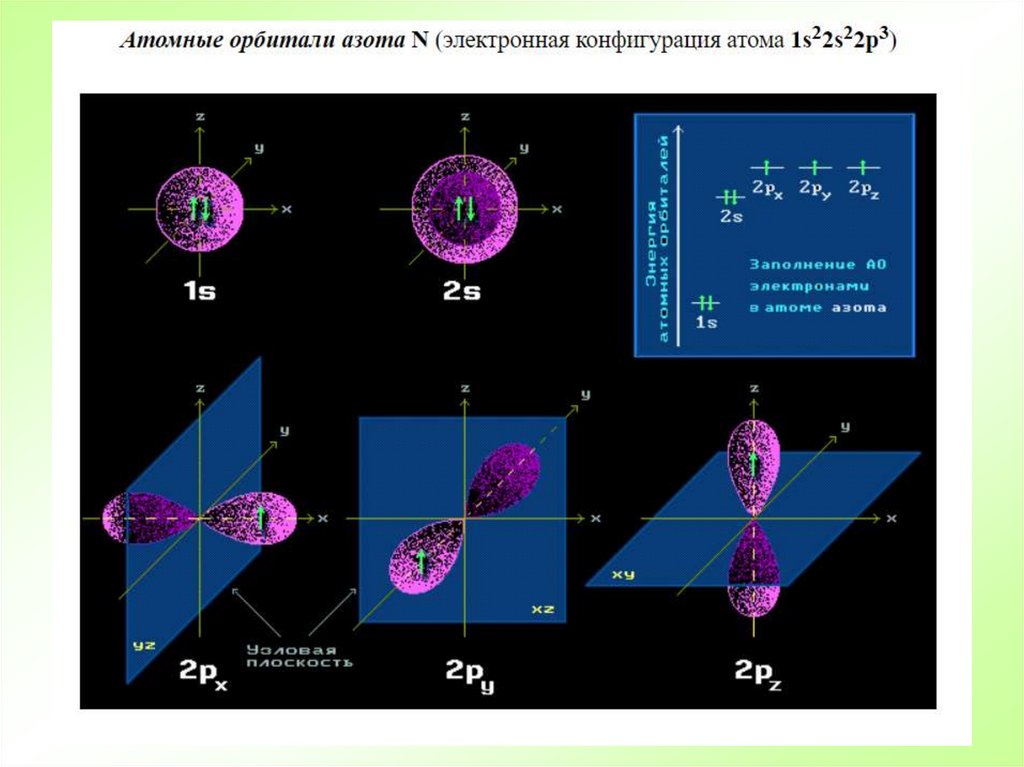
17. Квантовомеханическая теория строения атома
Электрон - частица(В. Гейзенберг)
(обладающие массой, размерами и
зарядом)
Электрон- волна
(Э. Шрёдингер)
(способность к дифракции,
интерференции)
Теория корпускулярно-волнового
дуализма
(А. Эйнштейн)
Электроны в атоме могут вести себя и
как частицы, и как волны!
Принцип неопределенности Гейзенберга:
невозможно определить траекторию движения электронов в атоме.
Электрон при своем движении может встречаться в любой точке объема атома, но с
разной вероятностью.
Область вокруг ядра, в пределах которой встречается электрон, называется
электронным облаком.
Та часть пространства электронного облака, в пределах которой электрон встречается с
вероятностью 90 %, называется атомной орбиталью (АО).
17
18.
19.
20.
n =1l =0
ml =0
n =3
l =0
ml =0
1s
3s
n =3
l =2
3d
ml =-2
n =2
l =0
ml =0
2s
n =3
l =1
3p
ml =-1
n =3
l =2
3d
ml =-1
n =2
l =1
2p
ml =-1
n =3
l =1
ml =0
n =3
l =2
ml =0
n =2
l =1
ml =0
2p
3p
n =3
l =1
3p
ml =+1
3d
n =3
l =2
3d
ml =+1
n =2
l =1
2p
ml =+1
n =3
l =2
3d
ml =+2
21. Энергетическая диаграмма
E3p
3s
3d
2p
2s
1s
21
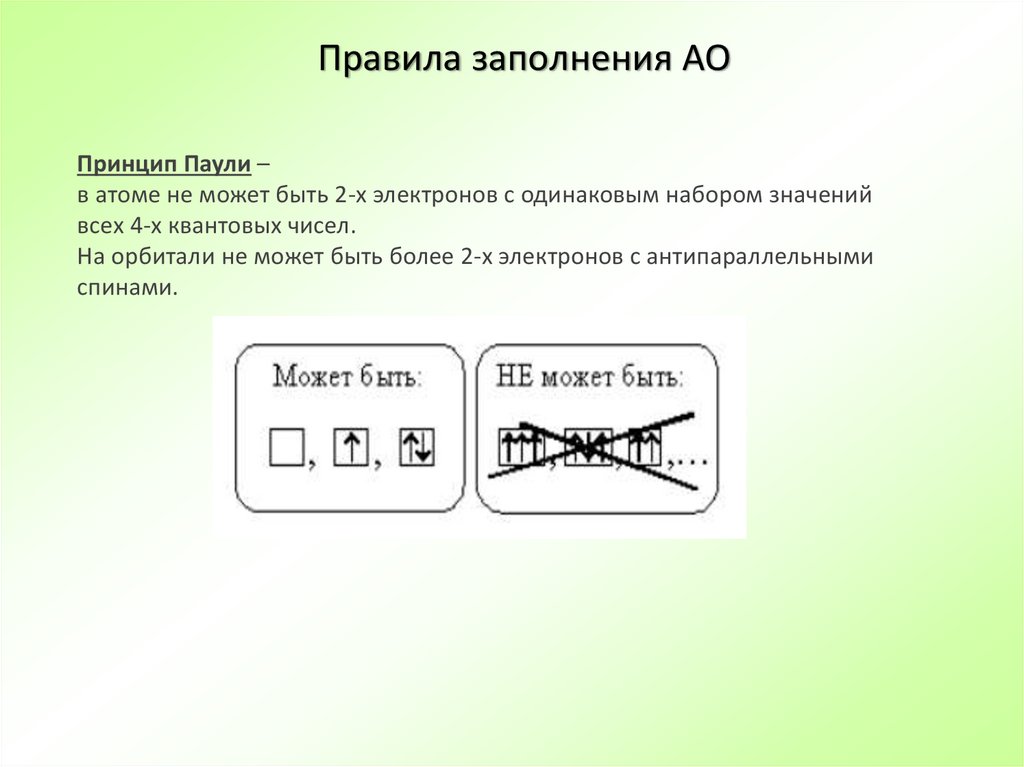
22. Правила заполнения АО
Принцип Паули –в атоме не может быть 2-х электронов с одинаковым набором значений
всех 4-х квантовых чисел.
На орбитали не может быть более 2-х электронов с антипараллельными
спинами.
23. Правила заполнения АО
Правило Гунда (Хунда) –в пределах данного подуровня электроны стремятся занять максимальное
число свободных орбиталей,
так чтобы суммарный спин был максимальным.
Согласно правилу вначале происходит заполнение по 1 электрону всех
орбиталей данного подуровня,
причем их спины параллельны.
Только после этого происходит заполнение
орбиталей другими электронами.
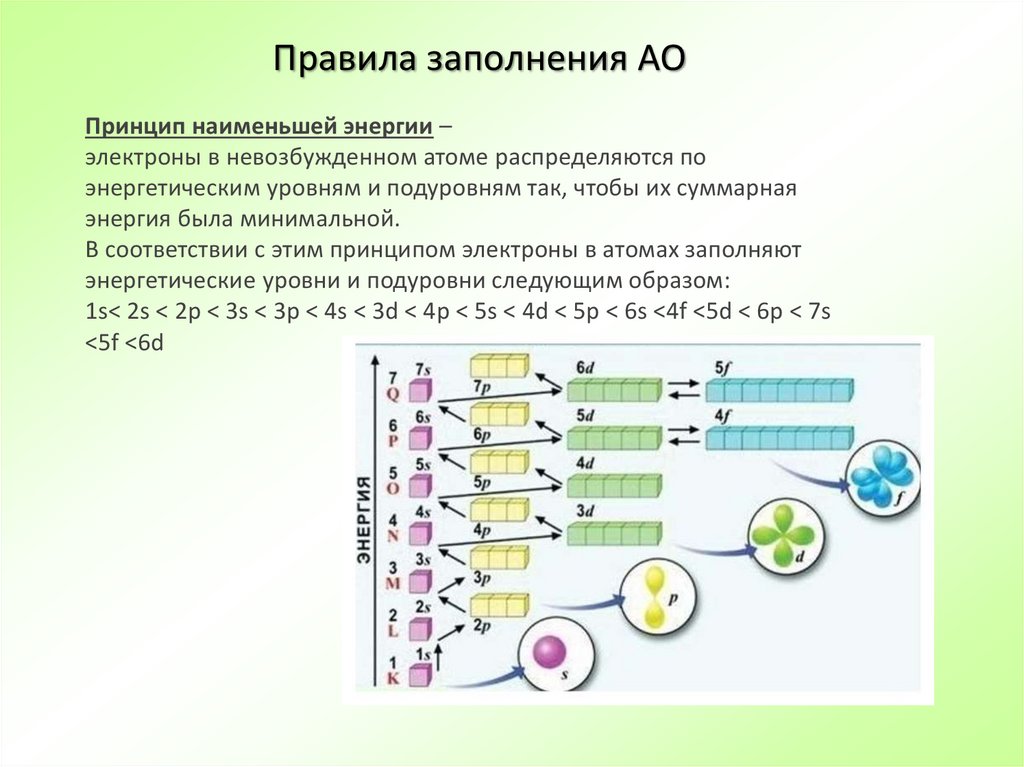
24. Правила заполнения АО
Принцип наименьшей энергии –электроны в невозбужденном атоме распределяются по
энергетическим уровням и подуровням так, чтобы их суммарная
энергия была минимальной.
В соответствии с этим принципом электроны в атомах заполняют
энергетические уровни и подуровни следующим образом:
1s< 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s <4f <5d < 6p < 7s
<5f <6d
25.
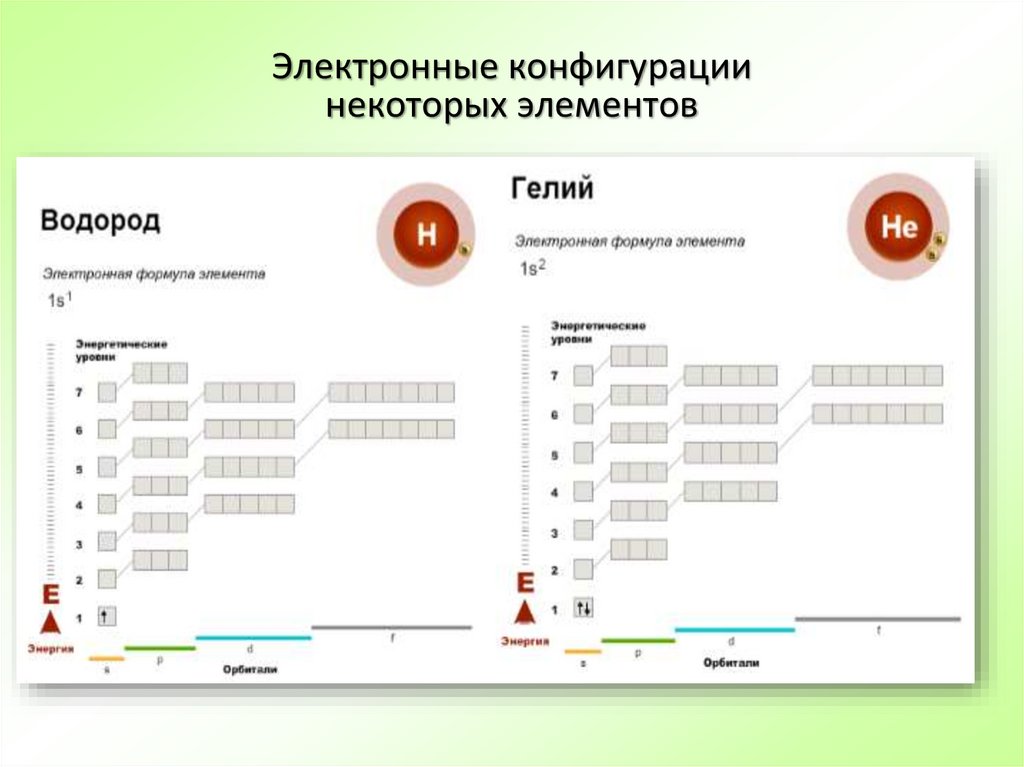
2526. Электронные конфигурации некоторых элементов
27.
28.
29.
30.
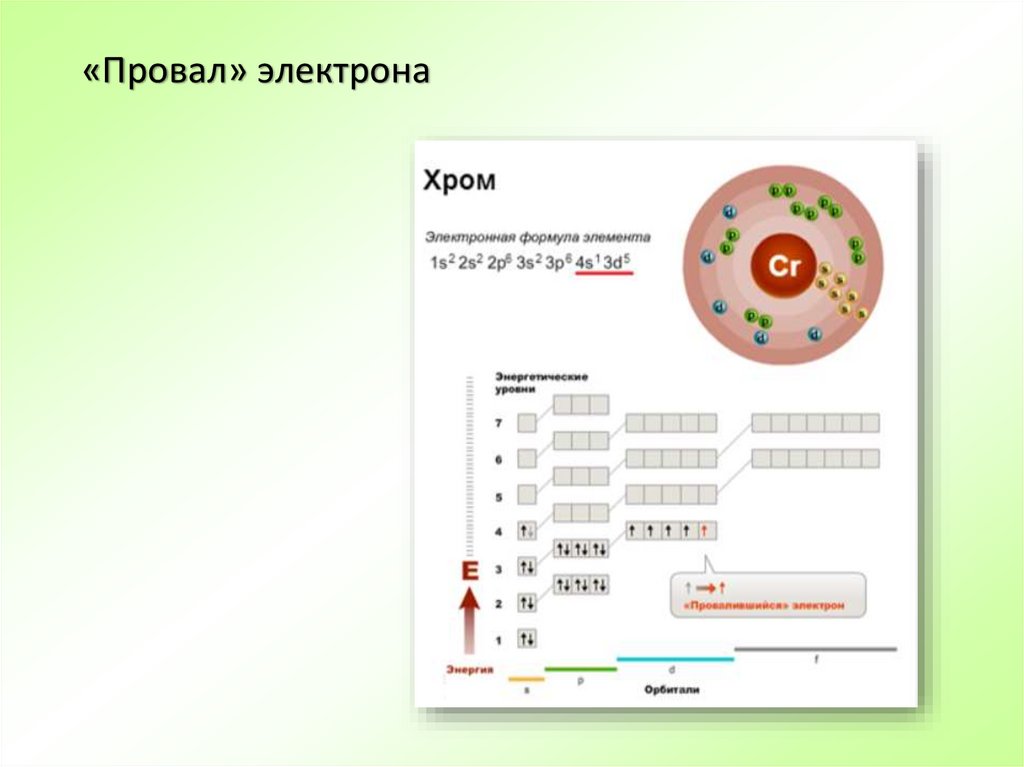
31. «Провал» электрона
32.
«Провал» электрона33. Основное и возбужденное состояние
Принцип наименьшей энергиисправедлив только
для основного состояния атома,
характеризующегося минимумом
энергии.
В возбуждённом состоянии (при
получении энергии извне,
например, при облучении или
нагревании), один или несколько
электронов могут переходить на
орбиталь с большим значением
энергии, но в пределах своего
энергетического уровня.
Такие состояния атома
называются возбуждёнными.
















 Химия
Химия








