Похожие презентации:
Альдегиды
1. Альдегиды
Преподаватель: РахматуллинаО.А.
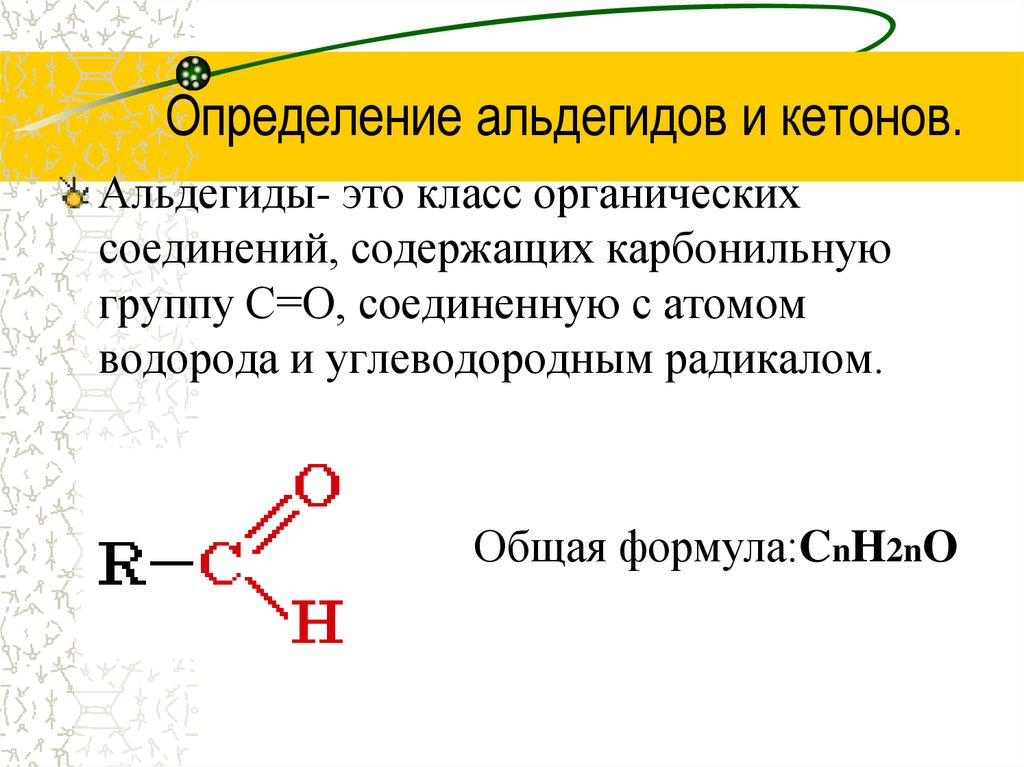
2. Определение альдегидов и кетонов.
Альдегиды- это класс органическихсоединений, содержащих карбонильную
группу С=О, соединенную с атомом
водорода и углеводородным радикалом.
Общая формула:CnH2nO
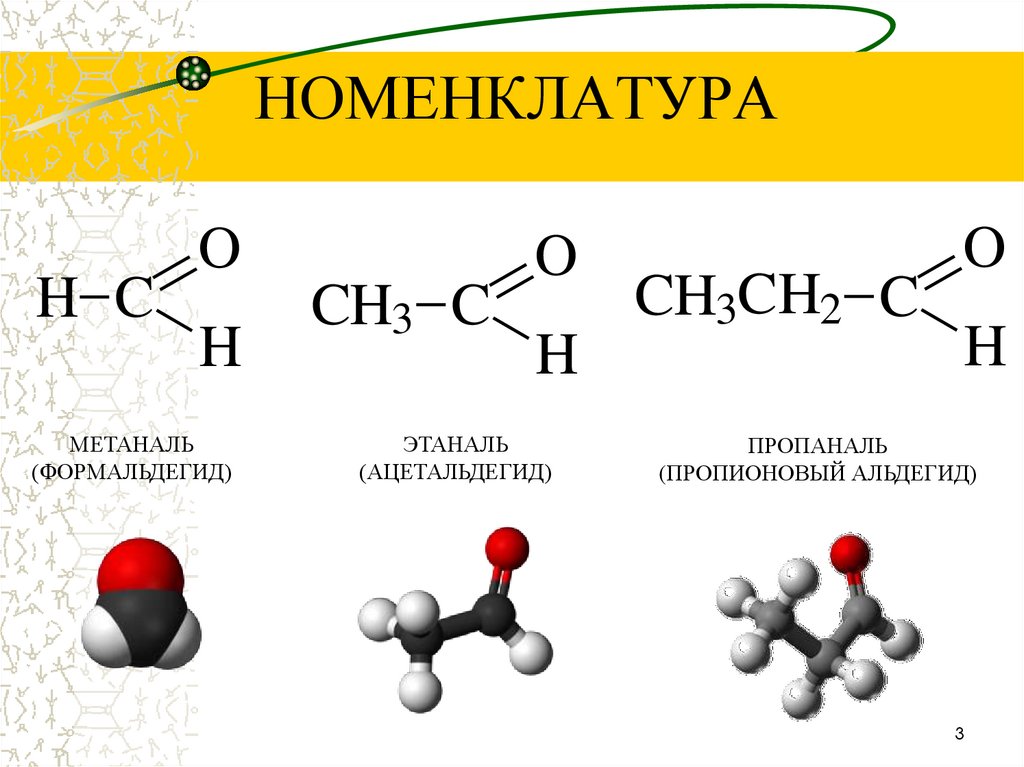
3. НОМЕНКЛАТУРА
H CO
H
МЕТАНАЛЬ
(ФОРМАЛЬДЕГИД)
CH3 C
O
H
ЭТАНАЛЬ
(АЦЕТАЛЬДЕГИД)
CH3CH2 C
O
H
ПРОПАНАЛЬ
(ПРОПИОНОВЫЙ АЛЬДЕГИД)
3
4. Изомерия альдегидов
Изомерия альдегидовсвязана со строением
углеродного скелета
Межклассовая изомерия
Альдегиды изомерны
кетонам
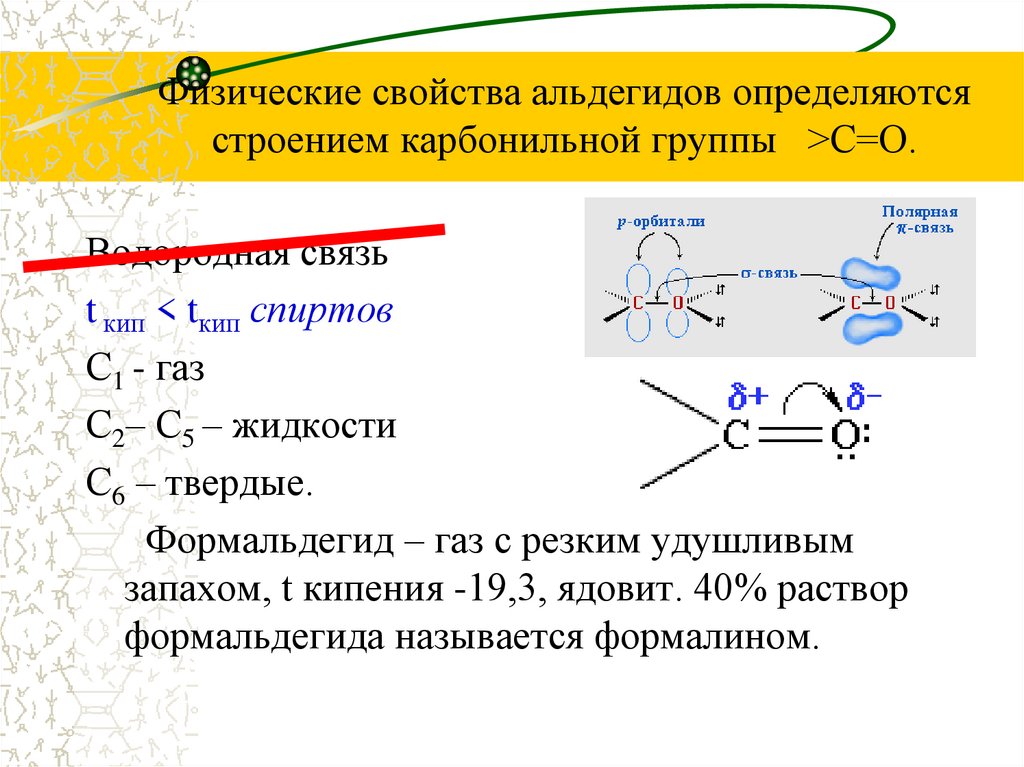
5. Физические свойства альдегидов определяются строением карбонильной группы >C=O.
Физические свойства альдегидов определяютсястроением карбонильной группы >C=O.
Водородная связь
t кип < tкип спиртов
С1 - газ
С2– С5 – жидкости
С6 – твердые.
Формальдегид – газ с резким удушливым
запахом, t кипения -19,3, ядовит. 40% раствор
формальдегида называется формалином.
6. Химические свойства
Реакции присоединения:А) реакция гидрирования
Б) реакция присоединения NaHSO3
2. Реакции окисления:
А) реакция серебряного зеркала
Б) реакция светофор
3. Реакция поликонденсации
4. Реакция полимеризации
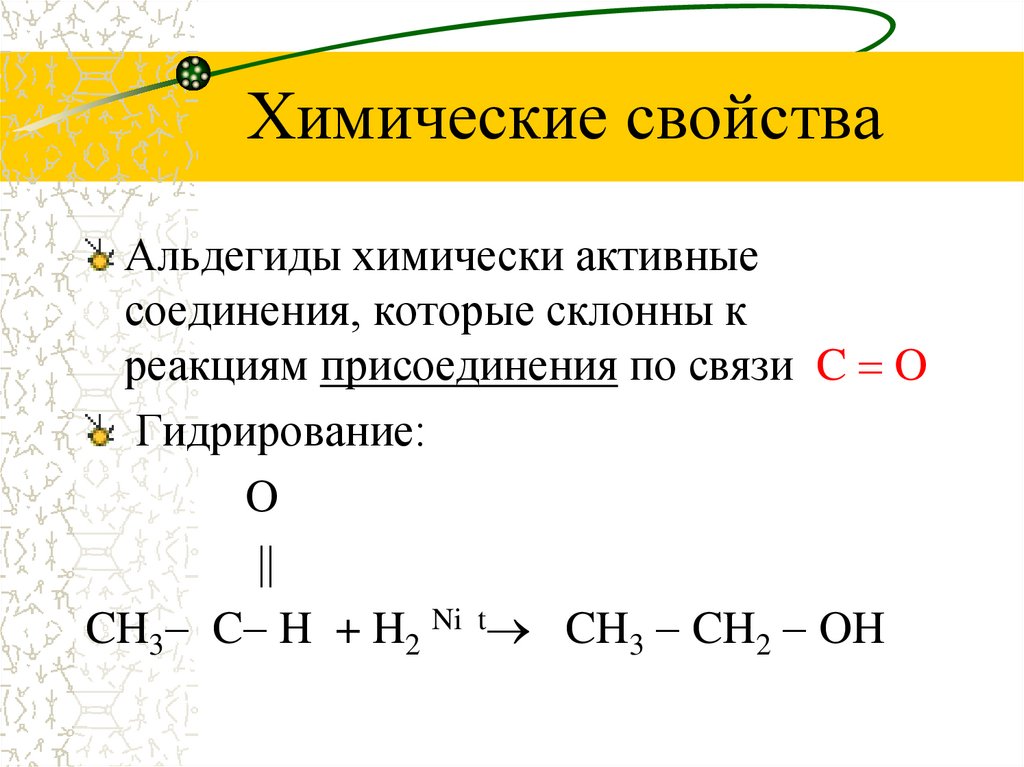
7. Химические свойства
Альдегиды химически активныесоединения, которые склонны к
реакциям присоединения по связи C O
Гидрирование:
O
CH3 C H + H2 Ni t CH3 CH2 OH
8. Химические свойства.
Качественные реакции на альдегиды – этоРеакция « серебряного зеркала»взаимодействие альдегидов с аммиачным
раствором серебра при нагревании. При этом
альдегид окисляется до соответствующей
карбоновой кислоты, а оксид серебра
превращается в свободное серебро, которое
покрывает пробирку.
O
• CH3 C H + Ag2O
t NH3
CH3 COOH + 2Ag
9. Химические свойства.
Качественные реакции на альдегиды – этоВзаимодействие с гидроксидом меди(2) с
образованием красного осадка оксида меди.
O
• CH3 C H + Сu(OH)2
Cu2O + 2H2O
t
CH3 COOH +
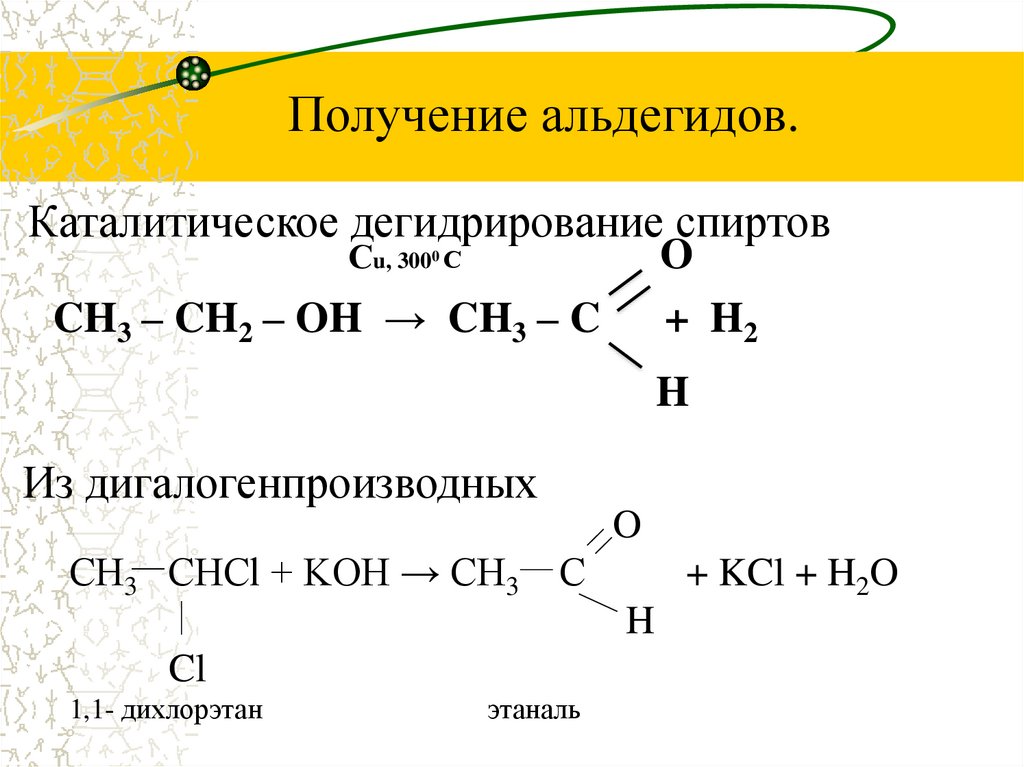
10. Получение альдегидов.
Метаналь получают окислением метанола :2 СН3ОН + О2 = 2НСНО + 2Н2О или
окислением метана:
СН4 + О2 = НСНО +Н2О
Этаналь получают окислением этилена:
2С2Н4 + О2 = 2СН3-СНО
Или гидратацией ацетилена:
С2Н2 + Н2О = СН3СНО
11.
Получение альдегидов.Каталитическое дегидрирование спиртов
Сu, 3000 С
O
+ H2
CH3 – CH2 – OH → CH3 – C
H
Из дигалогенпроизводных
O
СН3 СНСl + KOH → СН3
С
+ KCl + H2O
H
Cl
1,1- дихлорэтан
этаналь
12. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый, обепин
– жидкость с приятным
запахом мимозы
• Альдегид дециловый,
деканаль – при разбавлении
появляются нотки запаха
апельсиновой корки
13. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы
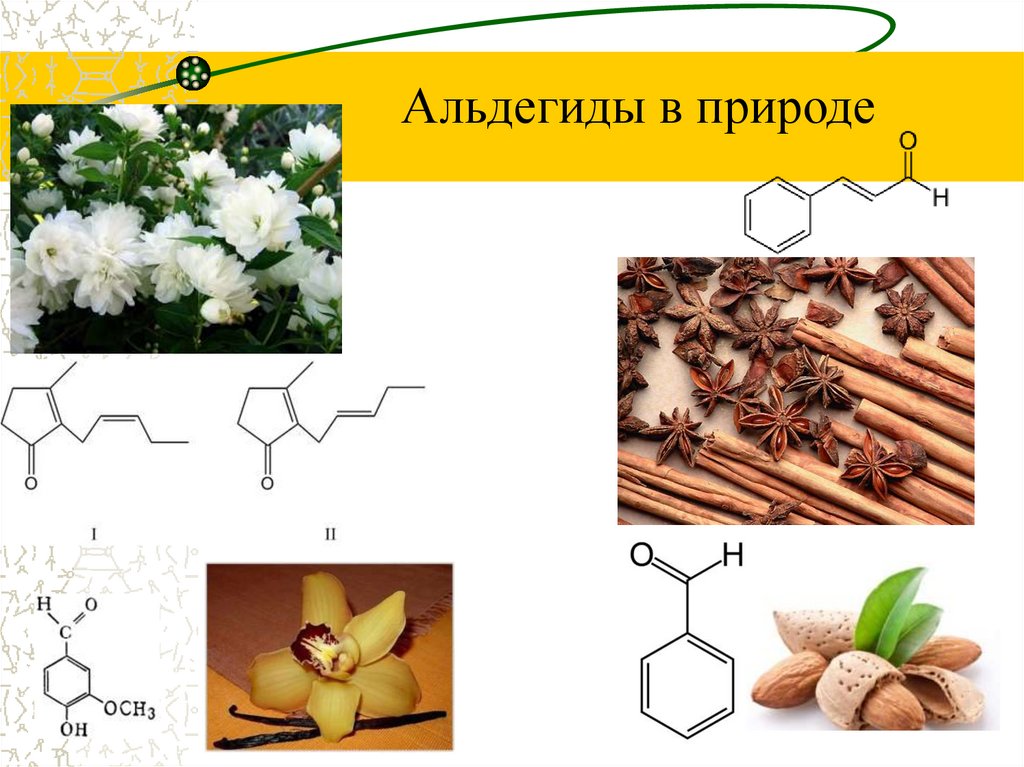
14.
Альдегиды в природе15.
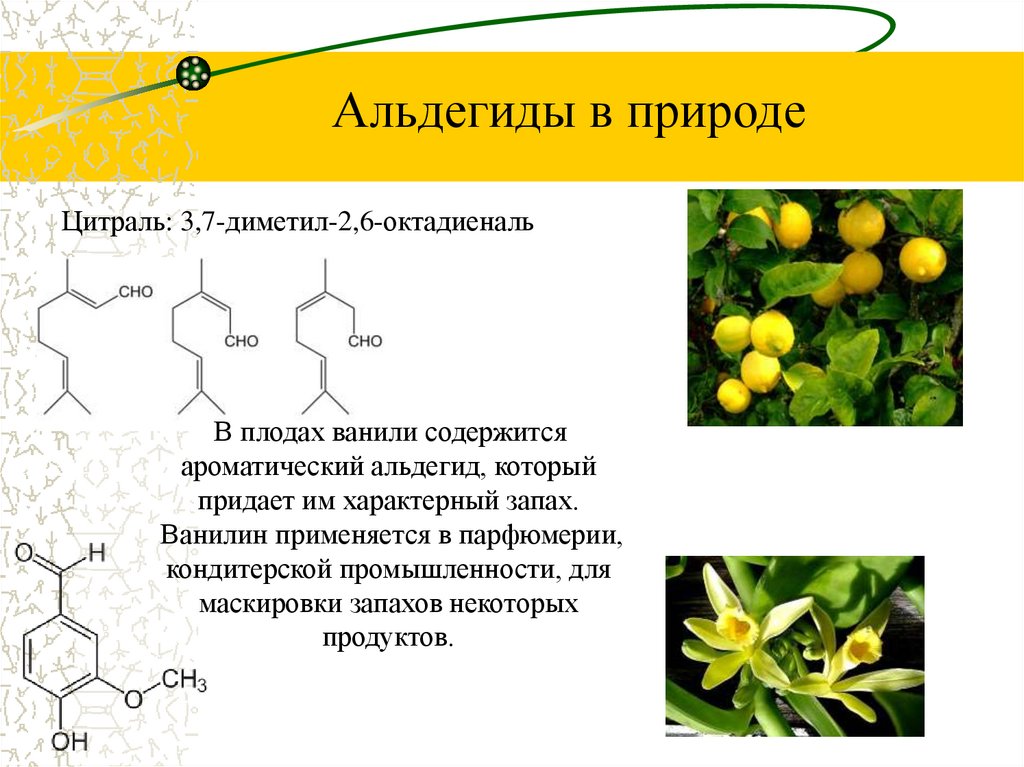
Альдегиды в природеЦитраль: 3,7-диметил-2,6-октадиеналь
В плодах ванили содержится
ароматический альдегид, который Запах цитрусовых обусловлен
придает им характерный запах.
данным диеновым
Ванилин применяется в парфюмерии, альдегидом. Его применяют в
кондитерской промышленности, для качестве отдушки средств
маскировки запахов некоторых
бытовой химии,
продуктов.
косметических и
парфюмерных веществ.
16.
Альдегиды в природеКоричный альдегид,
содержится в масле его
получают перегонкой коры
дерева корицы .
Применяется в кулинарии в
виде палочек или порошка.
Бензальдегид –
жидкость с запахом
горького миндаля.
Встречается в косточках
и семечках, особенно в
абрикосах и персиках.
17.
Альдегиды в природеФенилэтаналь пахнет
гиацинтом.
Кротоновый альдегид
Сильный лакриматор, используют
для получения бутанола,
сорбиновой и масляной кислот.
Содержится в соевом масле.










 Химия
Химия








