Похожие презентации:
Альдегиды и кетоны
1. АЛЬДЕГИДЫ И КЕТОНЫ
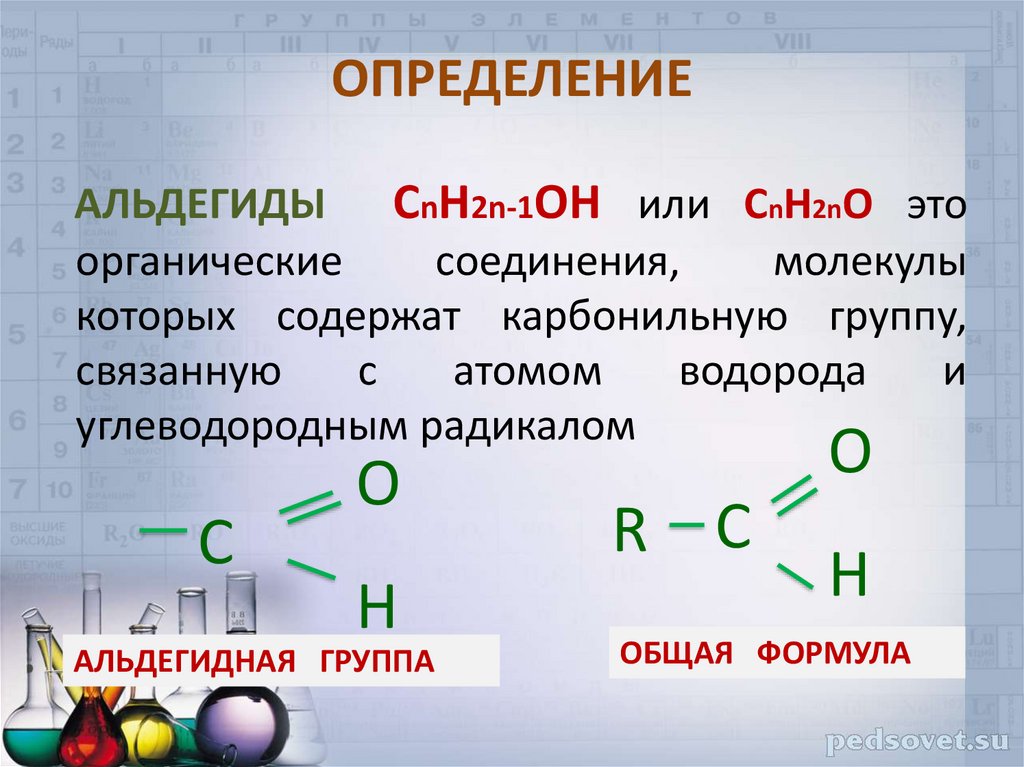
2. ОПРЕДЕЛЕНИЕ
АЛЬДЕГИДЫ СnH2n-1OН или СnH2nO этоорганические
соединения,
молекулы
которых содержат карбонильную группу,
связанную
с
атомом
водорода
и
углеводородным радикалом
С
O
H
АЛЬДЕГИДНАЯ ГРУППА
O
R С
H
ОБЩАЯ ФОРМУЛА
3. ОПРЕДЕЛЕНИЕ
• КЕТОНЫ – органические вещества, вмолекулах которых карбонильная группа
связана с двумя углеводородными
радикалами
С = О - кетогруппа R1 – C – R2
||
O
Общая формула
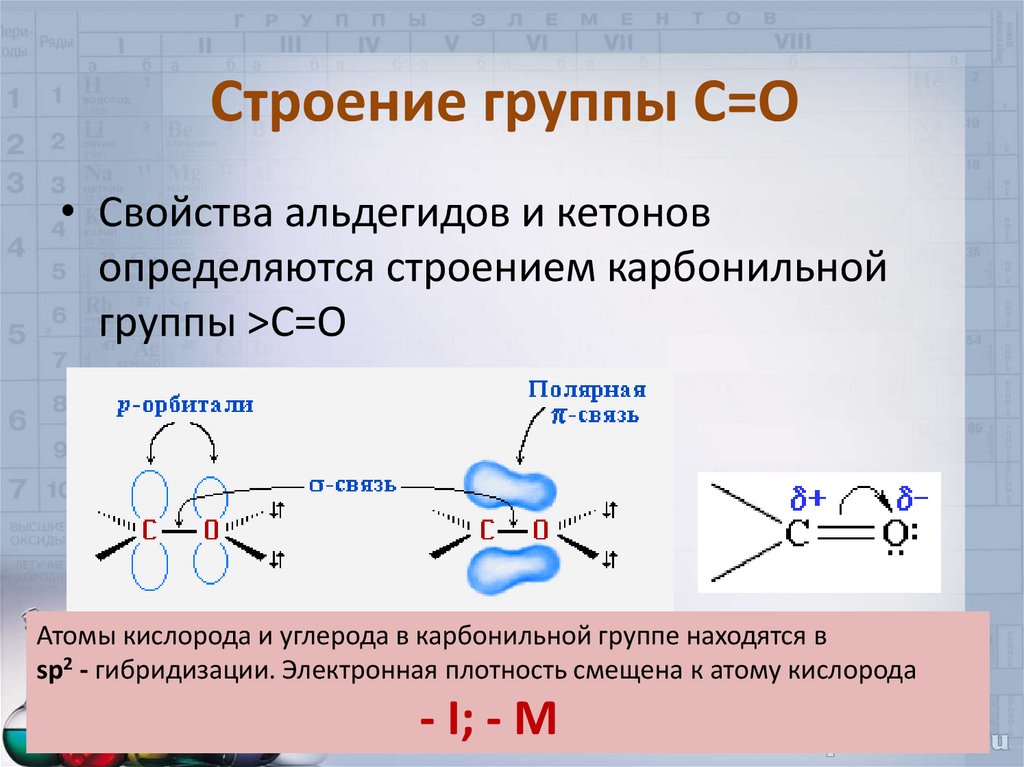
4. Строение группы С=О
• Свойства альдегидов и кетоновопределяются строением карбонильной
группы >C=O
Атомы кислорода и углерода в карбонильной группе находятся в
sp2 - гибридизации. Электронная плотность смещена к атому кислорода
- I; - M
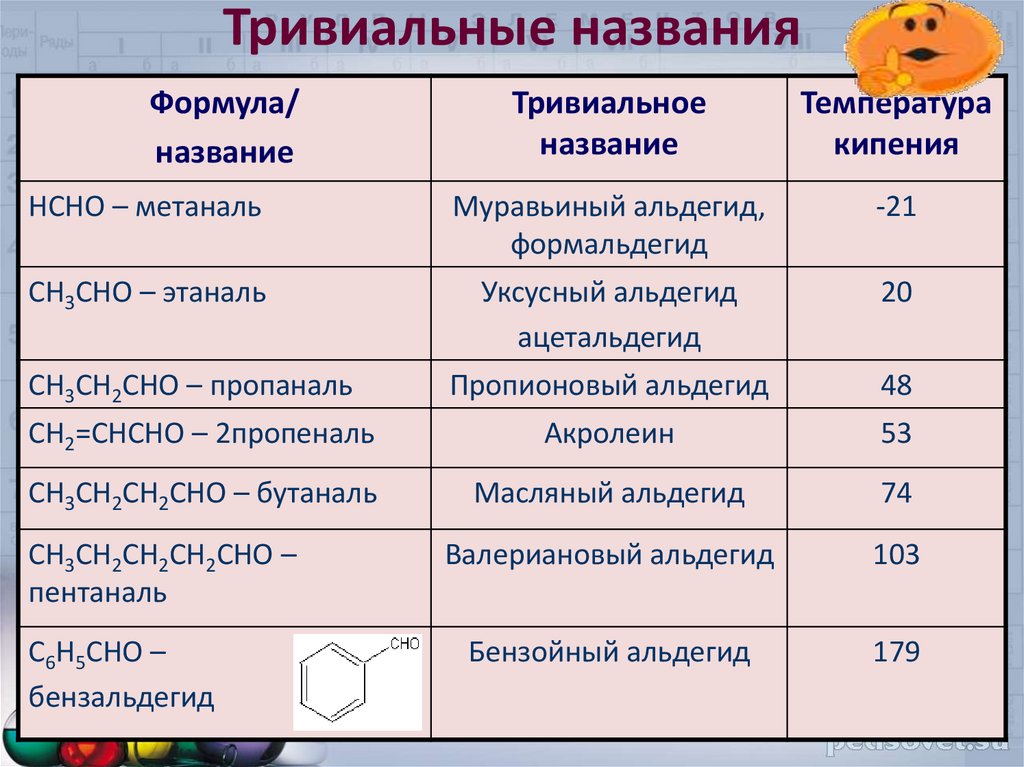
5.
Тривиальные названияФормула/
название
Тривиальное
название
Температура
кипения
HCHO – метаналь
Муравьиный альдегид,
формальдегид
-21
CH3CHO – этаналь
Уксусный альдегид
ацетальдегид
20
CH3CH2CHO – пропаналь
Пропионовый альдегид
48
CH2=CHCHO – 2пропеналь
Акролеин
53
CH3CH2CH2CHO – бутаналь
Масляный альдегид
74
Валериановый альдегид
103
Бензойный альдегид
179
CH3CH2CH2CH2CHO –
пентаналь
C6H5CHO –
бензальдегид
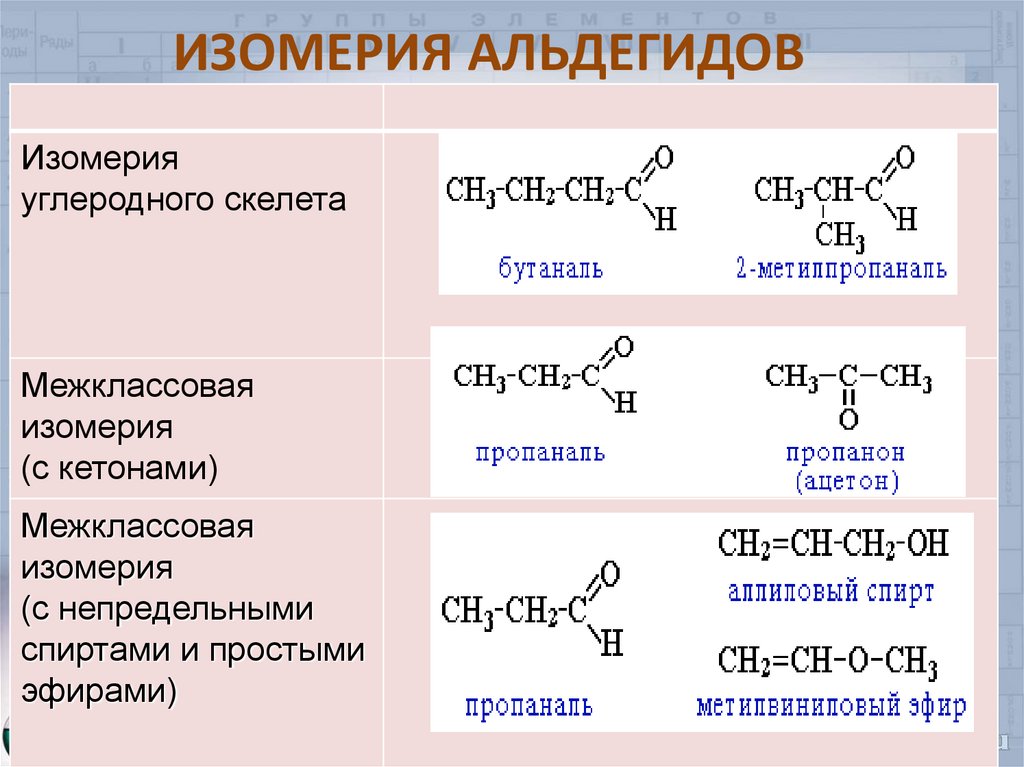
6. ИЗОМЕРИЯ АЛЬДЕГИДОВ
Изомерияуглеродного скелета
Межклассовая
изомерия
(с кетонами)
Межклассовая
изомерия
(с непредельными
спиртами и простыми
эфирами)
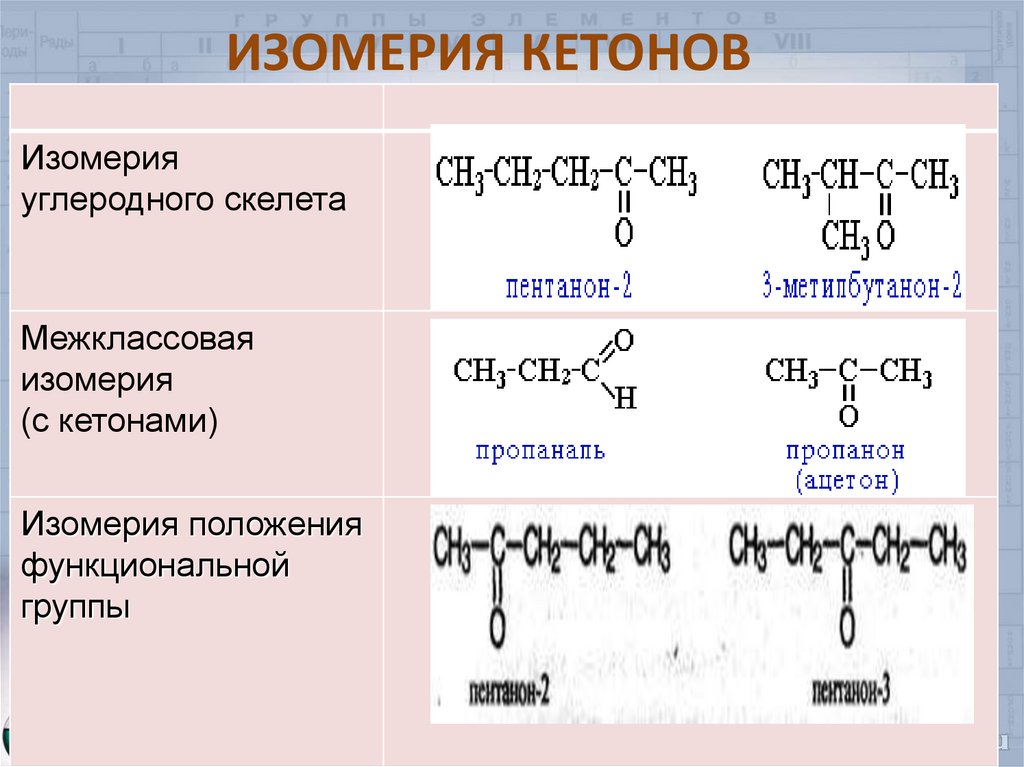
7. ИЗОМЕРИЯ КЕТОНОВ
Изомерияуглеродного скелета
Межклассовая
изомерия
(с кетонами)
Изомерия положения
функциональной
группы
8.
Изомерия и номенклатураO
Н3С – СН2 – СН2 – С
– бутаналь
H
O
Н3С – СН – С
CH3
2 – метилпропаналь
H
Н3С – С – СН2 – СН – CH3
O
CH3
4 – метилпентанон-2
2-этил – 2 гексеналь
Назовите!
9. Физические свойства альдегидов
С1– газ с резким запахом
С2 – С3 – жидкости с резким запахом
С4 – С6 – жидкости с неприятным запахом
>С6 – высшие (особенно непредельные или ароматические) –
твердые, нерастворимые в воде с цветочным запахом
НСОН - формальдегид – газ с резким удушливым
запахом, хорошо растворимый в воде, t кип. - 19,3С,
ядовит. 40% раствор формальдегида называется
формалином
СН3СОН – уксусный альдегид – жидкость с запахом
зелёного яблока, растворимая в воде t кип. 21С
у этих альдегидов температуры кипения ниже, чем у соответствующих
спиртов
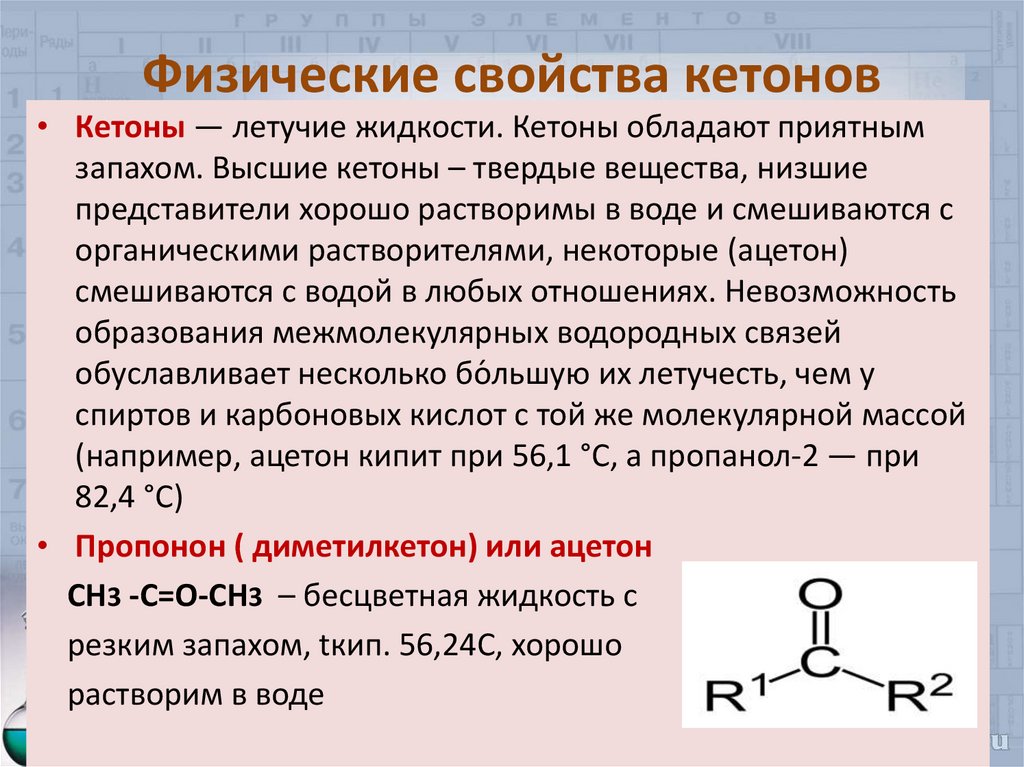
10. Физические свойства кетонов
• Кетоны — летучие жидкости. Кетоны обладают приятнымзапахом. Высшие кетоны – твердые вещества, низшие
представители хорошо растворимы в воде и смешиваются с
органическими растворителями, некоторые (ацетон)
смешиваются с водой в любых отношениях. Невозможность
образования межмолекулярных водородных связей
обуславливает несколько бо́ льшую их летучесть, чем у
спиртов и карбоновых кислот с той же молекулярной массой
(например, ацетон кипит при 56,1 °C, а пропанол-2 — при
82,4 °C)
• Пропонон ( диметилкетон) или ацетон
СН3 -С=О-СН3 – бесцветная жидкость с
резким запахом, tкип. 56,24С, хорошо
растворим в воде
11.
Альдегиды в природеОтличительной чертой многих альдегидов является их запах.
Высшие альдегиды, особенно непредельные и ароматические,
входят в состав эфирных масел и содержатся в цветах, фруктах,
плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
12.
Альдегиды в природеБулочки ванильные,
корицы аромат,
Амаретто, шоколад
Альдегидов вкус таят.
В землянике и кокосе,
И в жасмине, и в малине,
И в духах, и в еде
Альдегидов след везде.
Что за запах, что за
прелесть,
И откуда эта свежесть?!
Это высший альдегид
Аромат вам свой дарит!
13.
Альдегиды в природеВанилин
В
плодах
ванили
содержится ароматический
альдегид, который придает
им характерный запах.
Ванилин применяется в
парфюмерии, кондитерской
промышленности,
для
маскирования
запахов
некоторых продуктов
14.
Альдегиды в природеЦитраль
Запах цитрусовых обусловлен данным
диеновым альдегидом. Его применяют в
качестве отдушки средств бытовой химии,
косметических и парфюмерных веществ
15.
Альдегиды в природеКоричный альдегид
Коричный альдегид содержится в масле корицы,
его получают перегонкой коры дерева корицы .
Применяется в кулинарии в виде палочек или
порошка
16.
Альдегиды в природеБензальдегид
Бензальдегид – жидкость с запахом горького
миндаля.
Встречается в косточках и семечках (абрикос,
персик)
17.
Альдегиды в природеФенилэтаналь
Фенилэтаналь по сравнению с
бензальдегидом лучше соответствует
рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
18.
Кетоны в природеn-Гидроксифенилбутанон-2
Этот кетон обуславливает в основном запах спелых ягод
малины.
Его включают в состав синтетических душистых
композиций
19. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ВОССТАНОВЛЕНИЯО
t,Pt
СН3 С
+ Н2 → СН3
этаналь Н
СН2 ОН
этанол
t,Pt
CH3 – C – CH3 + H2 CH3 – CH – CH3
||
|
O
OH
ацетон
пропанол-2
19
20. ХИМИЧЕСКИЕ СВОЙСТВА
Реакции нуклеофильного присоединениясинильная к-та
гидроксинитрил
ацеталь
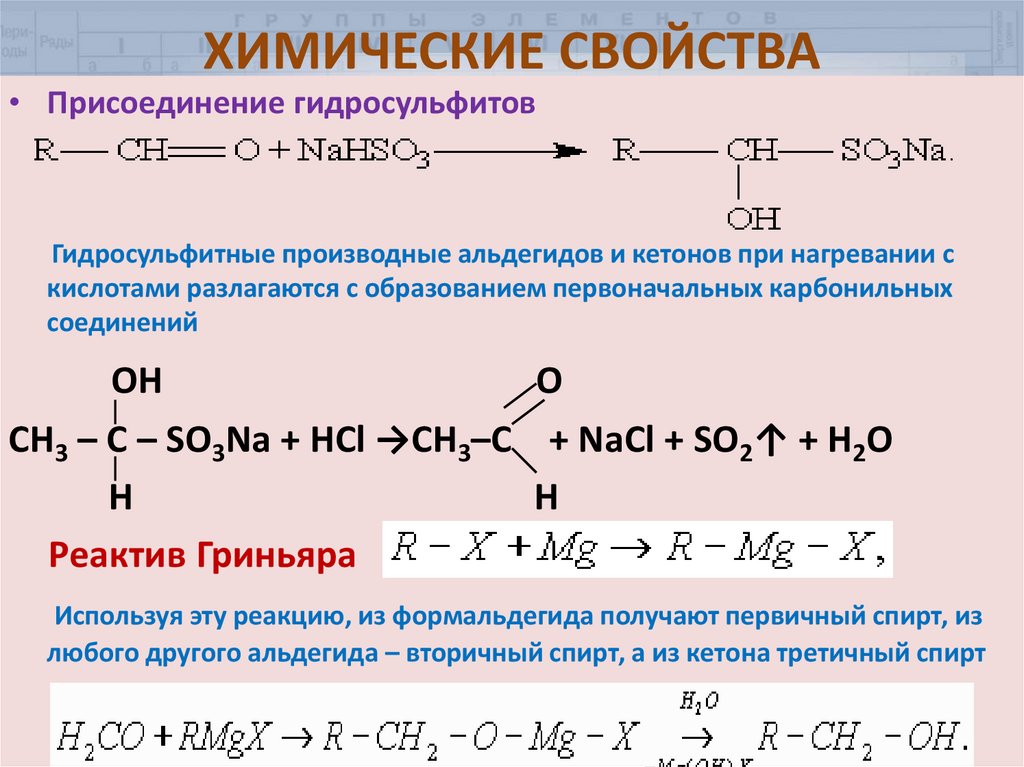
21. ХИМИЧЕСКИЕ СВОЙСТВА
• Присоединение гидросульфитовГидросульфитные производные альдегидов и кетонов при нагревании с
кислотами разлагаются с образованием первоначальных карбонильных
соединений
OH
O
СН3 – С – SO3Na + HCl →CH3–C + NaCl + SO2↑ + H2O
H
H
Реактив Гриньяра
Используя эту реакцию, из формальдегида получают первичный спирт, из
любого другого альдегида – вторичный спирт, а из кетона третичный спирт
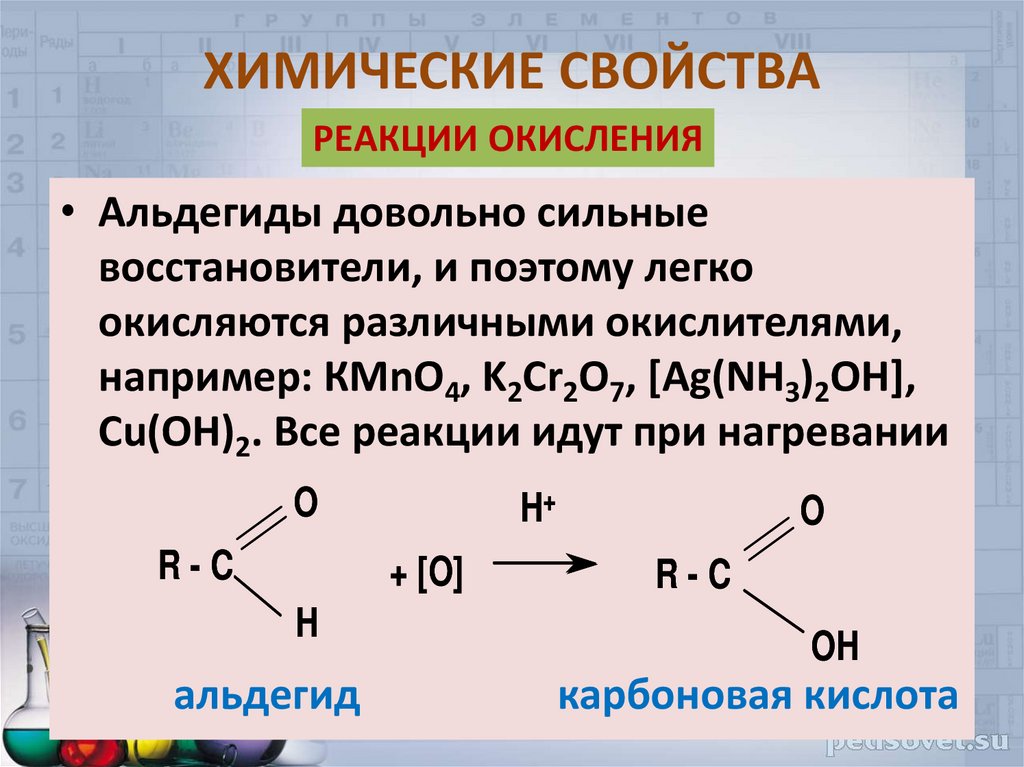
22. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯ• Альдегиды довольно сильные
восстановители, и поэтому легко
окисляются различными окислителями,
например: КМnO4, K2Cr2O7, [Ag(NH3)2OH],
Cu(OH)2. Все реакции идут при нагревании
O
R-C
H+
+ [O]
H
альдегид
O
R-C
OH
карбоновая кислота
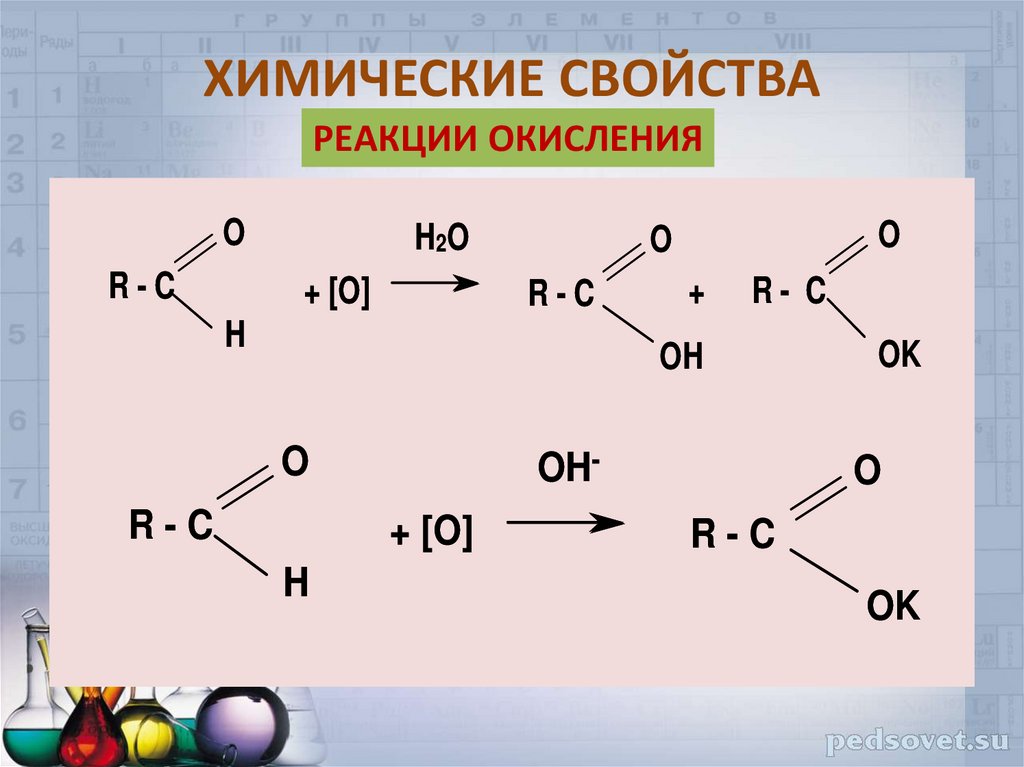
23. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯO
R-C
H2 O
+ [O]
O
O
R-C
H
+
R- C
OH
O
R-C
OH+ [O]
H
OK
O
R-C
OK
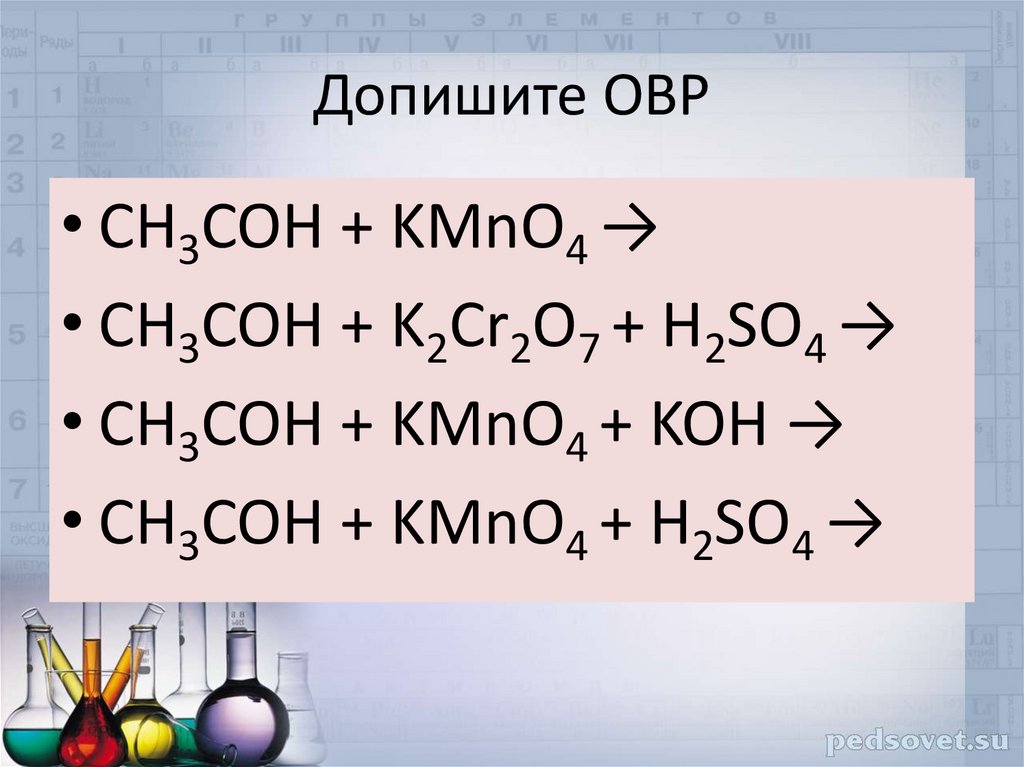
24. Допишите ОВР
• CH3COH + KMnO4 →• CH3COH + K2Cr2O7 + H2SO4 →
• CH3COH + KMnO4 + KOH →
• CH3COH + KMnO4 + H2SO4 →
25.
ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
Муравьиный альдегид окисляется до CO2
или карбонатов:
НСОН + К2Сr2O7 + H2SO4→CO2 + Cr2(SO4)3
+ K2SO4 + H2O
Расставьте коэффициенты!
3НСОН + 2К2Сr2O7 + 8H2SO4→3CO2 +
2Cr2(SO4)3 + 2K2SO4 + 11H2O
26. Допишите ОВР
• HCOH + KMnO4(изб) + H2SO4 →• HCOH + [Ag(NH3)2OH] →
• HCOH + Cu(OH)2 →
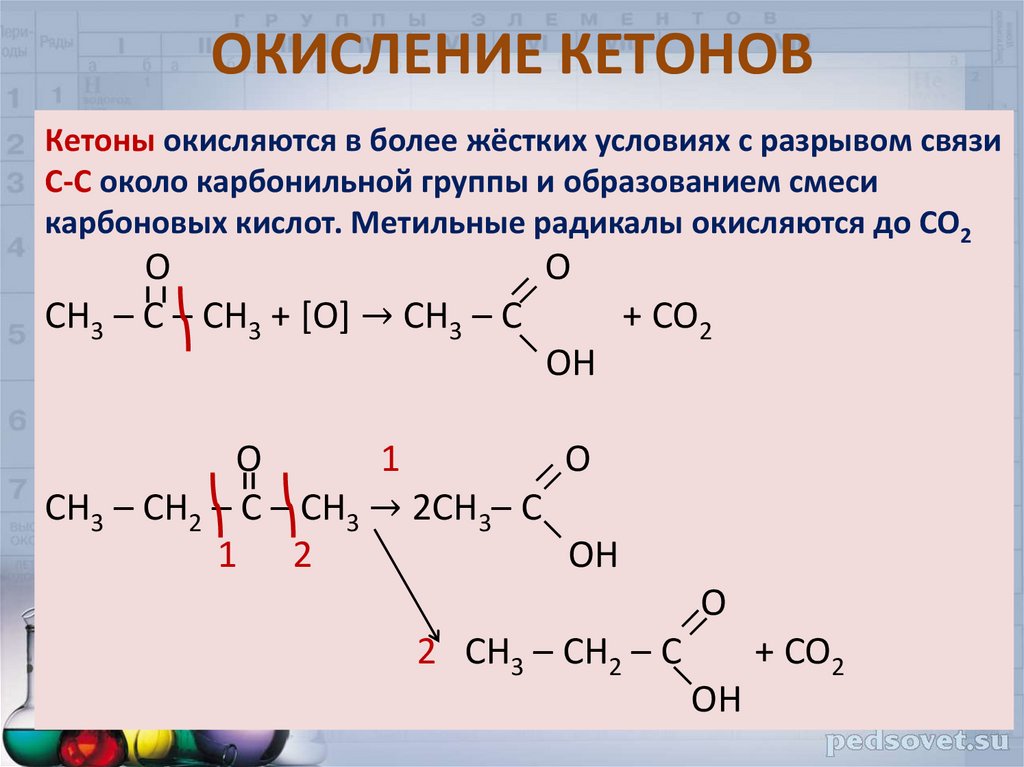
27. ОКИСЛЕНИЕ КЕТОНОВ
Кетоны окисляются в более жёстких условиях с разрывом связиС-С около карбонильной группы и образованием смеси
карбоновых кислот. Метильные радикалы окисляются до СО2
О
O
СН3 – С – СН3 + [O] → CH3 – C
+ CO2
OH
О
1
O
CH3 – CH2 – C – CH3 → 2CH3– C
1 2
OH
O
2 CH3 – CH2 – C
OH
+ CO2
28. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция серебряного зеркалакачественная реакция
СН3 С
СН3 С
О
О
+ 2[Ag(NH3)2]OH → СН3 С
Н
+ 2Ag + 4NH3 + 2H2O
OН
О
+ 2[Ag(NH3)2]OH → СН3 С
Н
О
+ 2Ag + 3NH3 + 2H2O
ONH4
28
29. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция с гидроксидом меди
качественная реакция
О
СН3 С
+ 2Cu(OH)2 → СН3 С
этаналь
Н
этановая кислота
О
+ 2H2O + Cu2O
OН
гидроксид
меди (I)
(кирпично-красный)
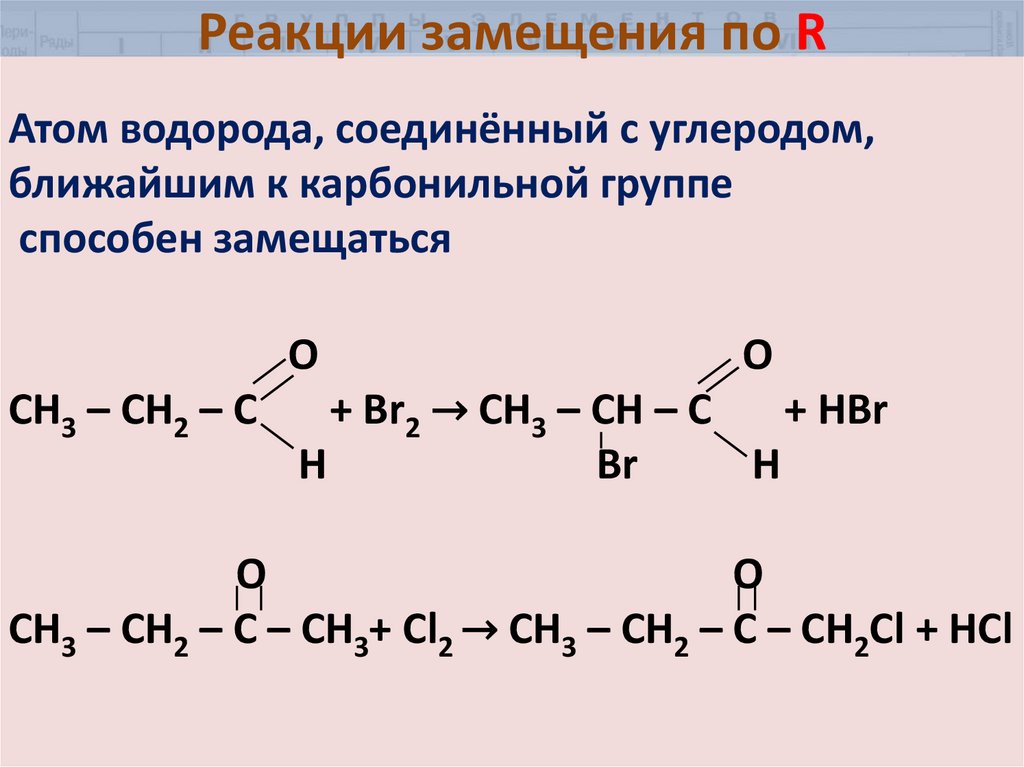
30. Реакции замещения по R
Атом водорода, соединённый с углеродом,ближайшим к карбонильной группе
способен замещаться
О
CH3 – CH2 – C
O
+ Br2 → CH3 – CH – C
+ HBr
Н
Br
H
O
О
CH3 – CH2 – C – CH3+ Cl2 → CH3 – CH2 – C – CH2Cl + HCl
31. Реакции замещения по R
На свету атом брома может замещать любой изатомов водорода
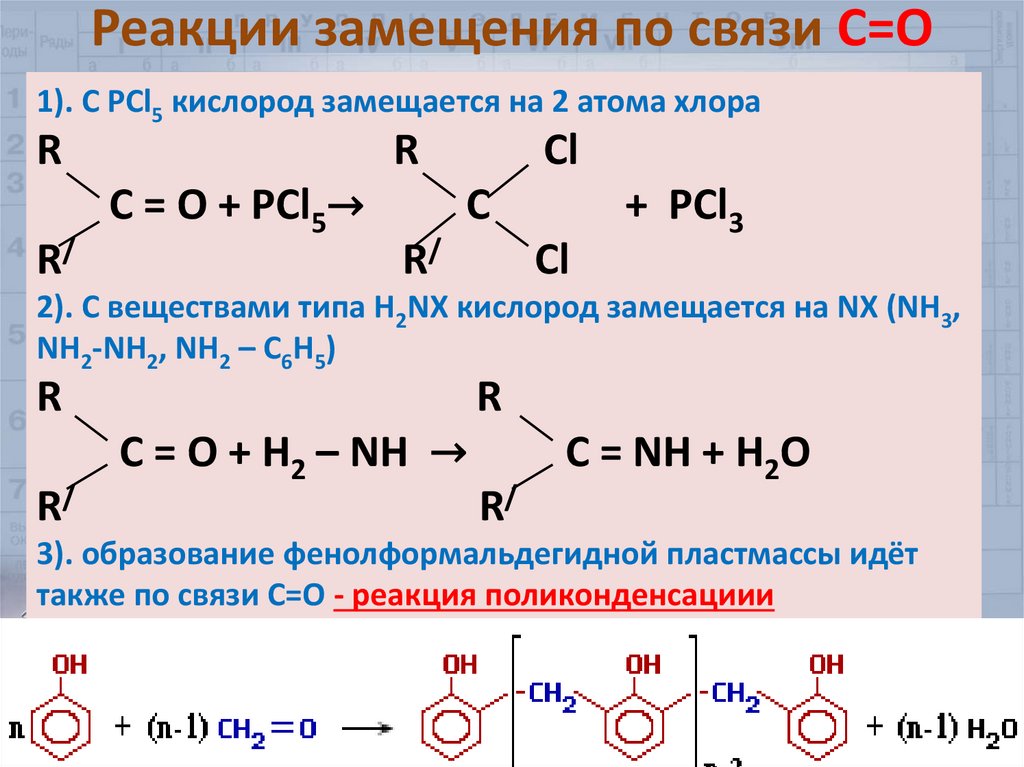
32. Реакции замещения по связи С=О
1). С РСl5 кислород замещается на 2 атома хлораR
R/
R
C = O + РСl5→
Cl
C
R/
Cl
+ РСl3
2). С веществами типа Н2NХ кислород замещается на NX (NH3,
NH2-NH2, NH2 – C6H5)
R
R/
R
C = O + H2 – NH →
R/
C = NH + H2O
3). образование фенолформальдегидной пластмассы идёт
также по связи С=О - реакция поликонденсациии
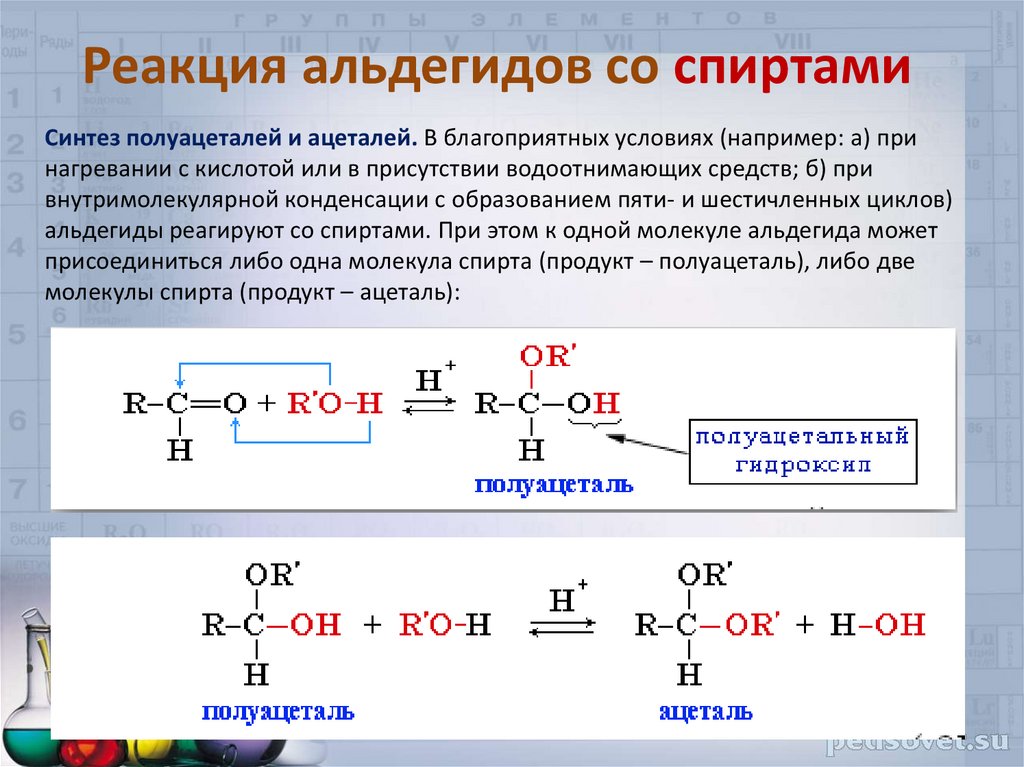
33. Реакция альдегидов со спиртами
Синтез полуацеталей и ацеталей. В благоприятных условиях (например: а) принагревании с кислотой или в присутствии водоотнимающих средств; б) при
внутримолекулярной конденсации с образованием пяти- и шестичленных циклов)
альдегиды реагируют со спиртами. При этом к одной молекуле альдегида может
присоединиться либо одна молекула спирта (продукт – полуацеталь), либо две
молекулы спирта (продукт – ацеталь):
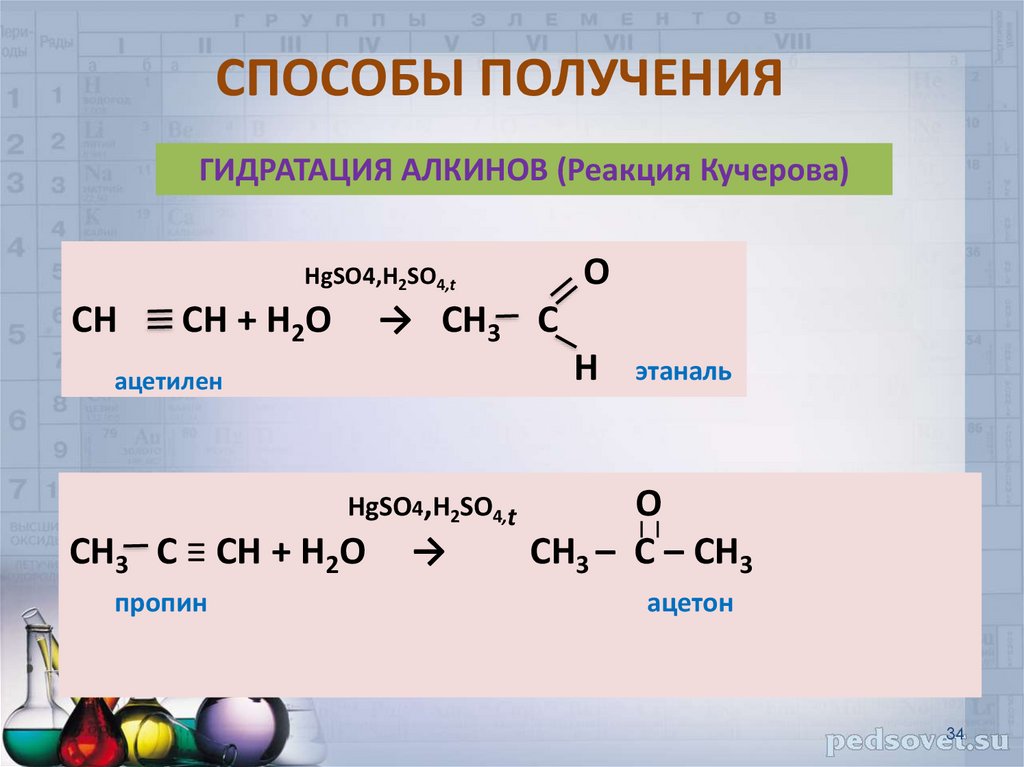
34. СПОСОБЫ ПОЛУЧЕНИЯ
ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)О
HgSO4,H2SO4,t
СН
СН + Н2О
→ СН3 С
Н
ацетилен
HgSO4,H2SO4,t
СН3 С ≡ СН + Н2О
пропин
→
этаналь
O
СН3 – С – СН3
ацетон
34
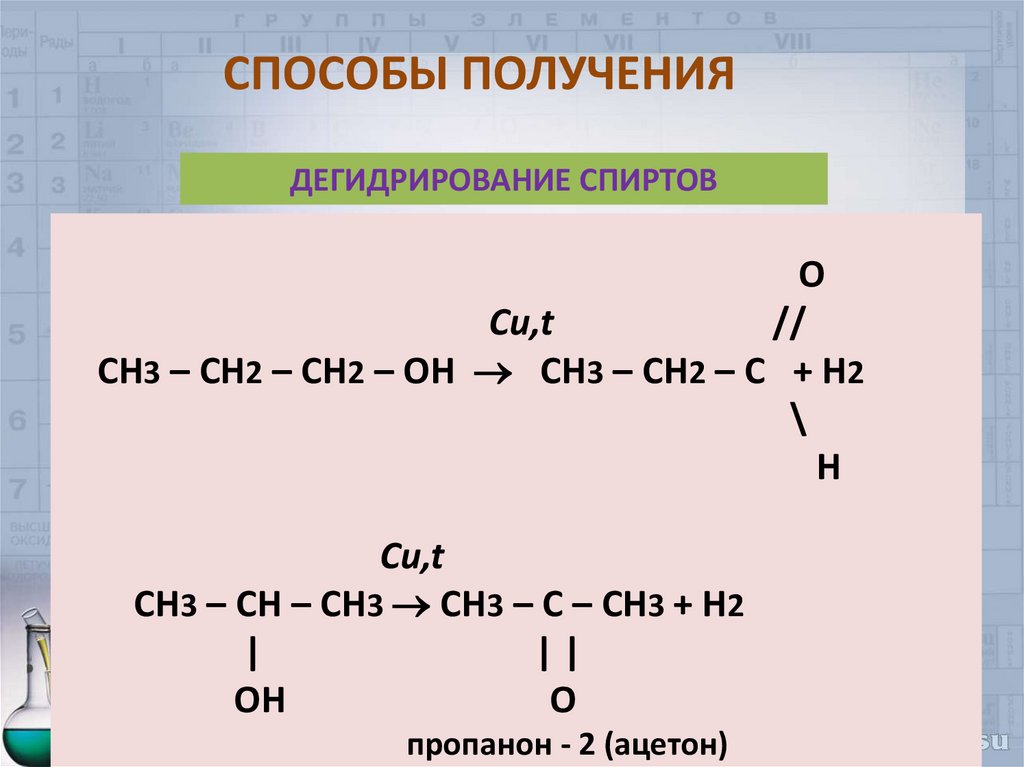
35. СПОСОБЫ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ СПИРТОВO
Cu,t
//
CH3 – CH2 – CH2 – OH СH3 – CH2 – C + H2
\
H
Cu,t
СH3 – CH – CH3 CH3 – C – CH3 + H2
|
||
OH
O
пропанон - 2 (ацетон)
35
36. СПОСОБЫ ПОЛУЧЕНИЯ
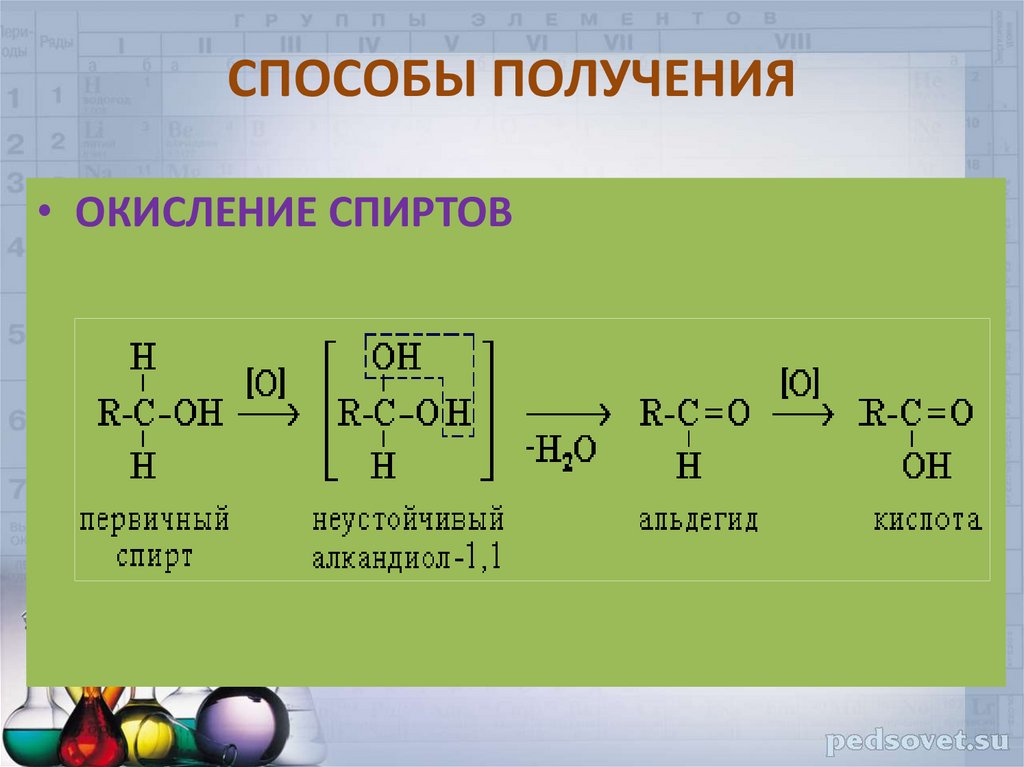
• ОКИСЛЕНИЕ СПИРТОВ37. СПОСОБЫ ПОЛУЧЕНИЯ
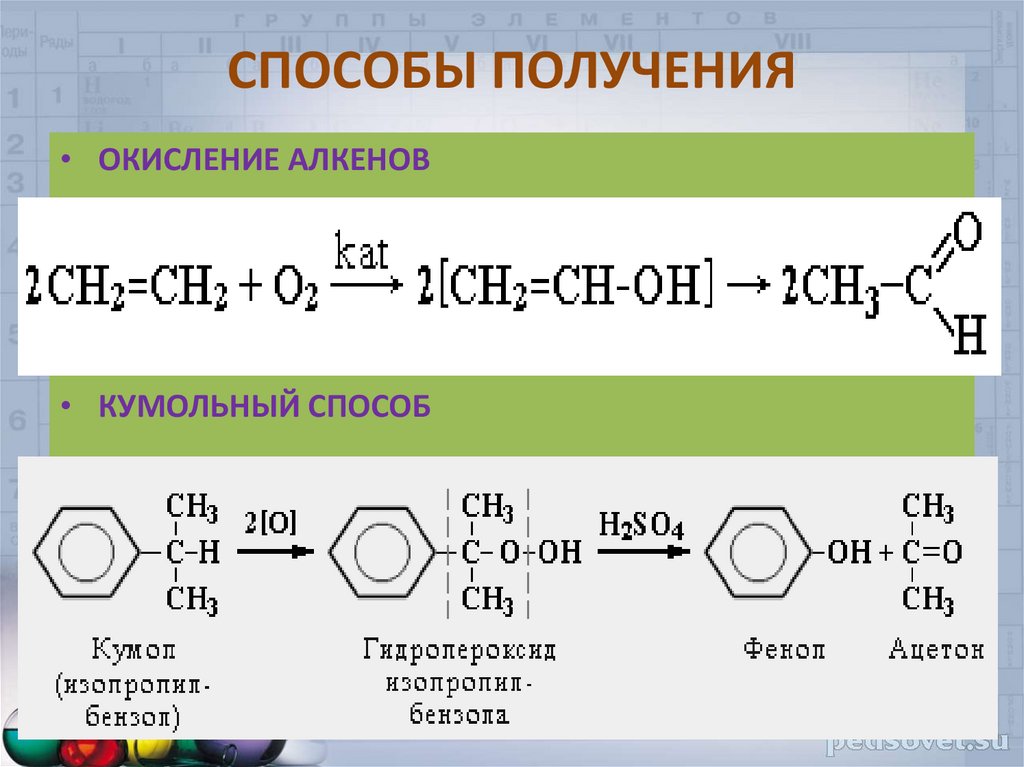
• ОКИСЛЕНИЕ АЛКЕНОВ• КУМОЛЬНЫЙ СПОСОБ
38.
ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХO
СН3 - СН - Сl + 2KOH → СН3-С
+ 2KCl + H2O
H
Cl
1,1- дихлорэтан
этаналь
ГИДРОЛИЗ ДИГАЛОГЕНАЛКАНОВ
O
СН3 - СН - Сl + H2O
→ СН3 - С
+ 2HCl
H
Cl
1,1- дихлорэтан
этаналь
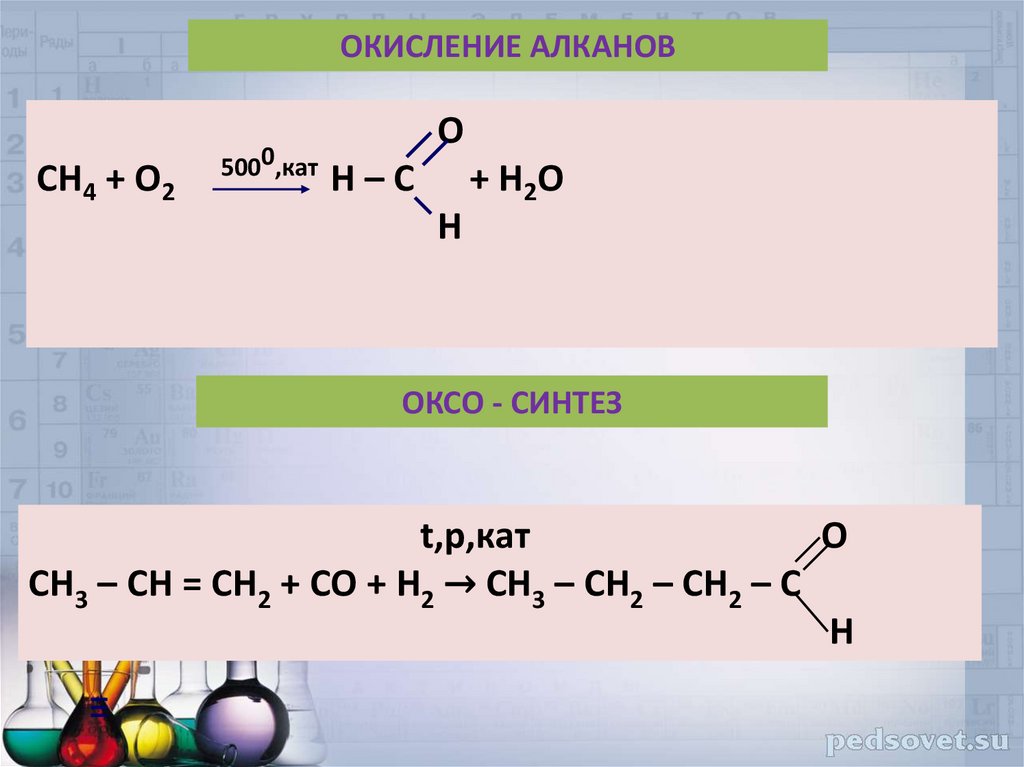
39. ОКИСЛЕНИЕ АЛКАНОВ
CH4 + O25000,кат
O
H–С
+ H2O
H
ОКСО - СИНТЕЗ
t,p,кат
О
CH3 – CH = CH2 + СО + Н2 → CH3 – CH2 – CH2 – С
Н
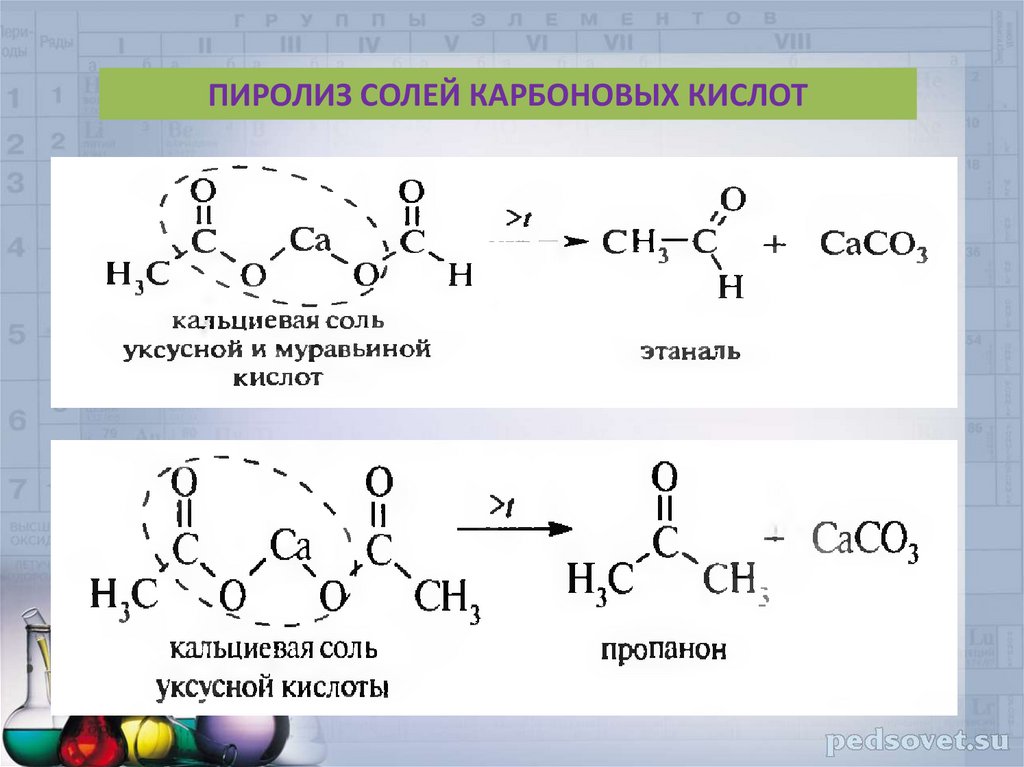
40.
ПИРОЛИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ41. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый,
обепин – жидкость с
приятным запахом мимозы
• Альдегид дециловый,
деканаль – при
разбавлении появляются
нотки запаха апельсиновой
корки
42. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы
43. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПРОИЗВОДСТВО ВЕЩЕСТВУксусная кислота
Этилацетат
Формалин
44.
Контрольные вопросы1. Найдите формулу альдегида:
2. Исключите лишнее вещество в ряду:
3. Какая функциональная группа называется карбонильной?
4. Атом углерода в альдегидной группе находится в состоянии гибридизации:
а) sp
б) sp2
в) sp3
г) не гибридизован
5. Назовите вещества с формулой
а) 2-метилбутанон-3,
в) 3-метилбутаналь,
б) 3-метилбутанон-2,
г) 1,2-диметилпентаналь
45.
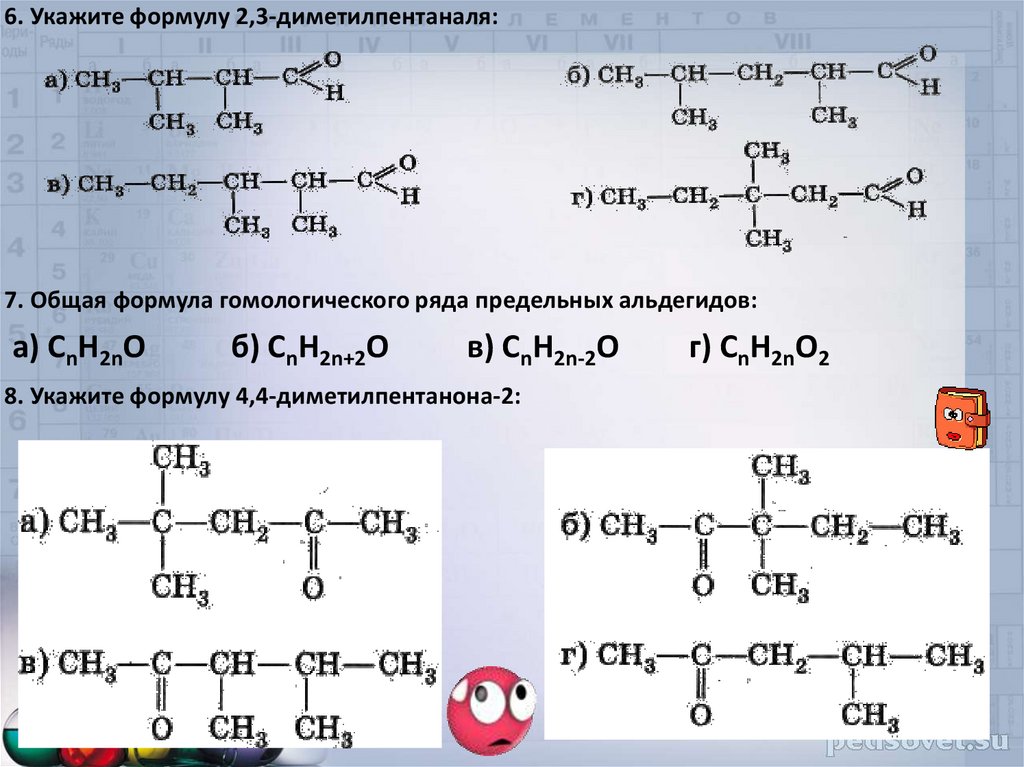
6. Укажите формулу 2,3-диметилпентаналя:7. Общая формула гомологического ряда предельных альдегидов:
а) CnH2nO
б) CnH2n+2O
в) CnH2n-2O
8. Укажите формулу 4,4-диметилпентанона-2:
г) CnH2nO2
46.
9. Гидратацией какого алкина можно получить альдегид?Напишите уравнение реакции, укажите условия её проведения.
а) этина
в) бутина
б) пропина
г) изобутина
10. Нагреваем соли ацетата кальция можно получить:
а) метаналь б) этаналь в) пропаналь г) пропанон
11. Какие признаки верно отражают физические свойства
метаналя: 1) бесцветная жидкость, 2) газообразное вещество, 3)
имеется характерный запах, 4) плохо растворим в воде, 5)
молекула полярная.
а) 1, 3, 4
б) 2, 3, 5
в) 3, 4, 5
г) 2, 4, 5
12. Какая из реакций носит имя М. Г. Кучерова.
а) гидратация ацетилена
б) тримеризация ацетилена
в) гидрирование ацетилена
г) бромирование ацетилена
47.
СПАСИБО ЗАВНИМАНИЕ!


























 Химия
Химия








