Похожие презентации:
Альдегиды и кетоны
1. АЛЬДЕГИДЫ И КЕТОНЫ
Составитель: И.Н. Пиялкина,учитель химии МБОУ СОШ № 37
города Белово
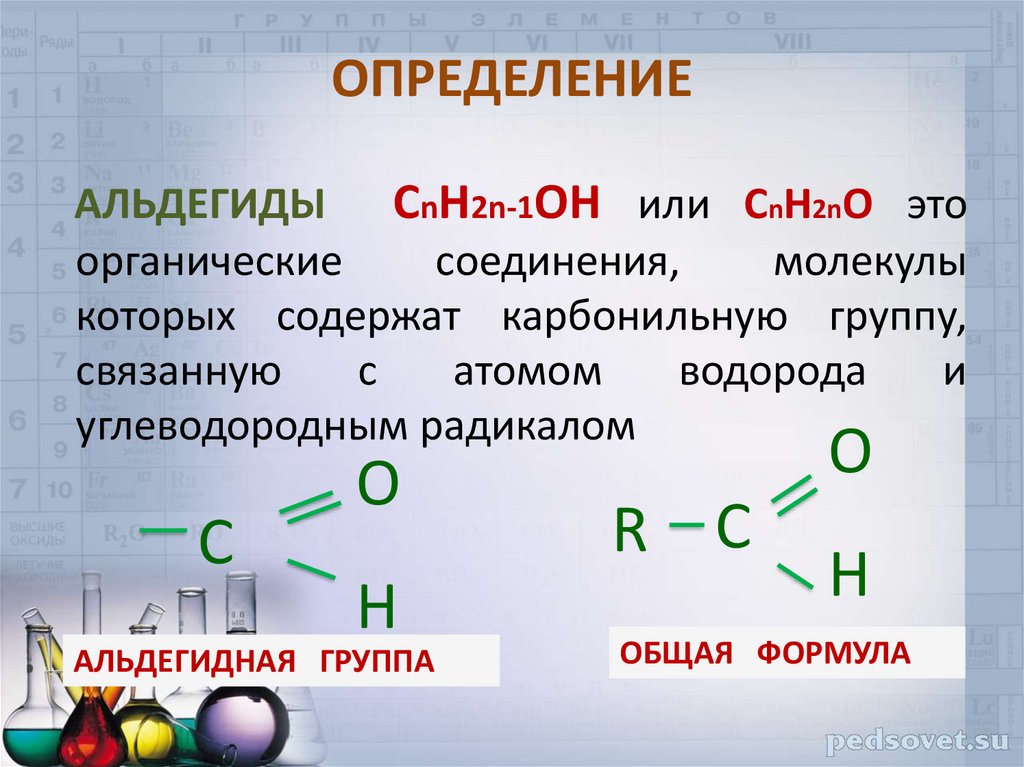
2. ОПРЕДЕЛЕНИЕ
АЛЬДЕГИДЫ СnH2n-1OН или СnH2nO этоорганические
соединения,
молекулы
которых содержат карбонильную группу,
связанную
с
атомом
водорода
и
углеводородным радикалом
С
O
H
АЛЬДЕГИДНАЯ ГРУППА
O
R С
H
ОБЩАЯ ФОРМУЛА
3. ОПРЕДЕЛЕНИЕ
• КЕТОНЫ – органические вещества, вмолекулах которых карбонильная группа
связана с двумя углеводородными
радикалами
С = О - кетогруппа R1 – C – R2
||
O
Общая формула
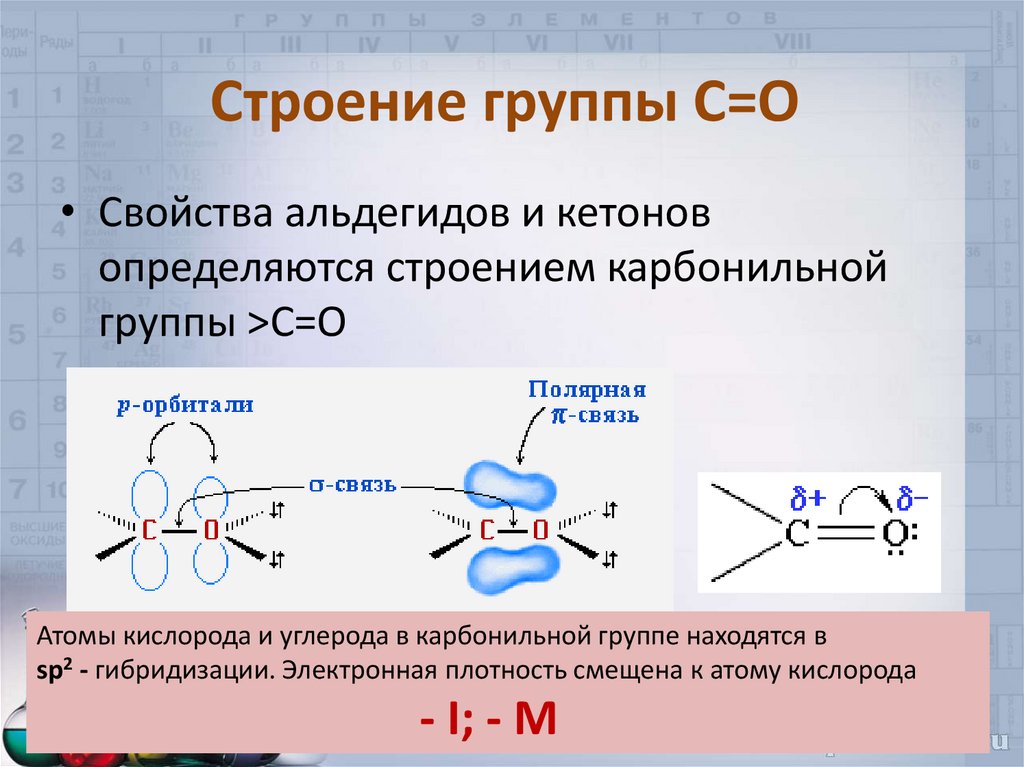
4. Строение группы С=О
• Свойства альдегидов и кетоновопределяются строением карбонильной
группы >C=O
Атомы кислорода и углерода в карбонильной группе находятся в
sp2 - гибридизации. Электронная плотность смещена к атому кислорода
- I; - M
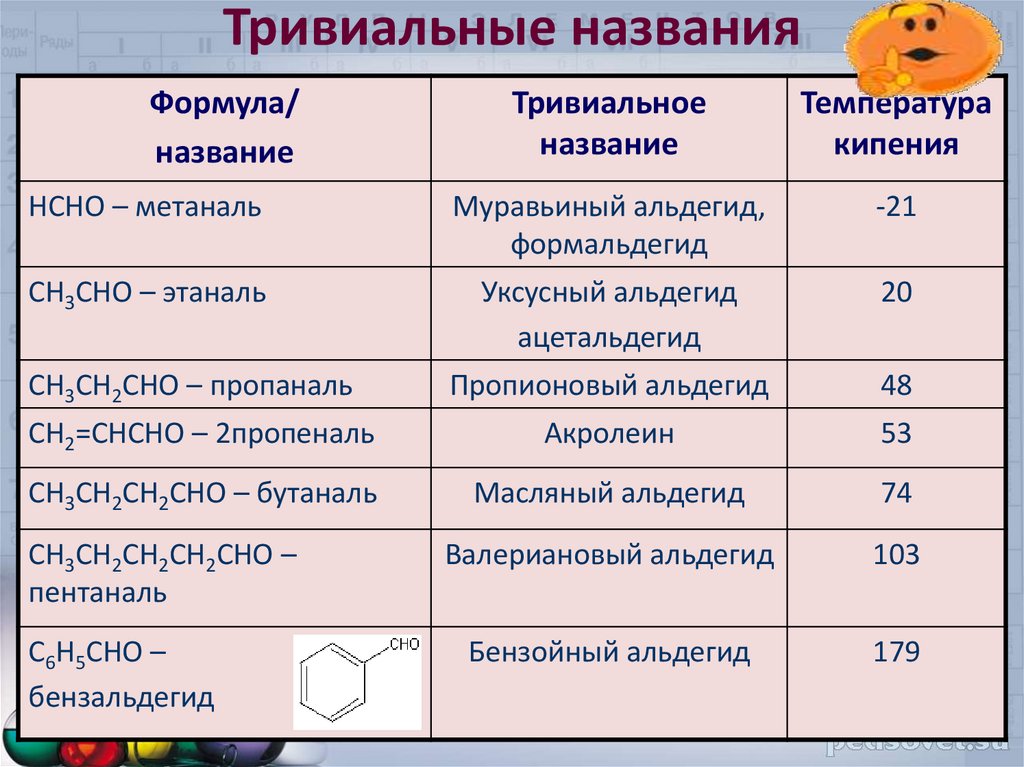
5.
Тривиальные названияФормула/
название
Тривиальное
название
Температура
кипения
HCHO – метаналь
Муравьиный альдегид,
формальдегид
-21
CH3CHO – этаналь
Уксусный альдегид
ацетальдегид
20
Пропионовый альдегид
48
CH2=CHCHO – 2пропеналь
Акролеин
53
CH3CH2CH2CHO – бутаналь
Масляный альдегид
74
Валериановый альдегид
103
Бензойный альдегид
179
CH3CH2CHO – пропаналь
CH3CH2CH2CH2CHO –
пентаналь
C6H5CHO –
бензальдегид
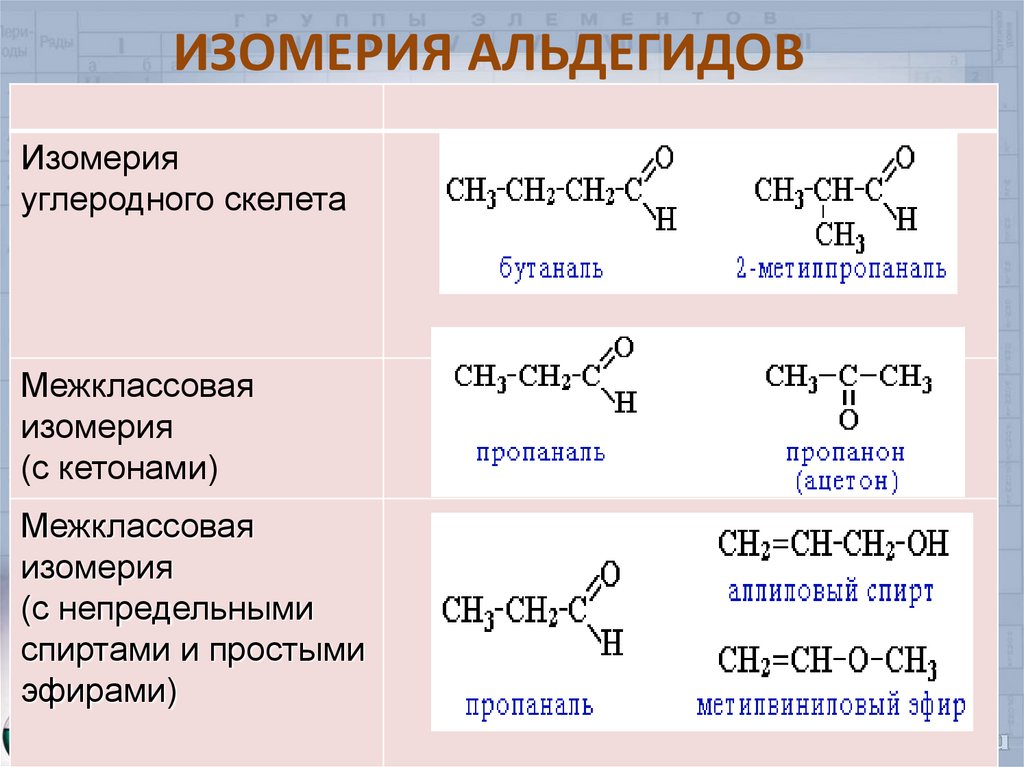
6. ИЗОМЕРИЯ АЛЬДЕГИДОВ
Изомерияуглеродного скелета
Межклассовая
изомерия
(с кетонами)
Межклассовая
изомерия
(с непредельными
спиртами и простыми
эфирами)
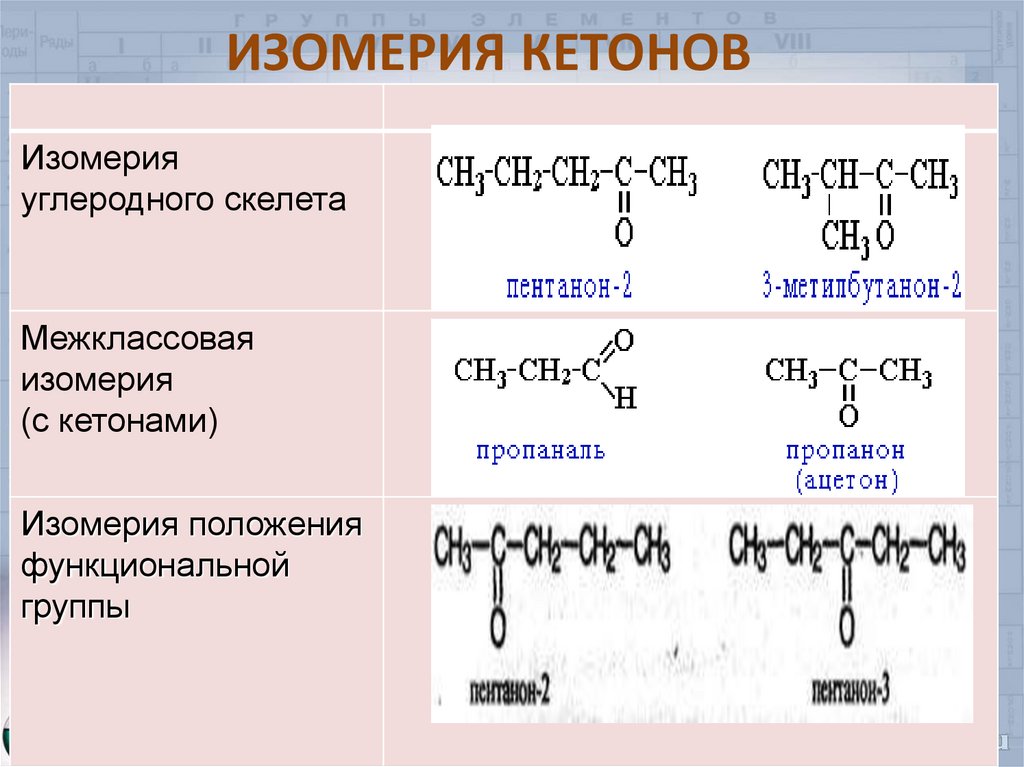
7. ИЗОМЕРИЯ КЕТОНОВ
Изомерияуглеродного скелета
Межклассовая
изомерия
(с кетонами)
Изомерия положения
функциональной
группы
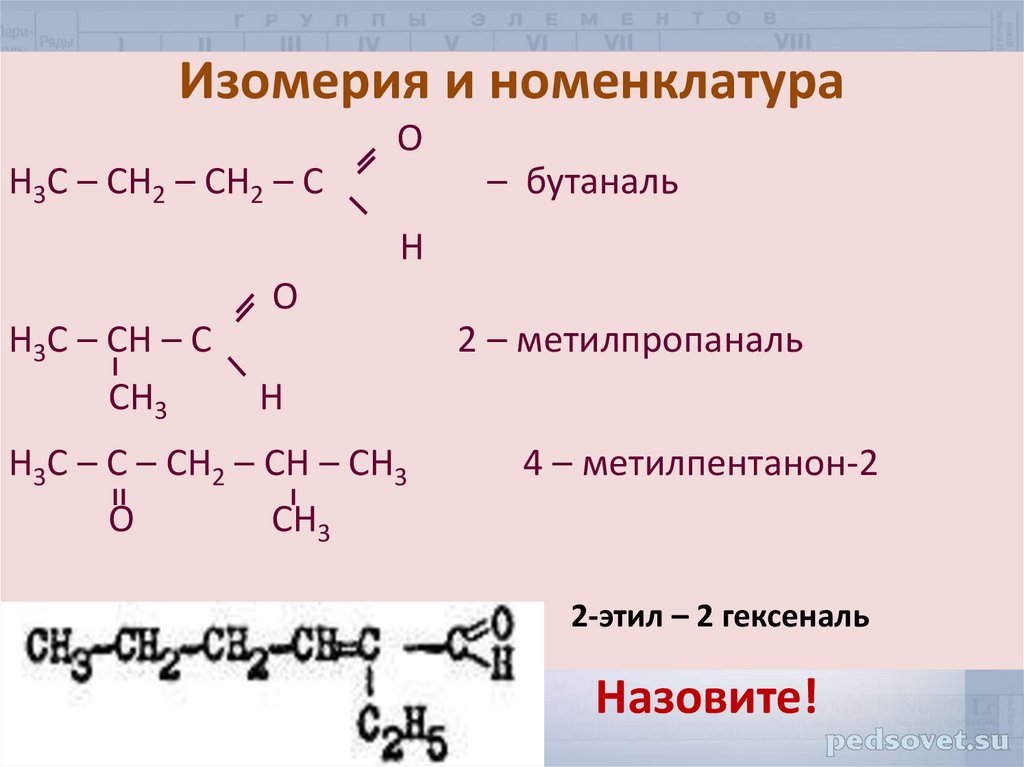
8.
Изомерия и номенклатураO
Н3С – СН2 – СН2 – С
– бутаналь
H
O
Н3С – СН – С
CH3
2 – метилпропаналь
H
Н3С – С – СН2 – СН – CH3
O
CH3
4 – метилпентанон-2
2-этил – 2 гексеналь
Назовите!
9. Физические свойства альдегидов
С1– газ с резким запахом
С2 – С3 – жидкости с резким запахом
С4 – С6 – жидкости с неприятным запахом
>С6 – высшие (особенно непредельные или ароматические) –
твердые, нерастворимые в воде с цветочным запахом
НСОН - формальдегид – газ с резким удушливым
запахом, хорошо растворимый в воде, t кип. - 19,3С,
ядовит. 40% раствор формальдегида называется
формалином
СН3СОН – уксусный альдегид – жидкость с запахом
зелёного яблока, растворимая в воде t кип. 21С
у этих альдегидов температуры кипения ниже, чем у соответствующих
спиртов
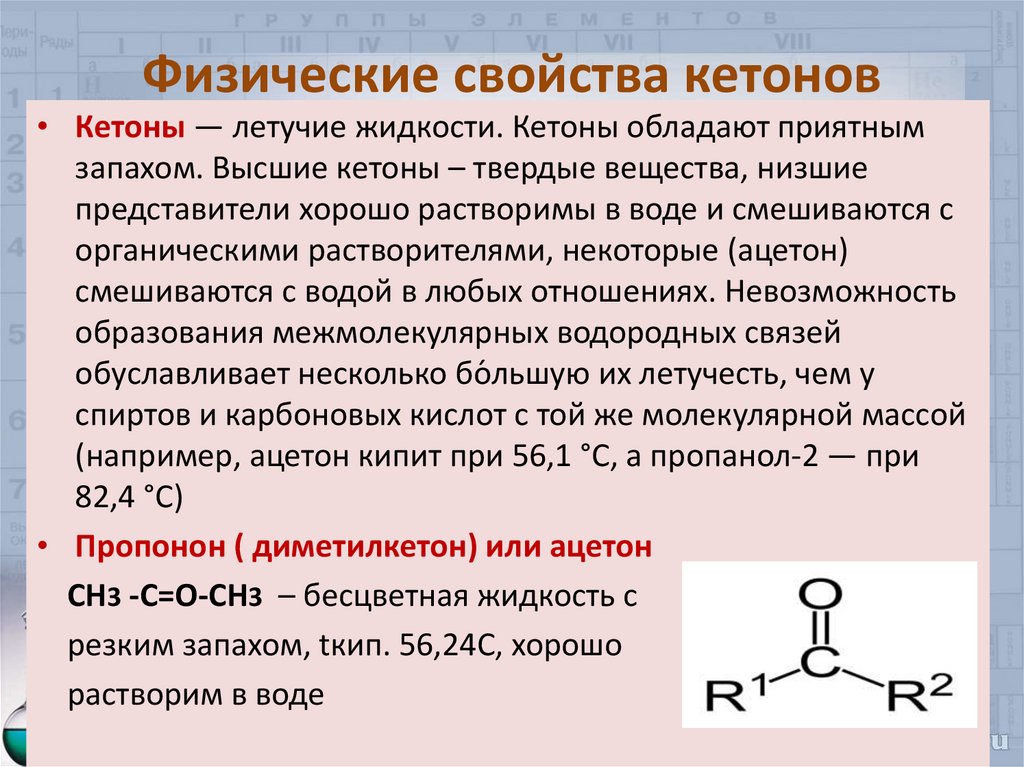
10. Физические свойства кетонов
• Кетоны — летучие жидкости. Кетоны обладают приятнымзапахом. Высшие кетоны – твердые вещества, низшие
представители хорошо растворимы в воде и смешиваются с
органическими растворителями, некоторые (ацетон)
смешиваются с водой в любых отношениях. Невозможность
образования межмолекулярных водородных связей
обуславливает несколько бо́ льшую их летучесть, чем у
спиртов и карбоновых кислот с той же молекулярной массой
(например, ацетон кипит при 56,1 °C, а пропанол-2 — при
82,4 °C)
• Пропонон ( диметилкетон) или ацетон
СН3 -С=О-СН3 – бесцветная жидкость с
резким запахом, tкип. 56,24С, хорошо
растворим в воде
11.
Альдегиды в природеОтличительной чертой многих альдегидов является их запах.
Высшие альдегиды, особенно непредельные и ароматические,
входят в состав эфирных масел и содержатся в цветах, фруктах,
плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
12.
Альдегиды в природеБулочки ванильные,
корицы аромат,
Амаретто, шоколад
Альдегидов вкус таят.
В землянике и кокосе,
И в жасмине, и в малине,
И в духах, и в еде
Альдегидов след везде.
Что за запах, что за
прелесть,
И откуда эта свежесть?!
Это высший альдегид
Аромат вам свой дарит!
13.
Альдегиды в природеВанилин
В
плодах
ванили
содержится ароматический
альдегид, который придает
им характерный запах.
Ванилин применяется в
парфюмерии, кондитерской
промышленности,
для
маскирования
запахов
некоторых продуктов
14.
Альдегиды в природеЦитраль
Запах цитрусовых обусловлен данным
диеновым альдегидом. Его применяют в
качестве отдушки средств бытовой химии,
косметических и парфюмерных веществ
15.
Альдегиды в природеКоричный альдегид
Коричный альдегид содержится в масле корицы,
его получают перегонкой коры дерева корицы .
Применяется в кулинарии в виде палочек или
порошка
16.
Альдегиды в природеБензальдегид
Бензальдегид – жидкость с запахом горького
миндаля.
Встречается в косточках и семечках (абрикос,
персик)
17.
Альдегиды в природеФенилэтаналь
Фенилэтаналь по сравнению с
бензальдегидом лучше соответствует
рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
18.
Кетоны в природеn-Гидроксифенилбутанон-2
Этот кетон обуславливает в основном запах спелых ягод
малины.
Его включают в состав синтетических душистых
композиций
19. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ВОССТАНОВЛЕНИЯО
t,Pt
СН3 С
+ Н2 → СН3
этаналь Н
СН2 ОН
этанол
t,Pt
CH3 – C – CH3 + H2 CH3 – CH – CH3
||
|
O
OH
ацетон
пропанол-2
19
20. ХИМИЧЕСКИЕ СВОЙСТВА
Реакции нуклеофильного присоединениясинильная к-та
гидроксинитрил
ацеталь
21. ХИМИЧЕСКИЕ СВОЙСТВА
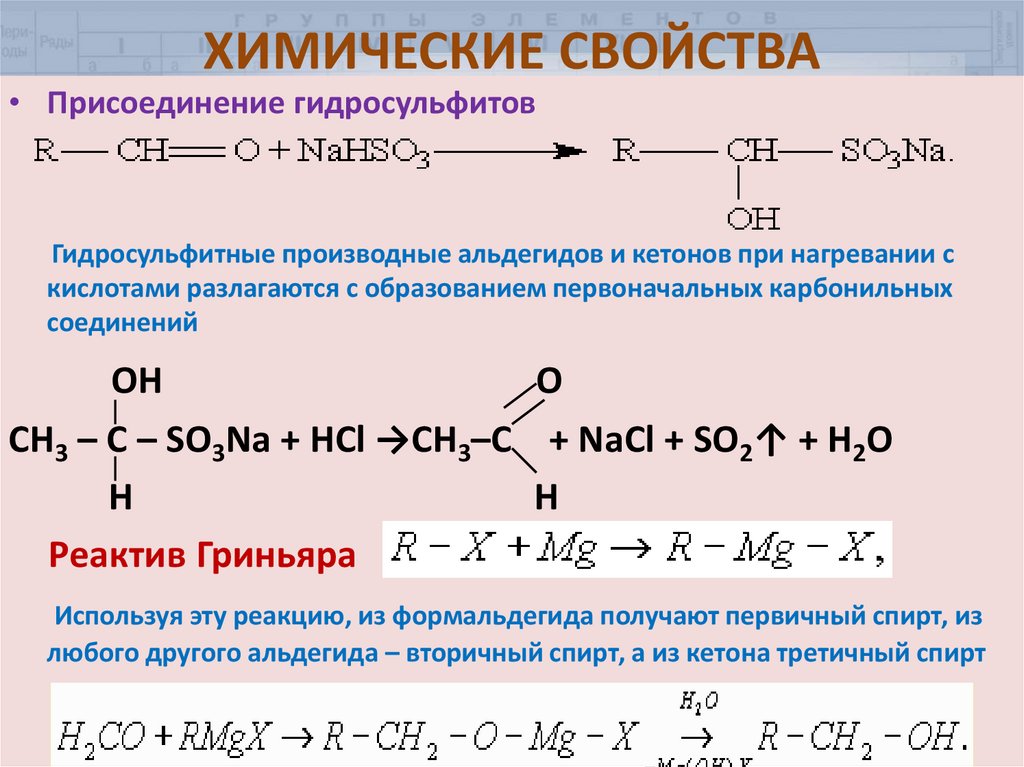
• Присоединение гидросульфитовГидросульфитные производные альдегидов и кетонов при нагревании с
кислотами разлагаются с образованием первоначальных карбонильных
соединений
OH
O
СН3 – С – SO3Na + HCl →CH3–C + NaCl + SO2↑ + H2O
H
H
Реактив Гриньяра
Используя эту реакцию, из формальдегида получают первичный спирт, из
любого другого альдегида – вторичный спирт, а из кетона третичный спирт
22. ХИМИЧЕСКИЕ СВОЙСТВА
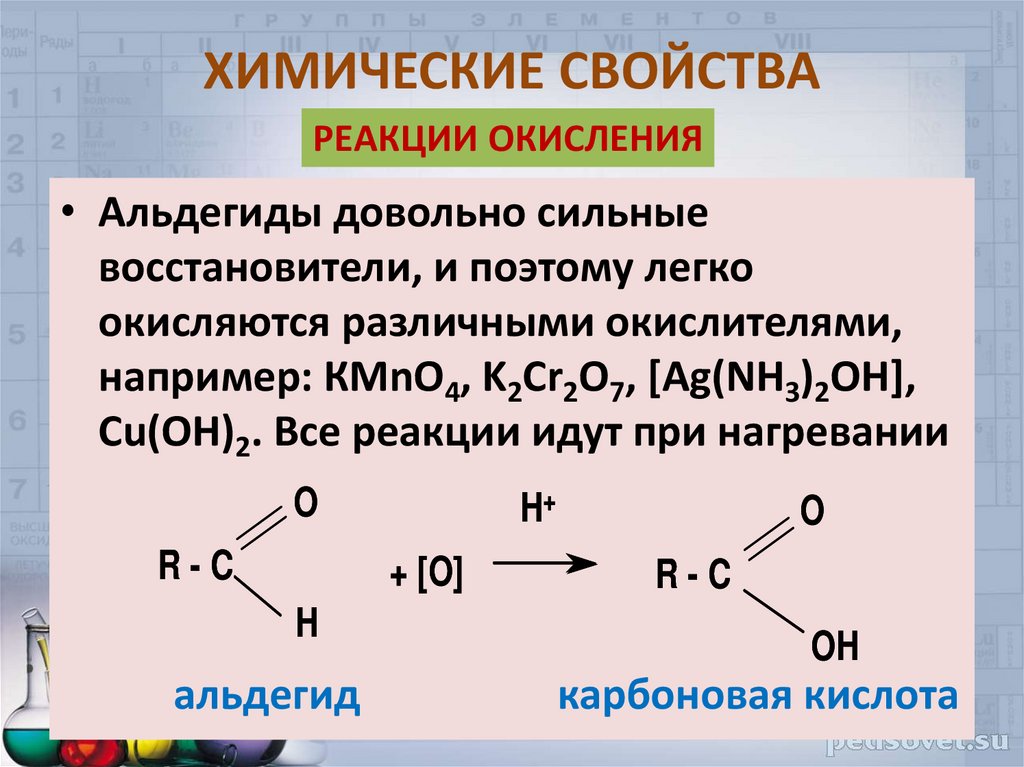
РЕАКЦИИ ОКИСЛЕНИЯ• Альдегиды довольно сильные
восстановители, и поэтому легко
окисляются различными окислителями,
например: КМnO4, K2Cr2O7, [Ag(NH3)2OH],
Cu(OH)2. Все реакции идут при нагревании
O
R-C
H+
+ [O]
H
альдегид
O
R-C
OH
карбоновая кислота
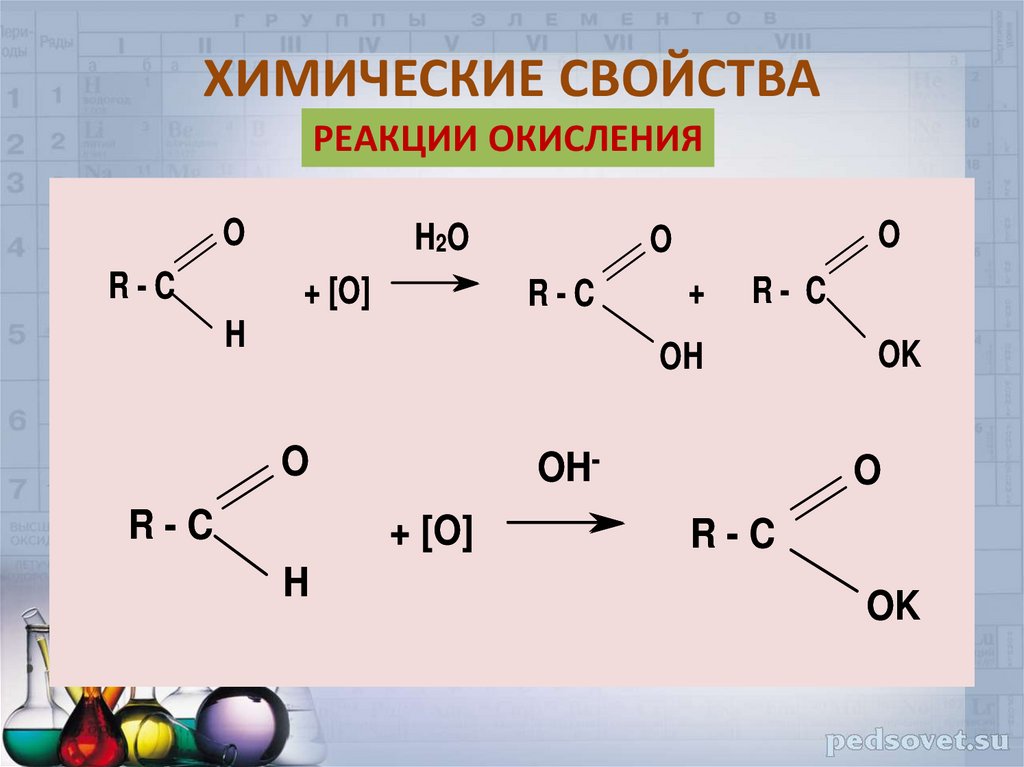
23. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯO
R-C
H2 O
+ [O]
O
O
R-C
H
+
R- C
OH
O
R-C
OH+ [O]
H
OK
O
R-C
OK
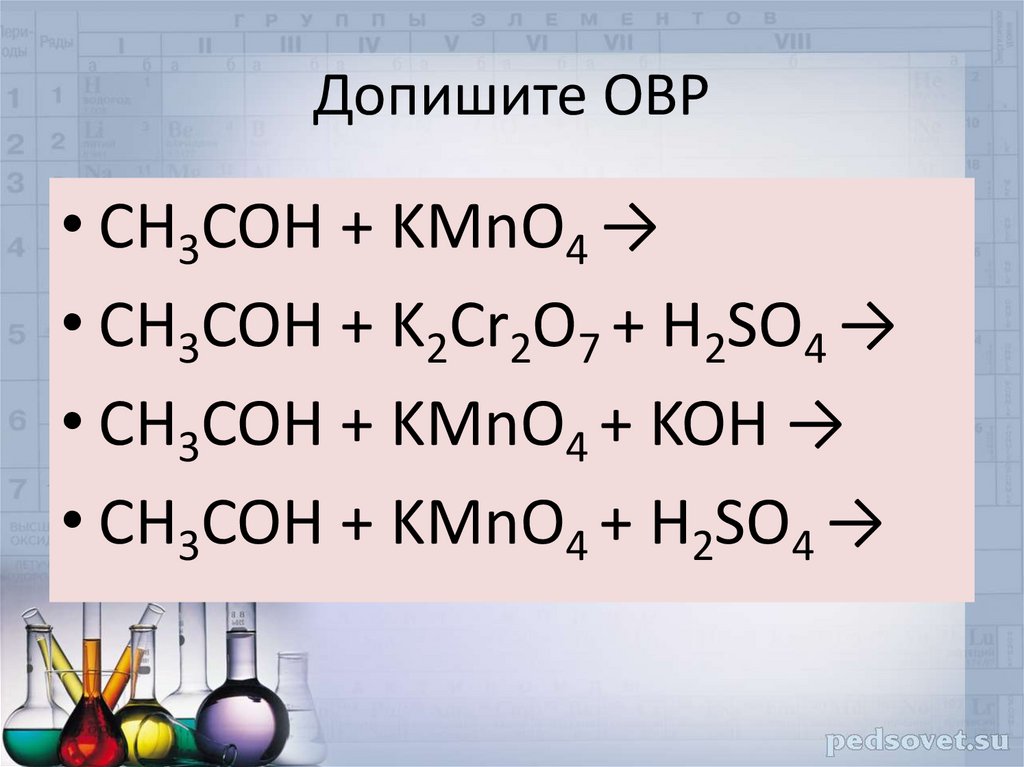
24. Допишите ОВР
• CH3COH + KMnO4 →• CH3COH + K2Cr2O7 + H2SO4 →
• CH3COH + KMnO4 + KOH →
• CH3COH + KMnO4 + H2SO4 →
25.
ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
Муравьиный альдегид окисляется до CO2
или карбонатов:
НСОН + К2Сr2O7 + H2SO4→CO2 + Cr2(SO4)3
+ K2SO4 + H2O
Расставьте коэффициенты!
3НСОН + 2К2Сr2O7 + 8H2SO4→3CO2 +
2Cr2(SO4)3 + 2K2SO4 + 11H2O
26. Допишите ОВР
• HCOH + KMnO4(изб) + H2SO4 →• HCOH + [Ag(NH3)2OH] →
• HCOH + Cu(OH)2 →
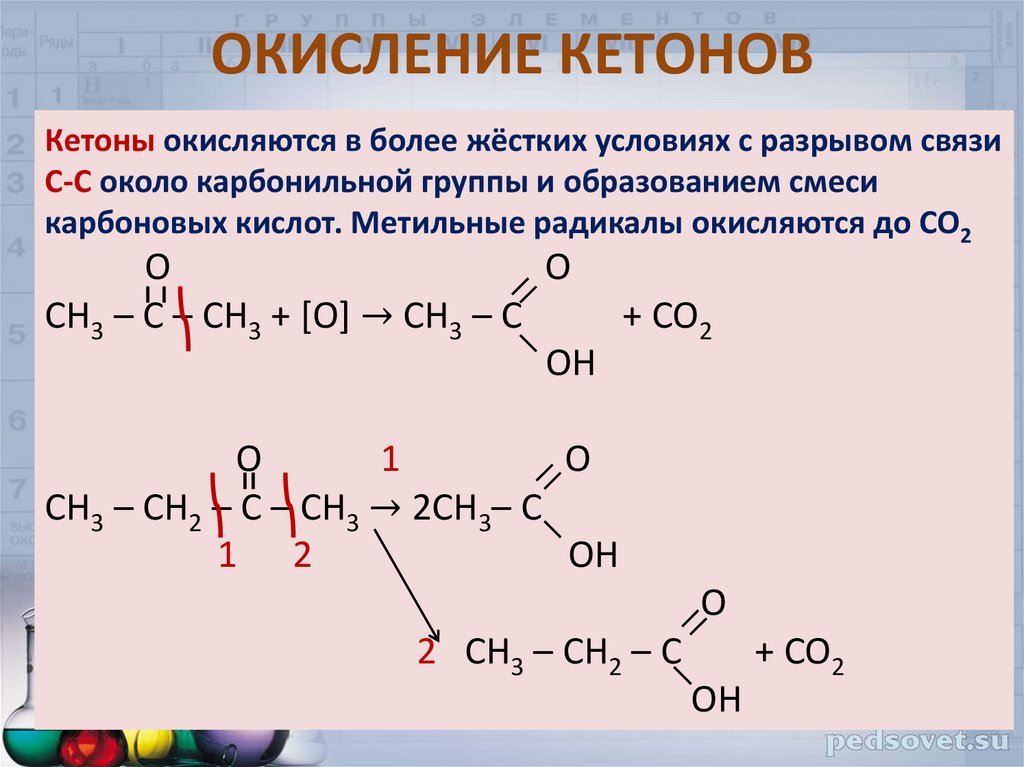
27. ОКИСЛЕНИЕ КЕТОНОВ
Кетоны окисляются в более жёстких условиях с разрывом связиС-С около карбонильной группы и образованием смеси
карбоновых кислот. Метильные радикалы окисляются до СО2
О
O
СН3 – С – СН3 + [O] → CH3 – C
+ CO2
OH
О
1
O
CH3 – CH2 – C – CH3 → 2CH3– C
1 2
OH
O
2 CH3 – CH2 – C
OH
+ CO2
28. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция серебряного зеркалакачественная реакция
О
СН3 С
+ 2[Ag(NH3)2]OH → СН3 С
Н
СН3 С
О
+ 2[Ag(NH3)2]OH → СН3 С
Н
О
+ 2Ag + 4NH3 + 2H2O
OН
О
+ 2Ag + 3NH3 + 2H2O
ONH4
28
29. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция с гидроксидом меди
качественная реакция
О
СН3 С
этаналь
+ 2Cu(OH)2 → СН3 С
Н
этановая кислота
О
+ 2H2O + Cu2O
OН
гидроксид
меди (I)
(кирпично-красный)
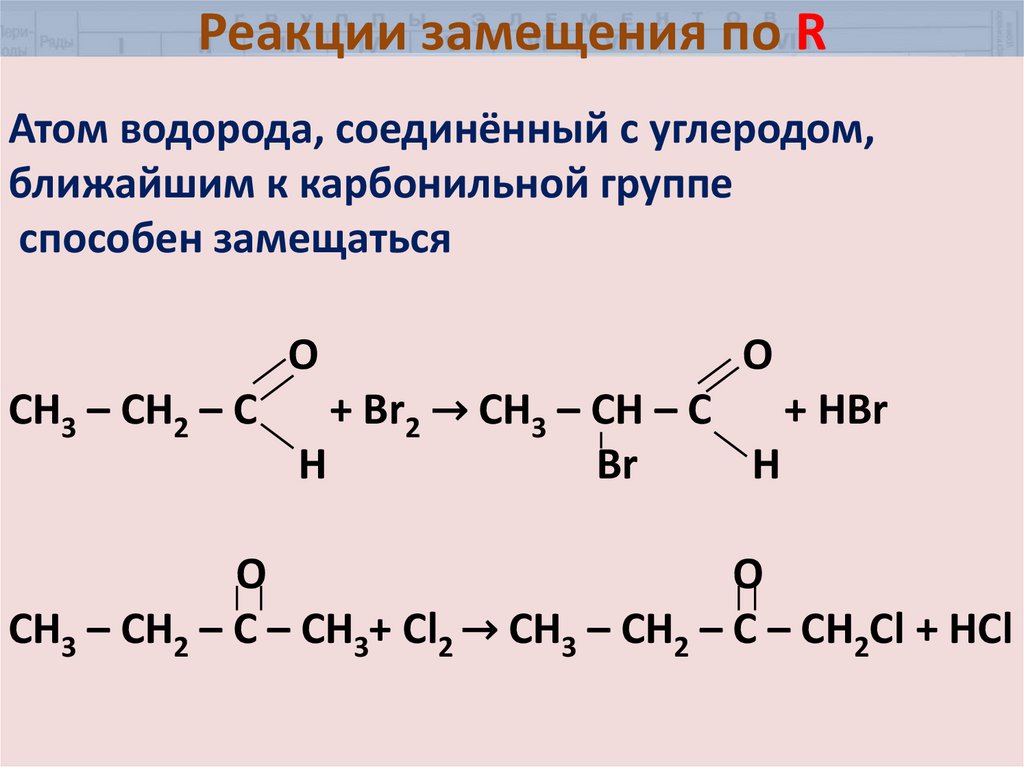
30. Реакции замещения по R
Атом водорода, соединённый с углеродом,ближайшим к карбонильной группе
способен замещаться
О
CH3 – CH2 – C
O
+ Br2 → CH3 – CH – C
+ HBr
Н
Br
H
O
О
CH3 – CH2 – C – CH3+ Cl2 → CH3 – CH2 – C – CH2Cl + HCl
31. Реакции замещения по R
На свету атом брома может замещать любой изатомов водорода
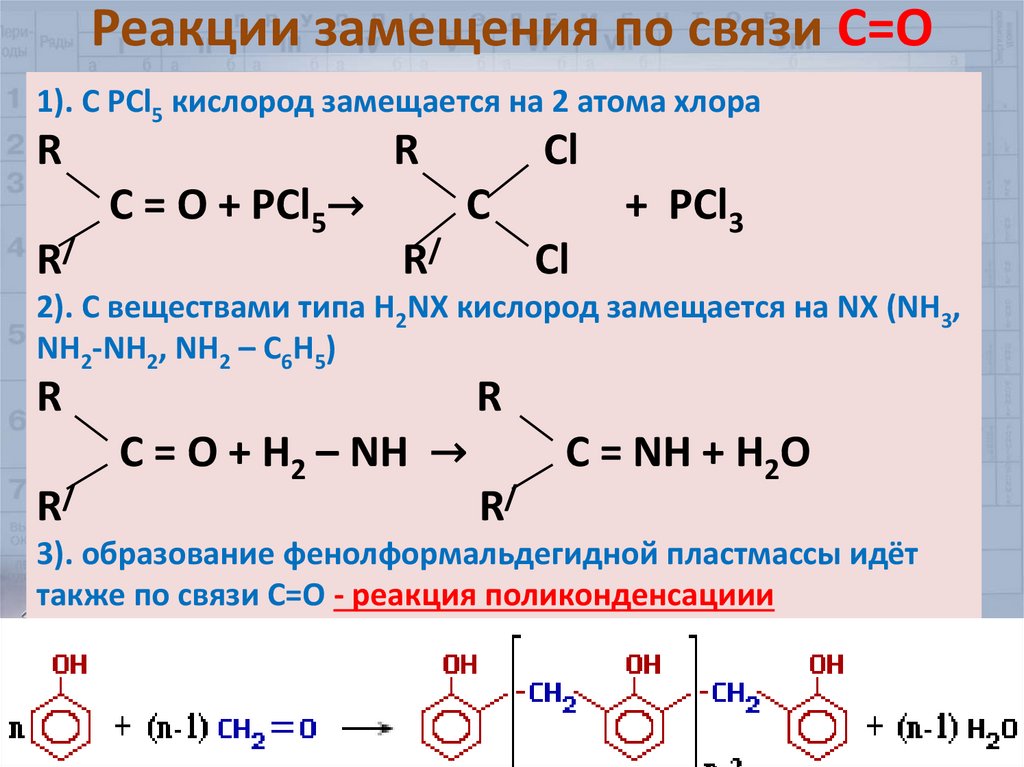
32. Реакции замещения по связи С=О
1). С РСl5 кислород замещается на 2 атома хлораR
R/
R
C = O + РСl5→
Cl
C
R/
Cl
+ РСl3
2). С веществами типа Н2NХ кислород замещается на NX (NH3,
NH2-NH2, NH2 – C6H5)
R
R/
R
C = O + H2 – NH →
R/
C = NH + H2O
3). образование фенолформальдегидной пластмассы идёт
также по связи С=О - реакция поликонденсациии
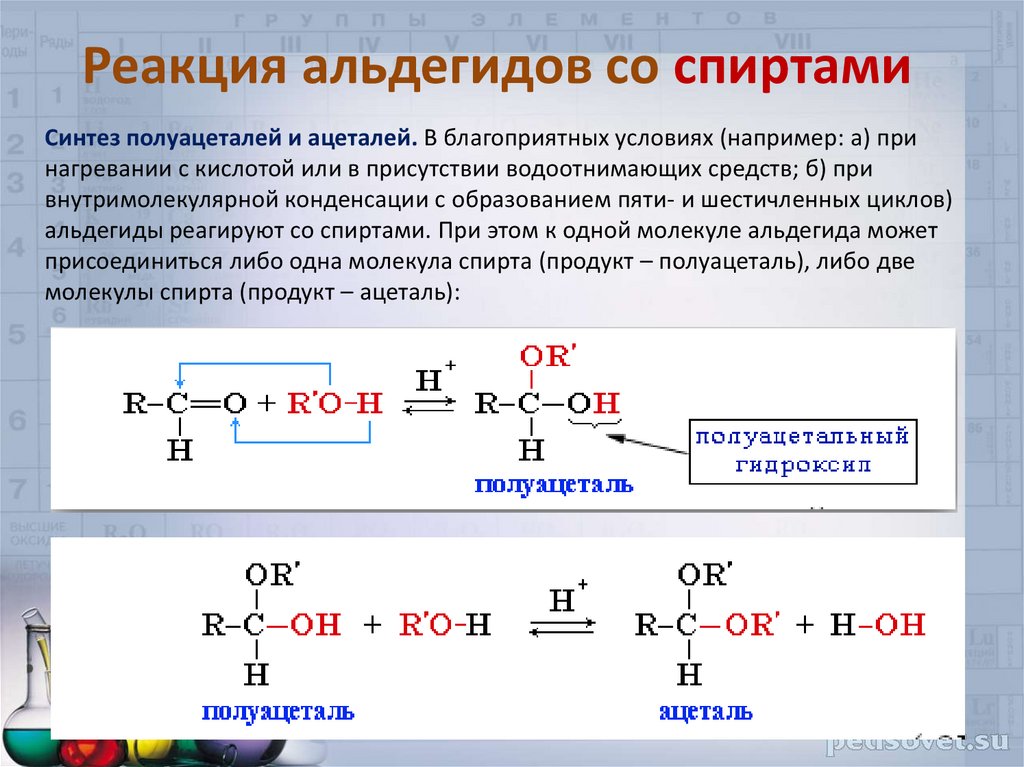
33. Реакция альдегидов со спиртами
Синтез полуацеталей и ацеталей. В благоприятных условиях (например: а) принагревании с кислотой или в присутствии водоотнимающих средств; б) при
внутримолекулярной конденсации с образованием пяти- и шестичленных циклов)
альдегиды реагируют со спиртами. При этом к одной молекуле альдегида может
присоединиться либо одна молекула спирта (продукт – полуацеталь), либо две
молекулы спирта (продукт – ацеталь):
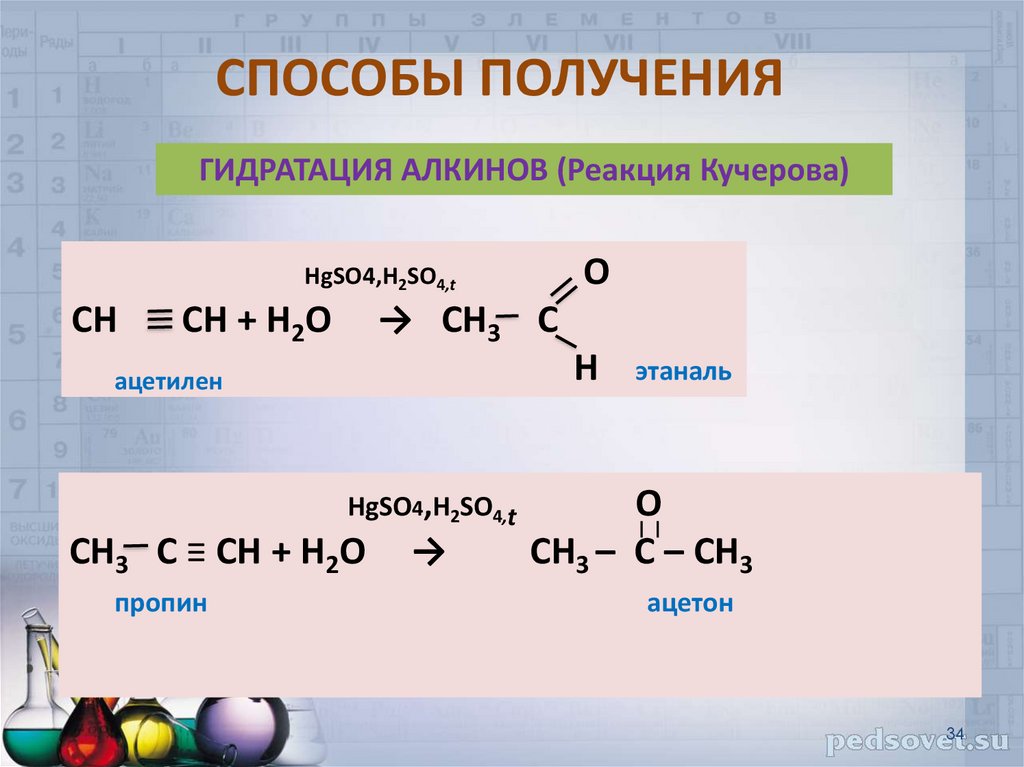
34. СПОСОБЫ ПОЛУЧЕНИЯ
ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)О
HgSO4,H2SO4,t
СН
СН + Н2О
→ СН3 С
Н
ацетилен
HgSO4,H2SO4,t
СН3 С ≡ СН + Н2О
пропин
→
этаналь
O
СН3 – С – СН3
ацетон
34
35. СПОСОБЫ ПОЛУЧЕНИЯ
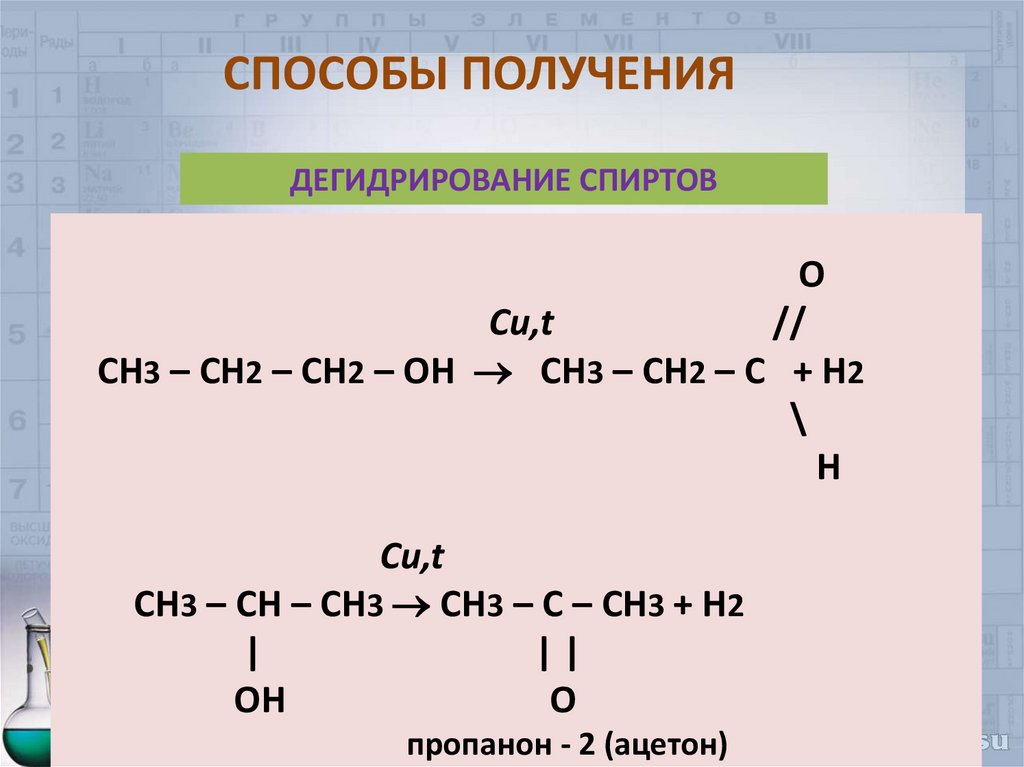
ДЕГИДРИРОВАНИЕ СПИРТОВO
Cu,t
//
CH3 – CH2 – CH2 – OH СH3 – CH2 – C + H2
\
H
Cu,t
СH3 – CH – CH3 CH3 – C – CH3 + H2
|
||
OH
O
пропанон - 2 (ацетон)
35
36. СПОСОБЫ ПОЛУЧЕНИЯ
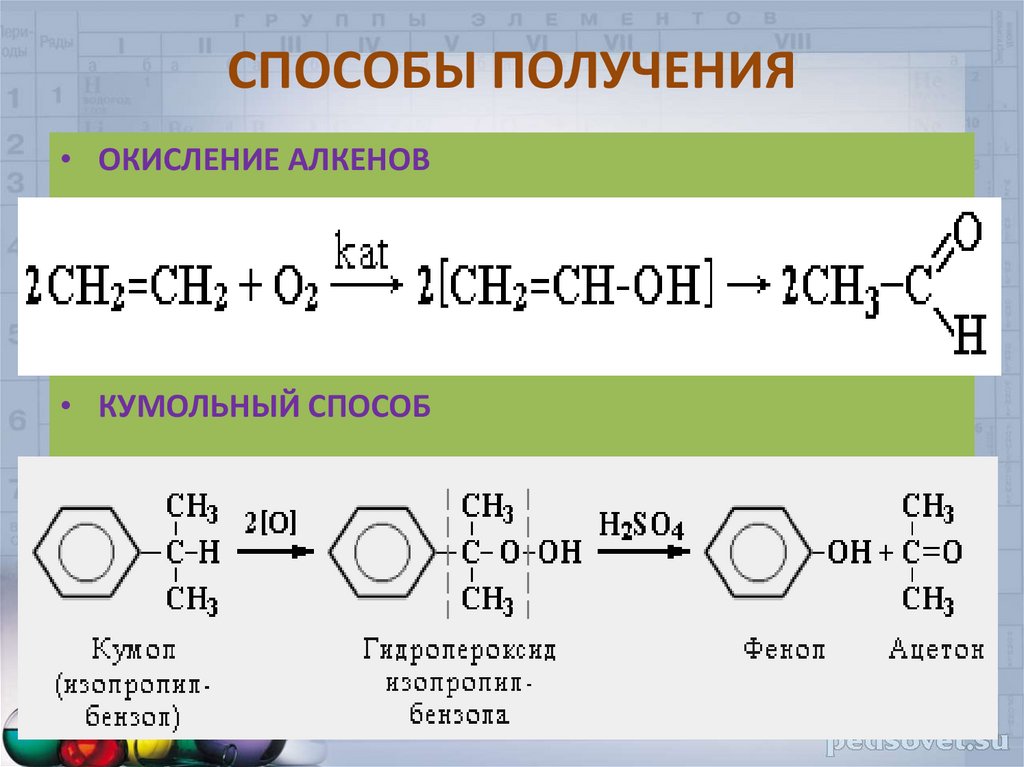
• ОКИСЛЕНИЕ СПИРТОВ37. СПОСОБЫ ПОЛУЧЕНИЯ
• ОКИСЛЕНИЕ АЛКЕНОВ• КУМОЛЬНЫЙ СПОСОБ
38.
ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХO
СН3 - СН - Сl + 2KOH → СН3-С
+ 2KCl + H2O
H
Cl
1,1- дихлорэтан
этаналь
ГИДРОЛИЗ ДИГАЛОГЕНАЛКАНОВ
O
СН3 - СН - Сl + H2O
→ СН3 - С
+ 2HCl
H
Cl
1,1- дихлорэтан
этаналь
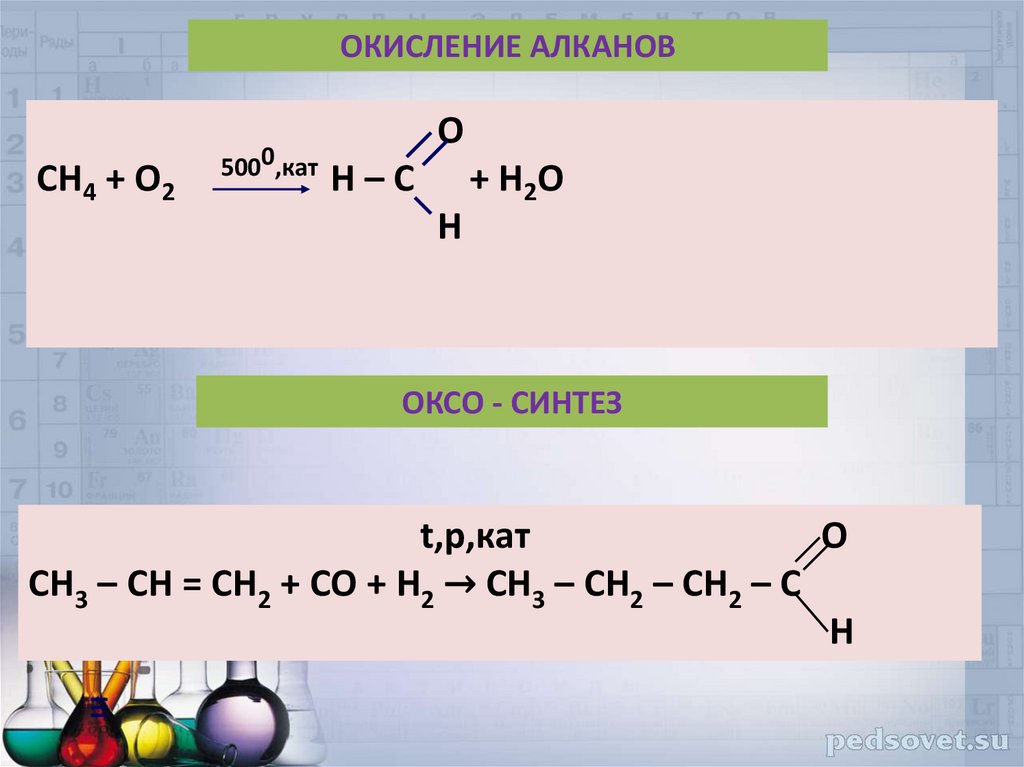
39. ОКИСЛЕНИЕ АЛКАНОВ
CH4 + O25000,кат
O
H–С
+ H2O
H
ОКСО - СИНТЕЗ
t,p,кат
О
CH3 – CH = CH2 + СО + Н2 → CH3 – CH2 – CH2 – С
Н
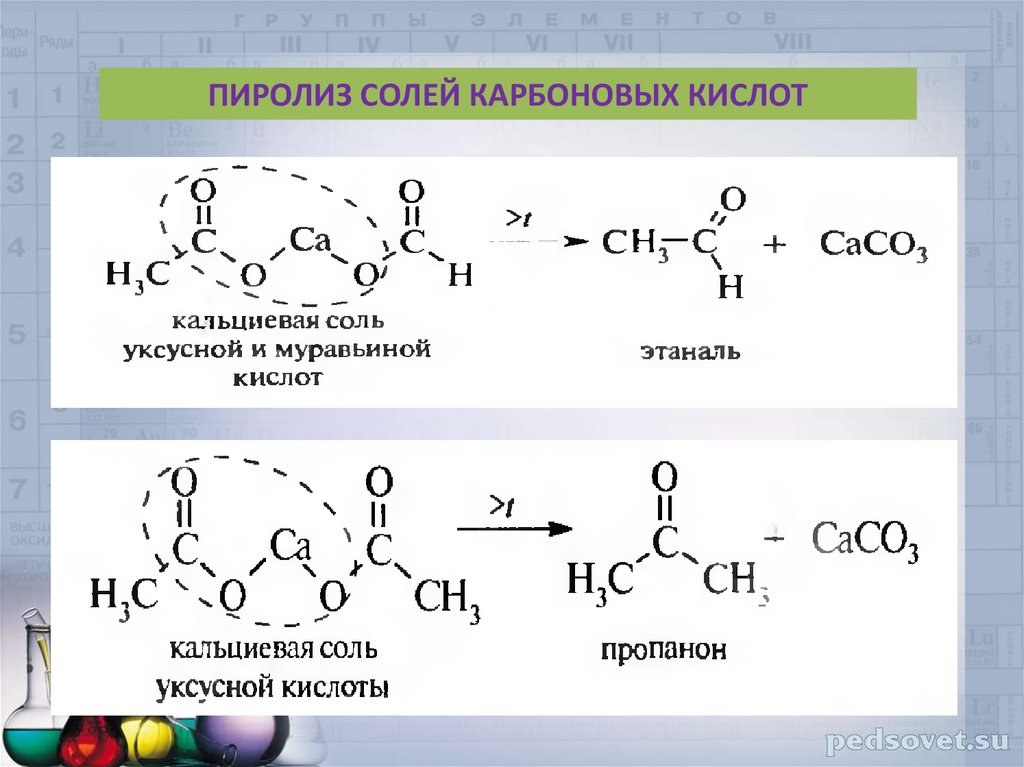
40.
ПИРОЛИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ41. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый,
обепин – жидкость с
приятным запахом мимозы
• Альдегид дециловый,
деканаль – при
разбавлении появляются
нотки запаха апельсиновой
корки
42. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы
43. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПРОИЗВОДСТВО ВЕЩЕСТВУксусная кислота
Этилацетат
Формалин
44.
Контрольные вопросы1. Найдите формулу альдегида:
2. Исключите лишнее вещество в ряду:
3. Какая функциональная группа называется карбонильной?
4. Атом углерода в альдегидной группе находится в состоянии гибридизации:
а) sp
б) sp2
в) sp3
г) не гибридизован
5. Назовите вещества с формулой
а) 2-метилбутанон-3,
в) 3-метилбутаналь,
б) 3-метилбутанон-2,
г) 1,2-диметилпентаналь
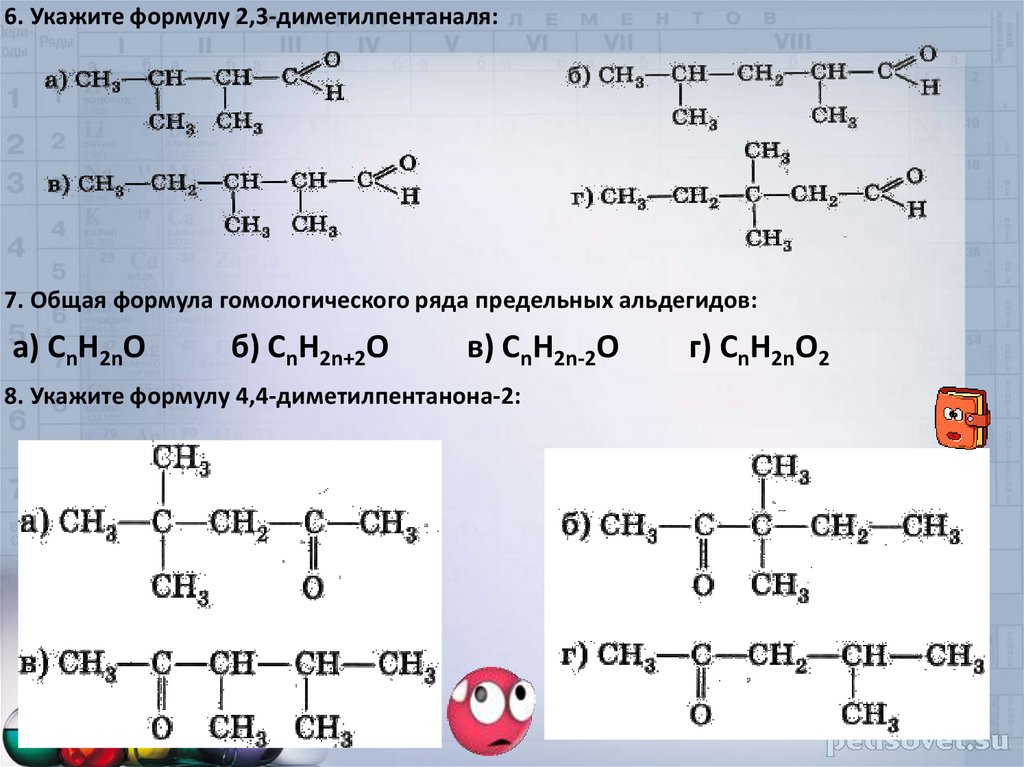
45.
6. Укажите формулу 2,3-диметилпентаналя:7. Общая формула гомологического ряда предельных альдегидов:
а) CnH2nO
б) CnH2n+2O
в) CnH2n-2O
8. Укажите формулу 4,4-диметилпентанона-2:
г) CnH2nO2
46.
9. Гидратацией какого алкина можно получить альдегид?Напишите уравнение реакции, укажите условия её проведения.
а) этина
в) бутина
б) пропина
г) изобутина
10. Нагреваем соли ацетата кальция можно получить:
а) метаналь б) этаналь в) пропаналь г) пропанон
11. Какие признаки верно отражают физические свойства
метаналя: 1) бесцветная жидкость, 2) газообразное вещество, 3)
имеется характерный запах, 4) плохо растворим в воде, 5)
молекула полярная.
а) 1, 3, 4
б) 2, 3, 5
в) 3, 4, 5
г) 2, 4, 5
12. Какая из реакций носит имя М. Г. Кучерова.
а) гидратация ацетилена
б) тримеризация ацетилена
в) гидрирование ацетилена
г) бромирование ацетилена
47.
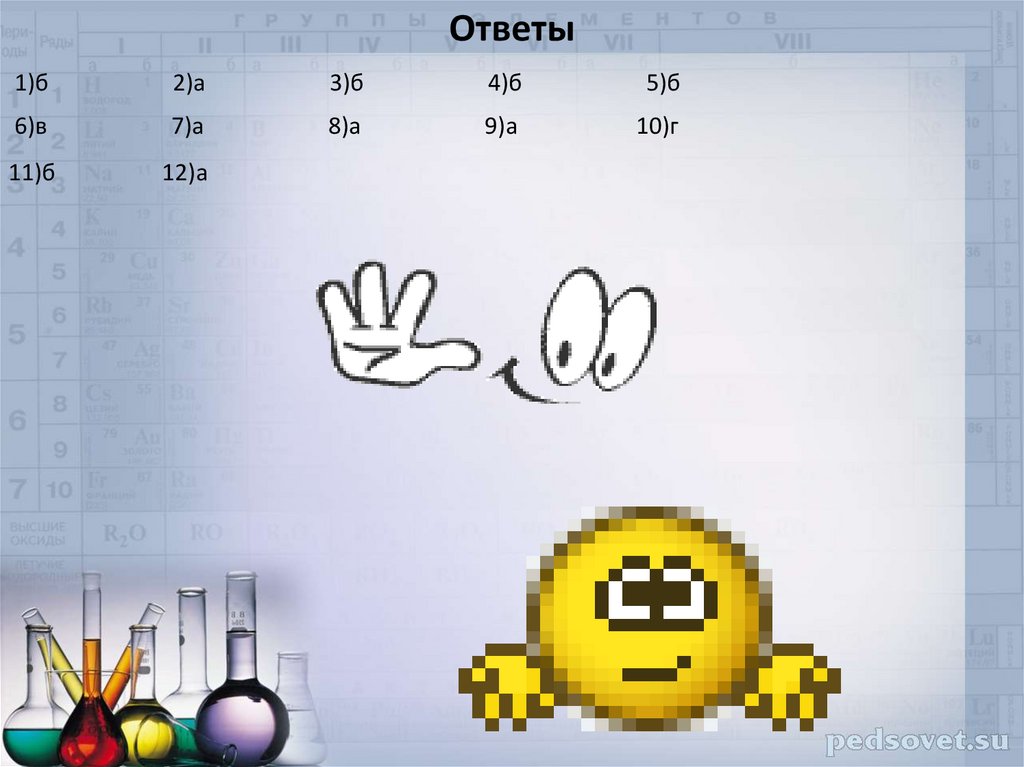
Ответы1)б
2)а
3)б
4)б
5)б
6)в
7)а
8)а
9)а
10)г
11)б
12)а
48.
СПАСИБО ЗАВНИМАНИЕ!


























 Химия
Химия








