Похожие презентации:
Положение галогенов в периодической таблице и строение их атомов
1.
Положение галогеновв периодической таблице
и строение их атомов
At
F
Cl
Br
I
2.
Положение галогенов в ПСХЭГруппы элементов
Пери –
оды
I
1
Н
2
Li
3
Na
6.939
3
Литий
11 Мg
22,9898
Калий
29
85,47
196,967
ЛВС
Бор
87,62
Алюминий
Скандий
Галлий
38 39
VI
VII
Иттрий
Индий
56 57
137.34
Барий
*
138,81
Галогены
9
204,37
[223]
Ртуть
Радий
R2О
RO
Кислород
F
Фтор
17 Cl
Сера
32,064
Хром
33 Se
74,9216
Мышьяк
41
92,906
Хлор
18,9984
Селен
34 Br
78,96
Бром
Молибден
51 Тe
121,75
Сурьма
52 I
Теллур
Железо
27
58,9332
Гафний
81 Pb
Таллий
Тантал
Кобальт
82 Вi
207,19
Свинец
83 Ро
208,980
Висмут
Полоний
44
101,07
Рутений
[262]
Родий
Иридий
[262]
[265]
[266]
Сиборгий
Борий
Хассий
Мейтнерий
R2O7
RH4
RH3
RH2
RH
78
195,09
Рt
Платина
Радон
107 Bh 108 Hs 109 Мt
RO3
54
131,30
Rn
Астат
R2O5
Палладий
Ксенон
85
RO2
36
83,80
Xe
Осмий
210
Никель
Ru 45
Rh 46
Pd
102,905
106,4
[263]
105 Db 106 Sg
Актиний Резерфордий Дубний
R2O3
84 At
[210]
18
39,948
Криптон
126,9044
Рений
10
20,183
Кr
35
Йод
Вольфрам
Nе
4.0026
Ni
Со 28
58,71
53
78,96
Гелий
Аргон
79,904
Технеций
2
Ar
17
Марганец
Не
Неон
35,453
Nb 42
Мо 43
Тс
[99]
95,94
Ниобий
50 Sb
118,69
** Ас 104 Rf
87 Rа[226] 88 89
138,81
[261]
Франций
8
15,9994
La 72
Hf 73
W 75
Re 76
Ir
Та 74
Оs 77
178.49
180,948
183.85
186,2
190,2
192,2
Лантан
Hg ТI
Аu 80
200,59
Фосфор
32 As
72,59
Цирконий
Олово
О
15 S
30,9738
Ванадий
Германий
49 Sn
Азот
7
14,0067
VIII
Ti 23
V 24
Cr 25
Fe
Мn 26
50,942
51,996
44,956
55,847
Y 40
Zr
91,22
88,905
N
14 P
28,086
Кремний
31 Ge
114,82
55 Ва
Углерод
Титан
26,9815
Ag 48
Сd In
112,40
132,905
6
12,01115
Sc 22
47,90
44,956
Кадмий
С
13 Si
26,9815
20 21
Стронций
Золото
Fr
40,08
Кальций
37 Sr
Цезий
79
5
10,811
12 Al
24,312
Цинк
Серебро
Cs
В
Zn Ga
Сu 30
65,37
Рубидий
47
4
9,0122
Магний
19 Сa
39,102
107,868
Высшие
оксиды
Ве
Бериллий
Натрий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
RO4
86
[222]
3.
Строение атома4.
Строение атома5.
История открытия галогеновAt
F2
Cl2
I2
Br2
6.
История открытия фтораВ 1886 году французский химик А. Муассан,
используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C (в жидкости
должно содержаться немного фторида калия,
который обеспечивает ее электропроводимость),
смог на аноде получить первую порцию нового,
газа. В первых опытах для получения фтора А.
Муассан использовал очень дорогой электролизер,
изготовленный из платины и иридия. При этом
каждый грамм полученного фтора «съедал» до 6 г
платины.
2HF→H2↑ + F2↑
Анри Муассан
(1852 – 1907 г.)
7.
История открытия хлораВ 1774 году шведский аптекарь К. Шееле
открыл хлор. «Я поместил смесь черной
магнезии с муриевой кислотой в реторту, к
горлышку
которой
присоединил
пузырь,
лишенный воздуха, и поставил ее на песчаную
баню. Пузырь наполнился газом, который имел
желто-зеленый цвет и пронзительный запах».
В 1807 году английский химик Гемфри Дэви
получил тот же газ. Он пришел к выводу, что
получил новый элемент и назвал его "хлорин" (от
"хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название
хлор.
Карл
Вильгельм
Шееле
(1742 – 1786 г.)
MnO2+ 4HCl Cl2+ MnCl2 + 2H2O
8.
История открытия бромаВ 1825 году французский химик А.Ж.Балар при
изучении маточных рассолов выделил темнобурую жидкость, который он назвал - "мурид" (от
латинского слова muria, означающего "рассол").
Комиссия Академии, проверив это сообщение,
подтвердила открытие Балара и предложила
назвать элемент бромом (от "бромос", с
греческого "зловонный"). Балар писал: «Точь-вточь как ртуть есть единственный металл,
который имеет жидкую фазу при комнатной
температуре, бром есть единственный жидкий
неметалл» .
2NaBr + Cl2 → 2NaCl + Br2
Антуан Жером
Балар
(1802 – 1876 г.)
9.
История открытия йодаВ 1811 году французский химик Бернар
Куртуа открыл йод
путём перегонки
маточных растворов от азотнокислого
кальция с серной кислотой Чтобы другие
химики могли изучать новое вещество, Б.
Куртуа подарил его (фармацевтической
фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название "иод"
происходит от греческого слова "иодэс" "фиолетовый" (по цвету паров).
Бернар Куртуа
(1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
10.
История открытия астатаВ 1869 г Д.И.Мендеелеев предсказал
его существование и возможность
открытия в будущем (как «эка-иод»).
Впервые
астат
был
получен
искусственно в 1940 г. открыт
Д.Корсоном, К.Маккензи и Э.Сегре
(Калифорнийский
университет
в
Беркли). Для синтеза изотопа 211At они
облучали висмут альфа-частицами.
Астат является наиболее редким
элементом среди всех, обнаруженных в
природе. В поверхностном слое земной
коры толщиной 1,6 км содержится
всего 70 мг астата.
209
4
211 At + 2 1 n
83Bi + 2He →
85
0
Эрст Сегре
(1914 – 1985 г.)
11.
Галогены12.
Сравнение физических свойствF2
светло-желтый газ
Cl2
желто-зеленый газ
Br2
I2
красно-бурая
жидкость (возгоняется)
фиолетовые кристаллы
с металлическим блеском
At2 черно-синие кристаллы
• Интенсивность
цвета усиливается
• Плотность
увеличивается
• Температуры
плавления и
кипения
увеличиваются
13.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
NaСl (галит)
Цвет
Бесцветный,
красный, желтый,
синий, голубой
Плотность
2,2—2,3 г/см3
Твердость
2,5
14.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
AgBr
(бромаргирит)примеси к другим
минералам
Цвет
Бесцветный,
розовый, желтый
Плотность
5,1—6,3г/см3
Твердость
1,9
15.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
CaF2 (флюорит)
Цвет
Бесцветный,
желтый,
голубой,
фиолетовый
Плотность
3,4—4,9 г/см3
Твердость
3,3
16.
Нахождение галогенов в природеФотография
Характеристика минерала
Химический
состав
3Ca(PO4 ) 2*CaF2
(апатит)
Цвет
Бесцветный,
фиолетовый
Плотность
3,9—5,6 г/см3
Твердость
3,7
17.
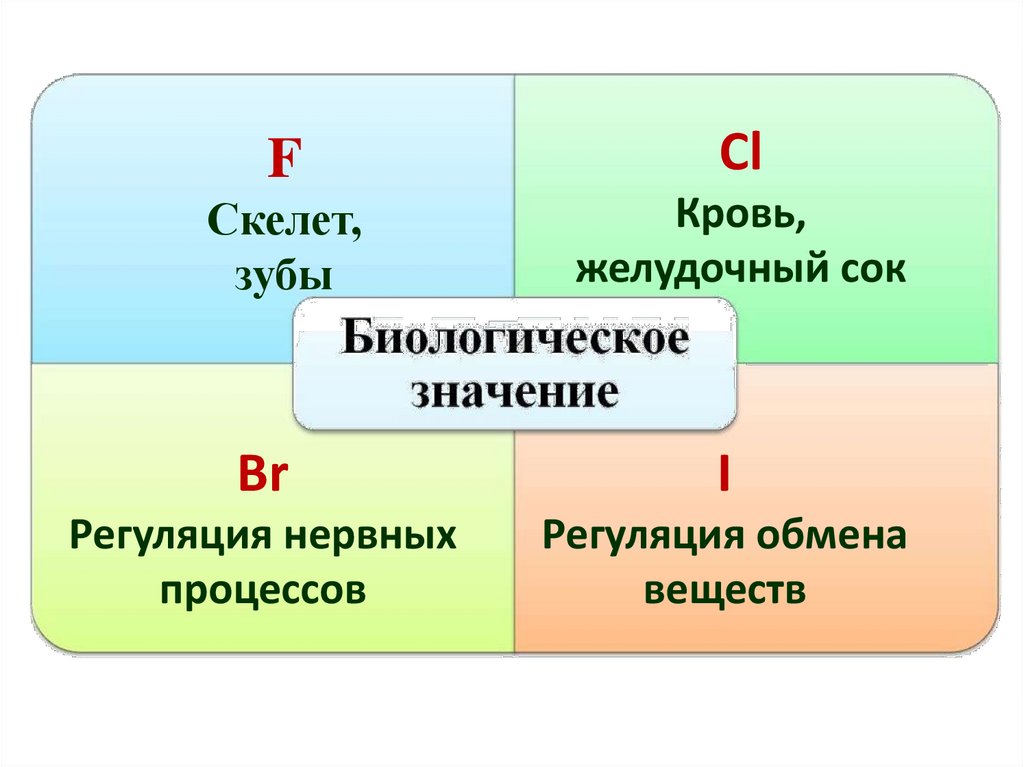
Галогены в живых организмах18.
FСl
Скелет,
зубы
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
19.
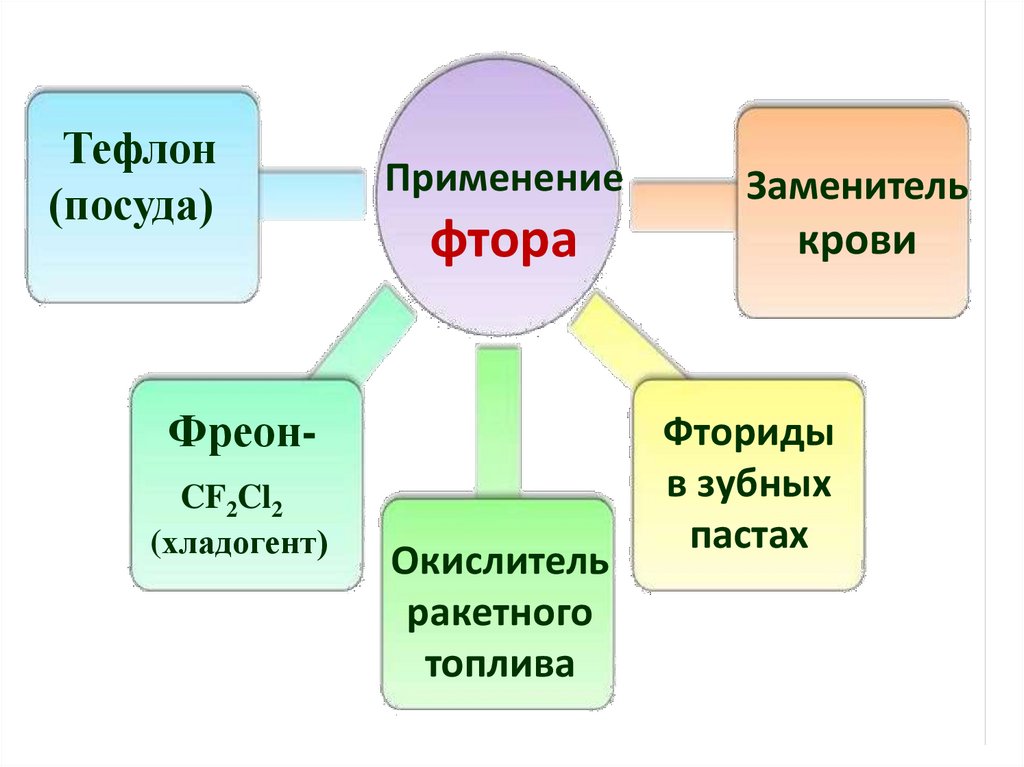
Тефлон(посуда)
Применение
Заменитель
фтора
крови
ФреонCF2Cl2
(хладогент)
Окислитель
ракетного
топлива
Фториды
в зубных
пастах
20.
Органическиерастворители
Отбеливатели
Лекарственные Применение
препараты
хлора
Хлорирование
органических
веществ
Дезинфекция
воды
Производство
HCl
Получение
неорганических
хлоридов
Получение
брома, йода
21.
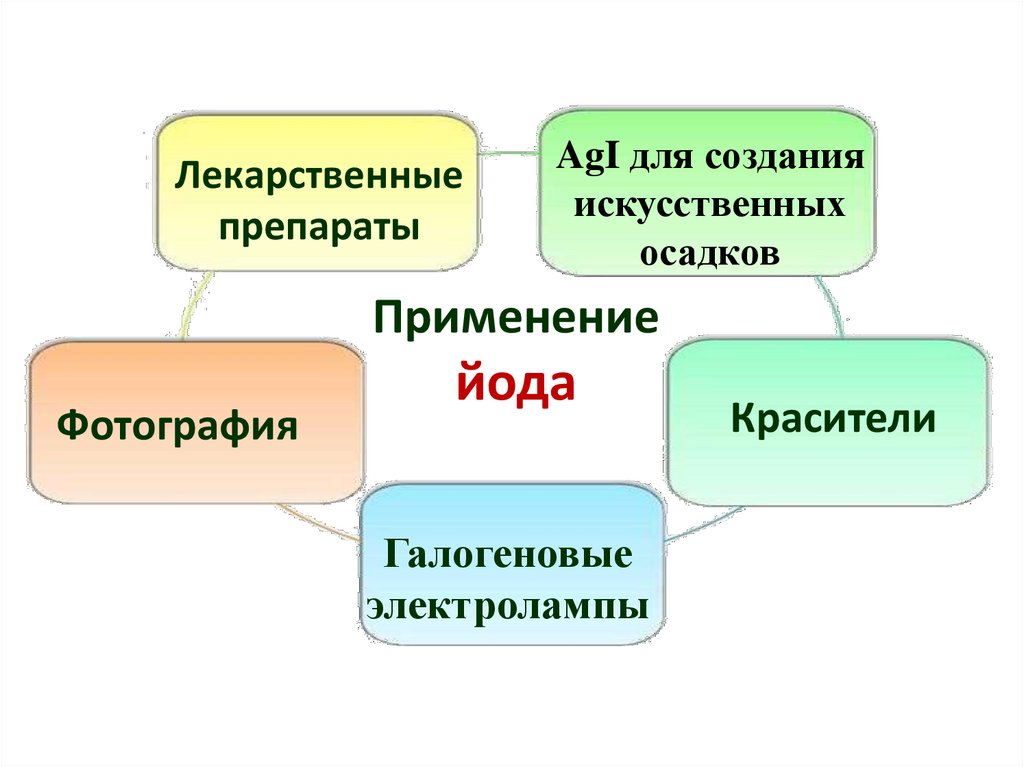
Лекарственныепрепараты
AgI для создания
искусственных
осадков
Применение
Фотография
йода
Галогеновые
электролампы
Красители
22.
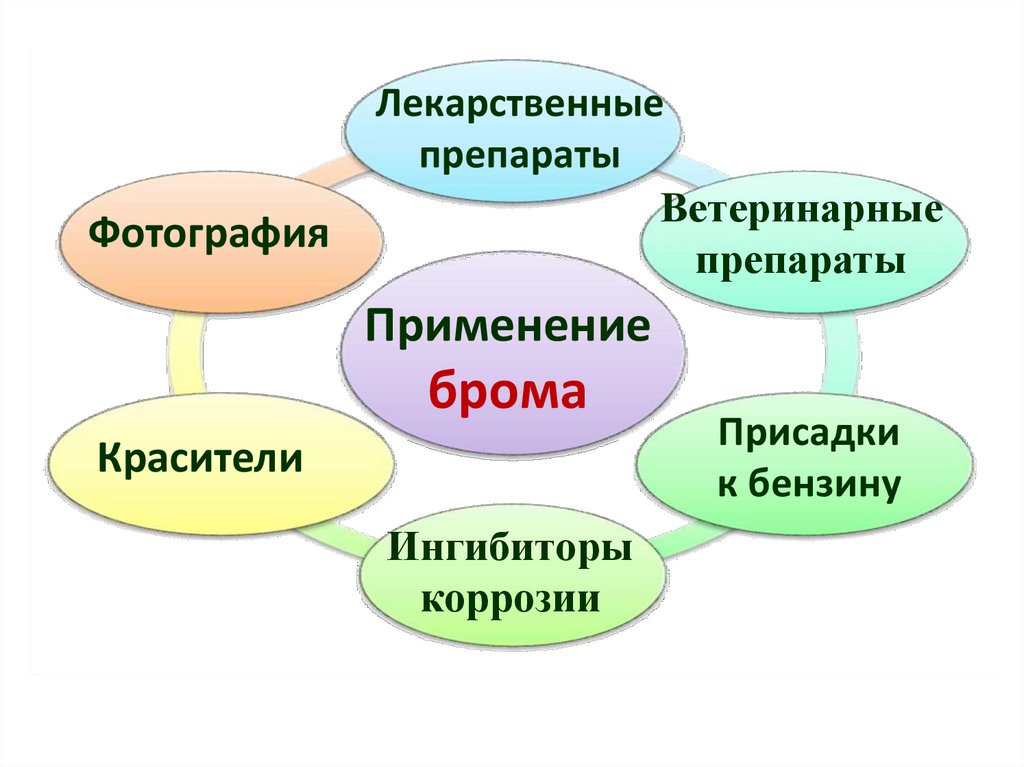
ФотографияЛекарственные
препараты
Ветеринарные
препараты
Применение
брома
Красители
Ингибиторы
коррозии
Присадки
к бензину
23.
Домашнее задание• Записать строение атома фтора и йода
• Выучить конспект
24.
Спасибоза работу !




















 Химия
Химия








