Похожие презентации:
Положение галогенов в Периодической системе Д.И. Менделеева
1.
2.
Цели:Охарактеризовать положение галогенов
в Периодической системе
Д.И.Менделеева.
Охарактеризовать особенности строения
атомов галогенов.
Охарактеризовать физические свойства.
Охарактеризовать химические свойства
галогенов.
Обобщить знания учащихся об
областях применения галогенов.
3.
4.
FФтор
Cl
Хлор
Br
Бром
I
Иод
At
Астат
ГАЛОГЕНЫ
(от греческого
halos - соль
genes-рождающий,
рождённый)
VII группа,
Главная подгруппа
5.
19Cl
35,5
35,5
Br
80
80
I
I
127
127
At
At
[210]
[210]
2s22p5
))
)))
))))
)))))
))))))
3s23p5
4s24p5
5s25p5
6s26p5
Уменьшаются
F
Уменьшаются
Ar
Увеличивается
Элемент
Число
Число
Число
НеМетал
Окисл.
НеМетал Окисл.
валентных
электронных RRатома
атома валентных
свойства свойства
свойства
электронов
электронов свойства
слоев
6.
Cl + ClCl
Cl Cl
Cl
Молекула двухатомная.
Тип связи – ковалентная неполярная.
Кристаллическая решетка – молекулярная.
Какие физические свойства можно предположить?
7.
8.
9.
10.
11.
12.
ГалогенF2
Cl2
Агрег.
сост.
Газ
Газ
Цвет
Запах
T
плавл.
°C
T
кип.
°C
Бледножелтый
Резкий
раздражающий запах
-219,7 -188,2
Желтозеленый
резкий
неприятный
запах
−100
Резкий
удушающий,
−7,2
пары
токсичны
−34
Br2
Жид- Краснокость бурый
I2
ТемноСпецифическ
Твер+113,5 +184,3
фиолето- ий резкий
дое
вый
запах
58,8
13.
At2Этот элемент был вторым (после технеция)
синтезированным искусственно элементом.
Все изотопы
неустойчивые.
короткоживущие, очень
Период полураспада самого стабильного
изотопа около 8 часов.
Свойства
остаются малоизученными.
14.
F215.
Cl216.
Cl217.
Br2Бром и иод добывают из
природных вод.
Источник иода – морские
водоросли –
ламинарии.
I2
18.
1. Взаимодействие с металлами.2. Взаимодействие с водородом.
3. Взаимодействие с водой.
4. Взаимодействие со сложными веществами.
19.
1. Взаимодействие с металлами.При взаимодействии галогенов с металлами
образуются соли – галогениды.
Zn + F2 = ZnF2
фторид цинка
Fe + 3Cl
Cl2 2==FeCl
железа
2Fe
2FeCl
хлорид
железа
3 3 хлорид
Al +
+ 3Br
Br2 2==AlBr
алюминия
2Al
2AlBr
3 бромид
3 бромид алюминия
Al +
+ 3I
I2 2==AlI
алюминия
2Al
2AlI
йодид
алюминия
3 3 йодид
20.
2.Взаимодействие c водородом.При взаимодействии галогенов с водородом
образуются галогеноводороды (при растворении в
воде галогеноводороды образуют кислоты)
H2 + F2 = 2HF фтороводород (со взрывом)
фтороводород (со взрывом)
H2 + F2 = HF
хлороводород
хлороводород (со
(совзрывом
взрывомпри
при
HH22++ClCl22== 2HCl
HCl ярком солнечном
ярком солнечном освещении)
освещении)
H2 + Br2 = HBr бромоводород (при нагревании)
H2 + Br2 =2HBr иодоводород (при нагревании,
бромоводород (при нагревании)
H2 + I2 = HI
медленно)
H2 + I2 = 2HI
иодоводород (при нагревании,
медленно)
21.
3. Взаимодействие с водой.Cl2, Br2, I2 взаимодействуют по схеме:
Гal2 + H2O = HГalО + НГal
Cl2 + H2O = HClO + HCl
(хлороводородная кислота)
(хлорноватистая кислота)
Вода горит во фторе:
F22++H2H
= HF
+ O+2 O2
2F
= 4HF
2O2O
22.
4. Взаимодействие со сложными веществами.Более активный галоген вытесняет менее активный из
растворов солей.
F2 > Cl2 > Br2 > I2
активность уменьшается
КBr ++ClCl22==KCl
+ Br
2КBr
2KCl
+ Br
2 2
Почему для этой реакции не используют фтор?
23.
F2Фреоны
(как хладогент)
Зубная паста
Тефлон и
другие
фторопласты
Окислитель
ракетного
топлива
Тефлон называют «органической платиной». Перед ним
бессильны расплавленные щелочи, высокие температуры,
сильные кислоты, даже «Царская водка»
24.
Cl2На санитарные
нужды и
хлорирование
воды
Отбеливание
бумаги и х/б
тканей
10%
6%
14%
70%
Производство
соляной кислоты
и хлоридов
Производство
медикаментов,
красок и
пластмасс
25.
Br2Лекарственные
вещества
В фотографии
Ингибиторы
воспламенения
26.
I2Лекарственные
препараты
Цветная
фотография
Глубокая
очистка
металлов
Галогеновые
лампы
27.
F2Фтор находится в организме во всех
органах и тканях.
Но наибольшее его количество содержится в
зубах, костях, волосах и ногтях.
Кости – своеобразное «депо» фтора.
Недостаток фтора –
один из факторов,
вызывающих
болезнь зубов –
кариес.
28.
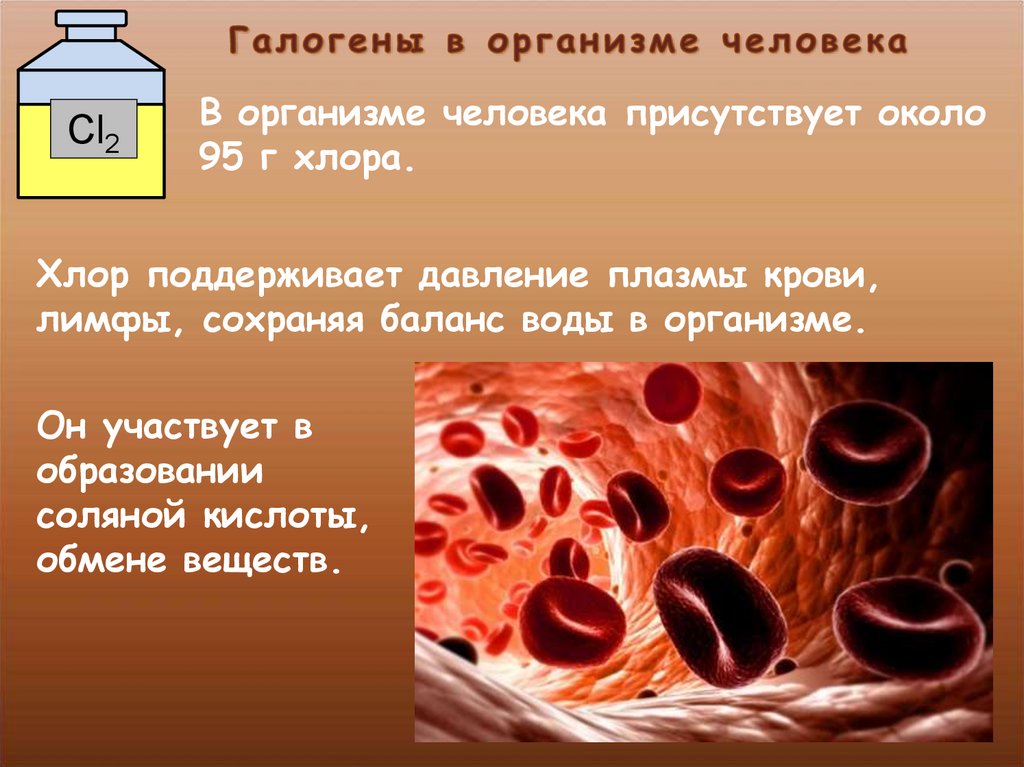
Cl2В организме человека присутствует около
95 г хлора.
Хлор поддерживает давление плазмы крови,
лимфы, сохраняя баланс воды в организме.
Он участвует в
образовании
соляной кислоты,
обмене веществ.
29.
Br2Содержание брома в организме человека
(масса тела 70 кг) составляет 260 мг.
Бром находится в крови, мозге, печени, почках.
Больше всего его в мозге человека.
Препараты брома
применяют при
заболеваниях нервной
системы: истерии,
неврастении и других
неврозах.
30.
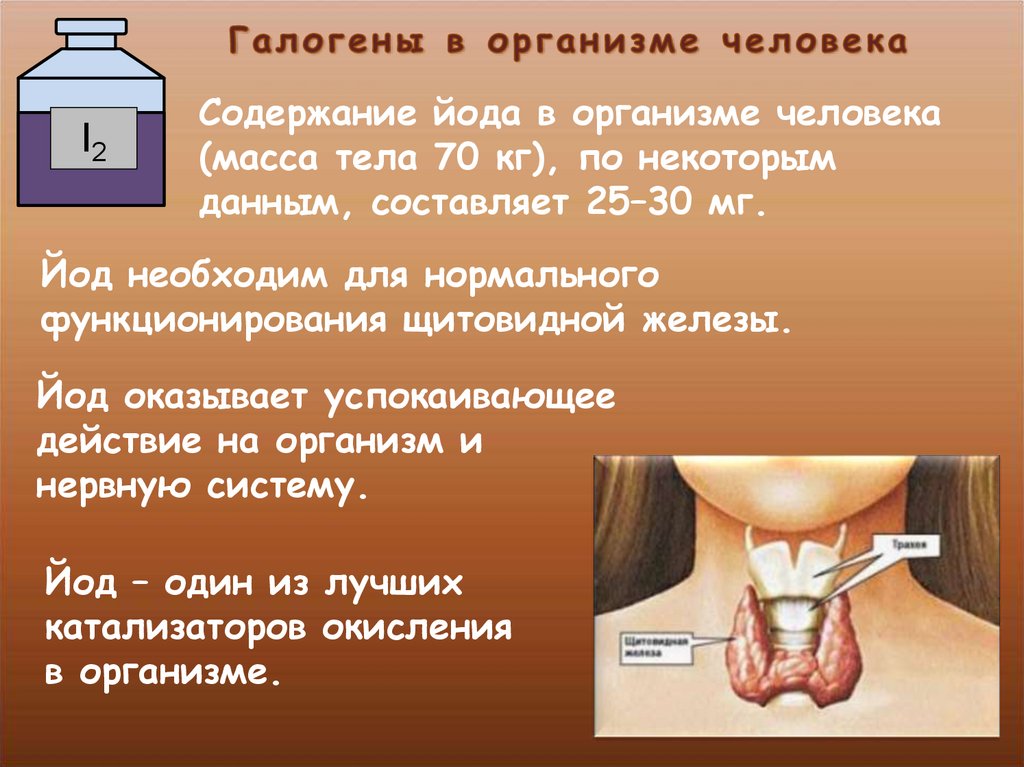
I2Содержание йода в организме человека
(масса тела 70 кг), по некоторым
данным, составляет 25–30 мг.
Йод необходим для нормального
функционирования щитовидной железы.
Йод оказывает успокаивающее
действие на организм и
нервную систему.
Йод – один из лучших
катализаторов окисления
в организме.
31.
Домашнее задание: параграф 12,выполнить тест





























 Химия
Химия








