Похожие презентации:
Скорость химической реакции. Порядок и молекулярность реакции. Катализ
1.
№4 Тема. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.ПОРЯДОК И МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ. КАТАЛИЗ
1. Основные понятия химической кинетики
Термодинамика изучает только состояния систем, она не прослеживает подробно путь
реакции, поэтому она определяет лишь потенциальную возможность ее протекания в
определенном направлении.
В уравнениях термодинамики нет такой величины как время, поэтому она не может описать
скорости процессов.
2.
Например, термодинамическая вероятность реакции окисления водорода до водыН2 + ½О2 = Н2О (ж) , ΔG0298 = 237,2 кДж/моль,
значительно выше, чем вероятность реакции нейтрализации с образованием воды
Н+ + ОН = Н2О (ж); ΔG0298 = 79,9 кДж/моль.
Однако первая реакция в обычных условиях без катализатора практически не идет, а
вторая реакция протекает мгновенно.
3.
Химическая кинетика представляет собой учение о скоростях химических реакций, о факторах,определяющих эти скорости (природы реагирующих веществ, концентрации, температуры,
присутствия катализаторов и др.), а также о механизме химических реакций.
Содержание кинетики химических реакций составляют два основных раздела:
1. Формально-математическое описание скорости реакции без учёта действительного механизма самой
реакции, так называемая формальная кинетика;
2. Учение о механизме химического взаимодействия.
4.
В зависимости от того, в одной или нескольких фазах находятся компоненты реакции,различают кинетику гомогенных реакций и кинетику гетерогенных реакций.
Гомогенной химической реакцией называется процесс, протекающий в одной фазе.
Гетерогенной реакцией называется процесс, протекающий на поверхности раздела фаз.
5.
Скоростью химической реакции называется изменение количества одного из реагирующих веществв единицу времени в единице объема, а для реакций при постоянном объеме - изменение
концентрации одного из реагирующих веществ в единицу времени.
Скорость реакции может быть установлена лишь для определенного промежутка времени.
Так, концентрация исходного вещества в некоторый момент времени t1 равна С1, в момент t2 – С2.,
то за промежуток времени ∆t = t2 - t1 изменение концентрации составит ∆С = С2 — С1
6.
Различают среднюю и истинную скорости.Ṽ=±
C
t
( t 0)
V= ±
dC моль
1
,
или
dt
л с
см 3 с
Знак минус ставится потому, что хотя концентрация исходного вещества убывает, скорость может быть
только положительной величиной.
Поскольку средняя скорость реакции изменяется в интервале ∆t , то в химической кинетике рассматривают
только истинную скорость реакции, т.е. скорость в данный момент времени, которая определяется как
первая производная от концентрации по времени.
В выражение скорости по исходному веществу ставят знак минус, а по продукту реакции – плюс.
7.
Пусть имеется реакция:аА + вВ сС + dD,
тогда между скоростями, определенными по различным веществам, существует связь:
1 dC A
1 dC B
1 dCC 1 dC D
...
...
a dt
b dt
C dt
d dt
Под механизмом реакции в кинетике понимают путь реакции, то есть подробное изменение
координат всех частиц в ее ходе, сближение и удаление атомов и радикалов, повороты молекул и их
частей, разрыв и образование новых химических связей.
В ходе изменения координат атомов происходит изменение энергии.
8.
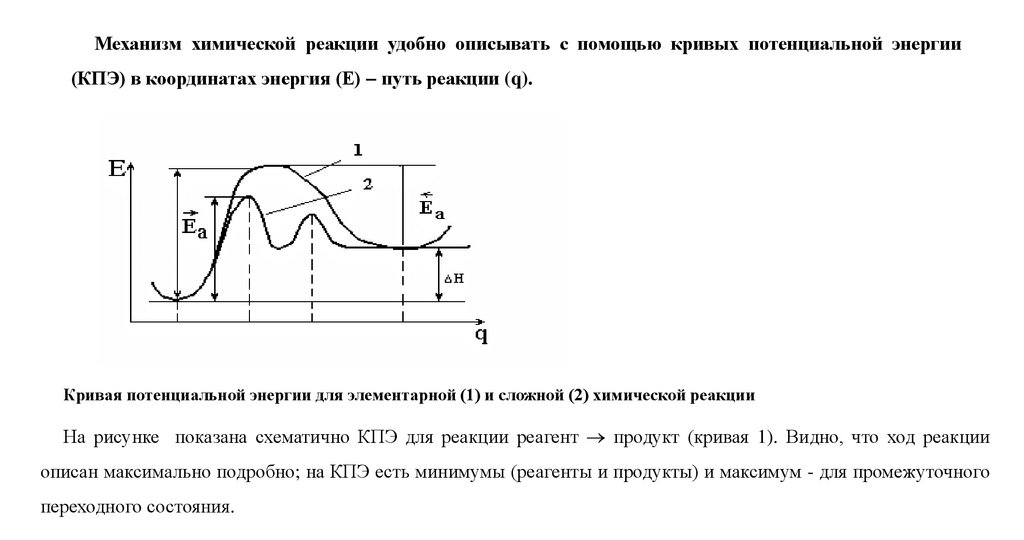
Механизм химической реакции удобно описывать с помощью кривых потенциальной энергии(КПЭ) в координатах энергия (Е) путь реакции (q).
Кривая потенциальной энергии для элементарной (1) и сложной (2) химической реакции
На рисунке показана схематично КПЭ для реакции реагент продукт (кривая 1). Видно, что ход реакции
описан максимально подробно; на КПЭ есть минимумы (реагенты и продукты) и максимум - для промежуточного
переходного состояния.
9.
Такие максимумы энергетические барьеры (Еа) на пути реакции, причем они разные для прямой иобратной реакции, так что
E a E a H реакци
Здесь Еа величины энергетических барьеров, которые называют энергиями активации.
Это выражение дает связь между кинетикой (Еа – кинетический параметр) и термодинамикой ( Н)
реакции.
Ключевым утверждением химической кинетики является положение о том, что реакции происходят
в результате столкновений атомов или молекул реагентов;
часть столкновений приводит к реакции.
10.
Кривая 1, изображенная на рисунке, относится к случаю простой (элементарной) реакции, то естьреакции, которая проходит в одно столкновение и в которой не образуются промежуточные устойчивые
соединения.
Кривая 2 соответствует сложной реакции, протекающей через две стадии (два барьера) и через один
промежуточный устойчивый продукт (минимум в середине кривой).
На скорость реакции влияют многие факторы: концентрация реагентов, температура, давление,
катализаторы, внешние воздействия, например излучения и др.
11.
2. Зависимость скорости химической реакции от концентрации реагентовТак как скорость химической реакции зависит от столкновений, а количество столкновений в
единице объема, очевидно, пропорционально концентрации сталкивающихся молекул.
Можно предположить, что скорость реакции пропорциональна концентрациям реагентов, то есть для
необратимой простой реакции
аА + bВ + .... = сС + dD + ...
V k[ A]a [ B]b
(закон действующих масс для скорости химической реакции).
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ
возведенных в
степени их стехиометрических коэффициентов.
Уравнения выражающие закон действующих масс для скорости реакции называются кинетическими
уравнениями химических реакций.
Здесь k константа скорости, то есть скорость реакции при
[A] = [B] = 1 моль/л.
12.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновенииучаствуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д.
Коэффициенты а и b в этих уравнении носят название "молекулярность" реакции по веществу А и В,
соответственно; сумма (а + b)= n суммарная (общая) молекулярность простой реакции.
Молекулярностью реакции называется число молекул, одновременно вступающих во взаимодействие.
Понятие "молекулярность" применимо только к простой реакции.
Молекулярность - это теоретическое понятие.
Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет
образование продуктов.
13.
По виду кинетического уравнения определяется порядок реакции, который равен сумме степенейконцентраций в кинетическом уравнении.
Cумма n=(a +в) общий порядок реакции.
Вычисления и наблюдения показывают, что (а + b) не может быть больше трех.
Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная.
По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и
тримолекулярными.
Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных
продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а
и b (они меньше их).
В этом случае кинетическое уравнение записывается:
V k [A] [B]
14.
Коэффициенты и в уравнении для сложных реакций носят название "частный порядок" реакции повеществу А и В.
Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и
равными нулю.
Для простых гомогенных реакций, протекающих в одну стадию, молекулярность и порядок реакции
совпадают,
т.е. мономолекулярная реакция соответствует реакции первого порядка,
бимолекулярная реакция – реакция 2-порядка, тримолекулярная – реакция 3-го порядка.
15.
Для сложных реакций, протекающих в несколько стадий, формальное представление о порядке несвязано с истинной молекулярностью реакции.
Поэтому встречаются реакции дробного, нулевого и даже отрицательного порядка по одному из
компонентов.
Порядок реакции определяется только из экспериментальных данных.
Например, каталитическое разложение аммиака на поверхности вольфрама описывается
уравнением V = k,
скорость не зависит от концентрации реагентов, т.е. реакция нулевого порядка.
16.
Для большинства реакций порядок реакции меньше молекулярности.Порядок реакции зависит от условий (концентрации, давления) протекания процесса.
Сравнительная характеристика
Порядок
Молекулярность
Формальная величина
Есть
физический
смысл,
показывает
число
реагирующих молекул
Может принимать различные числовые Принимает только одно из трех значений: 1,2,3
значения
Применяется
к
реакциям
сложности и многостадийности
любой Применяется только к элементарным одностадийным
реакциям
17.
Рассмотрим случаи несовпадения порядка реакции и молекулярности:1) Большой избыток одного из реагирующих веществ.
HCOOC2H5 + H2O → HCOOH + C2H5OH;
этиловый эфир муравьиной кислоты → муравьиная кислота +спирт
V= kCHCOOC2 H5 *CH2O
Порядок = 1; молекулярность = 2.
Поскольку взаимная растворимость исходных веществ крайне мала, то основная их масса
находится в разных фазах.
При расходовании эфира в химической реакции из эфирного слоя своевременно поступает новая
его порция, то есть концентрация его в растворе не уменьшается.
18.
2) Для гетерогенных реакцийCaO(тв) + CO2(г) → CaCO3(тв)
учитывается концентрация только газообразных веществ:
V= kCСO2
Порядок = 1; молекулярность = 2.
19.
Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов,направления реакции (природы продуктов) и от температуры.
Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., , ,...)
V
k
[ A] [ B] ..
Как видно из этого выражения, единицы измерения (размерность) k зависит от порядка реакции:
для реакций нулевого порядка [моль/л·с].
для реакции первого порядка ( + +...= 1) [ с 1];
для реакции второго порядка [л·с 1·моль 1];
для реакции третьего порядка [ л2·с 1·моль 2] .
20.
Приведем реакции различных порядков.1.Реакции нулевого порядка.
Нитрование бензола большим избытком азотной кислоты
С6H6 + HNO3 → C6H5NO2 + H2O
2HNO3 =NO2+ NO3 ̅ + H2O – медленная
C6H6 + NO2+ → C6H5NO2 + H+ - быстрая
V=kC2 HNO3
CHNO3 =const=1; V=k
21.
2. Реакции первого порядка.Классическим примером реакции первого порядка в растворе является гидролитический распад тростникового
сахара в воде на глюкозу и фруктозу:
C12H22O11 + H2O → C6H12O6 + C6H12O6.
Согласно закону действия масс для такой реакции
V= kCC12H22O11 *CH2O
но в разбавленном водном растворе количество воды, расходуемое на гидролиз, настолько незначительно, что
можно её концентрацию считать постоянной.
Тогда
V=kCC12H22O11 ,
что отвечает уравнению первого порядка.
22.
3.Реакции второго порядкаCH3COOC2H5 + NaOH = CH3COONa + C2H5OH;
Этилацетат (этиловый эфир уксусной кислоты → Ацетат натрия + спирт
V= kCCH3COOC2H5 *CNaOH
CH3Br+KOH = CH3OH+KBr;
V=kCCH Br *CKOH3
4.Реакции третьего порядка.
2NO + O2 =2NO2;
V= kC2NO *CO2
23.
3. ФОРМАЛЬНАЯ КИНЕТИКАРаздел химической кинетики, который математически описывает зависимость скорости реакций от
концентрации реагентов, называется формальной кинетикой.
Аппарат формальной кинетики позволяет рассчитать количество всех участников реакции в любой
момент времени.
Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом.
24.
3.1. Формальная кинетика реакций нулевого порядкаПусть CAº – начальная концентрация вещества А;
СА – текущая концентрация вещества А в момент t.
По определению
v=dCA/dt = kCAn = k,
т.к. n=0
-dCA = kdt.
CA
t
Возьмём определённый интеграл ∫- dC A kdt
CA0
-(СA-CAº) = k(t-0) → CAº - CA = kt
0
или
CA = CAº - kt → k = (CAº-CA)/t.
t1/2= (CAº-CAº/2)/k=CAº/2k.
Тогда размерность k для реакций 0 порядка [моль/л·с].
Константа скорости определяется как tg угла наклона кривой концентрации от времени.
25.
3.2.Формальная кинетика реакций первого порядкаВ общем виде реакция первого порядка запишется:
A→B+C.
Её скорость при постоянном объеме равна
V= –dCA/dt=kCA.
Разделим переменные –dCA/CA = kdt.
Интегрируем
CA
∫ dCA / CA
C A0
t
=
∫kdt → -(lnCA-lnCAº) = kt → lnCAº/CA = kt.
0
Вычислим CA:
lnCA/CAº = kt → CA/CAº = e-kt → CA = CAº e-kt
26.
Вычислим константу скорости k:k=1/t·lnCAº/CA. Для реакция первого порядка размерность k [с-1].
Вычислим время полупревращения
t1/2=1/k·lnCAº/½CAº=ln2/k.
t1/2 не зависит от начальной концентрации вещества А.
Константа скорости определяется как tg угла наклона прямой в координатах lnC от времени.
27.
3.3. Формальная кинетика реакций второго порядка2А→С+Д.
По определению скорость химической реакции есть первая производная концентрации вещества по
времени:
v = - dCA/dt.
По закону действующих масс кинетическое уравнение будет выглядеть
v = kCA2.
Тогда -dCA/dt = kCA2.
Разделим переменные
–dCA/CA2 = kdt.
28.
tA
Интегрируем
∫- dCA/С2А
=
CA0
∫kdt
→ -(-1/CA+1/CAº) = kt → 1/CA-1/CAº = kt →1/CA =1/CAº + kt;
0
k = 1/t(1/CA-1/CAº).
Размерность k [л/моль·с].
t1/2 = 1/k(2/CAº -1/CAº) = 1/kCAº.
В реакциях второго порядка t1/2 обратно пропорционально зависит от САº.
Константа скорости определяется как tg угла наклона прямой в координатах 1/CA от времени.




























 Химия
Химия








