Похожие презентации:
Термодинамическое равновесие
1.
РавновесиеТермодинамическим равновесием называется такое
термодинамическое состояние системы, которое при постоянстве
внешних условий не изменяется во времени, причем эта неизменяемость
не обусловлена каким-либо внешним процессом.
Δ r G Δ r G R T ln
0
K
0
νc
νd
ν
νb
(СC ) р (С D ) р
(С A ) р a (С B ) р
rG0T + R T lnK0 = 0
(С C ) р
νc
(С A ) р
νa
(С D ) р
νd
(С B ) р
νb
0
Стандартн.термод.константа равновесия
величина зависит только от природы
реагирующих веществ и температуры.
0
ΔrG Т
lnK
R T
0
K0 e
Δ r G 0T
R T
2.
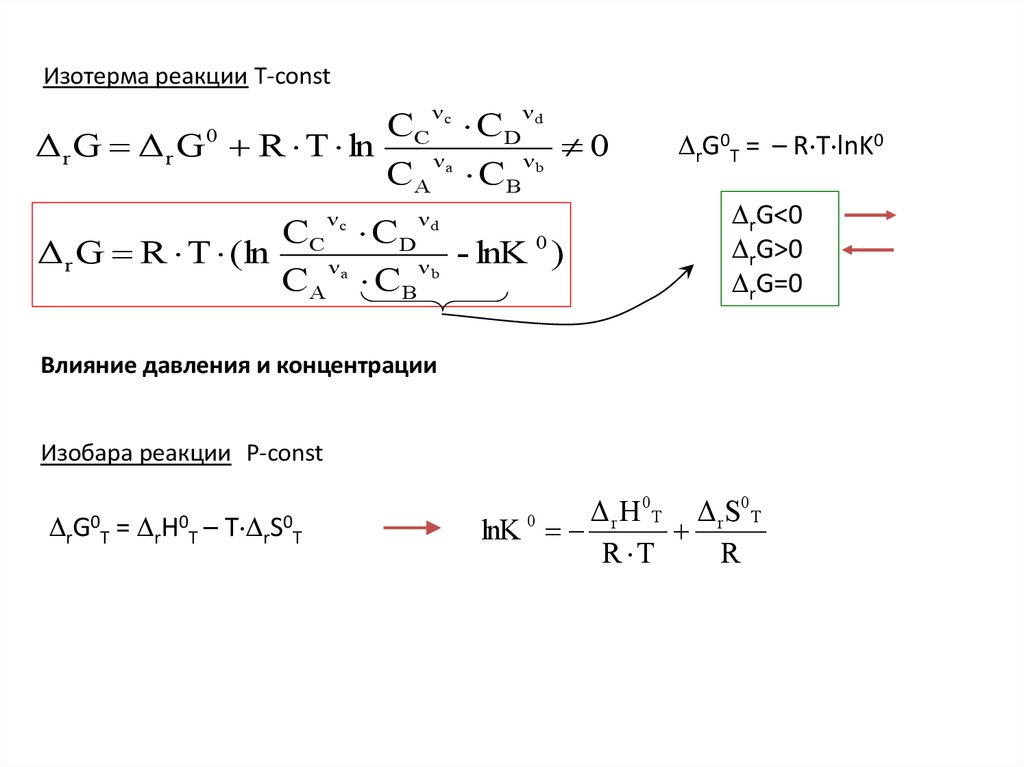
Изотерма реакции T-constν
ν
c
d
С
С
D
Δ r G Δ r G 0 R T ln C ν a
0
νb
СA СB
ν
ν
СC c С D d
0
Δ r G R T (ln
lnK
)
νa
νb
СA СB
rG0T = – R T lnK0
rG<0
rG>0
rG=0
Влияние давления и концентрации
Изобара реакции Р-const
rG0T
=
rН0T
–
Т rS0T
Δ r H 0 Т Δ rS0 Т
lnK
R T
R
0
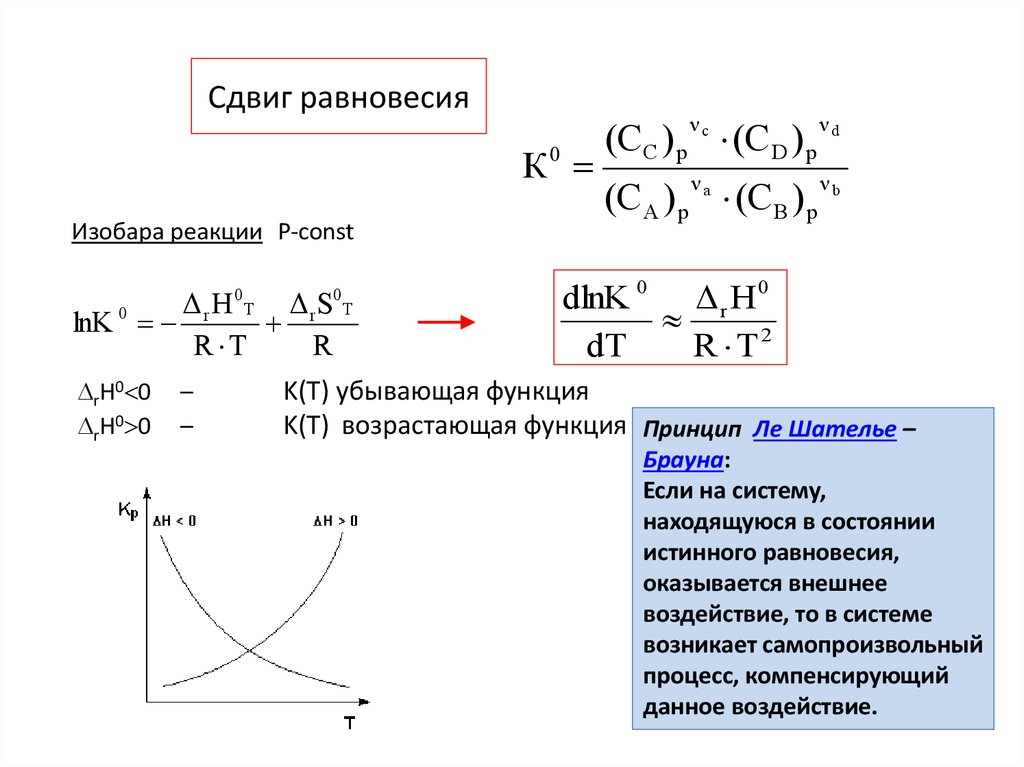
3. Сдвиг равновесия
К0Изобара реакции Р-const
0
0
lnK 0
Δ r H Т Δ rS
R T
R
rН0 0
rН0 0
–
–
Т
ν
νd
ν
νb
(С C ) р с (С D ) р
(С A ) р a (С B ) р
dlnK 0 Δ r H 0
dT
R T2
K(T) убывающая функция
K(T) возрастающая функция Принцип Ле Шателье –
Брауна:
Если на систему,
находящуюся в состоянии
истинного равновесия,
оказывается внешнее
воздействие, то в системе
возникает самопроизвольный
процесс, компенсирующий
данное воздействие.
4. Химическое равновесие
Термодинамические параметры: T; P; i; Сi – const1. Термодинамическое условие равновесия -
v v
2. Кинетическое условие равновесия -
реакция
rG = 0
аA + bB сC + dD
νa
νb
νc
νd
v k СA СB
v k СC СD
νa
νb
ν
ν
k СA СB k СC c СD d
νc
νd
(С
)
(С
)
k
C р
D р
K
νa
νb
k (С A ) р (С B ) р
Константа равновесия
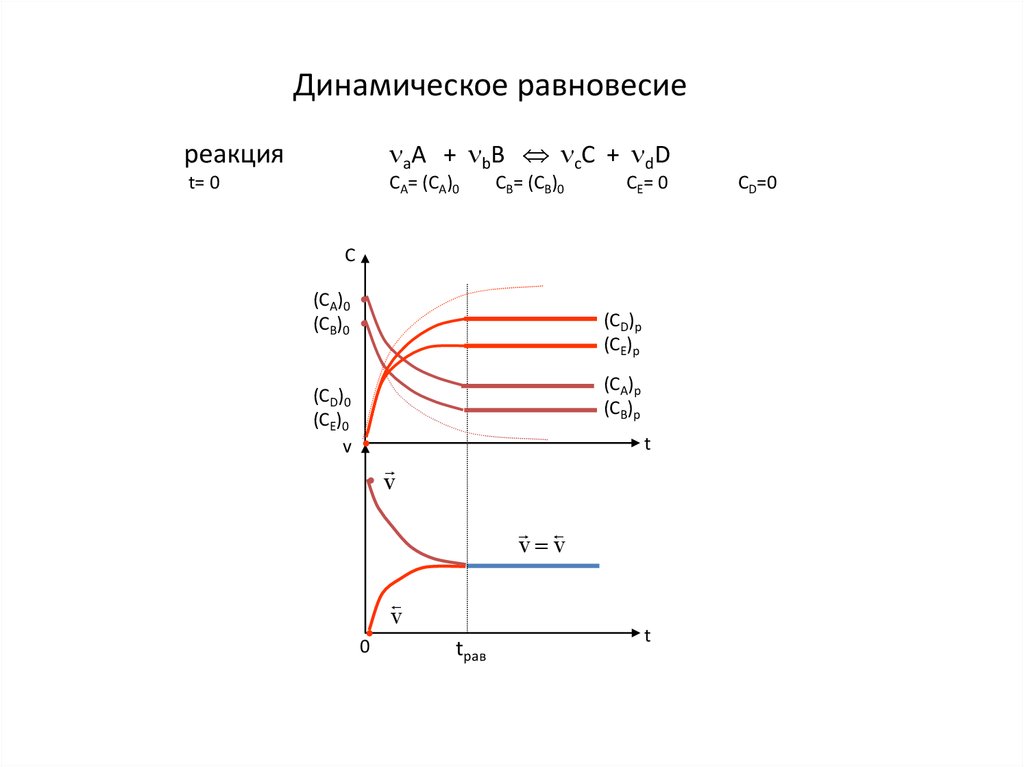
5.
Динамическое равновесиереакция
аA + bB сC + dD
t= 0
CA= (CA)0
CB= (CB)0
CE= 0
С
(CA)0
(CB)0
(CD)0
(CE)0
v
(CD)p
(CE)p
(CA)p
(CB)p
t
• v
v v
0
v
tрав
t
CD=0
6.
Константа равновесияK
ν
νd
νa
νb
(С C ) р c (С D ) р
(С A ) р (С B ) р
KX - концентрации задаются мольными долями (безразмерная величина)
Kp - концентрации задаются парциальными давлениями = ( c+ d) - ( a+ b)
KC – концентрации задаются молярной концентрацией -
(Па)
(моль/л)
7.
Равновесие в растворахРаствор - гомогенная однофазная многокомпонентная система,
образованная двумя или более веществами.
А - растворенное вещество
А+В
В - растворитель
Концентрация раствора относительное соотношение растворенного вещества и растворителя
• массовая доля
mA
m A B
• мольная доля
ν А моль
СМ
[
]
VA B
л
• моляльная концентрация С ν А [ моль ]
m
m B кг
• молярная концентрация
X
A
A B
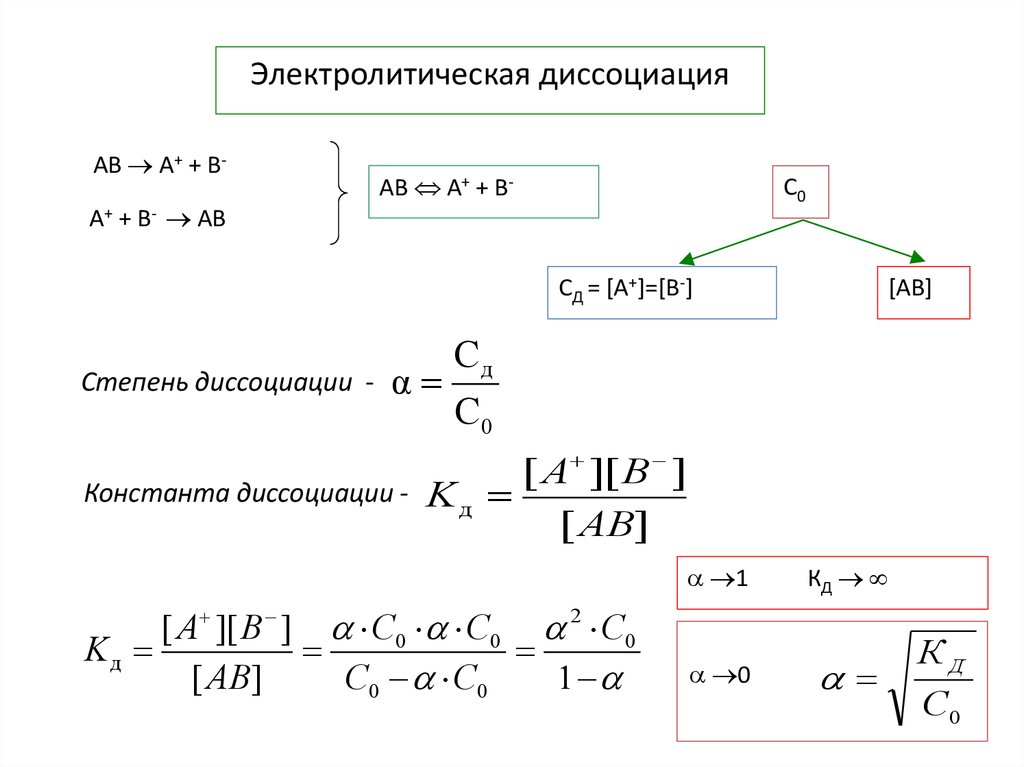
8.
Электролитическая диссоциацияАВ A+ + BA+ + B- AB
АВ A+ + B-
С0
СД = [A+]=[B-]
Степень диссоциации -
[AB]
Сд
α
С0
Константа диссоциации -
[ A ][ B ]
Kд
[ AB]
1
[ A ][ B ] С0 С0 2 С0
Kд
[ AB]
С0 С0
1
0
КД
КД
С0
9.
10.
Диссоциация воды[H ] [OH ]
Kд
[H 2O]
H2O H+ + OH-
0
Kw = [H+] [OH–] = 1.0 10-14 [(моль/л)2]
[H2O]-const
Kw - ионное произведение воды.
Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]
Кислая среда
Щелочная среда
[H+] > 10-7
[H+] < 10-7
[OH–] <10-7 [моль/л]
[OH–] > 10-7 [моль/л]
11.
Водородный показательpH = –lg[H+]
Нейтральная среда pH = 7
pОH = 7
Кислая среда
pОH > 7
Щелочная среда
pH < 7
pH > 7
pОH = –lg[ОH–]
pH + pОH = 14
pОH < 7
12.
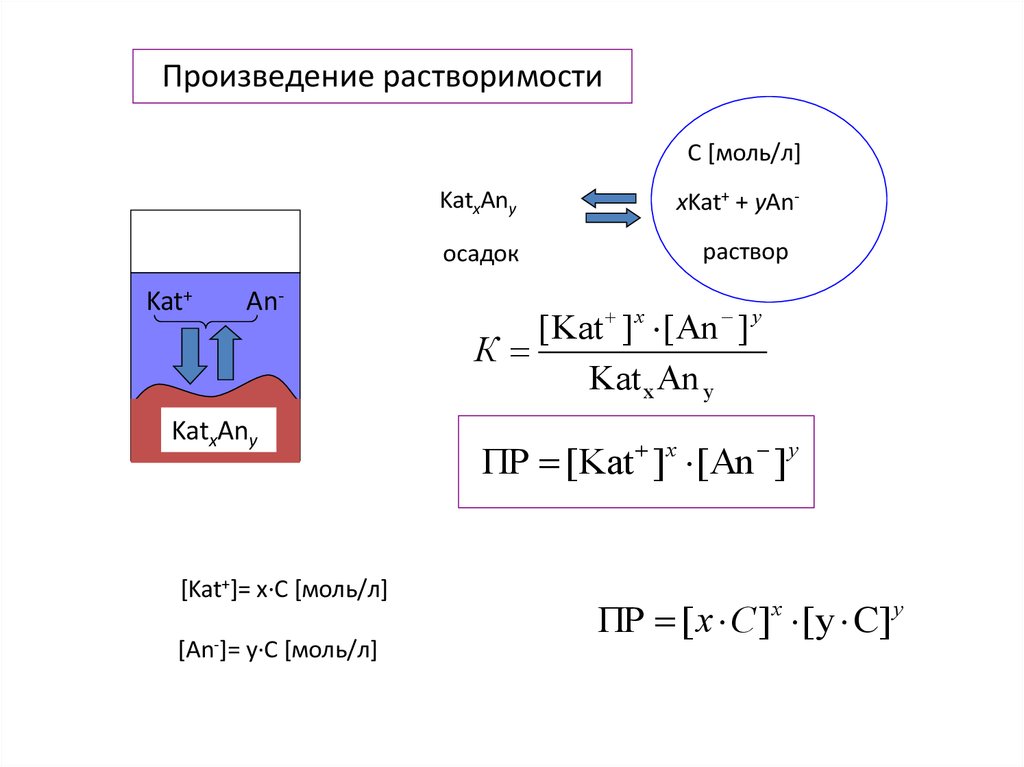
Произведение растворимостиC [моль/л]
KatxAny
осадок
Kat+
An-
KatxAny
[Kat+]= x·C [моль/л]
[An-]= y·C [моль/л]
xKat+ + yAnраствор
[Kat ]x [An ] y
К
Kat x An y
ПР [Kat ]x [An ] y
ПР [ x C ]x [ y C] y
13.
Число компонентов - ККомпонент – химически однородная составная часть системы,
которая может быть выделена из системы и существовать вне её.
Число независимых компонентов системы равно числу компонентов
минус число возможных химических реакций между ними.
N2+3H2 2NH3
N2, Н2O, He
N2, Н2, NН3
К=3
К=3–1=2
Число степеней свободы(С) – число параметров состояния системы,
которые могут быть одновременно произвольно изменены в
некоторых пределах без изменения числа и природы фаз в системе.
14.
Правило фаз Гиббса-
С=К–Ф+2
Число степеней свободы равновесной термодинамической системы С
равно числу независимых компонентов системы К минус число фаз Ф плюс
число внешних факторов, влияющих на равновесие.
Системы: ( по числу компонентов ) одно-, двухкомпонентные и т.д.
(по числу степеней свободы) инвариантные, моно-,
дивариантные и т.д.
графическая зависимость состояния системы от внешних условий –
диаграммы состояния
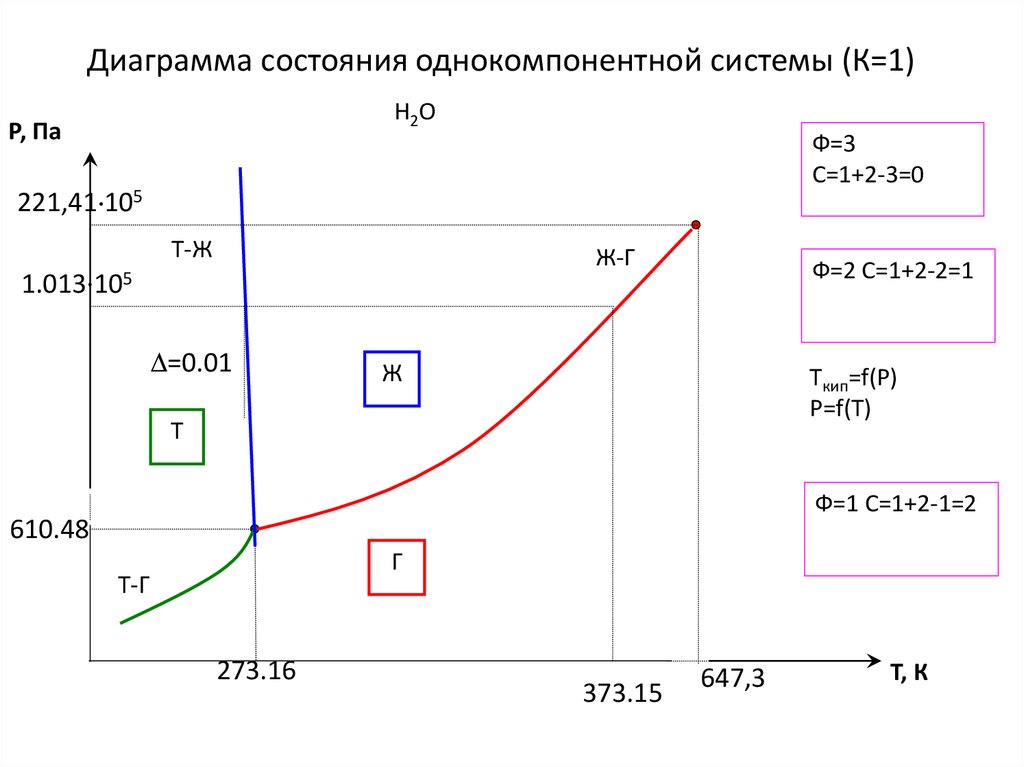
15. Диаграмма состояния однокомпонентной системы (К=1)
Н2ОР, Па
Ф=3
С=1+2-3=0
221,41 105
Т-Ж
Ж-Г
1.013·105
=0.01
Ф=2 С=1+2-2=1
Ж
Tкип=f(Р)
Р=f(T)
Т
Ф=1 С=1+2-1=2
610.48
Г
Т-Г
273.16
373.15
647,3
Т, К
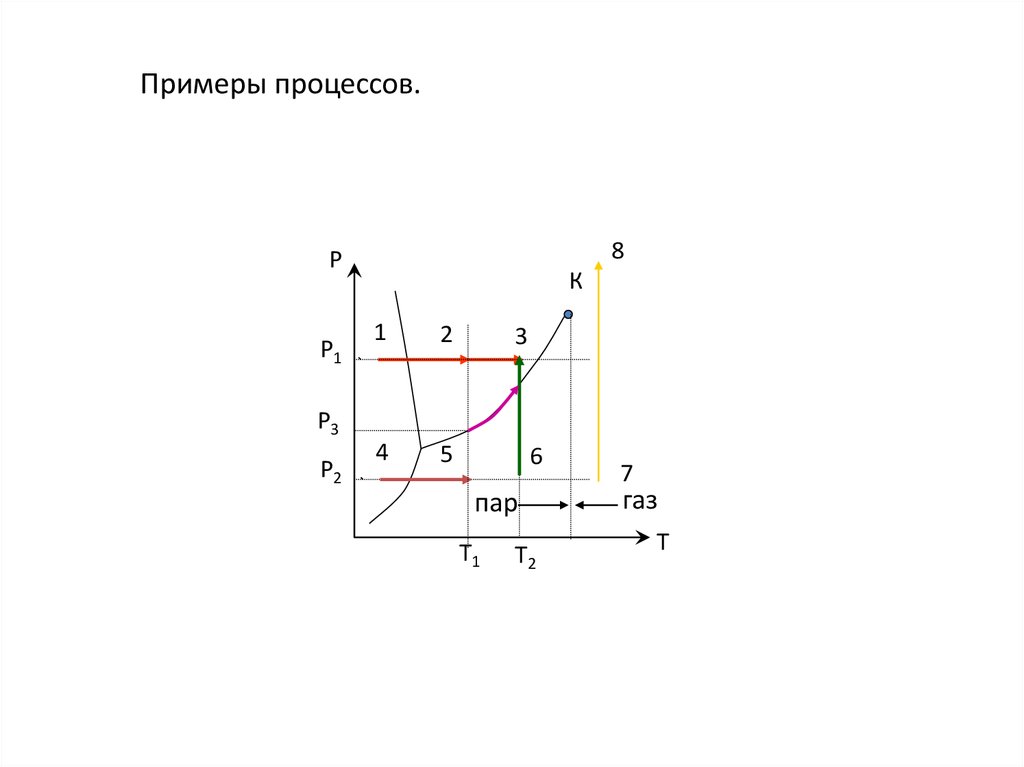
16. Примеры процессов.
8Р
Р1
К
1
2
4
5
3
Р3
Р2
6
пар
Т1
Т2
7
газ
Т
17. Двухкомпонентная система (К=2)
Н2Опарp
XA
p0
Закон Рауля
0
p0 p А
A
p0
A p
Н2О + А
Двухфазное равновесие
1) Т Ж; Ж Г
С=2+2–2=2
Tпл=f(р,СА)
Tкип=f(р,СА)
2) Т Г
Ф=3
С=2+2–3=1
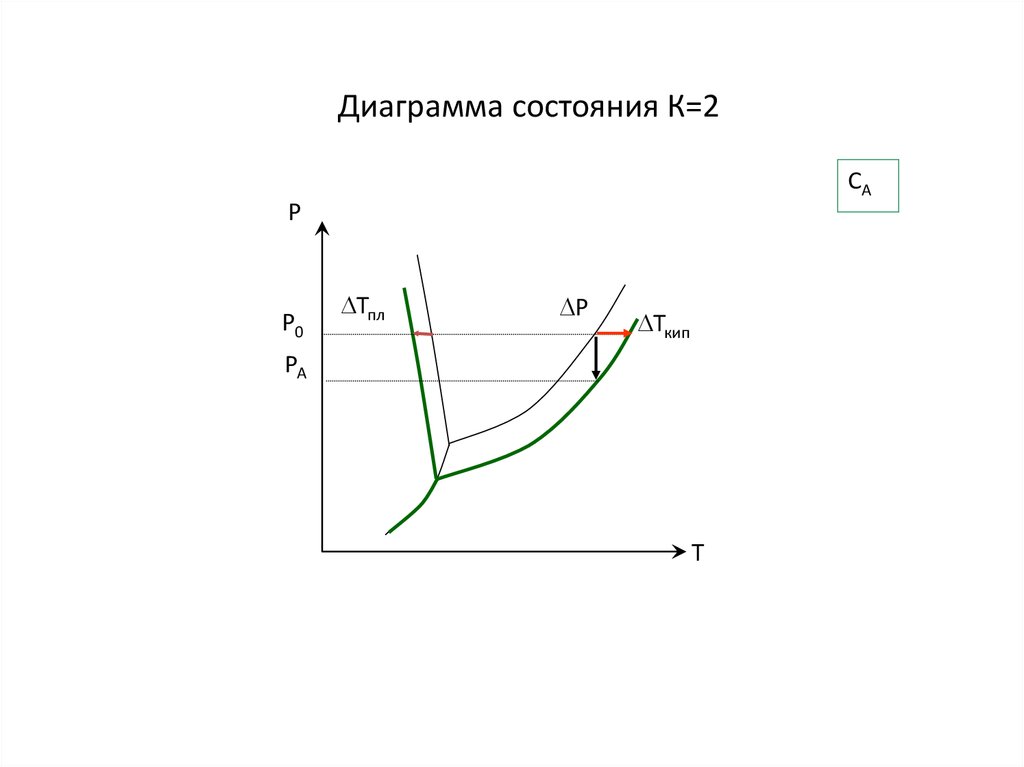
18. Диаграмма состояния К=2
САР
Р0
Тпл
P
Ткип
РА
Т
19. Кипение и кристаллизация растворов
• Повышение температуры кипения раствора по сравнению с чистымрастворителем ( Ткип) прямо пропорционально концентрации
растворенного вещества
Ткип = Kэб См
См [моль/кг] – моляльная концентрация
Kэб [К кг/моль]– эбуллиоскопическая постоянная растворителя
• Понижение температуры кристаллизации раствора по сравнению с
чистым растворителем прямо пропорционально концентрации
растворенного вещества
Ткр = Kкр См
Kкр [К кг/моль]– криоскопическая постоянная растворителя
R (Tкип ) 2 M
K эб
1000 Δ v H
vH - [Дж /кг]
K кр
R (Tкр ) 2 M
1000 Δ m H
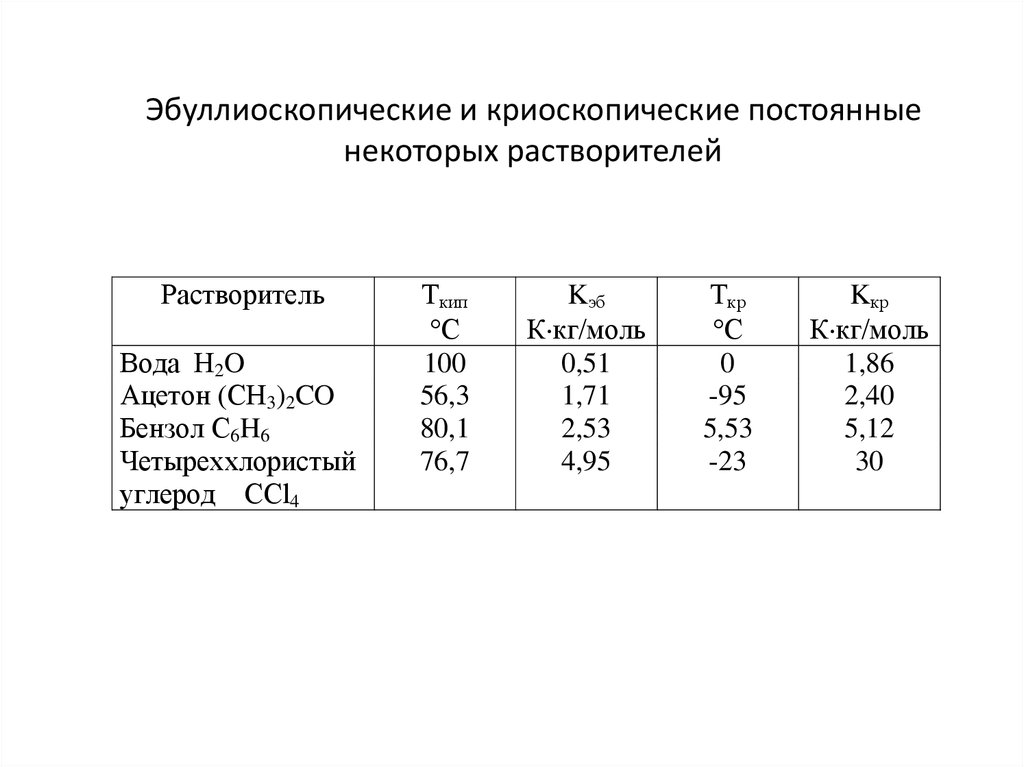
20. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
РастворительВода H2O
Ацетон (CH3)2CO
Бензол C6H6
Четыреххлористый
углерод CCl4
Ткип
С
100
56,3
80,1
76,7
Kэб
К кг/моль
0,51
1,71
2,53
4,95
Ткр
С
0
-95
5,53
-23
Kкр
К кг/моль
1,86
2,40
5,12
30
21. Изотонический коэффициент - i
- показывает увеличение числа частиц в растворе электролита по сравнениюс раствором не электролита той же концентрации
АxВy x А+ + y ВN0 - число молекул растворенного вещества
- степень диссоциации
m=x+y
α N 0 (x y) (N 0 α N 0 )
i
α m 1 α (m - 1) 1
N0
1
Ткип = i Kэб См
i=m
Ткр = i Kкр См
ΔP
i XA
P0












 Химия
Химия








