Похожие презентации:
Гидролиз солей
1. «Гидролиз солей»
Тема урока:«Гидролиз солей»
2. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
ИндикаторЦвет индикатора в среде
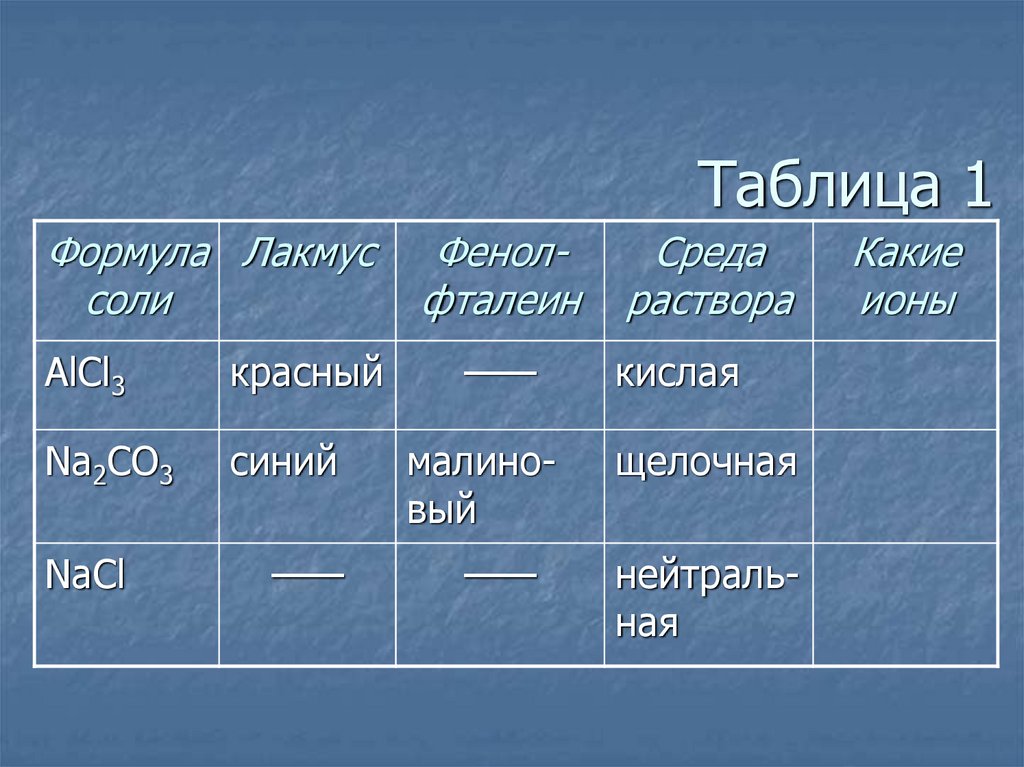
кислой
Лакмус
Красный
щелочной нейтральной
Синий
——
Фенолфта- Бесцветный Малиновый Бесцветный
леин
3. Таблица 1
Формула Лакмуссоли
AlCl3
Na2CO3
NaCl
Фенолфталеин
Среда
раствора
Какие
ионы
4. Таблица 1
Формула Лакмуссоли
AlCl3
Na2CO3
NaCl
красный
Фенолфталеин
——
Среда
раствора
Какие
ионы
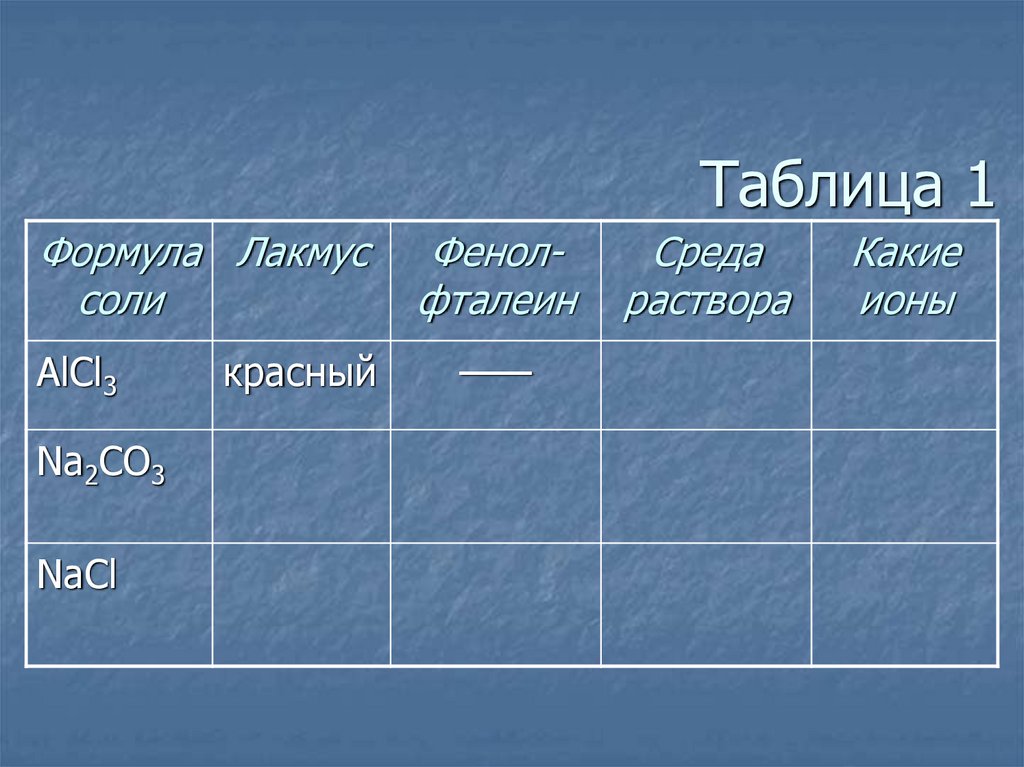
5. Таблица 1
Формула Лакмуссоли
AlCl3
красный
Na2CO3
синий
NaCl
Фенолфталеин
——
малиновый
Среда
раствора
Какие
ионы
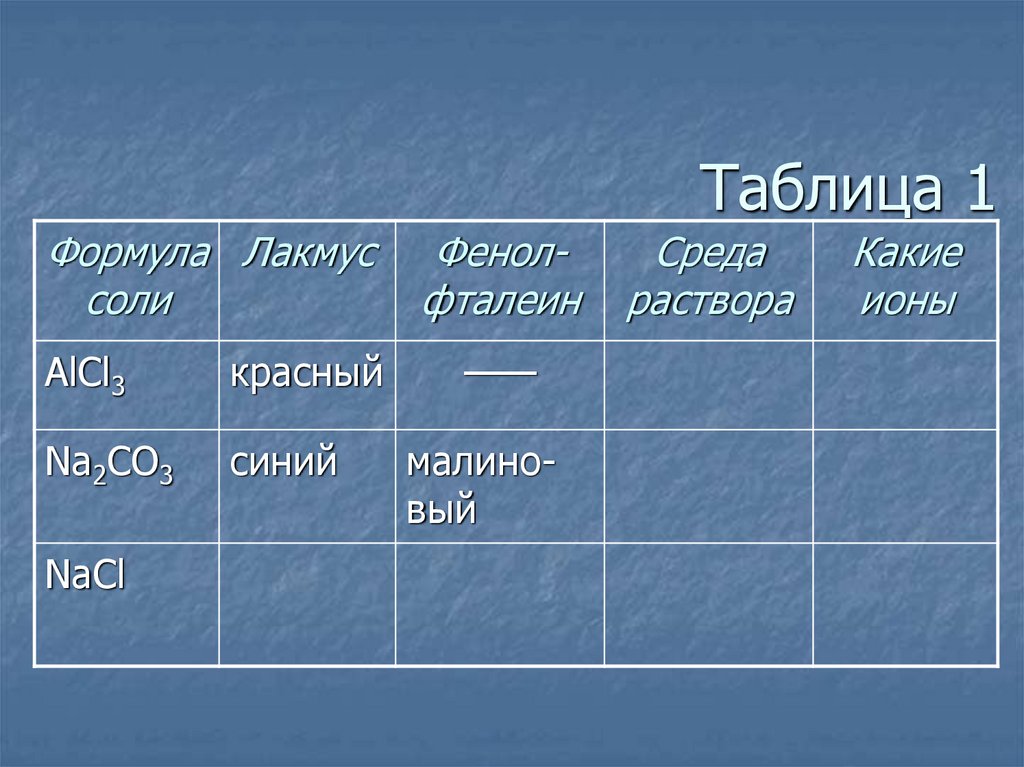
6. Таблица 1
Формула Лакмуссоли
AlCl3
красный
Na2CO3
синий
NaCl
——
Фенолфталеин
——
малиновый
——
Среда
раствора
Какие
ионы
7. Таблица 1
Формула Лакмуссоли
AlCl3
красный
Na2CO3
синий
NaCl
——
Фенолфталеин
——
малиновый
——
Среда
раствора
кислая
щелочная
нейтральная
Какие
ионы
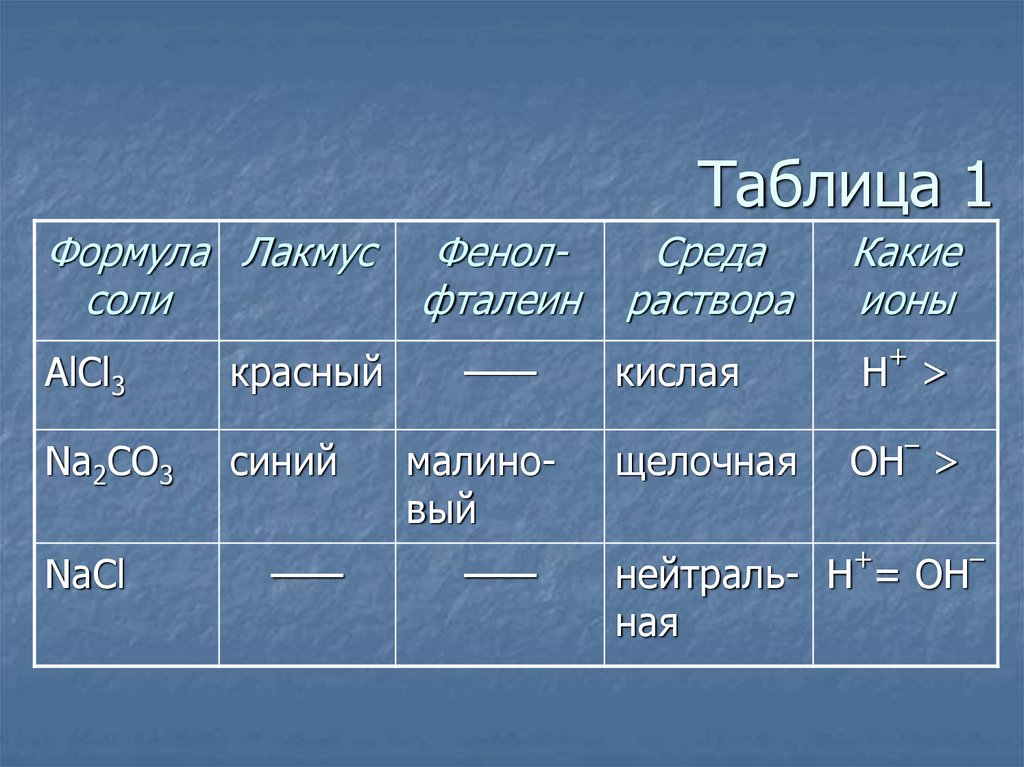
8. Таблица 1
Формула Лакмуссоли
AlCl3
Na2CO3
NaCl
красный
синий
——
Фенолфталеин
——
малиновый
——
Среда
раствора
Какие
ионы
кислая
Н >
щелочная
+
–
OH >
+
нейтраль- H = OH
ная
–
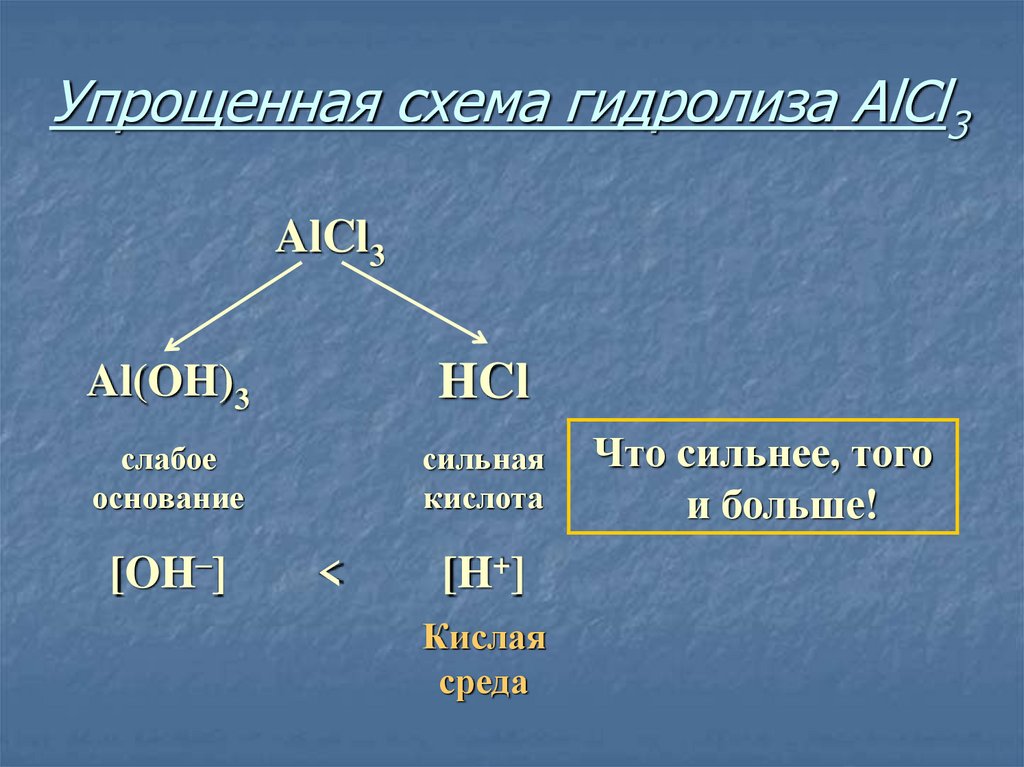
9. Упрощенная схема гидролиза AlCl3
AlCl3Al(OH)3
HCl
слабое
основание
сильная
кислота
[OH–]
<
[H+]
Кислая
среда
Что сильнее, того
и больше!
10. Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
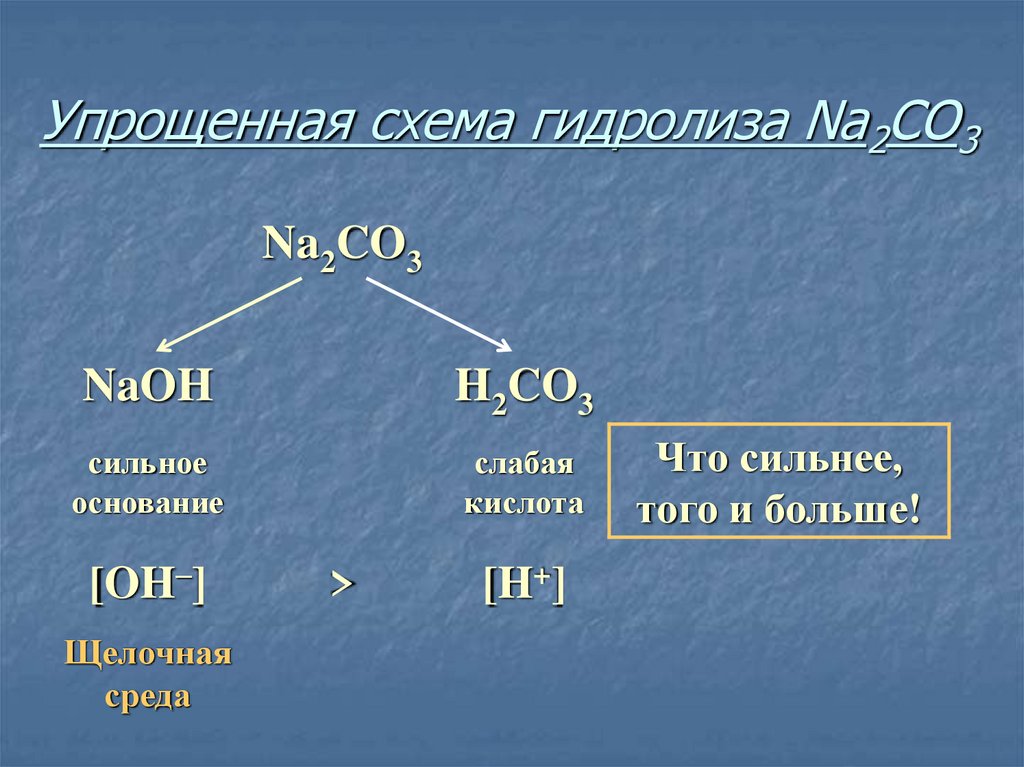
11. Упрощенная схема гидролиза Na2CO3
Na2CO3NaOH
H2CO3
сильное
основание
слабая
кислота
[OH–]
Щелочная
среда
>
[H+]
Что сильнее,
того и больше!
12. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
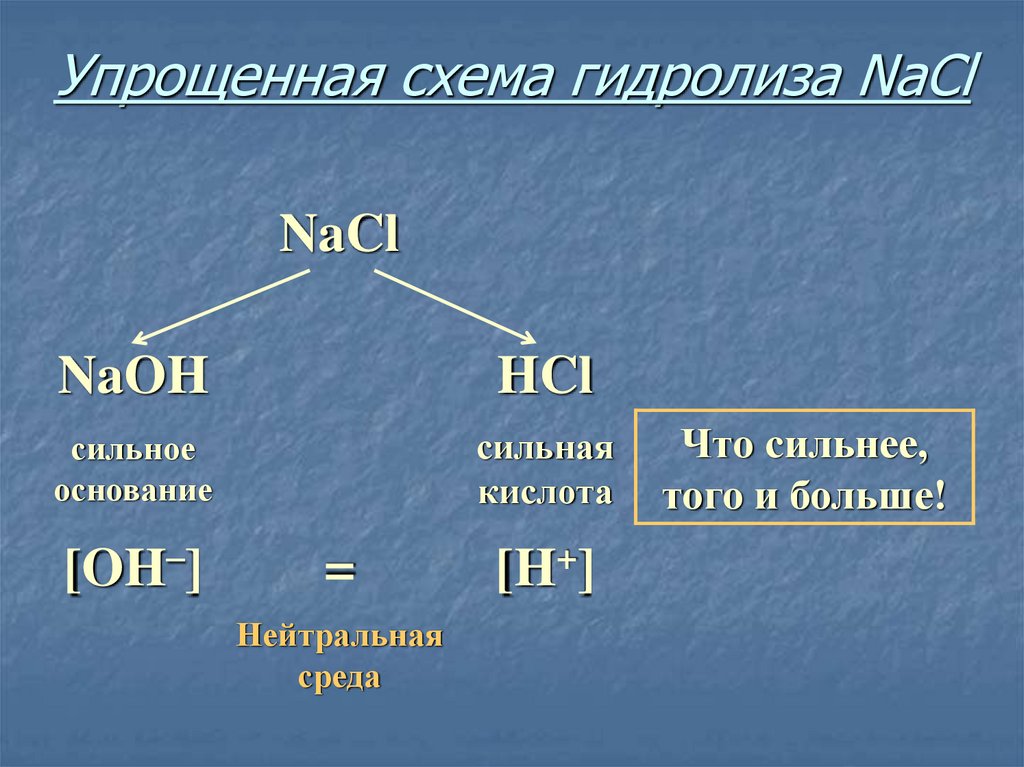
13. Упрощенная схема гидролиза NaCl
NaClNaOH
HCl
сильное
основание
сильная
кислота
[OH–]
=
Нейтральная
среда
[H+]
Что сильнее,
того и больше!
14. Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество
ионовводорода и гидроксид-ионов.
15. Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)
● Гидролиз — это реакцияобмена между некоторыми
солями и водой («гидро» —
вода, «лизис» — разложение)
16. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
–
+ 3Сl
17. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
+
–
+ 3Сl
–
Н2O ↔ Н + ОН
18. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
+
–
+ 3Сl
–
Н2O ↔ Н + ОН
_______________________________________________________________________________
19. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
+
–
+ 3Сl
–
Н2O ↔ Н + ОН
_______________________________________________________________________________
3+
Al
–
2+
+ 3Сl + Н2O ↔ АlOН
–
+
+ 3Сl + Н
20. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
+
–
+ 3Сl
–
Н2O ↔ Н + ОН
_______________________________________________________________________________
3+
Al
3+
Аl
–
2+
+ 3Сl + Н2O ↔ АlOН
2+
+ Н2O ↔ АlOН
+
+Н
–
+
+ 3Сl + Н
21. Уравнения гидролиза АlСl3
3+АlСl3 ↔ Аl
+
–
+ 3Сl
–
Н2O ↔ Н + ОН
___________________________________________________________________
3+
Al
3+
Аl
–
2+
+ 3Сl + Н2O ↔ АlOН
2+
+ Н2O ↔ АlOН
–
+
+ 3Сl + Н
+
+Н
Избыток ионов водорода дает
соли кислую среду, поэтому лакмус
краснеет.
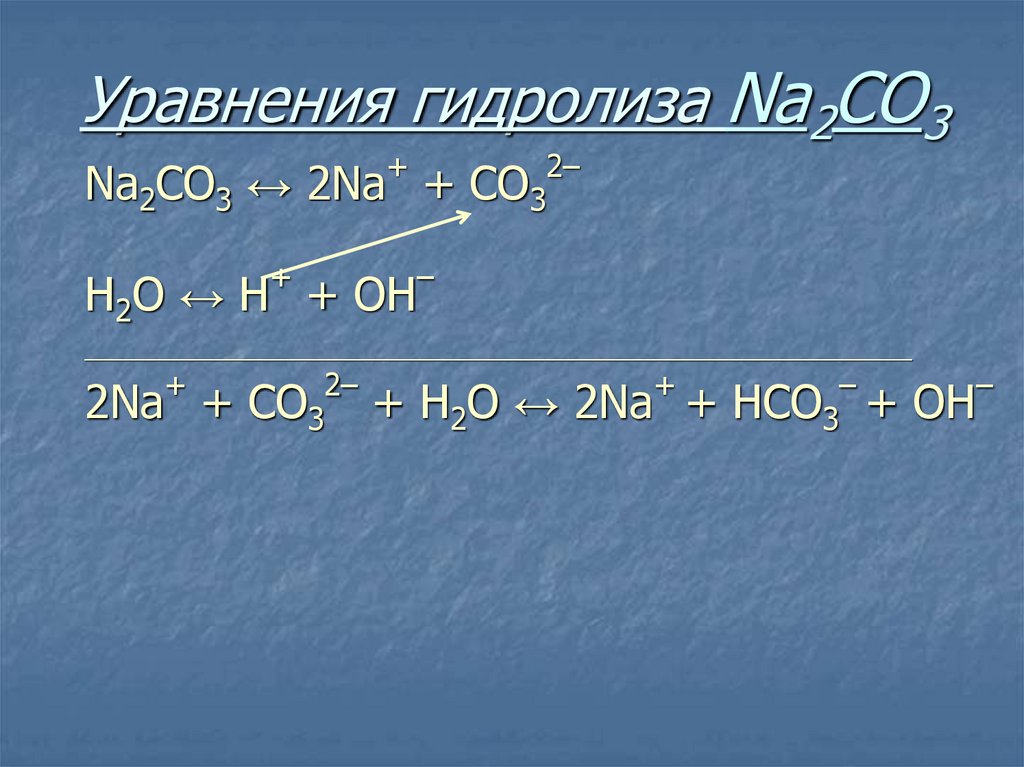
22. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
2–
СO3
23. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
+
Н2O ↔ Н + ОН
–
2–
СO3
24. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
+
Н2O ↔ Н + ОН
2–
СO3
–
____________________________________________________________________________
25. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
+
Н2O ↔ Н + ОН
2–
СO3
–
____________________________________________________________________________
+
2Na +
2–
СO3
+
+ Н2O ↔ 2Na +
–
HCO3
–
+ ОН
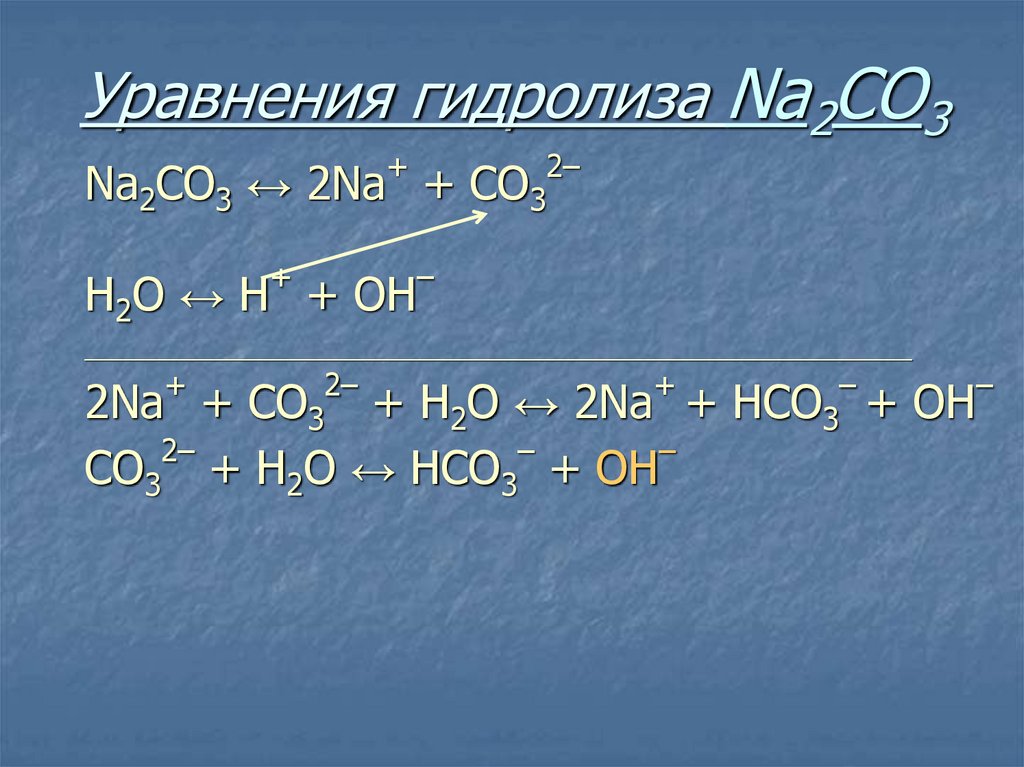
26. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
+
Н2O ↔ Н + ОН
2–
СO3
–
____________________________________________________________________________
+
2–
СO3
+
2Na +
+ Н2O ↔ 2Na +
2–
–
–
СO3 + Н2O ↔ НСO3 + ОН
–
HCO3
–
+ ОН
27. Уравнения гидролиза Na2CO3
+Na2CO3 ↔ 2Na +
+
Н2O ↔ Н + ОН
2–
СO3
–
____________________________________________________________________________
+
2–
СO3
+
2Na +
+ Н2O ↔ 2Na +
2–
–
–
СO3 + Н2O ↔ НСO3 + ОН
–
HCO3
+ ОН
–
Избыток гидроксид-ионов дает соли
щелочную среду, поэтому лакмус
синеет, а фенолфталеин становится
малиновым.
28. Уравнения гидролиза NaCl
+–
NaCl ↔ Na + Сl
+
–
Н2O ↔ Н + ОН
____________________________________________________________________________
+
–
+
–
Na + Сl + Н2O ↔ Na + Cl + H2O
Одинаковое количество гидроксидионов и ионов водорода дает соли
нейтральную
среду,
поэтому
индикаторы не меняют окраску
(гидролизу не подвергается).
29. Какую среду будут иметь водные растворы следующих солей:
•Какую среду будут иметь водныерастворы следующих солей:
1 вариант
а) нитрата цинка (II)
б) сульфата калия
в) сульфида натрия
Составьте
2 вариант
а) хлорида меди (II)
б) сульфита натрия
в) нитрата бария
ионное
гидролиза этих солей.
уравнение
30. Ответы
31. а) 1 вариант
–2+
Zn(NO3)2 ↔ Zn + 2NO3
+
Н2O ↔ Н + ОН
–
________________________________________________________
–
2+
–
+
+
Zn + 2NO3 + Н2O ↔ ZnOН + 2NO3 + Н
2+
+
+
Zn + Н2O ↔ ZnOН + Н
2+
CuCl2 ↔ Cu + 2Сl
+
Н2O ↔ Н + ОН
–
(среда кислая)
2 вариант
–
_______________________________________________________________________________________________________________________
2+
–
+
–
+
Cu + Сl + Н2O ↔ CuOH + Cl + Н
2+
+
+
Сu + Н2O ↔ СuOH + Н (среда кислая)
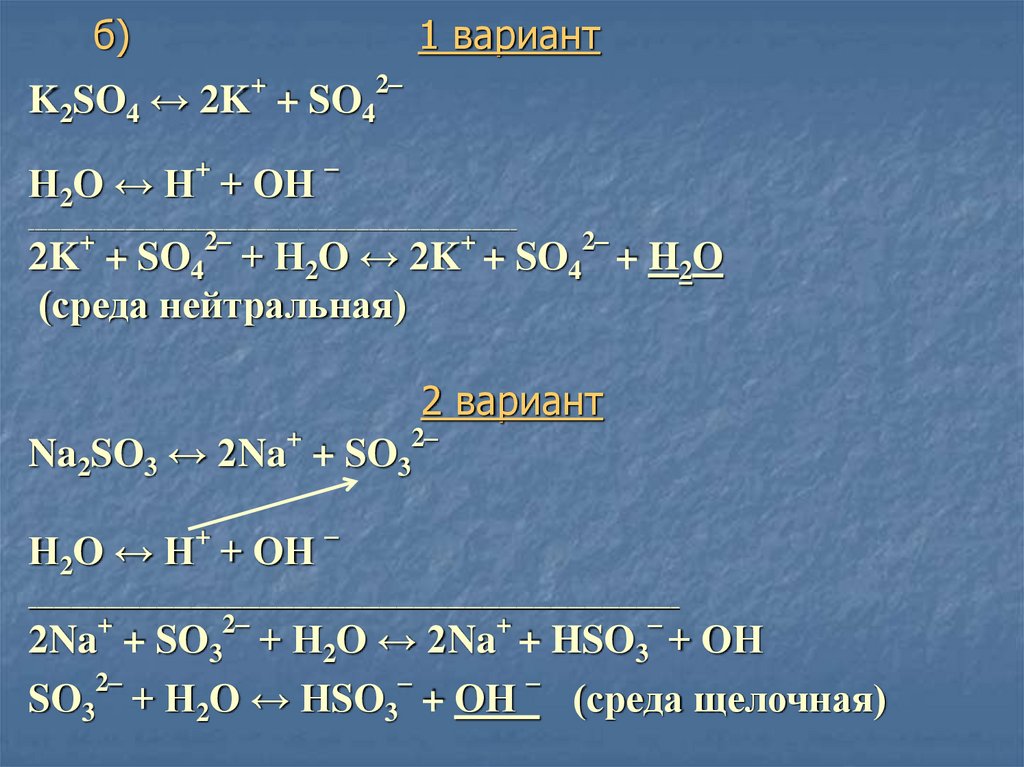
32. б) 1 вариант
+2–
K2SO4 ↔ 2K + SO4
+
Н2O ↔ Н + ОН
–
____________________________________________________________________________
+
2–
+
2–
2K + SO4 + Н2O ↔ 2K + SO4 + H2O
(среда нейтральная)
2 вариант
+
Na2SO3 ↔ 2Na + SO3
+
Н2O ↔ Н + ОН
2–
–
____________________________________________________________________________
+
2–
+
–
2Na + SO3 + Н2O ↔ 2Na + HSO3 + ОН
2–
–
–
SO3 + Н2O ↔ НSO3 + ОН (среда щелочная)
33. в) 1 вариант
в)+
2–
Na2S ↔ 2Na + S
+
Н2O ↔ Н + ОН
1 вариант
–
____________________________________________________________________________
+
2–
–
+
–
2Na + S + Н2O ↔ 2Na + HS + ОН
2–
–
–
S + Н2O ↔ НS + ОН (среда щелочная)
2 вариант
2+
Ba(NO3)2 ↔ Ba +
+
Н2O ↔ Н + ОН
–
2NO3
–
___________________________________________________________________
2+
–
2+
–
Ba + 2NO3 + Н2O ↔ Ba + 2NO3 + Н2O
(среда нейтральная)
34. О значении и применении гидролиза...
Под действием биологических катализаторов —ферментов в организме человека происходит гидролиз
крахмала, целлюлозы, белка, жиров.
В технике крахмал подвергают гидролизу при
взаимодействии с разбавленной серной кислотой и
превращают в глюкозу (это реакция Кирхгофа, 1811 г.).
Продукты гидролиза крахмала широко используются в
кондитерской
промышленности,
медицине,
для
технических целей.
В промышленности гидролизу подвергаются сложные
эфиры и жиры обязательно в щелочной среде. Такая
реакция называется омылением. На этой реакции
основано производство мыла, однако в настоящее время
на производство моющих средств идут главным образом
продукты переработки нефти.
Продукты гидролиза целлюлозы в промышленности —
это бумага, хлопчатобумажные ткани.
35. Домашнее задание.
Пользуясь таблицей «Сильные ислабые электролиты», приведите
свои примеры солей, которые будут
иметь
кислую,
щелочную
и
нейтральную среду раствора, и
напишите к ним ионные уравнения
гидролиза.
36. Урок окончен
37. Источники материалов
Кузьменко Н.Е., Еремин В.В., ПопковВ.А. Начала химии. — М.: Экзамен,
2001.
Хомченко Г.П. , Хомченко И.Г. Сборник
задач по химии. — М., 2000 .
http://hydorlysis.narod.ru/pages/teoria.h
tm
http://www.xumuk.ru/encyklopedia/1047
.html


























 Химия
Химия