Похожие презентации:
Гидролиз солей
1.
2.
Гидролизсолей
«Три пути ведут к знанию:
путь размышления – это
путь самый благородный;
путь подражания – это
путь самый легкий и
путь опыта – это путь
самый горький»
Конфуций
3.
СОДЕРЖАНИЕАлгоритм
составления
уравнений
гидролиза
Определение
Типы
солей,участвующих
в гидролизе
Примеры
солей,участвующих
в гидролизе
Применение
гидролиза
Обратите
внимание!
Вопросы для
самоконтроля
4.
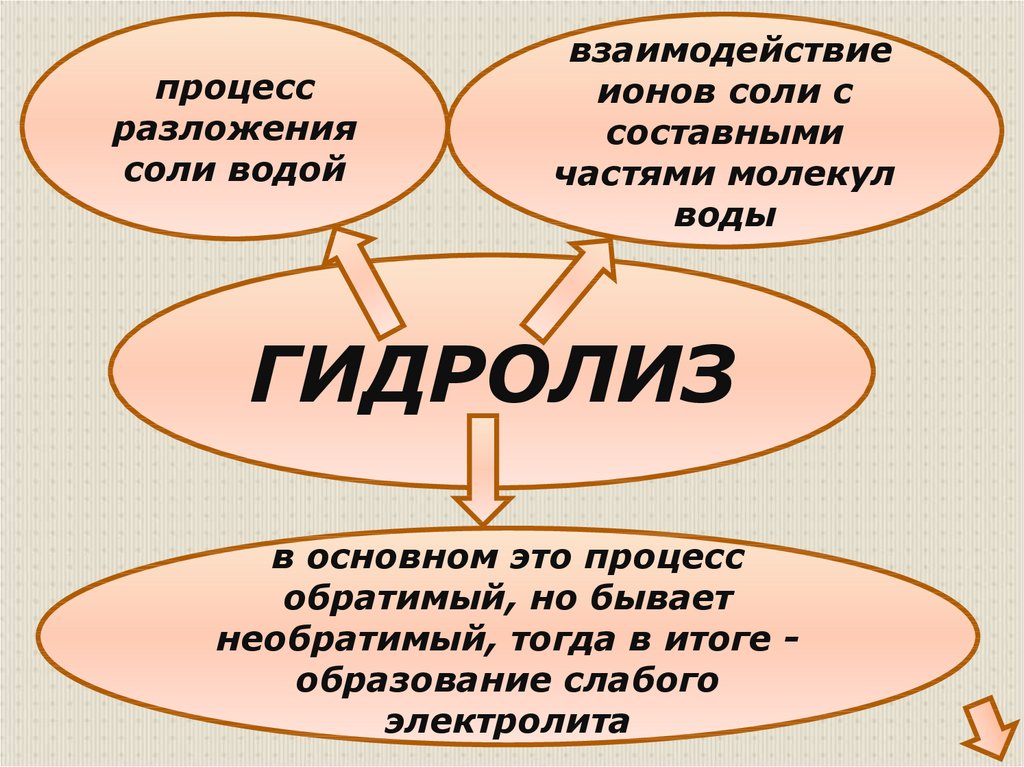
процессразложения
соли водой
взаимодействие
ионов соли с
составными
частями молекул
воды
ГИДРОЛИЗ
в основном это процесс
обратимый, но бывает
необратимый, тогда в итоге образование слабого
электролита
5.
Новые понятияГидролиз – реакция обмена между
растворимыми солями и водой
Сильные кислоты – кислоты, являющиеся сильными
электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми
электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
Сильные основания – сильные электролиты щелочи (NaOH, KOH, Ca(OH)2 и другие)
Слабые основания – нерастворимые
основания, слабые электролиты (Cu(OH)2,
Al(OH)3 и другие)
6.
Классификация солейучаствующих в гидролизе:
Соль образована
сильным основанием и слабой кислотой
Соль образована
слабым основанием и сильной кислотой
Соль образована
слабым основанием и слабой кислотой
Соль образована
сильным основанием и сильной кислотой
7.
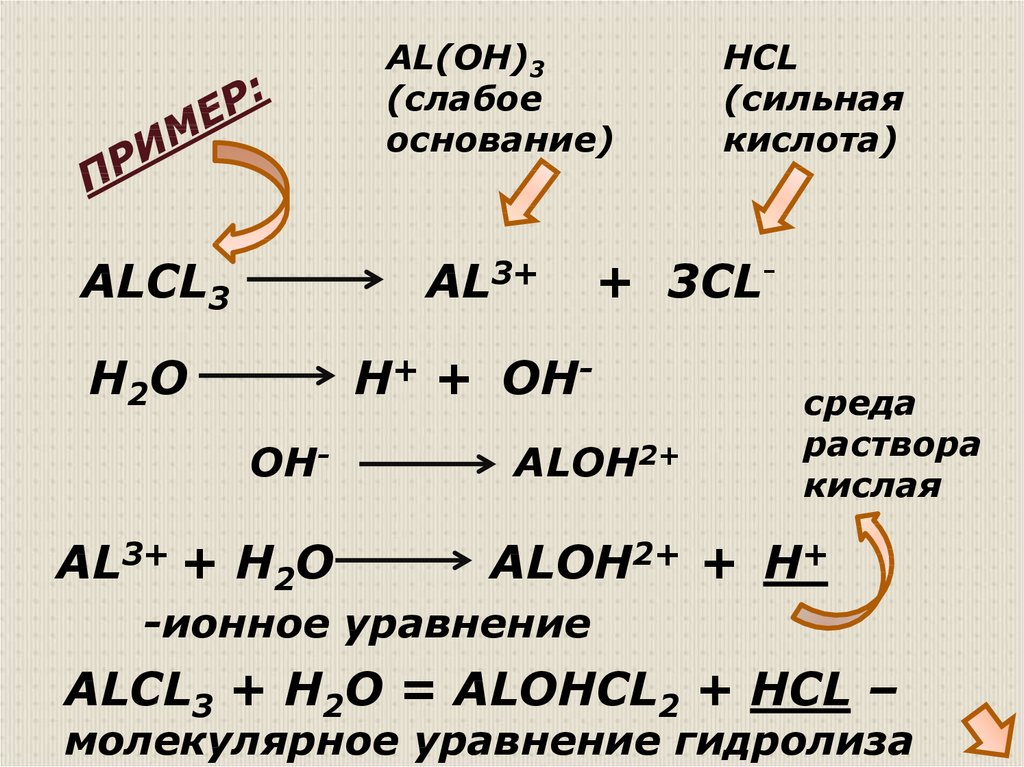
AL(OH)3(слабое
основание)
ALCL3
AL3+
H2O
+ 3CL-
H+ + OHOH-
AL3+ + H2O
HCL
(сильная
кислота)
ALOH2+
среда
раствора
кислая
ALOH2+ + H+
-ионное уравнение
ALCL3 + H2O = ALOHCL2 + HCL –
молекулярное уравнение гидролиза
8.
ОБРАТИТЕВ Н И М А Н И Е:
!
!
9.
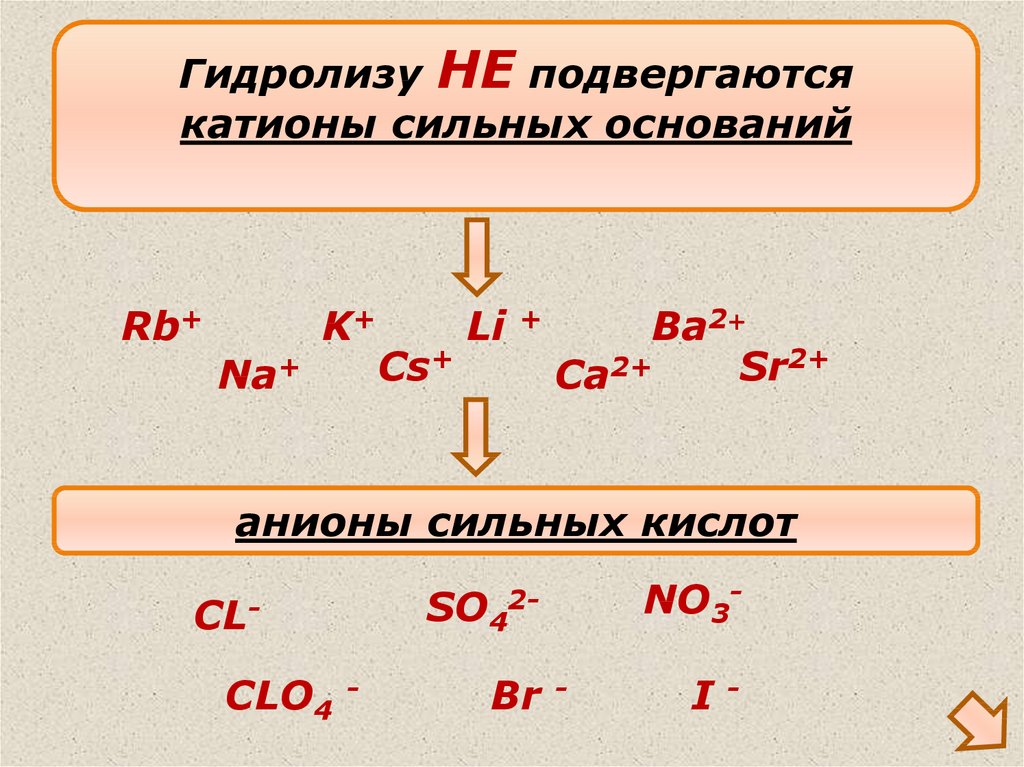
Гидролизу НЕ подвергаютсякатионы сильных оснований
Rb+
Na+
K+
Cs+
Li
+
Ba2+
2+
2+
Sr
Ca
анионы сильных кислот
SO4
CLCLO4
-
NO3-
2-
Br
-
I
-
10.
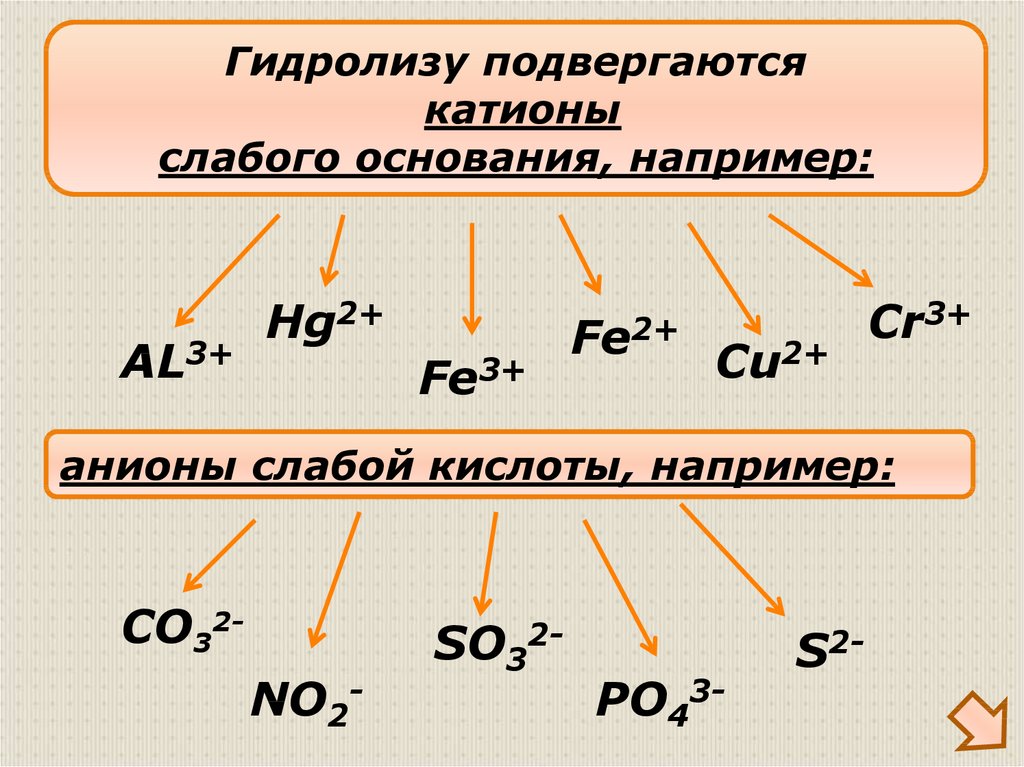
Гидролизу подвергаютсякатионы
слабого основания, например:
AL3+
Hg2+
Fe3+
Fe2+
Cu2+
Cr3+
анионы слабой кислоты, например:
CO32NO2-
SO32-
PO43-
S2-
11. Классификация солей
Задание1.Разделите предложенные формулы
солей на четыре типа, объясните свой выбор:
BaCl2, ZnSO4, CuCl2, Na2SO4, Al(NO3)3,
MnCl2, Cr2(SO4)3, K2SiO3, LiNO3,
Co(NO2)2,MgSO3
12.
Алгоритм составленияуравнений гидролиза
Проверить растворимость соли.
Определить состав соли, т.е. указать, каким
по силе основанием и какой по силе кислотой
образована данная соль
Записать диссоциацию соли и подчеркнуть
ион слабого электролита
Записать уравнение взаимодействия иона
слабого электролита с водой
Определить среду раствора соли
Записать молекулярное уравнение
13.
ПРИМЕРЫС О Л Е Й,
ПОДВЕРГАЮЩИХСЯ
ГИДРОЛИЗУ
14.
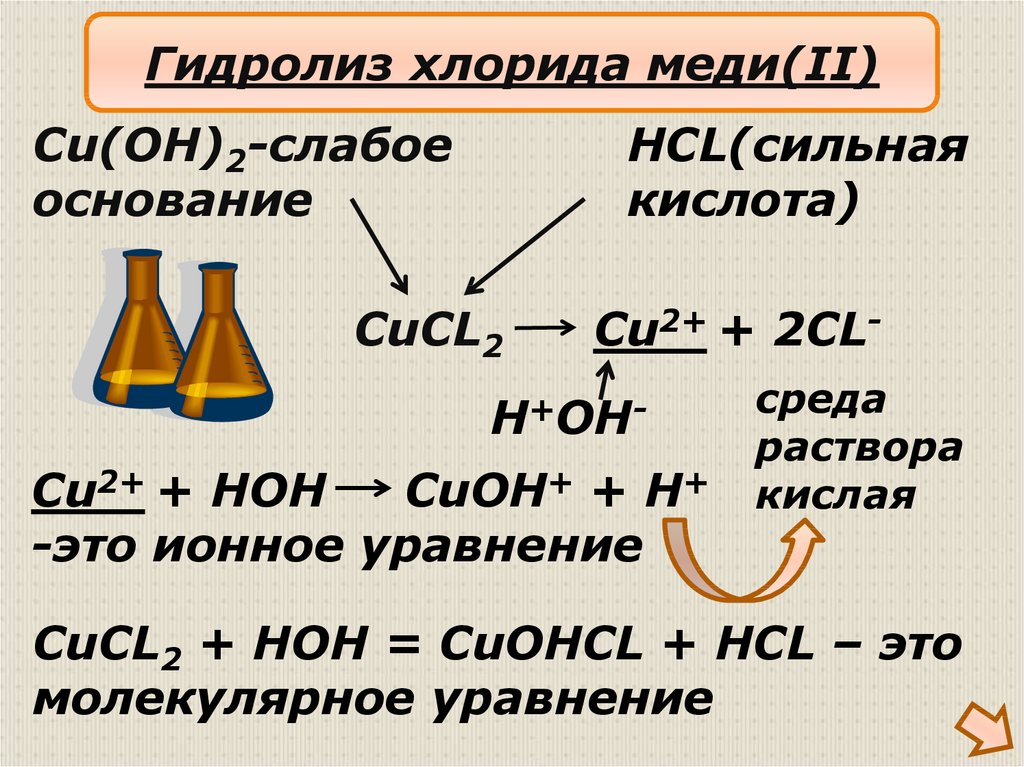
Гидролиз хлорида меди(II)Cu(OH)2-слабое
основание
HCL(сильная
кислота)
CuCL2
Cu2+ + 2CL-
H+OHCu2+ + HOH
CuOH+ + H+
-это ионное уравнение
среда
раствора
кислая
CuCL2 + HOH = CuOHCL + HCL – это
молекулярное уравнение
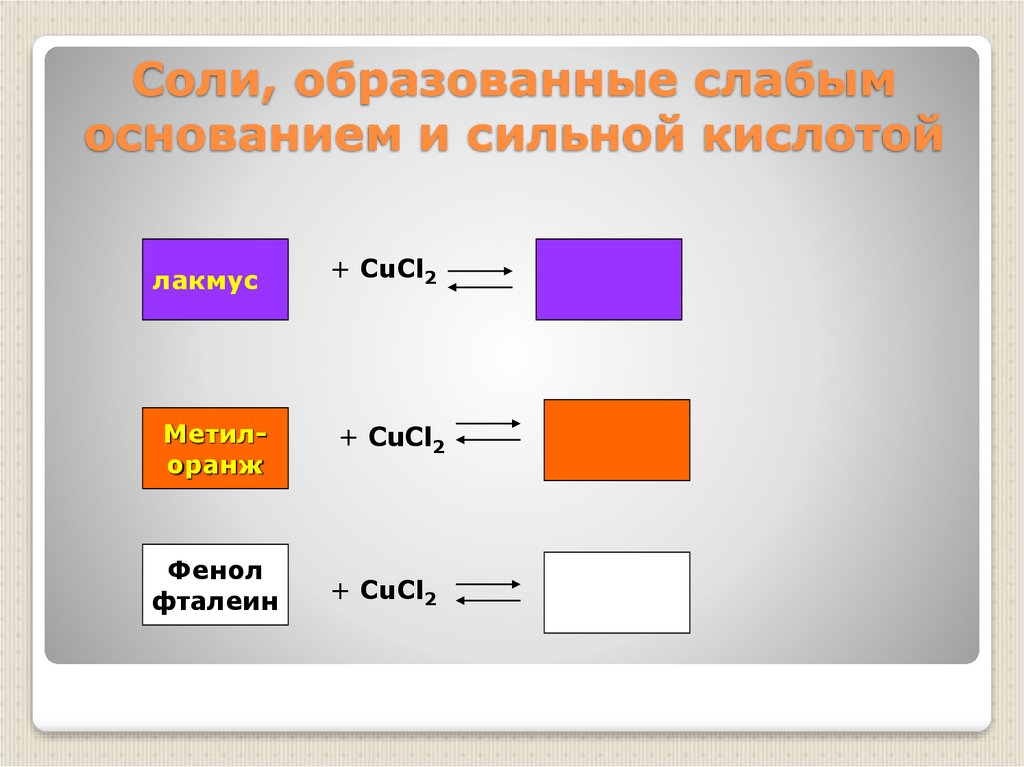
15. Соли, образованные слабым основанием и сильной кислотой
лакмусМетилоранж
Фенол
фталеин
+ CuCl2
+ CuCl2
+ CuCl2
16.
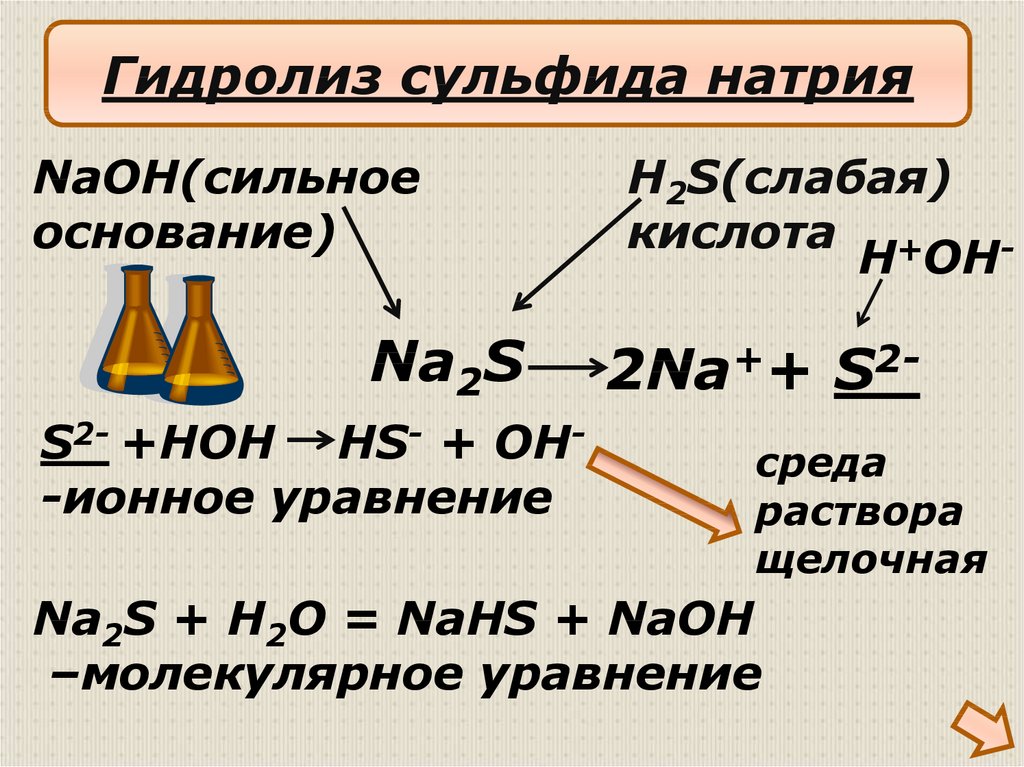
Гидролиз сульфида натрияNaOH(сильное
основание)
Na2S
S2- +HOH HS- + OH-ионное уравнение
H2S(слабая)
кислота +
H OH-
2Na++ S2среда
раствора
щелочная
Na2S + H2O = NaHS + NaOH
–молекулярное уравнение
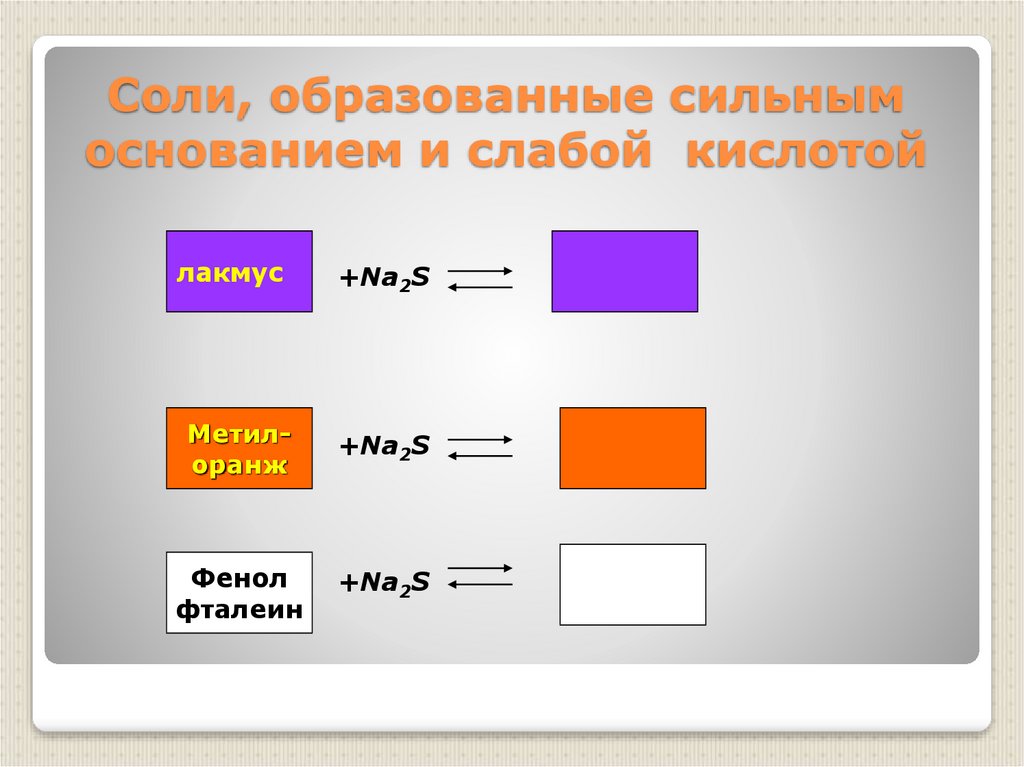
17. Соли, образованные сильным основанием и слабой кислотой
лакмус+Na2S
Метилоранж
+Na2S
Фенол
фталеин
+Na2S
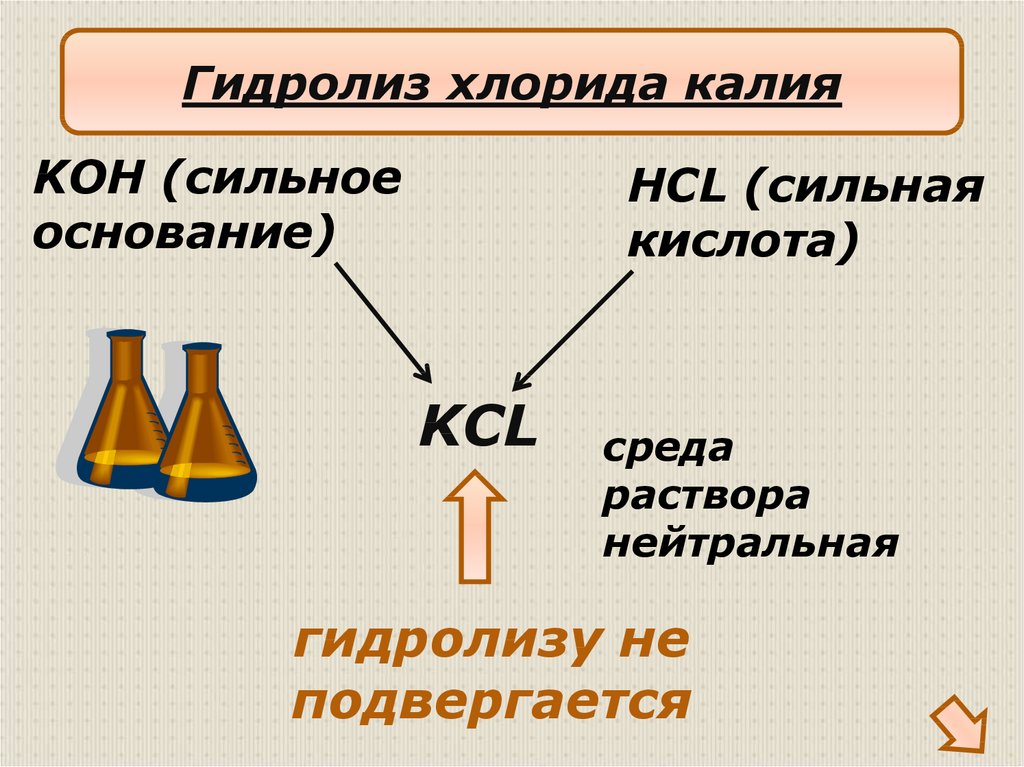
18.
Гидролиз хлорида калияKOH (сильное
основание)
HCL (сильная
кислота)
KCL
среда
раствора
нейтральная
гидролизу не
подвергается
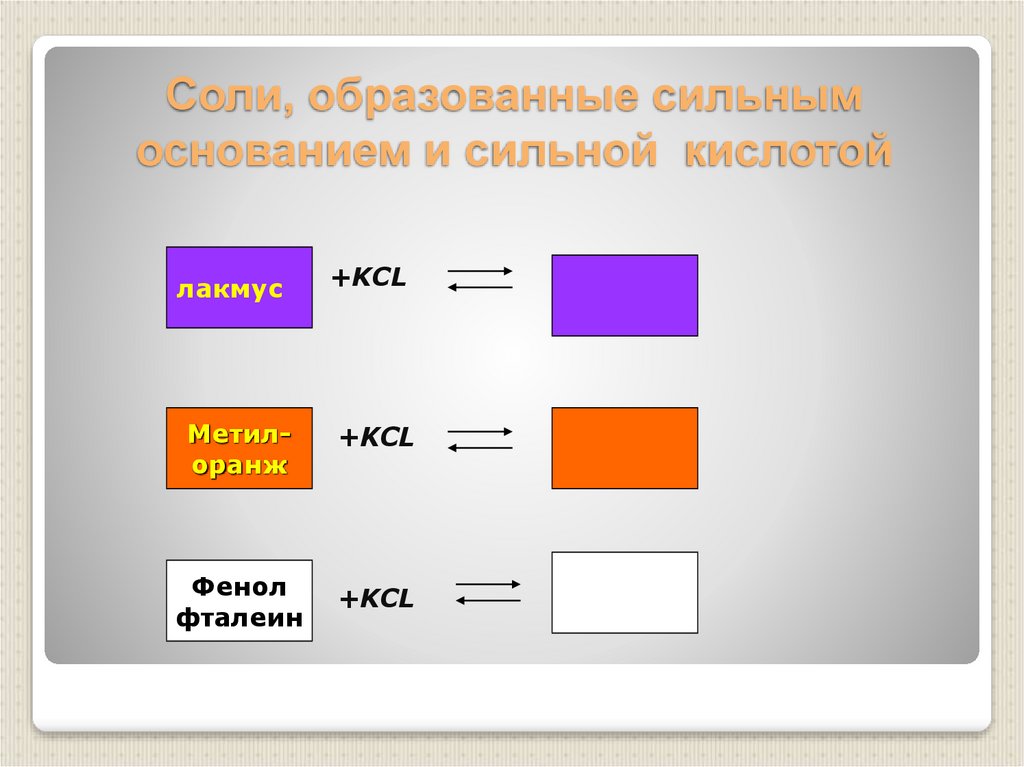
19. Соли, образованные сильным основанием и сильной кислотой
лакмус+KCL
Метилоранж
+KCL
Фенол
фталеин
+KCL
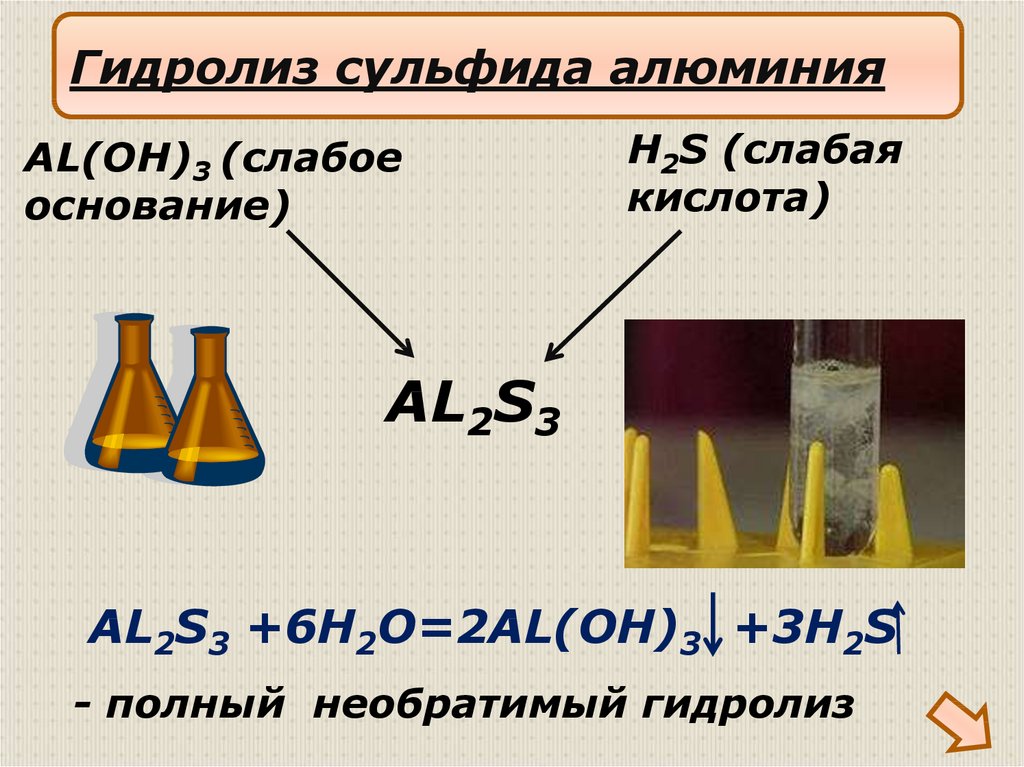
20.
Гидролиз сульфида алюминияAL(OH)3 (слабое
основание)
H2S (слабая
кислота)
AL2S3
AL2S3 +6H2O=2AL(OH)3 +3H2S
- полный необратимый гидролиз
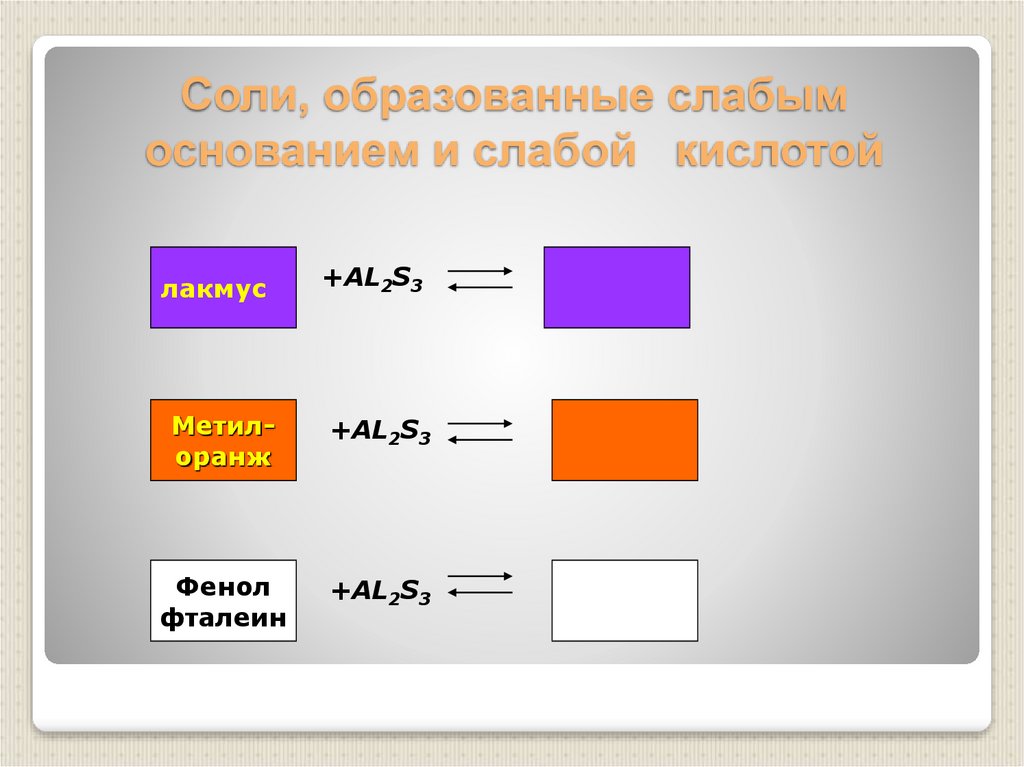
21. Соли, образованные слабым основанием и слабой кислотой
лакмус+AL2S3
Метилоранж
+AL2S3
Фенол
фталеин
+AL2S3
22.
стиркаРоль гидролиза в
повседневной
жизни человека
умывание
с мылом
мытье
посуды
23.
Загрязнения представляют собойсмесь твердых частиц (пыли, сажи,
соли, жировых, а также потовых
пленок,
прилипших кстирки,
поверхности
Для умывания,
мытья
тканей
и других
предметов).
посуды
нужны
синтетические
моющие средства, в основе
Чтобы удалить
загрязнения
которых
содержатся
в
необходимо:
основном соли сильных
• отделить
загрязнение
оснований
и слабыхот
кислот.
очищаемой
поверхности;
При их попадании
в воду идет
• перевести
частицы в
гидролиз грязевые
с созданием
моющий
раствор;
щелочной
среды (ОН-), в
•удержать
в моющем растворе
и
которой их
и удаляется
грязь.
устранить возможность
повторного осаждения на
очищаемую поверхность.
24.
А ТЕПЕРЬ ВОПРОСЫ….25.
Найди верныйответ
Нейтральную среду имеет водный
раствор:
1)нитрита натрия
2)силиката калия
3)хлорида железа (II)
4)нитрата калия
26.
Найди верныйответ
В водном растворе какой соли
фенолфталеин окрашен в малиновый
цвет?
1)CaCl2
2)KNO3
3)FeSO4
4)Na2CO3
27.
Найди верныйответ
Одинаковую реакцию среды имеют
растворы карбоната натрия и
1) нитрата натрия
2) силиката натрия
3) сульфата калия
4) хлорида алюминия
28.
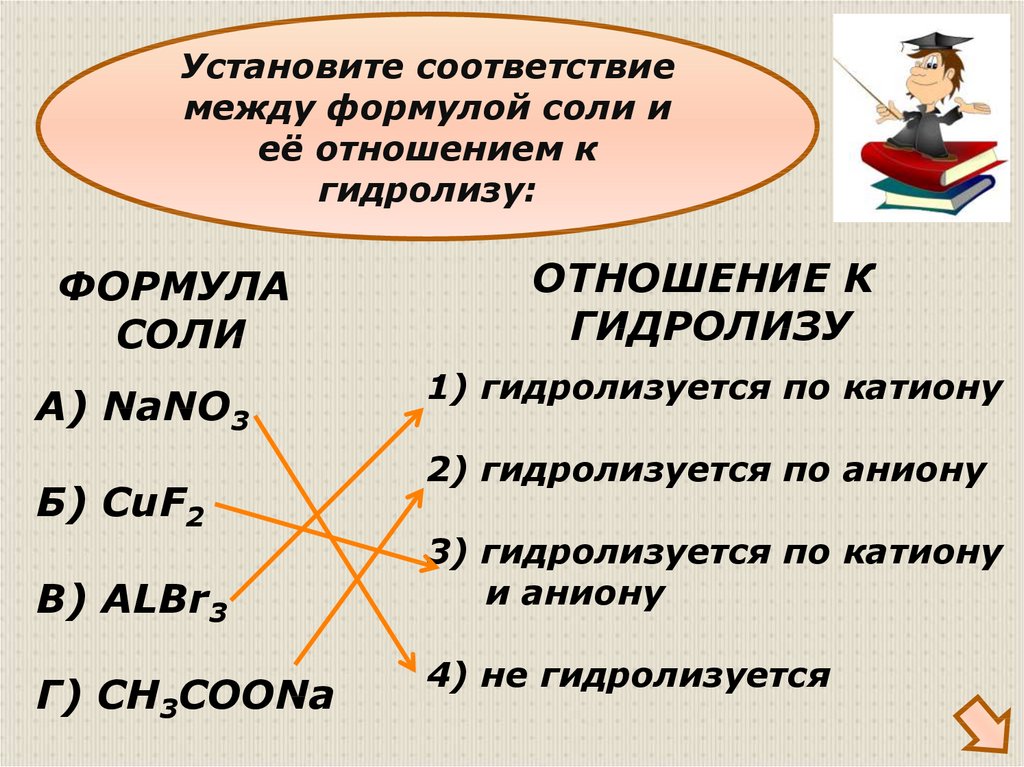
Установите соответствиемежду формулой соли и
её отношением к
гидролизу:
ФОРМУЛА
СОЛИ
А) NaNO3
Б) CuF2
В) ALBr3
Г) CH3COONa
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону
и аниону
4) не гидролизуется
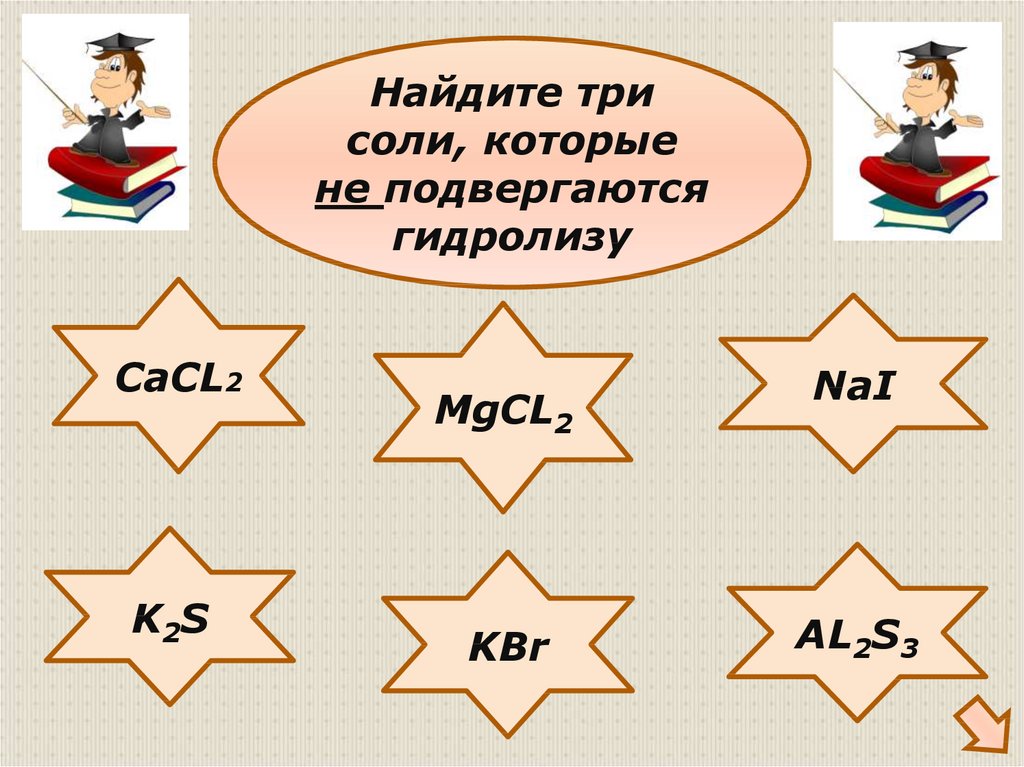
29.
Найдите трисоли, которые
не подвергаются
гидролизу
CaCL2
K 2S
MgCL2
KBr
NaI
AL2S3
30.
Выберите истинные и ложныеутверждения
Гидролиз нитрата
алюминия идет по катиону
да
Гидролиз сульфата бария
идет по аниону
нет
Гидролиз щелочей не
возможен
Оксиды подвергаются
гидролизу
да
нет
Хлорид бария не
подвергается гидролизу
да
В растворе сульфата
меди(ll) кислая среда
да
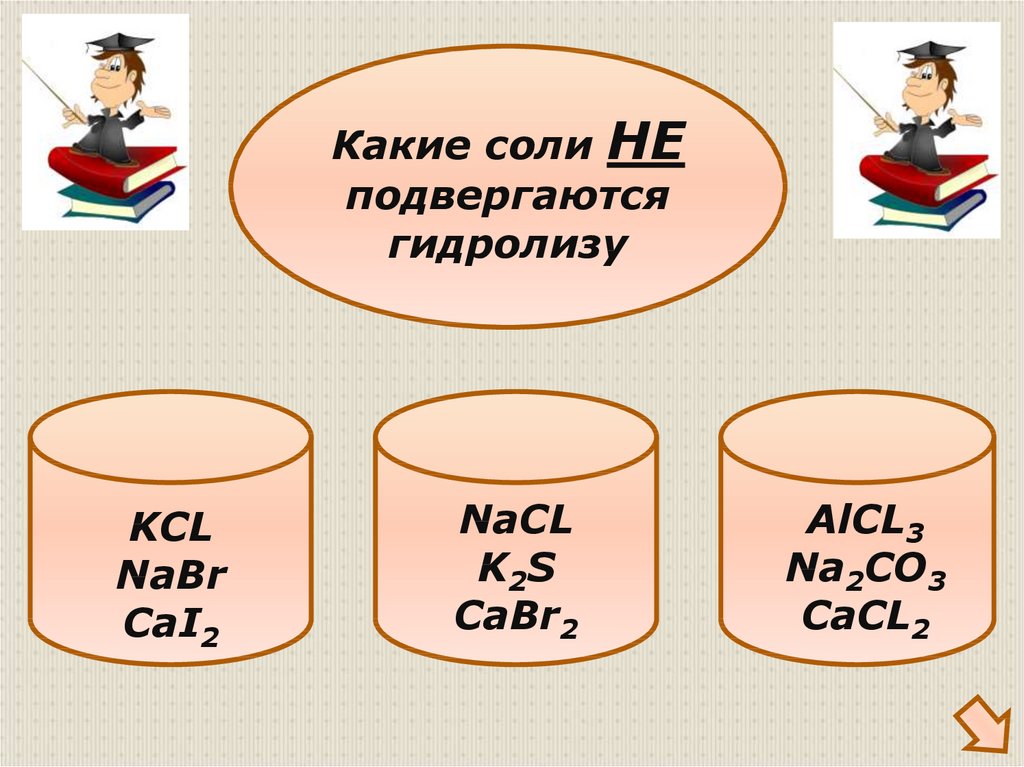
31.
Какие соли НЕподвергаются
гидролизу
KCL
NaBr
CaI2
NaCL
K2S
CaBr2
AlCL3
Na2CO3
CaCL2
32.
Какая сольподвергается
гидролизу
по катиону и по
аниону
ВаCL2
Cr2S3
KNO2
CuI2
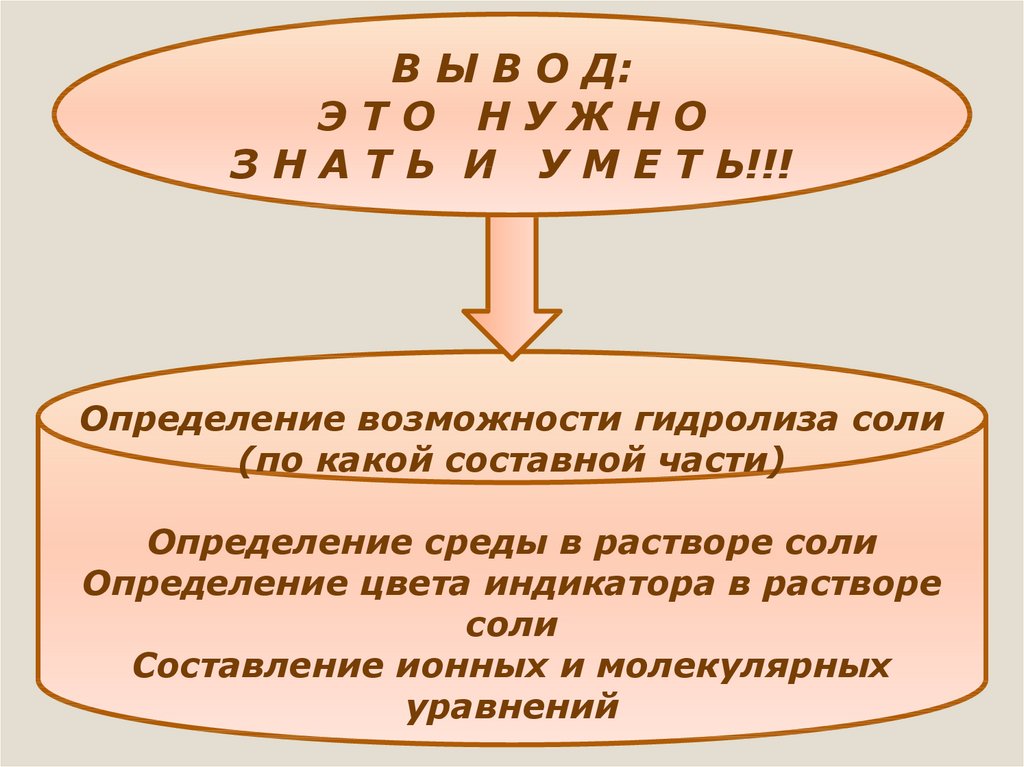
33.
В Ы В О Д:ЭТО НУЖНО
З Н А Т Ь И У М Е Т Ь!!!
Определение возможности гидролиза соли
(по какой составной части)
Определение среды в растворе соли
Определение цвета индикатора в растворе
соли
Составление ионных и молекулярных
уравнений
34.
Домашнее задание§ 1.12
Упр 7 стр 47















 Химия
Химия








