Похожие презентации:
Оксиды
1.
Оксиды- это…1 Выписать формулы
оксидов. Дать им названия.
•BaO , H2SO4, NaCl, P2O5,
HCl
1 Выписать формулы
оксидов. Дать им названия.
•HCN, K2O, NO, AgNO3,
Ba(OH)2
•2 Написать формулы
веществ по их названиям:
•Оксид хлора (I)
•Оксид калия
•Оксид марганца (VII)
•2 Написать формулы
веществ по их названиям:
•Оксид серы (VI)
•Оксид железа (III)
•Оксид водорода
2.
1. Оксиды- это бинарные соединения, в составкоторых обязательно входит кислород в степени
окисления -2.
2. Выписать формулы
оксидов. Дать им названия.
•BaO- оксид бария
•P2O5 – оксид фосфора(V)
2. Выписать формулы
оксидов. Дать им названия.
•K2O- оксид калия
•NO- оксида азота (II)
3. Написать формулы
веществ по их названиям:
•Оксид хлора (I)- Cl2O
•Оксид калия- K2O
3. Написать формулы
веществ по их названиям:
•Оксид серы (VI) SO3
•Оксид водорода H2O
3.
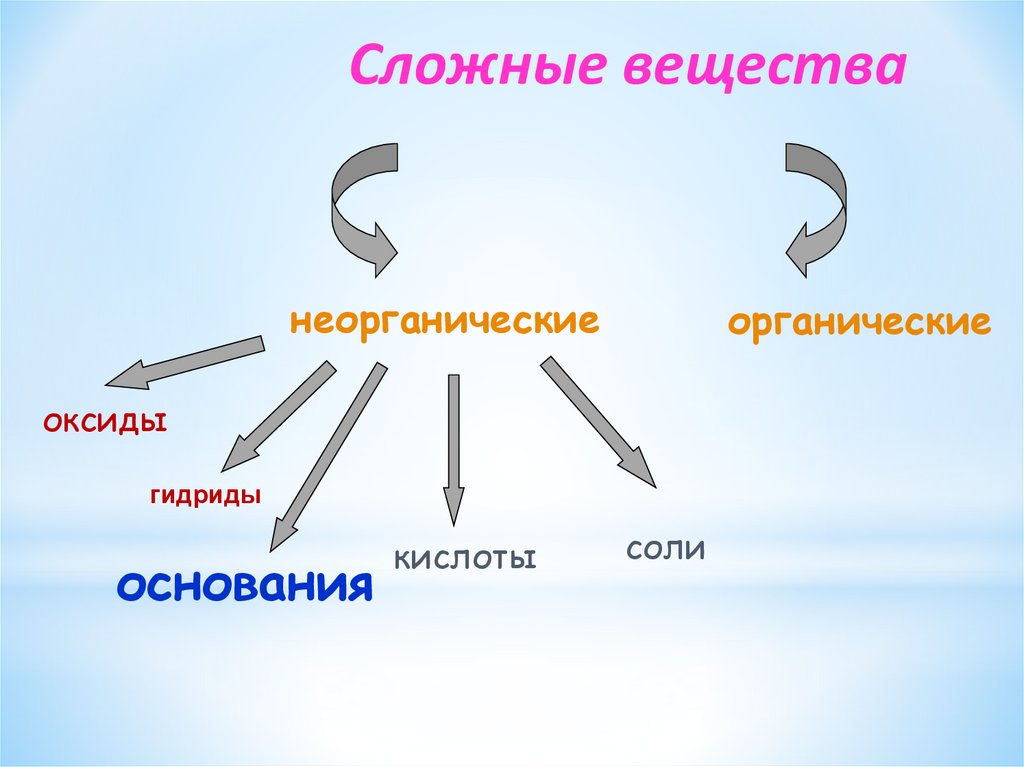
Сложные веществанеорганические
органические
оксиды
гидриды
основания
кислоты
соли
4.
Выбрать формулы веществ, относящихсяк классу оснований, и записать их в
тетрадь.
КОН, CaO, PCl5, Mg(OH)2, LiOH, Cl2,
Fe(OH)3, Na2O, Cl2O7, Ca(OH)2, N2
5.
Тема урокаОСНОВАНИЯ
6.
ЦЕЛИ УРОКА:дать определение основаниям
рассмотреть состав оснований
классифицировать основания
ознакомиться с номенклатурой
оснований
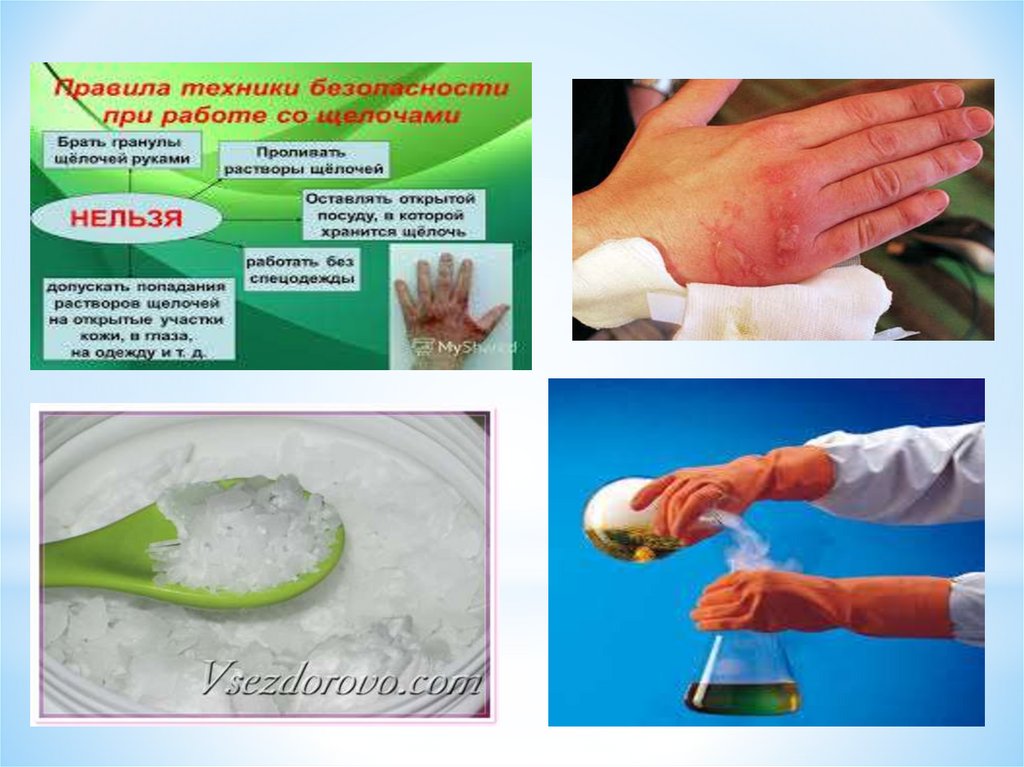
• изучить правила техники
безопасности при работе со
щелочами
7.
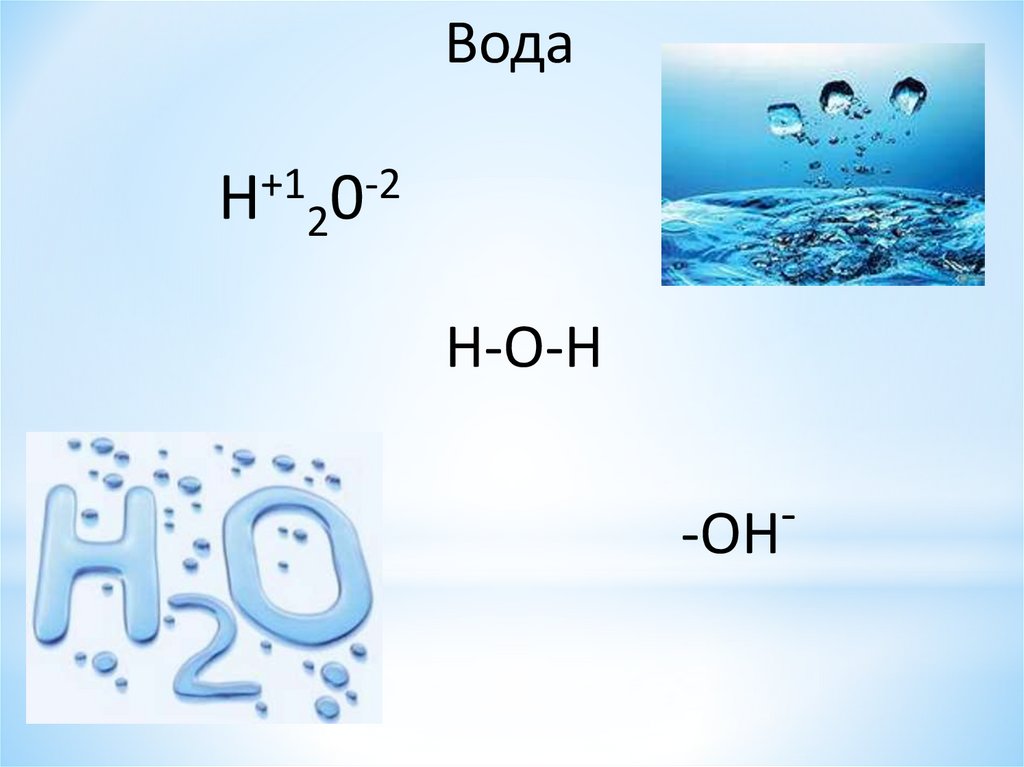
ВодаH+120-2
H-O-H
-OH
8.
Основания- это сложные вещества, состоящие из
атомов металлов и гидроксильных
групп ОН.
Me(OH)n
n = валентность металла
9.
НоменклатураАлгоритм составления названий оснований
•На первое место ставится слово «гидроксид»;
•Затем – наименование металла в родительном падеже.
Ca(ОН) 2 гидроксид кальция
Мg(ОН) 2 гидроксид магния
Если элемент проявляет переменную степень
окисления, её значение указывают скобках римской
после названия элемента.
Fe(ОН) 2 гидроксид железа (II)
Fe(ОН) 3 гидроксид железа (III)
10.
Названия основанийКОН
Mg(OH)2
LiOH
Fe(OH)3
Ca(OH)2
Al(OH)3
гидроксид
гидроксид
гидроксид
гидроксид
гидроксид
гидроксид
калия
магния
лития
железа (III)
кальция
алюминия
11.
Классификация оснований1. По растворимости в воде:
Растворимые
нерастворимые
ЩЕЛОЧИ
ОБРАЗУЮТ:
Металлы I А группы - щелочные
Металлы I I А группы – щелочно-земельные
ОБРАЗУЮТ:
Остальные металлы
12.
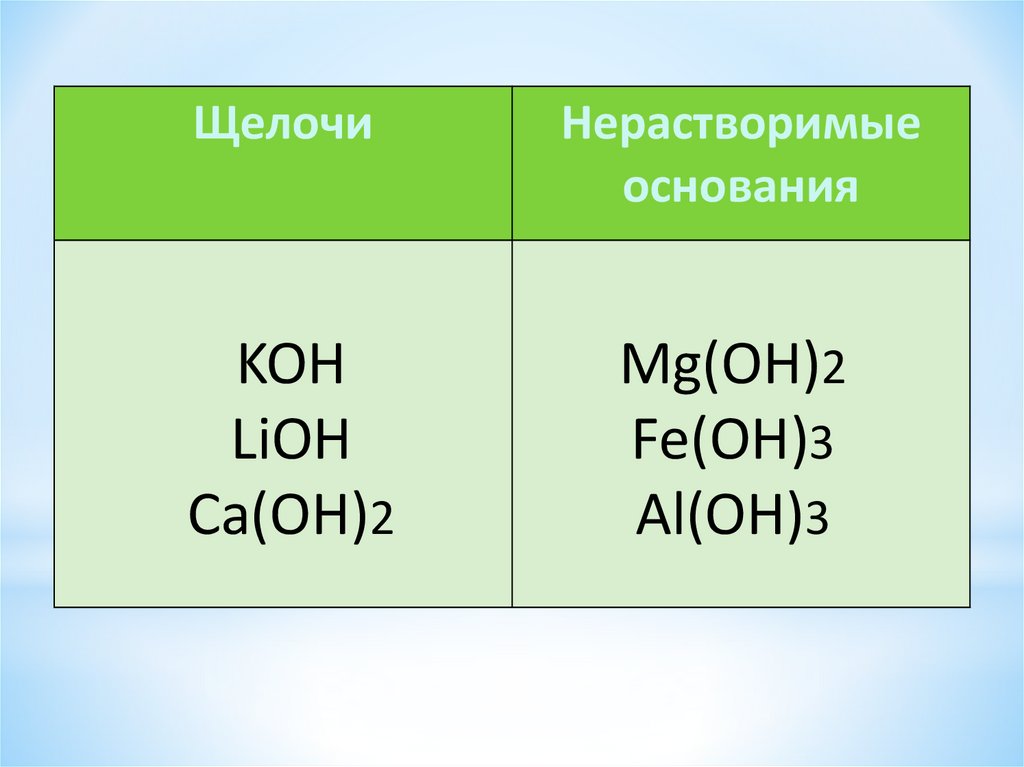
ЩелочиНерастворимые
основания
KOH
LiOH
Ca(OH)2
Mg(OH)2
Fe(OH)3
Al(OH)3
13.
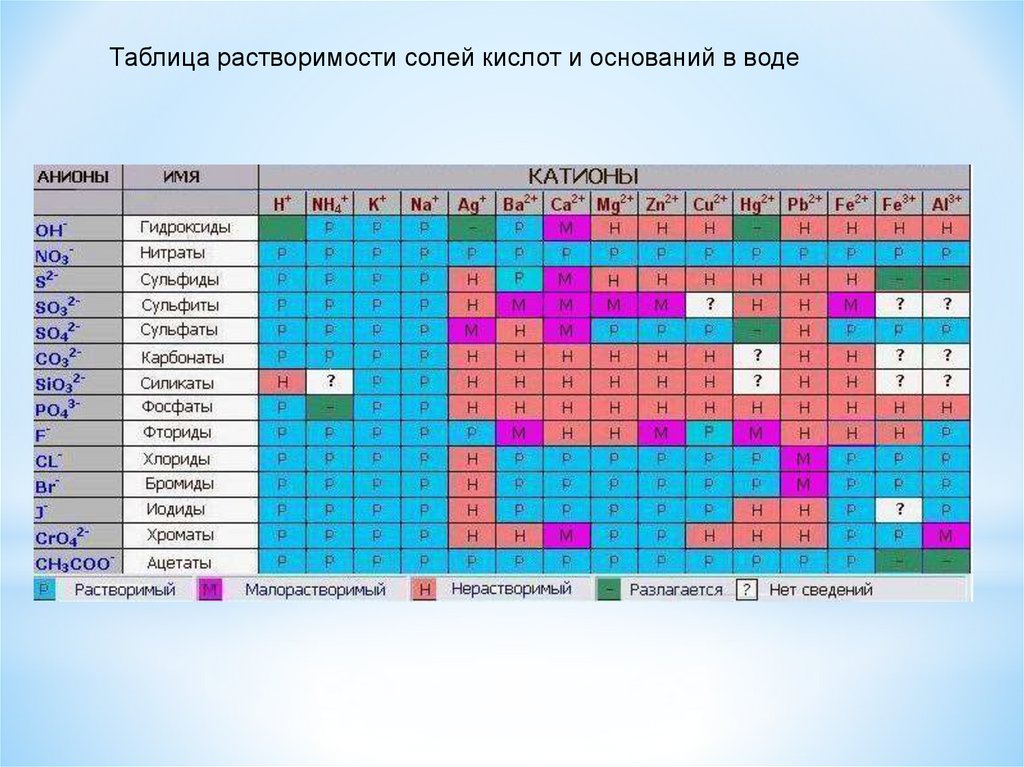
Таблица растворимости солей кислот и оснований в воде14.
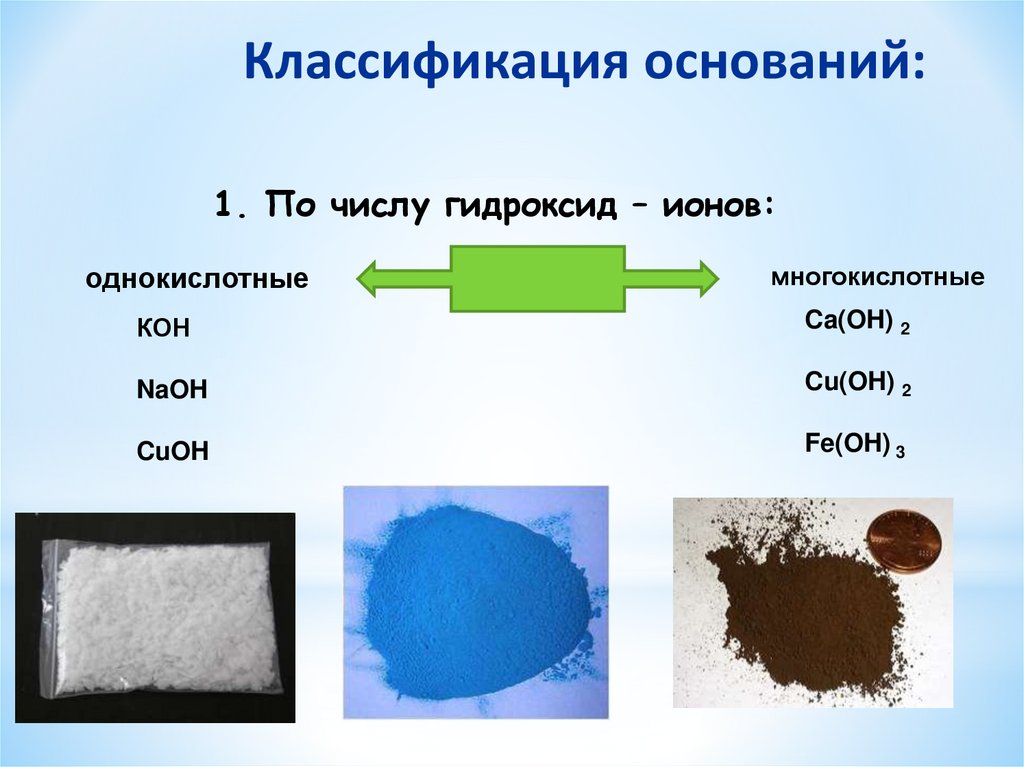
Классификация оснований:1. По числу гидроксид – ионов:
однокислотные
многокислотные
КОН
Ca(OH) 2
NaOH
Cu(OH) 2
CuOH
Fe(OH) 3
15.
Физические свойстваоснований
Ba(OH)2
Ca(OH)2
LiOH
NaOH
Cu(OH)2
Co(OH)2
16.
Получение оснований1. Активный металл + вода =
= щелочь + водород
2. Оксид активного металла +
+ вода = щелочь
1. Соль (в растворе)+ щелочь =
= нерастворимое основание +
+ другая соль
17.
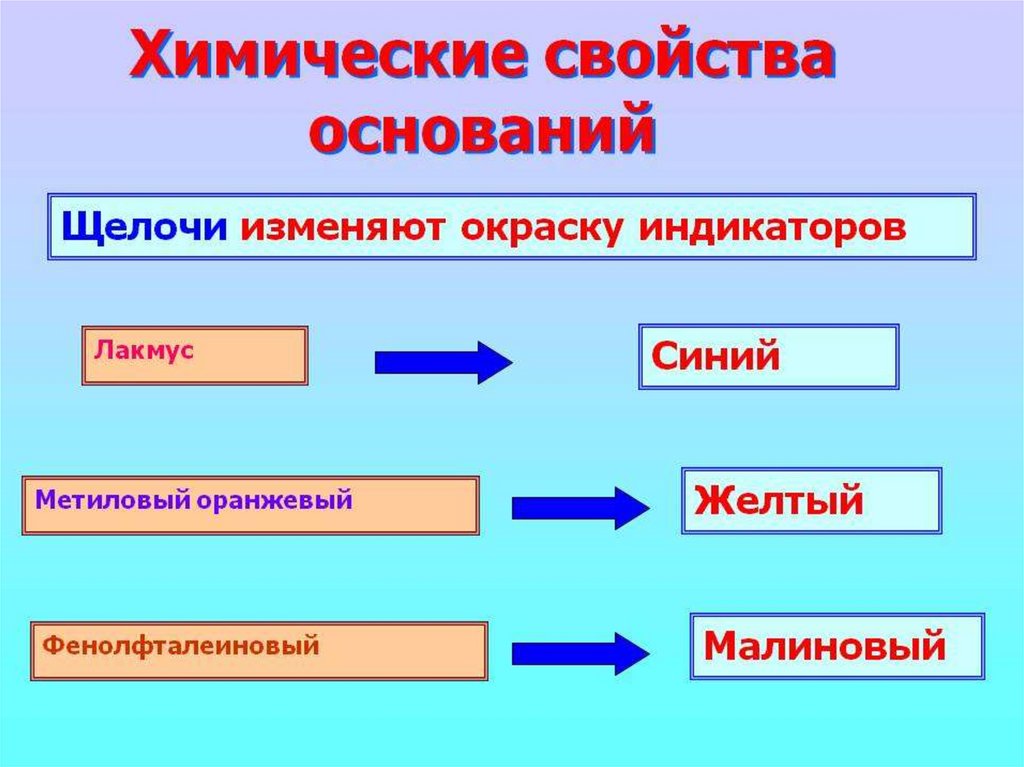
Химические свойства щелочей18.
19.
ПрименениеФормула
основания
NaOH
КОН
Са(ОН)2
Mg(OH)2
Al(OH)3
Применение
20.
ПРОВЕРЬ СЕБЯ1.Формула основания это:
а) NaOH
б) HCL
в) CuCL2 г)
SO3
2. Формула растворимого основания:
а) КOН
б) Сu(ОН)2 в) Аl(ОН)3
3. Степень окисления железа в Fe(OH)3 :
а) -2
б) -1
в) +3
г) +2
4. Формула гидроксида бария:
а) Ва(ОН)2
б) ВаОН
в) Ва(ОН)3
5. Многокислотное основание:
а) КOН
б) NаOН
в) LiОH г) Аl(ОН)3
21.
Домашнее задание§19
Упражнение 1,2,3,4
22.
Источники информации:О.С. Габриелян «Химия» 8 класс, учебник.- М.: Дрофа, 2012
О.С. Габриелян «Программа курса химии для 8-11 классов общеобразовательных
учреждений» М.: Дрофа, 2005
О.С. Габриелян «Настольная книга учителя». Химия. 8 класс.
О.Г. Блохина «Я иду на урок химии». Книга для учителя. М.: Издательство «Первое
сентября», 2001
Р.Г. Иванова «Уроки химии в 8-9 классах». Методическое пособие для учителя. – М.:
Просвещение, 2001.
Приложение к газете «Первое сентября»
М.Ю. Горковенко «Поурочные разработки по химии» 8 класс. «ВАКО» Москва 2004
В.А. Крицман «Книга для чтения по неорганической химии» ч.1 и 2. Москва
«Просвещение» 1984
С.Б. Шустов, Л.В.Шустова «Химия и экология» Нижний Новгород, Нижегородский
гуманитарный центр, 1995
О.С. Габриелян «Химия. Рабочая тетрадь. 8 класс» М.: Дрофа, 2003
Н.П. Гаврусейко «Проверочные работы по неорганической химии» Дидактический
материал. Москва «Просвещение», 1990
О.С. Габриелян, Т.В.Смирнова «Изучаем химию в 8 классе» Москва: «БЛИК и К», 2001
Открытые уроки по химии.VIII – XI классы. – Волгоград. Издательство «Учитель», 2009














 Химия
Химия