Похожие презентации:
Окислительно-восстановительные реакции
1.
2.
Процессы обмена веществ, протекающие вживом организме, гниение и брожение,
фотосинтез.
гниение
брожение
фотосинтез
3.
Окислительно-восстановительные процессысопровождают круговороты веществ в природе.
4.
Сгорание топлива, в процессахкоррозии металлов, при электролизе и
выплавке металлов.
5.
Окислительно-восстановительные реакции лежат в основепреобразования энергии взаимодействующих химических
веществ в электрическую энергию в гальванических и
топливных элементах.
Гальванические элементы и батареи,
составленные из них.
Топливный элемент электрохимическое
устройство.
6.
Задание: определить степеньокисления элементов в соединениях.
H2SO4, Н2, H2SO3, Ва,
KMnO4, AI2(SO4)3,
HNO3, Ba(NO3)2, NH3,
(HN4)2SO4 .
7.
Задание: определите тип данныхреакций.
Ca Cl2 + AgNO3 = AgCl + Ca(NO3)2
CaBr2 + Cl2 = CaCl2 + Br2
Ca + O2 = CaO
CaO + P2O5 = Ca3(PO4)2
C + O2 = CO2
CaCO3 = CaO + CO2
KMnO4 = K2MnO4 + MnO2 + O2
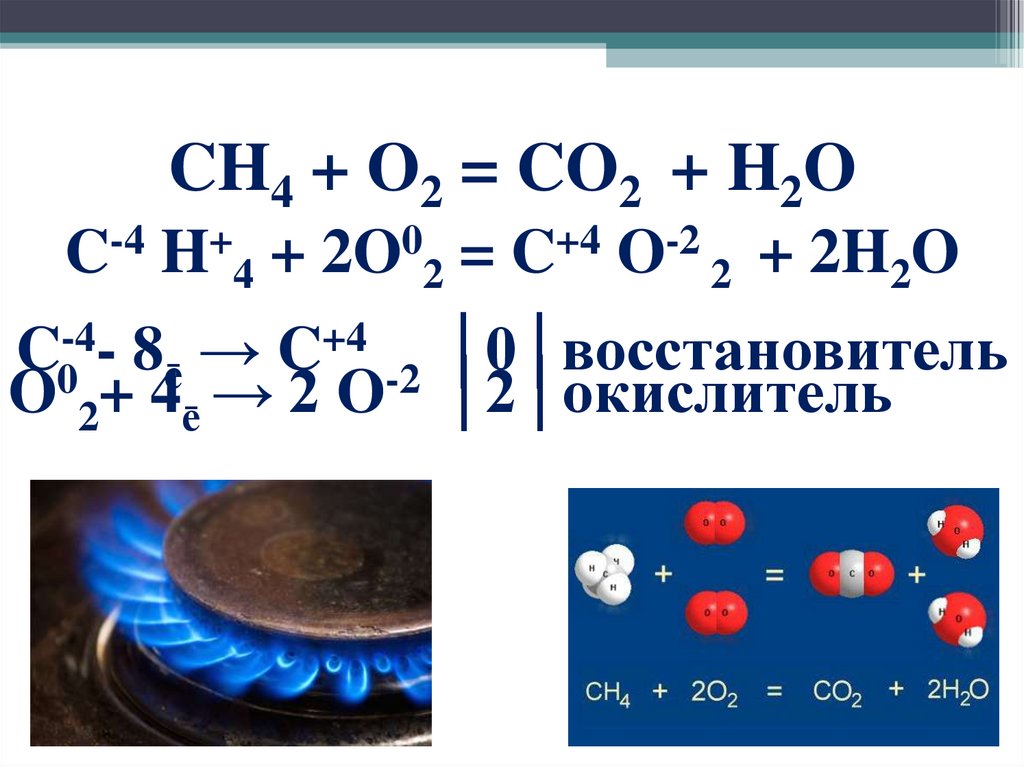
CH4 + O2 = CO2 + H2O
8.
CH4 + O2 = CO2 + H2O-4
C
+
H4
+
0
2O
-4
+4
C0 - 8ē → C -2
O 2+ 4ē → 2 O
2
=
+4
C
-2
O
2
+ 2H2O
│0│восстановитель
│2│окислитель
9.
ОВР- это такие реакции,при которых происходит
изменение степеней
окисления атомов
химических элементов или
ионов, образующих
реагирующие вещества.
10.
переход электронов отодних атомов, молекул
или ионов к другим.
11.
ОКИСЛЕНИЕ – ОТДАЧАЭЛЕКТРОНОВ
(повышение с.о.)
ВОССТАНОВЛЕНИЕВЗЯТИЕ ЭЛЕКТРОНОВ
(понижение с.о.)
12.
Восстановители (отдающиеэлектроны): металлы, водород,
уголь, СO,сероводород, аммиак.
Окислители(принимающие
электроны): O2 ,галогены, азотная
и серная кислоты,KMnO4 , K2Cr2O7 .
13.
Задание: выписать ОВР, расставитькоэффициенты с помощью электронного
баланса.
Ca Cl2 + AgNO3 = AgCl + Ca(NO3)2
CaBr2 + Cl2 = CaCl2 + Br2
Ca + O2 = CaO
CaO + P2O5 = Ca3(PO4)2
C + O2 = CO2
CaCO3 = CaO + CO2
KMnO4 = K2MnO4 + MnO2 + O2
14.
Лабораторныеопыты.
Ход
Наблюдения, уравнения
действий.
реакций.
15.
Опыт №1КУСОЧЕК
ЦИНКА
ОПУСТИТЕ
В ПРОБИРКУ С
РАСТВОРОМ
СОЛЯНОЙ
КИСЛОТЫ
16.
Опыт №2ЖЕЛЕЗНЫЙ ГВОЗДЬ
ОПУСТИТЕ В РАСТВОР
СУЛЬФАТА МЕДИ(II)
17.
Выводы:1.ОВР чрезвычайно распространены.
1.Суть ОВР – переход электронов от одних
атомов, молекул, ионов к другим.
3.ОВР – единство двух противоположных
процессов окисления и восстановления.
18.
Домашнее задание:1. Составить кластер по теме.
2. Подготовить сообщение о
значении ОВР в природе и для
человека.

















 Химия
Химия








