Похожие презентации:
Дикарбоновые кислоты
1.
Лекция 102.2.2 Дикарбоновые кислоты
Дикарбоновые
кислоты
(или
двухосновные карбоновые кислоты) —
это карбоновые
кислоты, содержащие
две карбоксильные группы —COOH, с общей
формулой HOOC—R—COOH, где R — любой
двухвалентный органический радикал.
2.
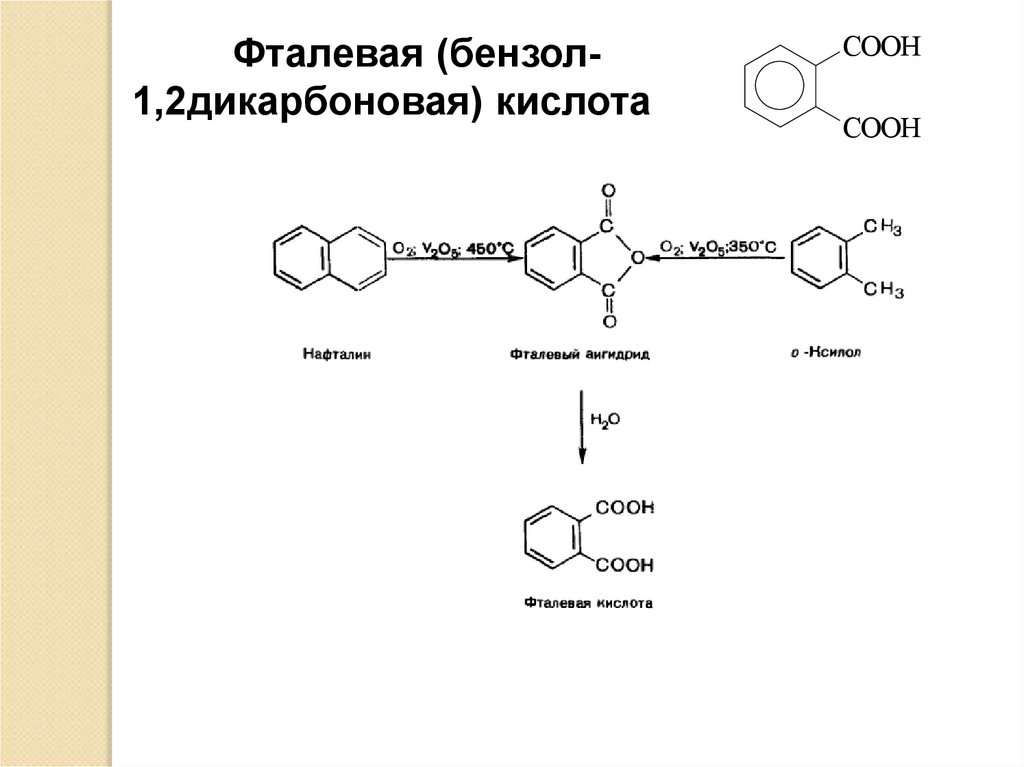
Фталевая (бензол1,2дикарбоновая) кислотаCOOH
COOH
3.
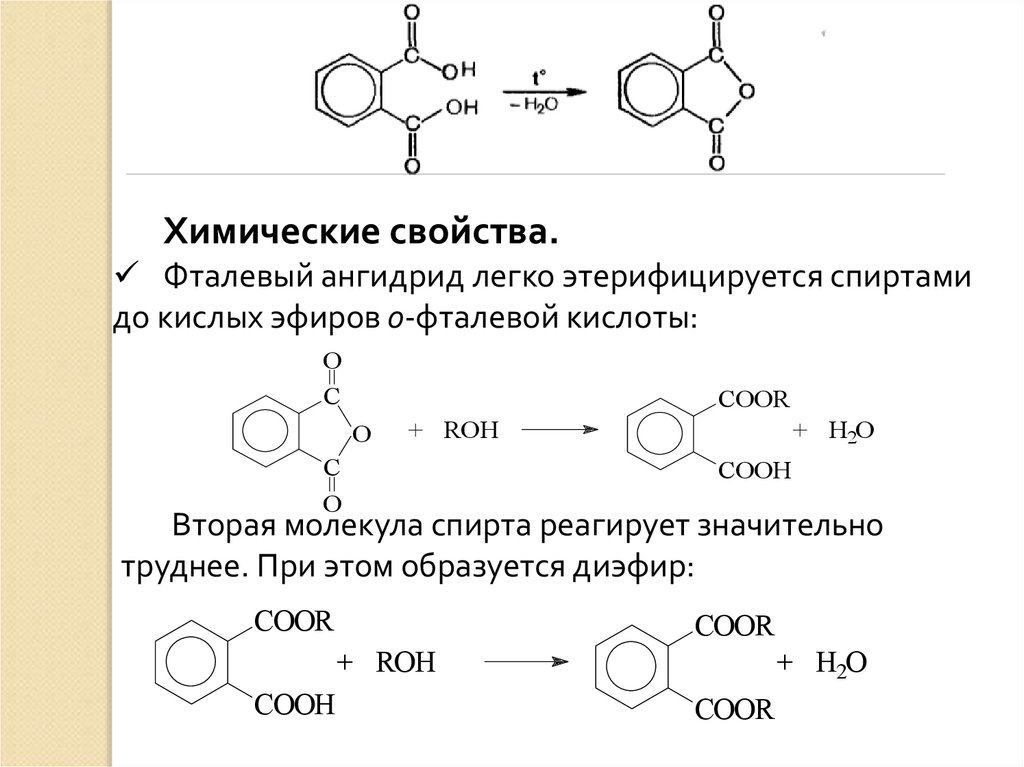
Химические свойства.Фталевый ангидрид легко этерифицируется спиртами
до кислых эфиров о-фталевой кислоты:
O
C
COOR
O
+ ROH
C
O
+ H2O
COOH
Вторая молекула спирта реагирует значительно
труднее. При этом образуется диэфир:
COOR
COOR
+ ROH
COOH
+ H2O
COOR
4.
При декарбоксилировании фталевого ангидрида вприсутствии воды образуется бензойная кислота:
COOH
COOH
+ CO2
(24)
COOH
Весьма важны реакции фталевого ангидрида. с
фенолами, продукты которых являются красителями
фталеинового ряда
5.
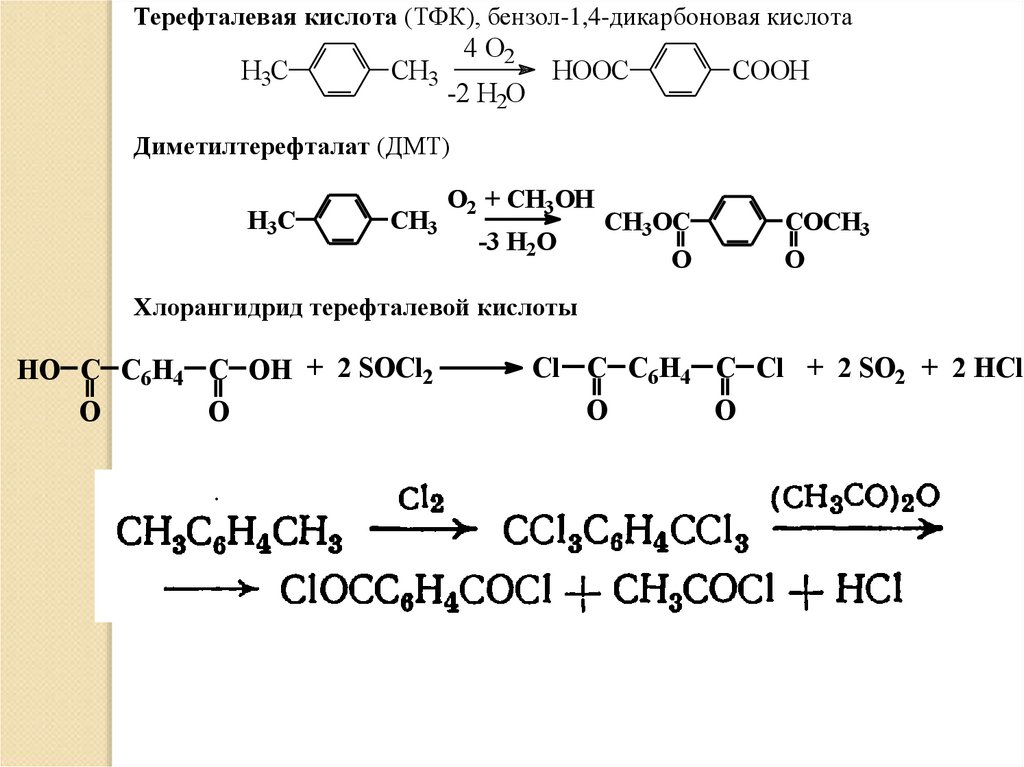
Терефталевая кислота (ТФК), бензол-1,4-дикарбоновая кислотаH3C
СH3
4 O2
-2 H2O
HOOC
СOOH
Диметилтерефталат (ДМТ)
H3C
СH3
O2 + CH3OH
-3 H2O
CH3OC
O
СOCH3
O
Хлорангидрид терефталевой кислоты
HO C C6H4 C OH + 2 SOCl2
O
O
Cl C C6H4 C Cl + 2 SO2 + 2 HCl
O
O
6.
1 стадия. Получение дигликолевого эфира терефталевой кислотыдигликольтерефтала HOOCСOOH + 2 HO CH2 CH2 OH
- 2 H2O
HO CH2 CH2 O C
O
C O CH2 CH2 OH
O
2 стадия. Поликонденсация дигликольтерефталата и его низших линейных
олигомеров
n HO CH2 CH2 O C
C O CH2 CH2 OH
O
HO CH2 CH2 O C
O
ПЭТФ
O
C O CH2 CH2 OH + n-1 HOCH2CH2OH
n
O
n = 95 … 110 для традиционных текстильных областей применения;
n =130 и выше для бутылочного полимера и некоторых технических нитей



 Химия
Химия








