Похожие презентации:
Дикарбоновые кислоты
1.
Дикарбоновые кислотыНоменклатура
Алифатические дикарбоновые кислоты обозначают сочетанием -диовая кислота
O
HO
HO
C C
O
C CH2 C
OH
O
этандиовая
кислота
(щавелевая
кислота)
OH
O
пропандиовая
кислота
(малоновая
кислота)
HO
O
C (CH2)2 C
OH
O
бутандиовая
кислота
(янтарная
кислота)
Ароматические дикарбоновые кислоты называют фталевые кислоты
O
C
OH
O
C
OH
O
C
C
HO
C
O
терефталевая
кислота
O
OH
изофталевая
кислота
C
OH
O
OH
фталевая
кислота
1
2.
Способы полученияОбщие способы получения: окисление диолов, диальдегидов; гидролиз
динитрилов; окислительное расщепление кетонов.
Получение малоновой кислоты из уксусной
O
H3C C
Cl2
OH
O
Cl CH2 C
+
N C CH2 C
H 3O
+
O Na
t OC
O
HO
Cl CH2 C
NaCN
+
O Na
Na-хлорацетат
OH
хлоруксусная
кислота
O
O
NaOH, H2O
O
C CH2 C
OH
малоновая
кислота
Окислительное расщепление кетонов.
O
HO
HNO3, 50%-я
t OC
O
C (CH2)3 C
O
OH
глутаровая к-та
O
HNO3, 50%-я HO
t OC
O
C (CH2)4 C
O
OH
адипиновая к-та
2
3.
Получение щавелевой кислоты пиролизом формиата натрияO
H C
400 OC
O
+
C
O Na
C
+
O Na
формиат Na
H2SO4
+
O
O Na
ди-Na-оксалат
O
O
C
C
OH
+
Na2SO4
OH
Получение малеиновой и янтарной кислот из бензола
O
COOH
H
COOH
C
O
H
C
O2 / V2O5
H
,
Pt
H 2O
2
2
C
H2C
t OC
450 OC
H
O
COOH
COOH
малеиновый малеиновая
янтарная
кислота
ангидрид
кислота
Получение ароматических дикарбоновых кислот
COOH
CH3
CH3
[O]
COOH
о-ксилол → фталевая кислота
м-ксилол → изофталевая кислота
п-ксилол → терефталевая кислота
3
4.
pKa некоторых дикарбоновых алифатических кислот HOOC-(CH2)n-COOHn
Кислота
HO
pKa,1
pKa,2
pKa,2pKa,1
0
Щавелевая
1,27
4,27
3,00
1
Малоновая
2,86
5,70
2,84
2
Янтарная
4,21
5,64
1,43
O
C C
O
HO
H 2O
H2C
Глутаровая
4,34
5,27
0,93
C
4
Адипиновая
4,41
5,28
0,87
O
1/2
1/2
O
O
O
O
OH H2O
+
3
O1/2 H O
2
C C
+
H
O
1/2
3
O1/2
O
O1/2
O
OH H3O
дестабилизация
стабилизация (-I)
+
O
C
C C
OH H O
3
CO
H 2O
C O
электростатическое отталкивание
(дестабилизация)
HC
+ 2
H
H
O
3
C O
C O
O
O
H2C
pKa некоторых ненасыщенных дикарбоновых кислот
Кислота
pKa,1
Малеиновая
1,92
pKa,2
6,23
pKa,2pKa,1
4,31
Фумаровая
3,02
4,32
1,30
Итаконовая
3,82
5,66
1,82
Ацетиленкарбоновая
1,73
4,40
2,67
H
COOH
C C
фумаровая
HOOC
H
O
H
C
C
COOH
H
COOH
малеиновая
кислота
COOH
H2C C CH2 COOH
итаконовая
H
C
C
C
H
C
O
O
водородная
связь
H+
H
+
O
HOOC C C COOH
ацетилендикарбоновая
4
5.
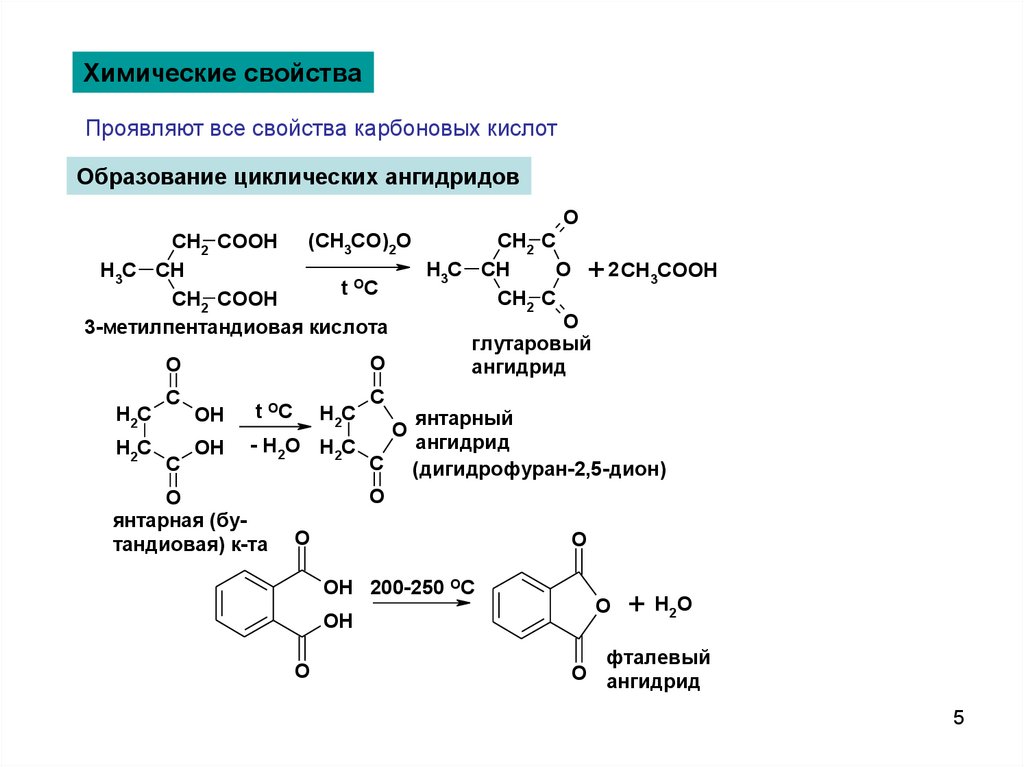
Химические свойстваПроявляют все свойства карбоновых кислот
Образование циклических ангидридов
O
CH2 C
(CH3CO)2O
CH2 COOH
O + 2 CH3COOH
H3C CH
H3C CH
t OC
CH2 C
CH2 COOH
O
3-метилпентандиовая кислота
глутаровый
O
O
ангидрид
C
C
t OC H2C
H2C
OH
янтарный
O
ангидрид
H2C
OH - H2O H2C
C (дигидрофуран-2,5-дион)
C
O
O
янтарная (буO
тандиовая) к-та O
OH 200-250 OC
OH
O
O
+
H 2O
фталевый
O ангидрид
5
6.
Образование циклических имидовO
H2C
H2C
C
O
2 NH3
C
янтарный
ангидрид O
t OC
H2C
H2C
O
O
O
C
NH
+ NH4OH
C
O
2 NH3
NH
t OC
фталевый
ангидрид O
O
+
NH4OH
O
Образование амидов и сложных эфиров
O
O
H2C C NH2
H2C C
NH3
H2C
H2C
O
H2C C OH
H2C C
O
O
глутаровый
моноамид глуангидрид
таровой кислоты
O
O
O
C2H5OH , H
t OC
t OC
O C2H5
OH
O
моноэтилфталат
O
O
2 C2H5OH , H
+
+
O C2H5
O CH
2 5
O
диэтилфталат
6
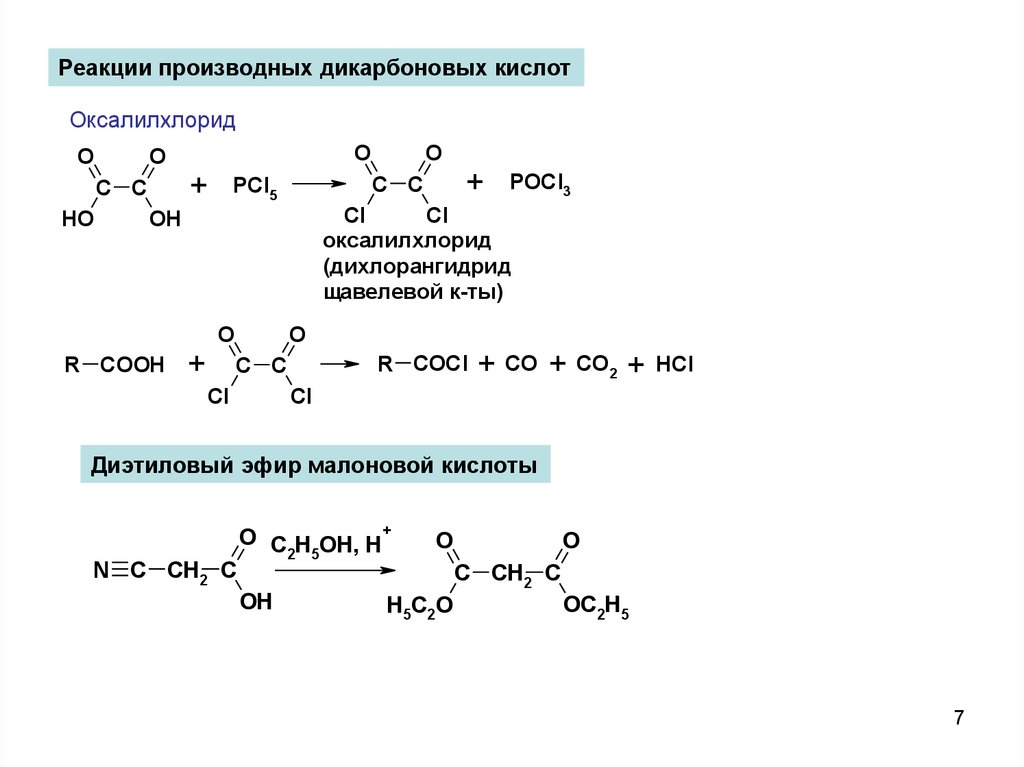
7.
Реакции производных дикарбоновых кислотОксалилхлорид
O
O
C C
HO
O
+
C C
PCl5
R COOH
+
+
O
R COCl
C C
Cl
POCl3
Cl
Cl
оксалилхлорид
(дихлорангидрид
щавелевой к-ты)
OH
O
O
+ CO + CO2 +
HCl
Cl
Диэтиловый эфир малоновой кислоты
N C CH2 C
O C H OH, H+
2 5
OH
O
O
H5C2O
C CH2 C
OC2H5
7
8.
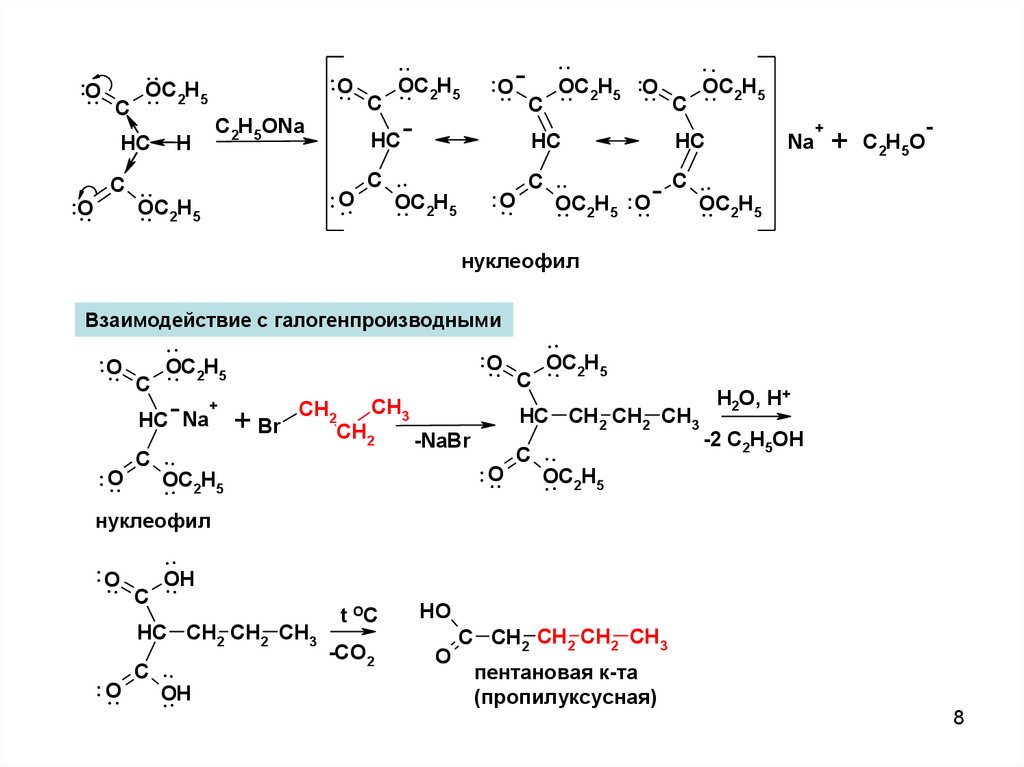
..O..
C
..
OC
.. 2H5
HC
..O
..
H
.. O
..
C2H5ONa
C ..
OC
.. 2H5
C
..
OC
.. 2H5
HC
.. O
..
.. O
..
..
..
.
OC
OC
..
.. 2H5
.. 2H5 .O
C
C
HC
HC
C ..
OC
.. 2H5
.
.. O C .
OC
..
.. 2H5
.. O
..
+
Na
+
C2H5O
C ..
OC
.. 2H5
нуклеофил
Взаимодействие с галогенпроизводными
..
..
.. O
.. O
OC
OC
..
.. 2H5
..
.. 2H5
C
C
H2O, H+
+
CH
CH
3
2
HC CH2 CH2 CH3
HC Na + Br
CH2
-2 C2H5OH
-NaBr
C ..
C ..
.. O
.. O
OC
OC
H
..
. . 2H5
..
2
5
.
.
нуклеофил
..
O
..
C
..
OH
..
HC CH2 CH2 CH3
..
.. O C
OH
..
..
t OC
HO
-CO2
O
C CH2 CH2 CH2 CH3
пентановая к-та
(пропилуксусная)
8
9.
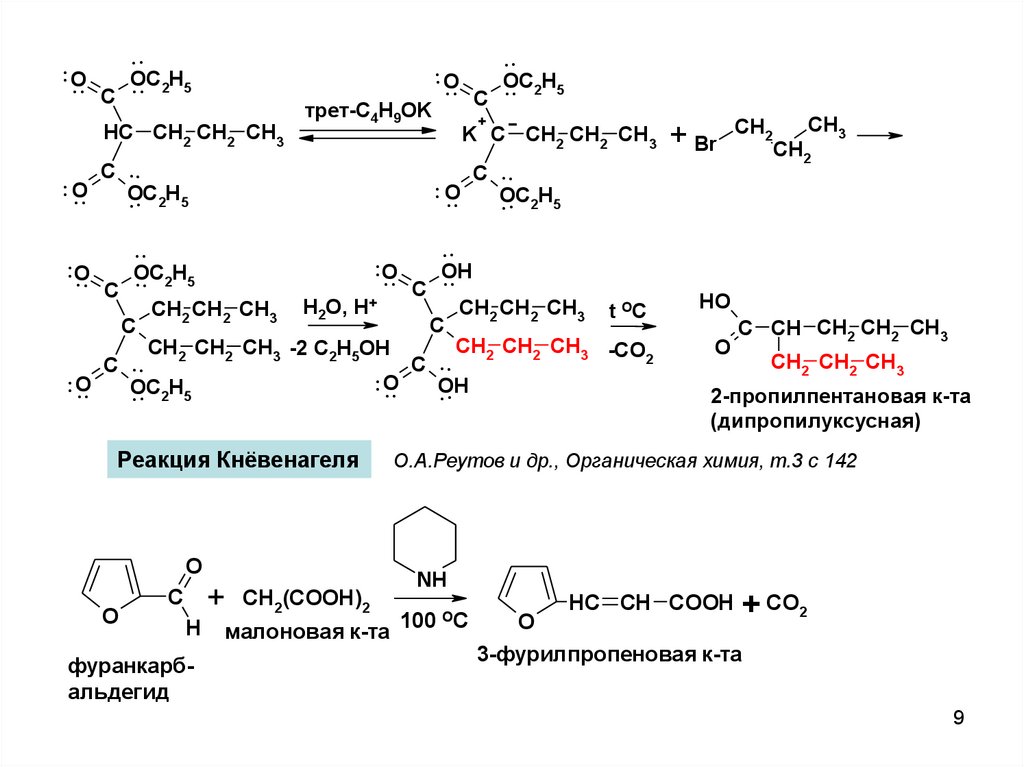
....
OC
O
..
.. 2H5
C
HC CH2 CH2 CH3
трет-C4H9OK
.
.. O C .
OC
..
. . 2H5
..
O
..
C
..
OC
. . 2H5
+
K C CH2 CH2 CH3
.
.. O C .
OC
..
. . 2H5
..
..
..
OH
O
OC
..
..
. . 2H5
C
C
CH2 CH2 CH3 t OC
CH2 CH2 CH3 H2O, H+
C
C
CH2 CH2 CH3 -CO
CH2 CH2 CH3 -2 C2H5OH
2
C ..
C ..
.. O
.. O
OH
OC
..
..
..
. . 2H5
..
O
..
Реакция Кнёвенагеля
O
O
+
C
H
фуранкарбальдегид
+ Br
CH2(COOH)2
малоновая к-та
CH2
CH3
CH2
HO
O
C CH CH2 CH2 CH3
CH2 CH2 CH3
2-пропилпентановая к-та
(дипропилуксусная)
О.А.Реутов и др., Органическая химия, т.3 с 142
NH
100 OC
HC CH COOH + CO2
O
3-фурилпропеновая к-та
9
10.
Реакция МихаэляПрисоединение малонат-иона к непредельным карбонильным соединеничм
O
O
O
C O CH
C2H5ONa
2 5
H3C C CH2 CH2 CH
H3C C HC CH2 + CH2(COOC2H5)2
C2H5OH
C O C2H5
3-бутен-2-он
диэтил-2-(3'-оксоO
бутил)малонат
Конденсация Дикмана (внутримолекулярная конденсация Кляйзена)
-
H O
C2H5O
H2C
H2C
O
CH C OC H
2 5
CH2C
H2C
OC2H5 -C2H5OH H2C
O
O
O
C
CH2
OC H
2 5
C
OC2H5
O
O
OC2H5
OC2H5
CH
-C H O
2
5
OC2H5
Этил-2-оксо-1-циклоO пентанкарбоксилат
10
11.
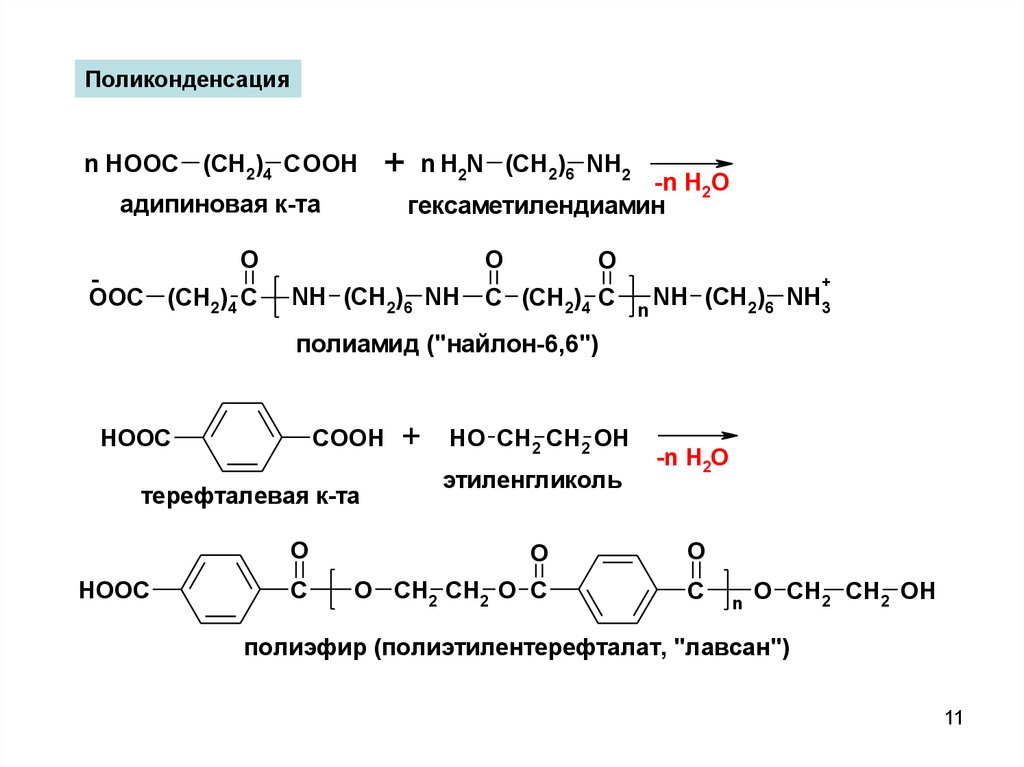
Поликонденсацияn HOOC (CH2)4 COOH
+
адипиновая к-та
O
OOC (CH2)4 C
n H2N (CH2)6 NH2
-n H2O
гексаметилендиамин
O
O
NH (CH2)6 NH C (CH2)4 C
+
NH (CH2)6 NH3
n
полиамид ("найлон-6,6")
COOH
HOOC
терефталевая к-та
HOOC
+
HO CH2 CH2 OH
этиленгликоль
-n H2O
O
O
O
C
O CH2 CH2 O C
C
n
O CH2 CH2 OH
полиэфир (полиэтилентерефталат, "лавсан")
11






 Химия
Химия








