Похожие презентации:
Дикарбоновые кислоты
1.
ДИКАРБОНОВЫЕ КИСЛОТЫCOOH
H2C
COOH
ФОРМУЛА
ТРИВИАЛЬНАЯ
ИЮПАК
КАРБОНОВАЯ
(COOH)2
Щавелевая
Этандиовая
-
CH2(COOH)2
Малоновая
Пропандиовая
Метандикарбоновая
COOH(CH2)2COOH
Янтарная
Бутандиовая
1,2-этандикарбоновая
COOH(CH2)3COOH
Глутаровая
Пентандиовая
1,3-пропандикарбоновая
COOH(CH2)4COOH
Адипиновая
Гександиовая
1,4-дикарбоновая
pK’a(COOH)2 = 1,27
pK’aCH2(COOH)2 = 2,85
pK”a ( CH2)2 (COOH)2 = 4,27
pK”a ( CH2)3 (COOH)2 = 5,70
2.
Щавелевая кислотаПолучение
1. Окисление глюкозы или сахарозы азотной кислотой
CH
COOH
HNO3
CH
COOH
2. В промышленности
O
O
H
to
C
ONa
O
C
ONa
C
ONa
3. Окисление этиленгликоля
[O]
HO CH2 CH2 OH
HO C
O
C OH
O
3.
4. Вёллер (1824г.) – гидролиз дицианаN C
C
N
COOH
2H2O, H+
COOH
Свойства
1. Образование внутренних солей
O
C
COOH
O
Ca
+ CaCl2
C
COOH
O
O
2. Разложение щавелевой кислоты
COOH
COOH
COOH
H2SO4
CO2 + CO + H2O
COOH
Щавелевая кислота не образует ангидрида!!!
150oC
HCOOH + CO2
4.
3. Образование функциональных производныхА)
COOH
Cl
+ PCl5
COOH
C
C
O
O
Cl
Безводн.
Дихлорангидрид щавелевой кислоты (хлористый оксалил или оксалил хлорид)
используется для получения хлорангидридов карбоновых кислот из алканов:
RH + Cl C
O
Б)
COOH
C Cl
O
h
Азеотропная
отгонка воды C
R
C
Cl
+ CO + HCl
O
O
C
OC2H5
O
+ C2H5OH
COOH
O
C
C2H5OH
OC2H5
O
C
OH
Кислый
этиловый эфир
щ. кислоты
OC2H5
Диэтилоксалат
5.
В) Получение амидовRO C
C
O
O
OR
+ 2NH3
H2N C
C
O
O
NH2
+ 2ROH
Оксамид
RO C
C
O
O
OR
+ NH3
H2N C
C
O
O
OR
Оксаминовая к-та
+ ROH
6.
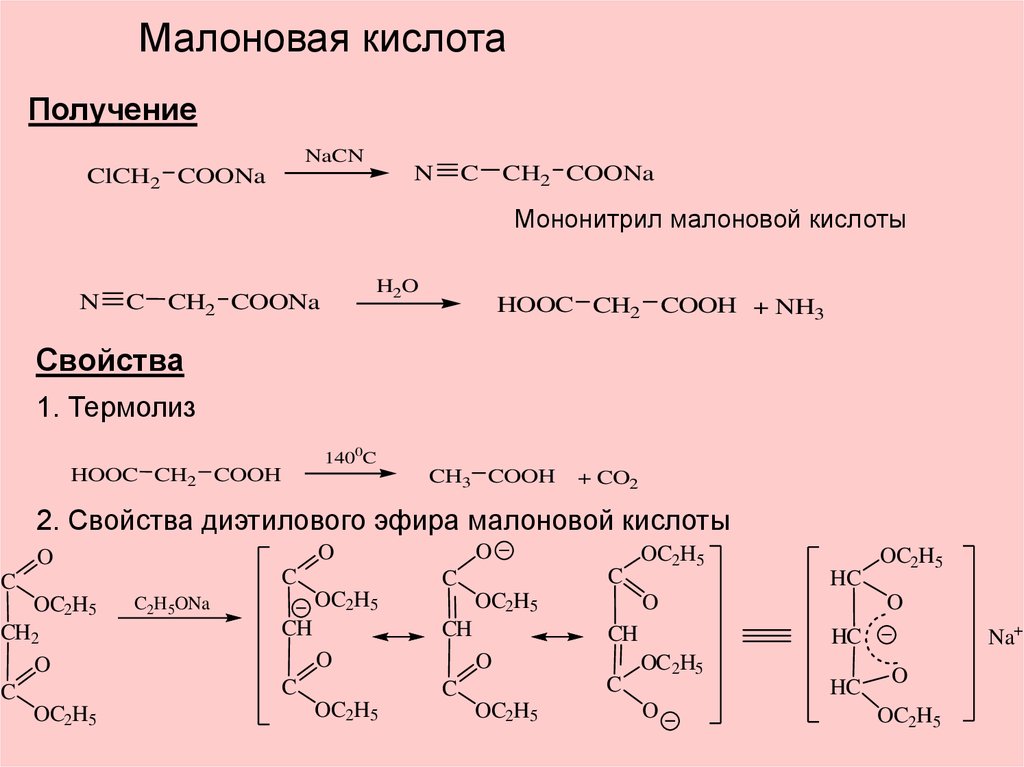
Малоновая кислотаПолучение
NaCN
N
ClCH2 COONa
C
CH2 COONa
Мононитрил малоновой кислоты
N
C
H2O
CH2 COONa
HOOC CH2 COOH + NH3
Свойства
1. Термолиз
1400C
HOOC CH2 COOH
CH3 COOH
+ CO2
2. Свойства диэтилового эфира малоновой кислоты
C
C
OC2H5
CH2
O
C
OC2H5
O
O
O
OC2H5
C2H5ONa
C
C
CH
OC2H5
CH
O
C
HC
O
CH
O
C
C
OC2H5
OC2H5
OC2H5
OC2H5
O
Na+
HC
OC2H5
HC
O
O
OC2H5
7.
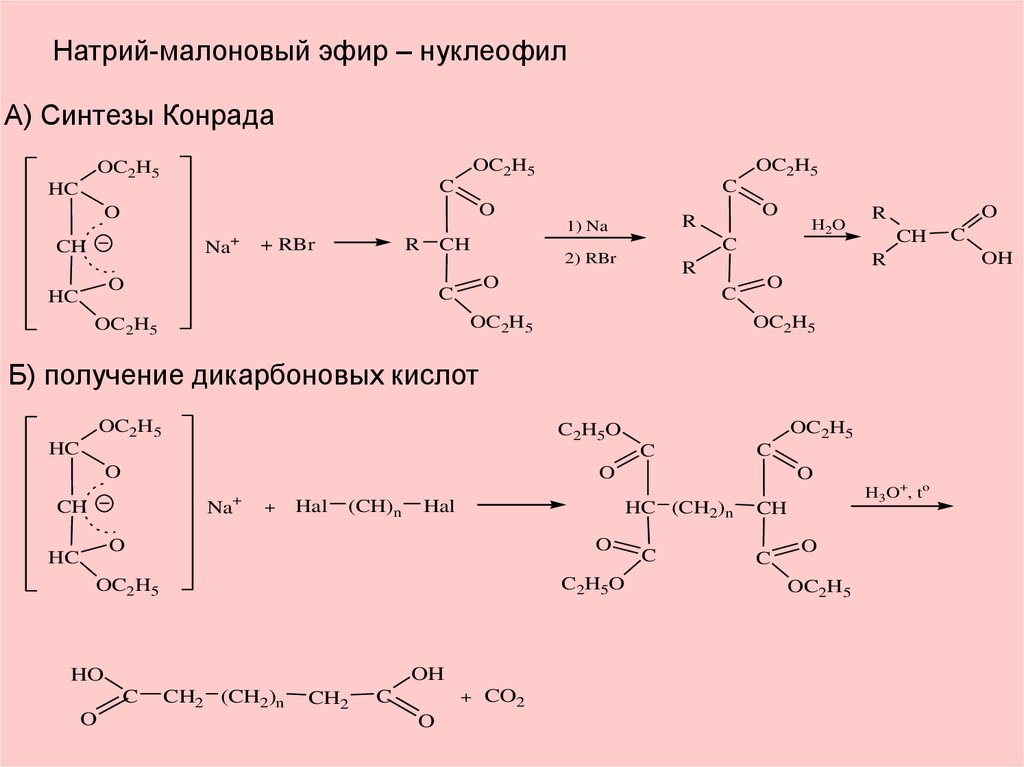
Натрий-малоновый эфир – нуклеофилА) Синтезы Конрада
OC2H5
OC2H5
C
HC
C
O
O
Na+
R
+ RBr
CH
O
R
O
C
OC2H5
OC2H5
H2O
C
2) RBr
C
O
R
1) Na
CH
HC
OC2H5
O
R
CH
R
O
OC2H5
Б) получение дикарбоновых кислот
OC2H5
OC2H5
C2H5O
HC
C
O
O
CH
Na
+
+
Hal
(CH)n
Hal
O
C2H5O
OC2H5
OH
HO
C
O
CH2 (CH2)n
CH2
+ CO2
C
O
O
HC (CH2)n
O
HC
C
C
CH
C
O
OC2H5
H3O+, to
C
OH
8.
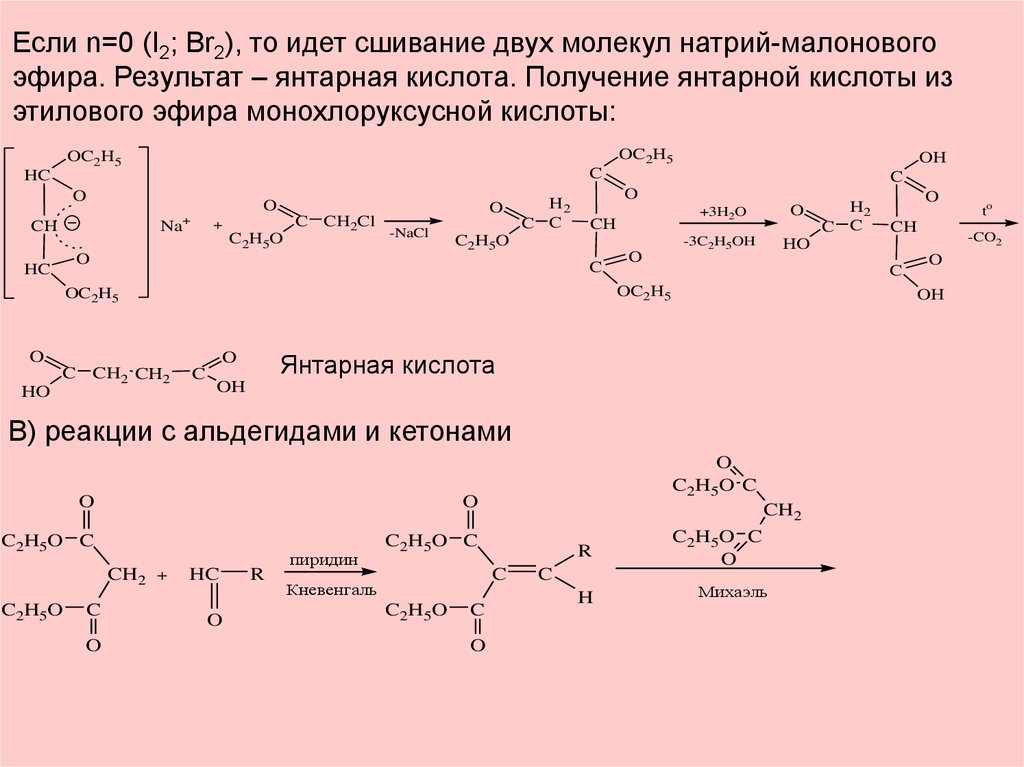
Если n=0 (I2; Br2), то идет сшивание двух молекул натрий-малоновогоэфира. Результат – янтарная кислота. Получение янтарной кислоты из
этилового эфира монохлоруксусной кислоты:
OC2H5
OC2H5
O
O
+
CH
+
Na
C2H5O
C CH2Cl
O
-NaCl
H2
C C
CH
C
O
HO
O
+3H2O
O
-3C2H5OH
HO
OH
В) реакции с альдегидами и кетонами
O
O
C2H5O C
C2H5O C
CH2 +
C2H5O
C
O
HC
O
R
пиридин
O
C2H5O C
CH2
R
C
Кневенгаль
C2H5O
C
O
C
H
O
CH
C2H5O C
O
Михаэль
to
-CO2
O
OH
Янтарная кислота
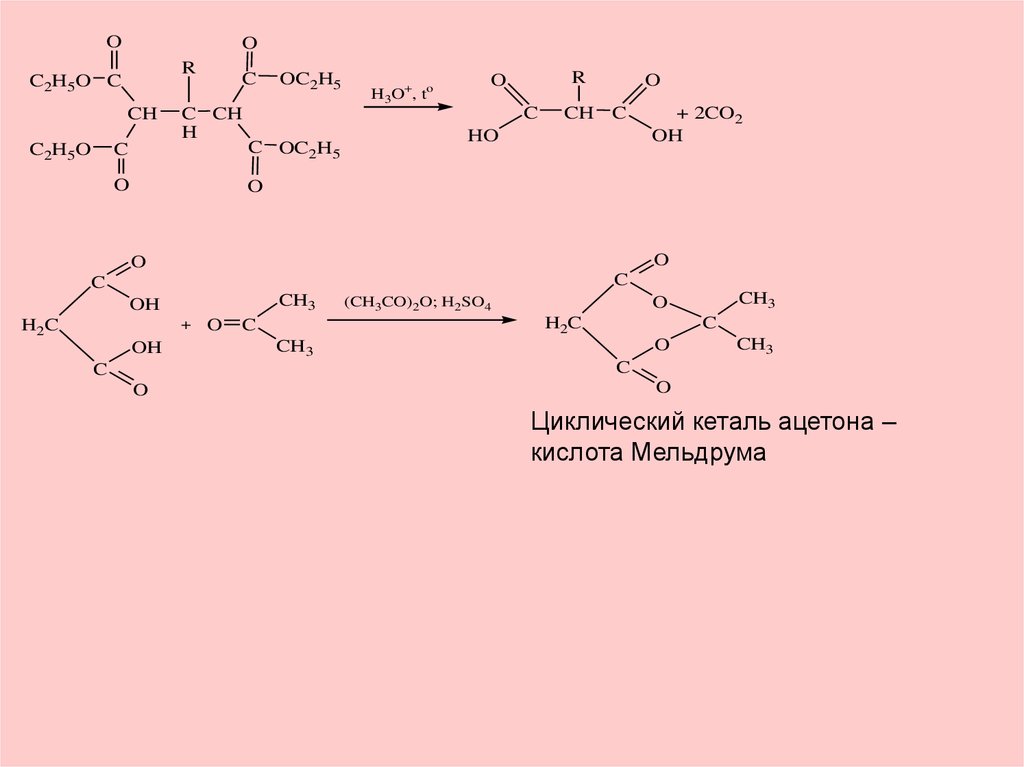
O
C
H2
C C
C
OC2H5
OC2H5
C CH2 CH2
C
O
C2H5O
O
HC
OH
C
HC
9.
OO
R
C2H5O C
CH
C2H5O
C
C CH
H
OC2H5
H3O+, to
R
O
C
C
C OC2H5
O
O
CH
O
C
HO
+ 2CO2
OH
O
O
C
C
CH3
OH
H2C
+
OH
O
H2C
C
CH3
O
(CH3CO)2O; H2SO4
C
O
CH3
CH3
C
C
O
O
Циклический кеталь ацетона –
кислота Мельдрума
10.
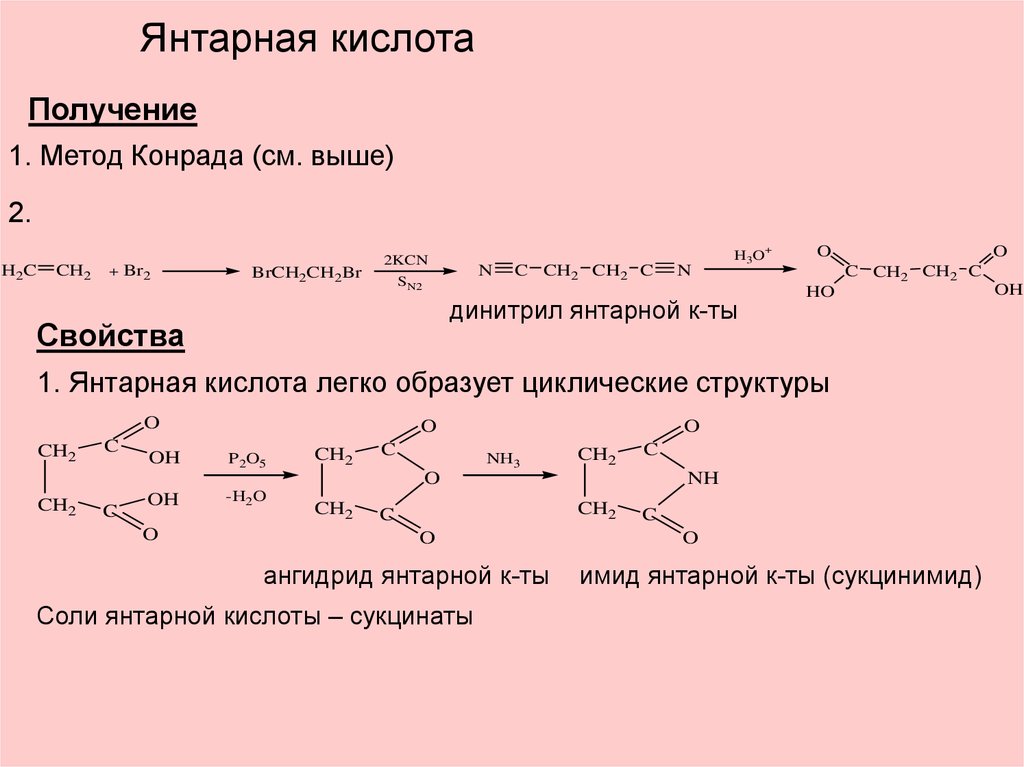
Янтарная кислотаПолучение
1. Метод Конрада (см. выше)
2.
H2C
CH2
+ Br2
BrCH2CH2Br
2KCN
SN2
N
C CH2 CH2 C
N
H3O+
динитрил янтарной к-ты
Свойства
O
O
C CH2 CH2 C
HO
1. Янтарная кислота легко образует циклические структуры
O
CH2
C
O
OH
P2O5
OH
-H2O
CH2
C
O
NH3
CH2
C
O
CH2
C
O
CH2
NH
CH2
C
O
ангидрид янтарной к-ты
Соли янтарной кислоты – сукцинаты
C
O
имид янтарной к-ты (сукцинимид)
OH
11.
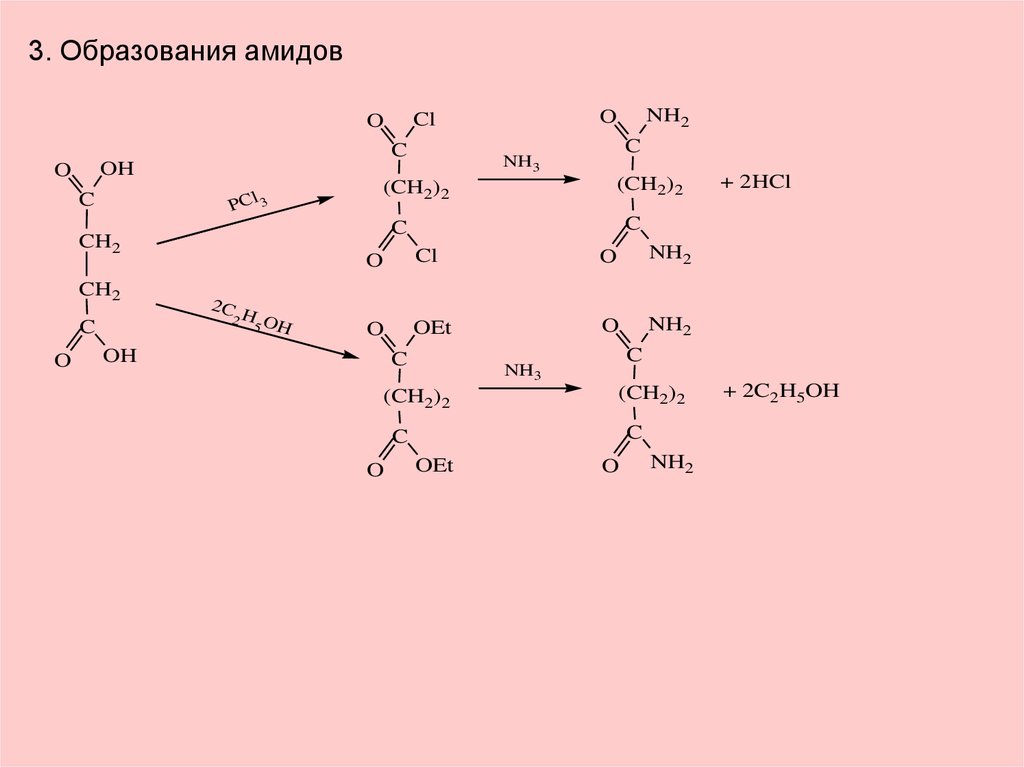
3. Образования амидовC
PCl 3
C
O
O
Cl
O
NH2
O
OEt
O
NH2
OH
C
C
NH3
(CH2)2
(CH2)2
C
C
O
+ 2HCl
C
2C
2H O
5 H
C
(CH2)2
(CH2)2
C
CH2
CH2
C
NH3
OH
O
NH2
O
Cl
O
OEt
O
NH2
+ 2C2H5OH
12.
Превращения сукцинимидаРеакция Габриэля
O
CH2
C
CH2
NH
CH2
O
O
C
+ C2H5ONa
N Na
CH2
C
O
Br2
-NaBr
C
CH2
C
NBr
CH2
C
O
O
Бромсукцинимид – источник
радикального брома
Br
Br2
Br
бро
мсу
кц
Br
ини
мид
Свободно-радикальная атака
аллильного положения углерода
13.
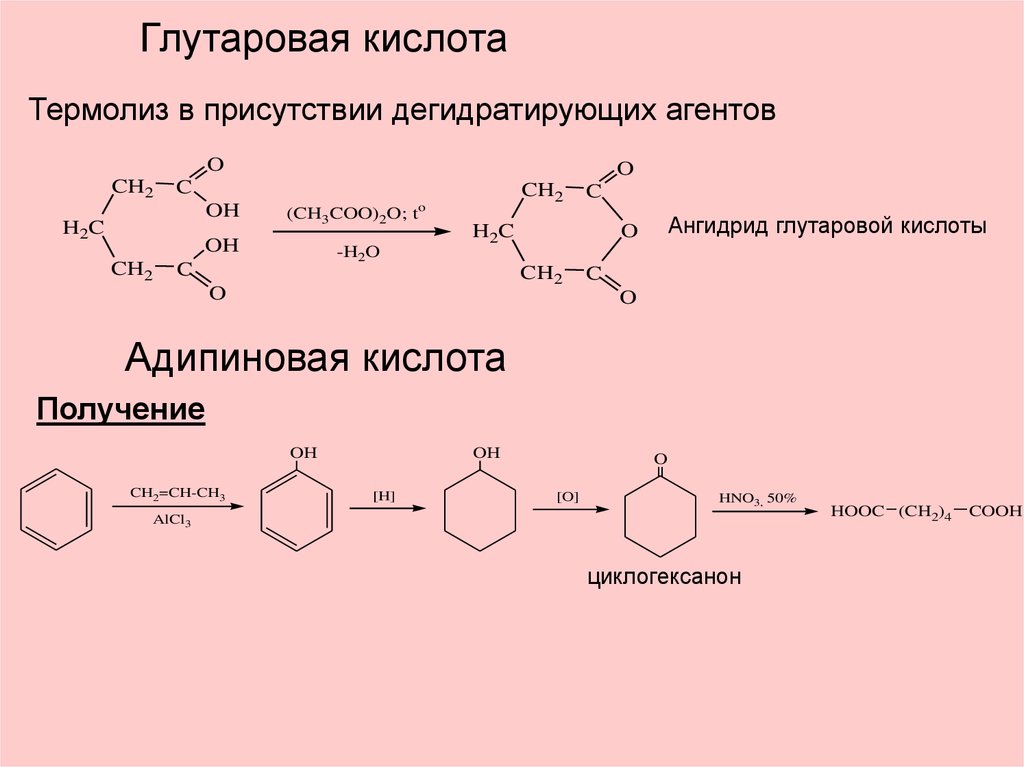
Глутаровая кислотаТермолиз в присутствии дегидратирующих агентов
O
CH2
O
C
OH
H2C
(CH3COO)2O; t
OH
CH2
-H2O
C
CH2
o
C
CH2
O
Ангидрид глутаровой кислоты
O
H2C
C
O
Адипиновая кислота
Получение
OH
CH2=CH-CH3
OH
[H]
O
[O]
HNO3, 50%
AlCl3
циклогексанон
HOOC (CH2)4
COOH
14.
СвойстваКонденсация Дикмана
CH2
CH
C
OEt
H2C
OEt
CH2
C
H2C CH
H2C
80oC
CH2
C
H2C
OEt
C
O
O
C
OEt
H2C
C2H5ONa
H2C
O
O
O
CH2
O
OEt
C
O
C
OEt
H2C CH
-C2H5O-
H2C
OEt
C
CH2
Получение конденсированных полимеров
HOOC (CH2)4
NH3
COOH
NC (CH2)4
динитрил
CN
H4NOOC (CH2)4
H2; Pt, P
H2N (CH2)6
COONH4
NH2
гексаметилендиамин
to
-H2O
H2NOC (CH2)4
CONH2
Диамид
адипиновой к-ты
P2O5, t
-2H2O
O
15.
OH2N (CH2)6
NH2 + HOOC (CH2)4
COOH
-H2O
OOC (CH2)4
C
NH (CH2)6
NH
O
O
C (CH2)4
C NH (CH2)6 NH3
Получение лавсана
COOCH3 + 2 OH-CH2-CH2-OH
H3COOC
CH3O-
диметилтерефталат
O
2 CH3-OH + HO CH2 CH2 O C
O
C O CH2 CH2 OH
O
O
n HO CH2 CH2 O C
C O CH2 CH2 OH
O
n HO CH2 CH2 O C
O
C O CH2 CH2 O
H
n
(n-1) OH-CH2-CH2-OH +
16.
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫH3C CH2 CH
COOH
OH
α – гидроксимасляная к-та
2-гидроксибутановая к-та
HO
CH2 COOH
CH3 CH COOH
Гидроксиуксусная, гликолевая
Молочная (DL, D, L)
α – гидроксипропионовая к-та
OH
HO CH2 CH2 COOH
HOOC CH2 CH
β – гидроксипропионовая к-та
COOH
Гидроксибутановая к-та, яблочная (DL, L, D)
OH
HO CH2 CHOH COOH
дигидроксиянтарная к-та (виноградная – рацемат,
винная L и D)
17.
CH2 COOHHO
C
2-гидрокси-1,2,3-пропантрикарбоновая к-та (лимонная)
COOH
CH2 COOH
O
гидроксимуравьиная к-та (угольная)
CO2 + H2O
H-O C OH
Способы получения
α - гидроксикислоты
1. Циангидринный синтез
H3C
HCN
C
H3C
CN
H3C
O
C
H3C
H2O, H+
OH
Циангидрин ацетона
OH
H3C
C
H3C
COOH
2-гидрокси-2-метилпропановая к-та
18.
2. Гидролиз α-галогензамещенных кислотBrCH2COOH
H2O, OH-
Монобромукс
усная к-та
HOCH2COOH
Гликолевая к-та
3. Восстановление α-галогензамещенных кислот
H3C
C
COOH
[H]
O
H3C CH COOH
OH
Молочная к-та
4. Бактериальное окисление сахаридов
C6H12O6
бактерии
2 H3C CH COOH
OH
19.
β - гидроксикислотыH2C CH COOH
H2O, H+
H2C CH2 COOH
OH
γ - гидроксикислоты
O
O
[H]
O
-H2O
O
γ – бутиролактон
O
H2O (H+)
O
O
H2C CH2 CH2 COOH
OH
γ – гидроксимасляная к-та
(ГОМК)
NH3
H2C CH2 CH2 COOH
NH2
γ – аминомасляная к-та
(ГАМК)
ГОМК – снотворное
ГАМК – умственный допинг, участвует в работе мозга, превращаясь
при этом в ГОМК













 Химия
Химия








