Похожие презентации:
Кислоты
1. КИСЛОТЫ
ОБЛАСТНОЕБЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ
«СВОБОДИНСКИЙ АГРАРНО-ТЕХНИЧЕСКИЙ ТЕХНИКУМ ИМЕНИ К.К.
РОКОССОВСКОГО»
КИСЛОТЫ
Н+
Н+
Н+
Плешакова Е.В.
Н+
Н+
Н+
преподаватель химии
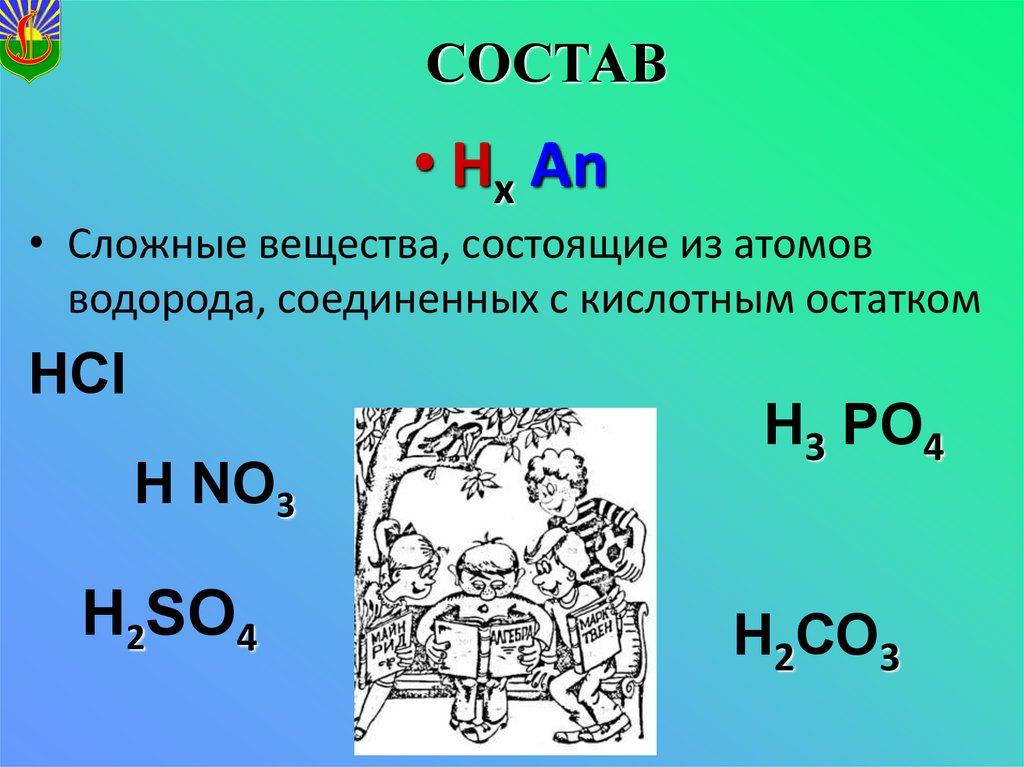
2. СОСТАВ
• Hх Аn• Сложные вещества, состоящие из атомов
водорода, соединенных с кислотным остатком
НСI
Н NО3
Н2SО4
Н3 РО4
Н2СО3
3. КИСЛОТЫ - это вкусно
4. КИСЛОТЫ – это важно
Объём продукции желудочного сокаСоляная кислота HCl
В сутки в желудке взрослого человека
вырабатывается около 2 л желудочного
сока.
Базальная (то есть в состоянии покоя,
не стимулированная пищей,
химическим стимуляторами и т.п.)
секреция у мужчин составляет (у
женщин на 25—30 % меньше):
желудочного сока — 80—100 мл/ч;
соляной кислоты — 2,5—5,0 ммоль/ч;
пепсина — 20—35 мг/ч.
Максимальная продукция соляной
кислоты у мужчин 22—29 ммоль/ч, у
женщин — 16—21 ммоль/ч.
5. КИСЛОТЫ – это опасно
КИСЛОТЫ — едкие вещества, при попаданиина кожу вызывает сильные химические ожоги.
Особенно опасно попадание в глаза. Они
поражают кожу, слизистые оболочки,
дыхательные пути
6. КЛАССИФИКАЦИЯ
Признакиклассификации
Группы кислот
Наличие
А) кислородные
кислорода в
Б)
кислотном остатке бескислородные
Примеры
А) H3PO4, H2SO4
Б) HBr, H2S
Основность
А) одноосновные А) HNO3, HCl
Б) многоосновные Б) H2SO4, H3PO4
Растворимость в
воде
А) растворимые
А) HNO3, HCl
Б) нерастворимые Б) H2SiO3
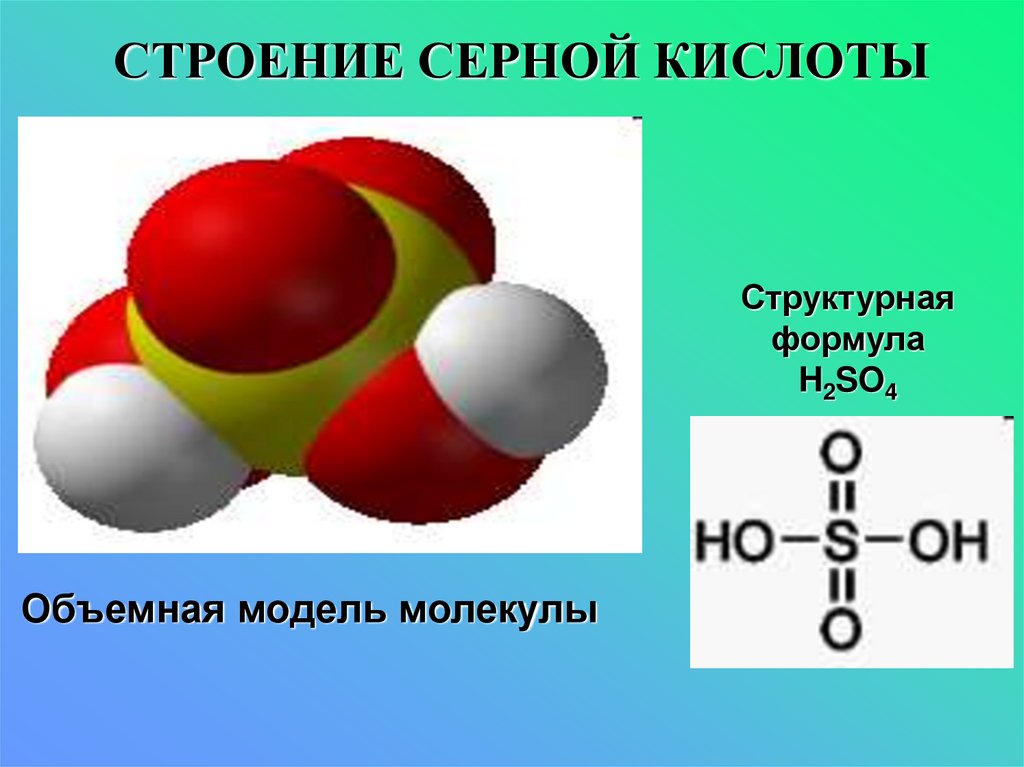
7. СТРОЕНИЕ СЕРНОЙ КИСЛОТЫ
Структурнаяформула
H2SO4
Объемная модель молекулы
8. ХИМИЧЕСКИЕ СВОЙСВА
1.кислота + металл (стоящий до водорода в ЭХРнапряжений)
2HCl + Mg →MgCl2 + H2
2.кислота + основный оксид
2HCl + MgO → MgCl2 + H2O
3. кислота + основание
HCl + NaOH → NaCl + H2O
4. кислота + соль
HCl +AgNO3 → AgCl + HNO3
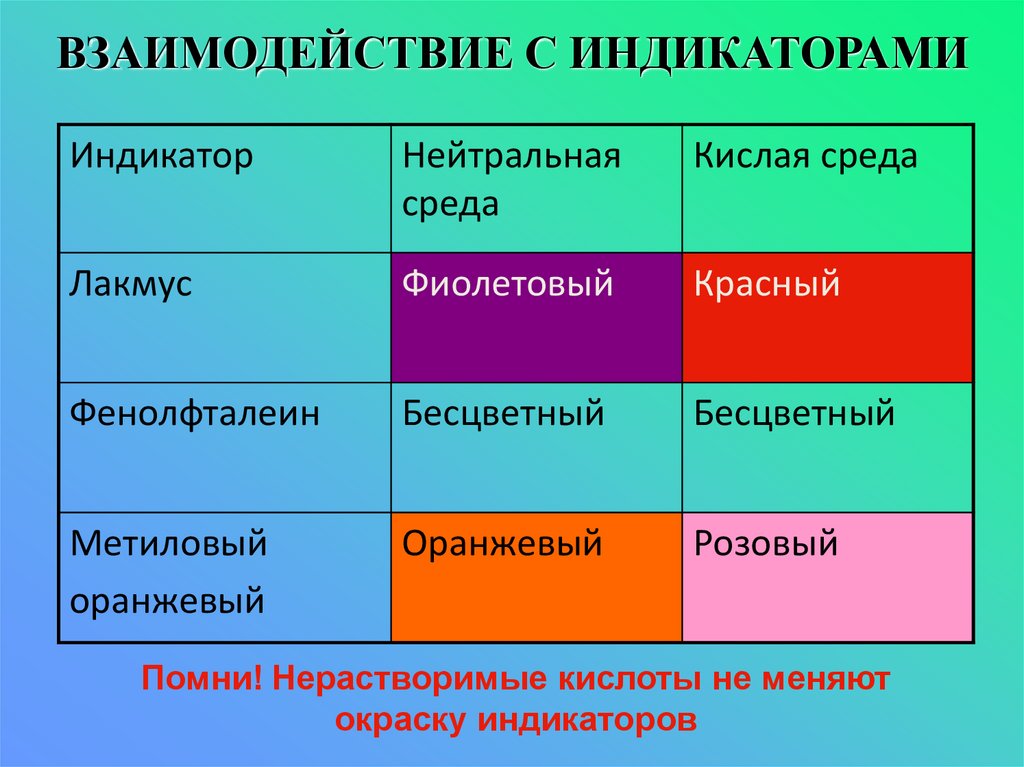
9. Взаимодействие кислот с индикаторами
10. ВЗАИМОДЕЙСТВИЕ С ИНДИКАТОРАМИ
ИндикаторНейтральная
среда
Кислая среда
Лакмус
Фиолетовый
Красный
Фенолфталеин
Бесцветный
Бесцветный
Метиловый
оранжевый
Оранжевый
Розовый
Помни! Нерастворимые кислоты не меняют
окраску индикаторов
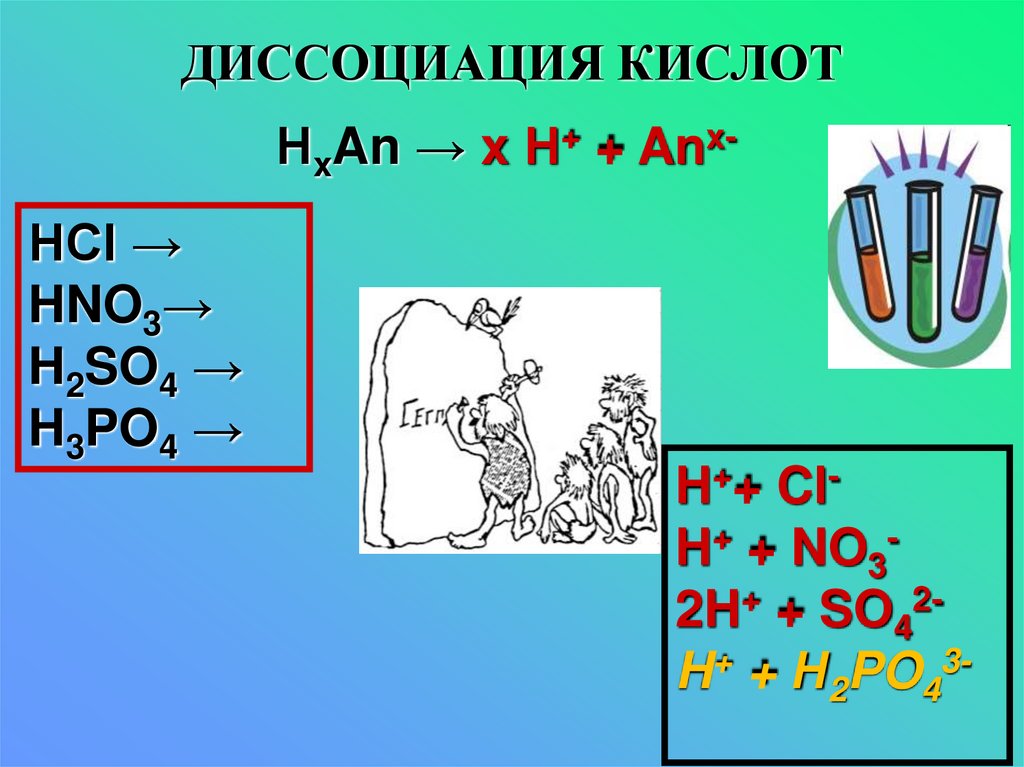
11. ДИССОЦИАЦИЯ КИСЛОТ
НxAn → x Н+ + AnxHCl →HNO3→
H2SO4 →
H3PO4 →
H++ ClH+ + NO32H+ + SO42H+ + Н2PO43-
12. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С Ме
МЕТАЛЛ + КИСЛОТА→СОЛЬ + ВОДОРОДлевее
Pb + H2SO4 →Х
???
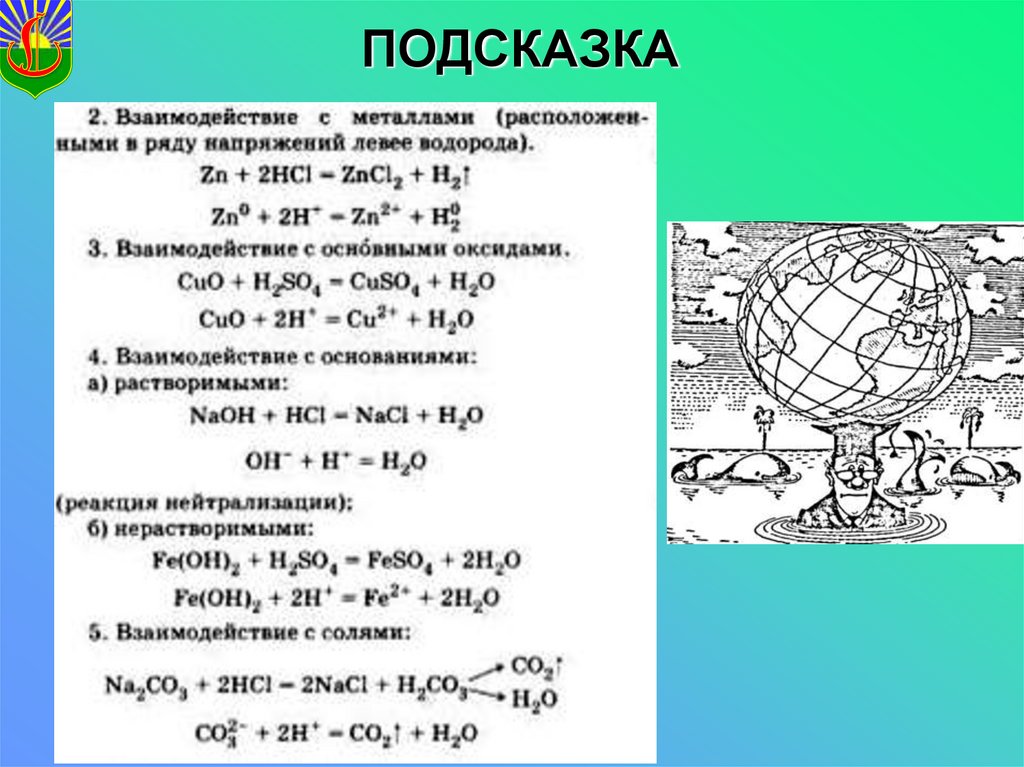
13. ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
ОСНОВНЫЙ ОКСИД + КИСЛОТА → СОЛЬ + ВОДА14. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
ОСНОВАНИЕ + КИСЛОТА → СОЛЬ + ВОДАРеакция между основанием и кислотой с образованием
соли и воды называется реакцией нейтрализации
15. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
СОЛЬ + КИСЛОТА → НОВАЯ КИСЛОТА + НОВАЯ СОЛЬРеакция возможна, ЕСЛИ образуется
↓ или ↑
16. ХИМИЧЕСКИЕ СВОЙСТВА
17. О КИСЛОТНЫХ ДОЖДЯХ
• Оксиды азота, серы содержатся ввыхлопных газах реактивных двигателей и
двигателей внутреннего сгорания,
отработанных газах металлургических и
химических предприятий,
теплоэлектростанций, которые неизбежно
превращаются в кислоты и выпадают нам
на голову в виде кислотных дождей
18.
О КИСЛОТНЫХ ДОЖДЯХ• Кислотные дожди виноваты в исчезновении
рыбы во многих реках и озёрах, так как рыба не
выдерживает кислой воды
• Такие дожди вымывают из почвы питательные
вещества, без которых растениям грозит
голодная смерть
• Многие растения погибают, если увеличивается
кислотность почвы. Оксид серы, кроме того,
прямо повреждает зелень
19. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
• Диссоциация• Взаимодействие с
индикаторами
• Взаимодействие с металлами
• Взаимодействие с основными
оксидами
• Взаимодействие с основаниями
• Взаимодействие с солями
20. «Воспоминание о лете» Погадаем на ромашке:
«Взаимодействует – не взаимодействует?»Задание
С какими из веществ взаимодействует
серная кислота?
а) НСl
д) Na
б) КОН
e) P2O5
в) СuО
ж)Cu
г) СО2
(2 балла.)
Составьте молекулярные и
ионные уравнения
возможных реакций к
заданию 1
(3балла.)
21.
ПОДСКАЗКА22. Какое свойство кислот?
Кислота, когда здорова,Угостить друзей готова
Тем, что ей дала природа Катионом водорода!
23. ВЕК ЖИВИ- ВЕК УЧИСЬ
«Сами трудясь, вы многое сделаете для себя идля близких, а если при труде успеха не будет,
будет неудача, не беда – попробуйте ещё»
Д.И. Менделеев
Остальные важные свойства
кислот представлены в
приложенном файле
«Опорный конспект
Кислоты»



















 Химия
Химия








