Похожие презентации:
Химическая связь в твердых веществах и жидкостях
1. 3.ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях
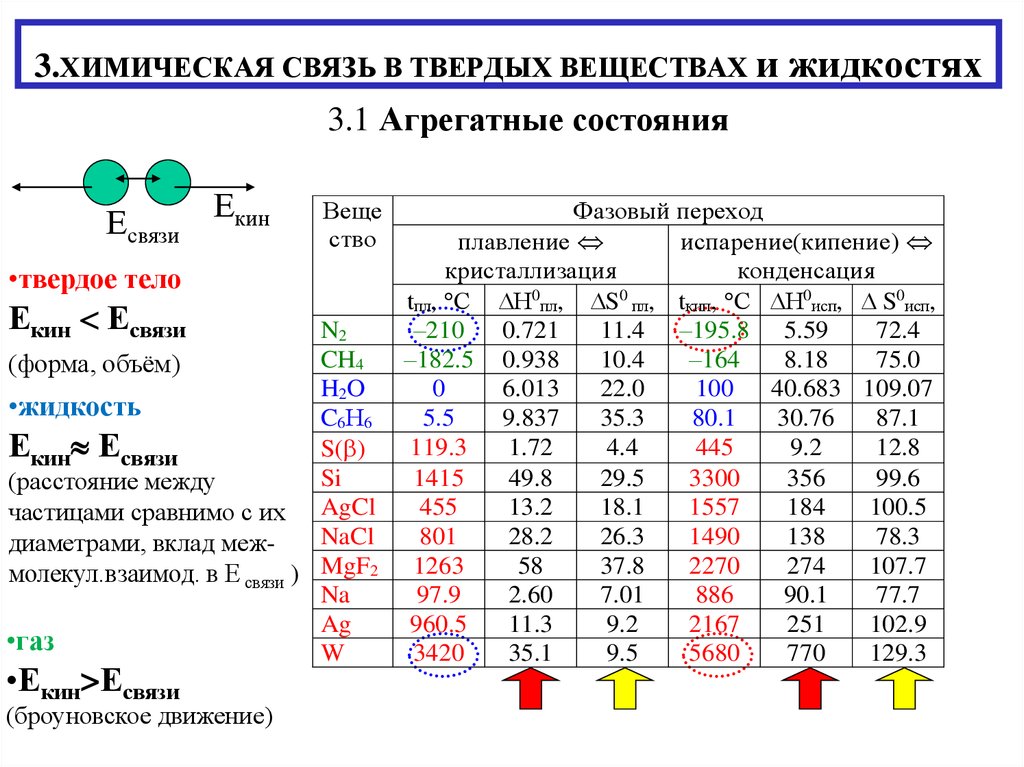
3.1 Агрегатные состоянияЕсвязи Екин
Веще
ство
•твердое тело
Екин Есвязи
N2
CH4
(форма, объём)
H2O
•жидкость
C6Н6
Екин Есвязи
S( )
Si
(расстояние между
частицами сравнимо с их AgCl
NaCl
диаметрами, вклад межмолекул.взаимод. в Е связи ) MgF2
Na
Ag
•газ
W
•Екин>Есвязи
(броуновское движение)
Фазовый переход
плавление
испарение(кипение)
кристаллизация
конденсация
0
0
tпл, С Н пл, S пл, tкип, С Н0исп, S0исп,
–210
0.721
11.4 –195.8 5.59
72.4
–182.5 0.938
10.4
–164
8.18
75.0
0
6.013
22.0
100
40.683 109.07
5.5
9.837
35.3
80.1
30.76
87.1
119.3
1.72
4.4
445
9.2
12.8
1415
49.8
29.5
3300
356
99.6
455
13.2
18.1
1557
184
100.5
801
28.2
26.3
1490
138
78.3
1263
58
37.8
2270
274
107.7
97.9
2.60
7.01
886
90.1
77.7
960.5
11.3
9.2
2167
251
102.9
3420
35.1
9.5
5680
770
129.3
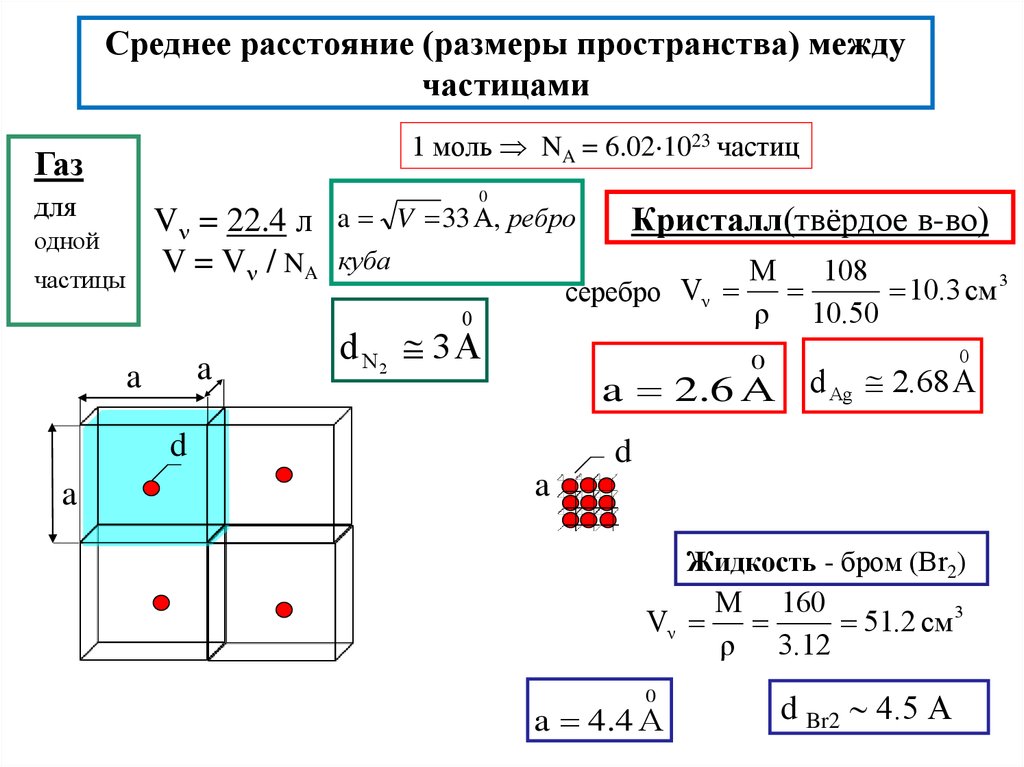
2. Среднее расстояние (размеры пространства) между частицами
1 моль NA = 6.02 1023 частицГаз
0
для
V = 22.4 л a V 33 А, ребро
V = V / NA куба
одной
частицы
серебро Vν
0
a
a
d N2 3 А
M
108
10.3 cм 3
ρ 10.50
0
0
a 2.6 А d Ag 2.68 А
d
a
Кристалл(твёрдое в-во)
d
a
Жидкость - бром (Br2)
M 160
Vν
51.2 cм 3
ρ 3.12
0
a 4.4 А
d Br2 4.5 А
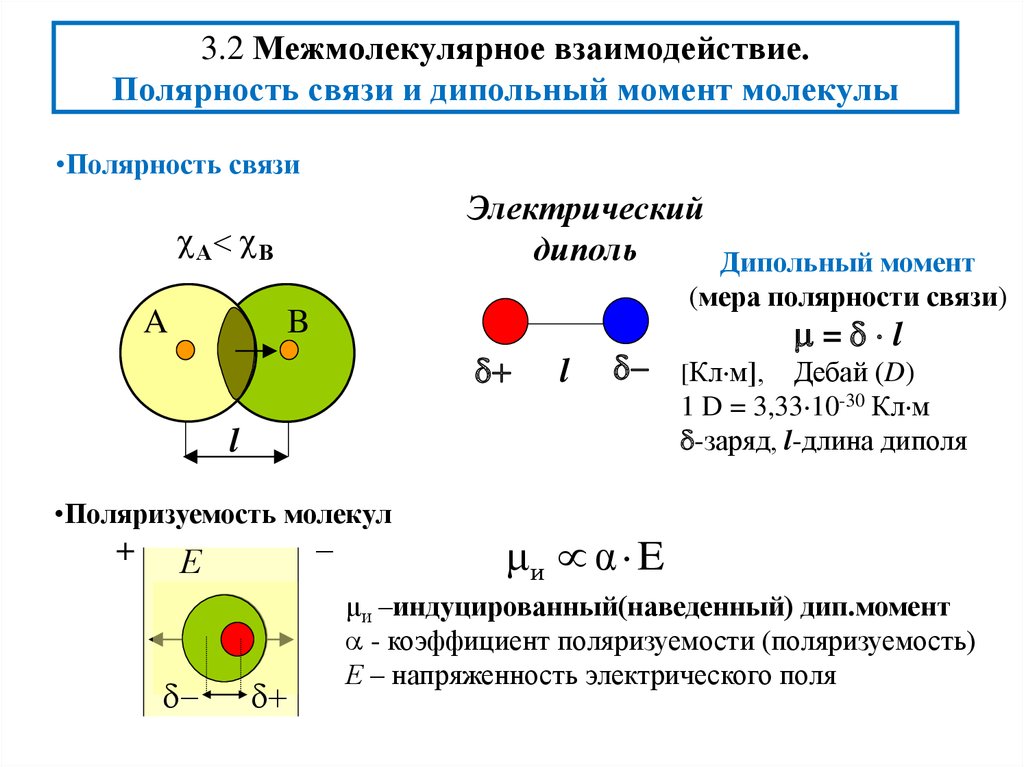
3. 3.2 Межмолекулярное взаимодействие. Полярность связи и дипольный момент молекулы
•Полярность связиЭлектрический
диполь
Дипольный момент
А В
A
(мера полярности связи)
B
l
l
•Поляризуемость молекул
+
–
Е
= l
[Кл м],
Дебай (D)
1 D = 3,33 10-30 Кл м
-заряд, l-длина диполя
μи α E
μи –индуцированный(наведенный) дип.момент
- коэффициент поляризуемости (поляризуемость)
Е – напряженность электрического поля
4. Дипольный момент молекул
МолекулаДипольный
момент
связи, D
Дипольный
момент
молекулы, D
Строение
молекулы
О
O3
H2O
CO2
0
1,5
2,7
0
1,84
0
О
О
Н +
+
О
Н
+
O
С O
5. Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей]
1. Ориентационный эффект (Кьезома) (взаимодействие(электростатическоепритяжение) пост.диполь – пост.диполь)
+
1
+
2
+
+
E ор
1. 2
r 6T
2. Индукционный эффект (Дебая ) (взаимодействие постоянный диполь
– наведенный(индуцированный) диполь).
2
- +
E инд
μ α
6
r
3. Дисперсионный эффект (Лондона) (взаимодействие мгновенных диполей).
1
2
α1 α 2
E дис 6
r
6. Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
Относительный вклад каждой составляющей в энергиюМолекул
а
межмолекулярного взаимодействия для различных молекул
CO
HCl
NH3
H2O
Ориентационное Индукционное Дисперсионное
Кл м
м3
%
0,01
14,4
44,9
76,9
0,1
4,2
5,3
4,0
99,9
81,4
49,7
19,0
1030
0,33 1,926
3,47 2,561
4,94 2,145
6,10 1,444
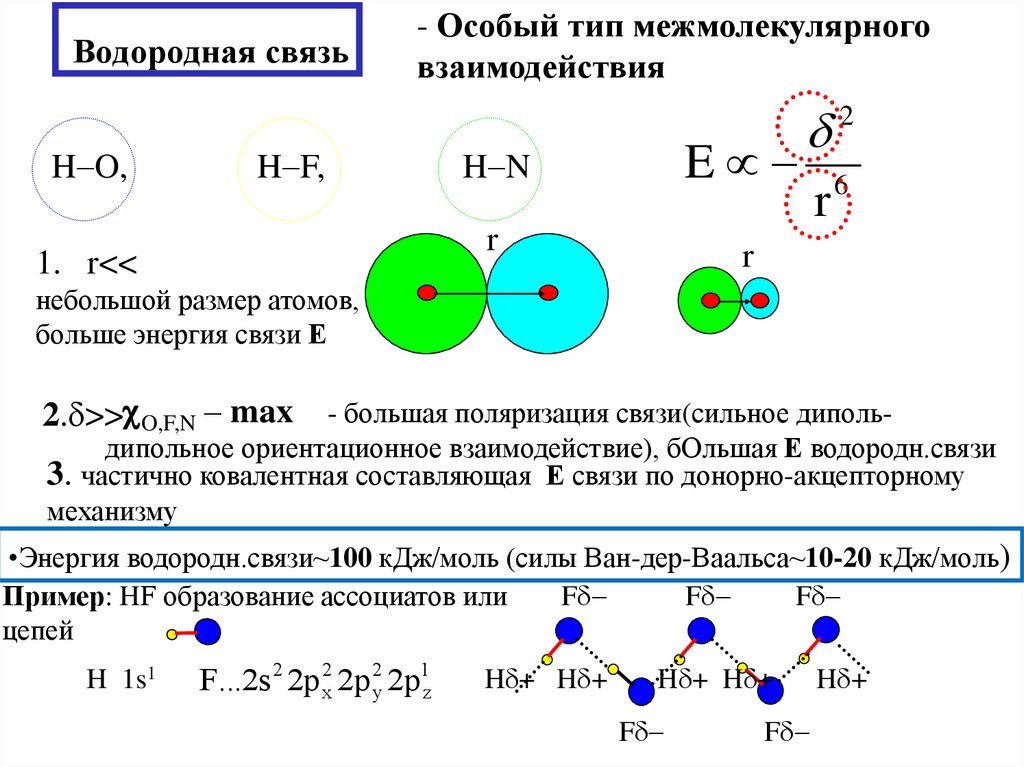
7. Водородная связь
H O,- Особый тип межмолекулярного
взаимодействия
H F,
1. r<<
H N
E
r
r
2
r
6
небольшой размер атомов,
больше энергия связи Е
2. >> O,F,N – max
- большая поляризация связи(сильное дипольдипольное ориентационное взаимодействие), бОльшая Е водородн.связи
3. частично ковалентная составляющая Е связи по донорно-акцепторному
механизму
•Энергия водородн.связи~100 кДж/моль (силы Ван-дер-Ваальса~10-20 кДж/моль)
F
F
F
Пример: HF образование ассоциатов или
цепей
H 1s1
F...2s 2 2p 2x 2p 2y 2p1z
H + H +
H + H +
F
F
H +
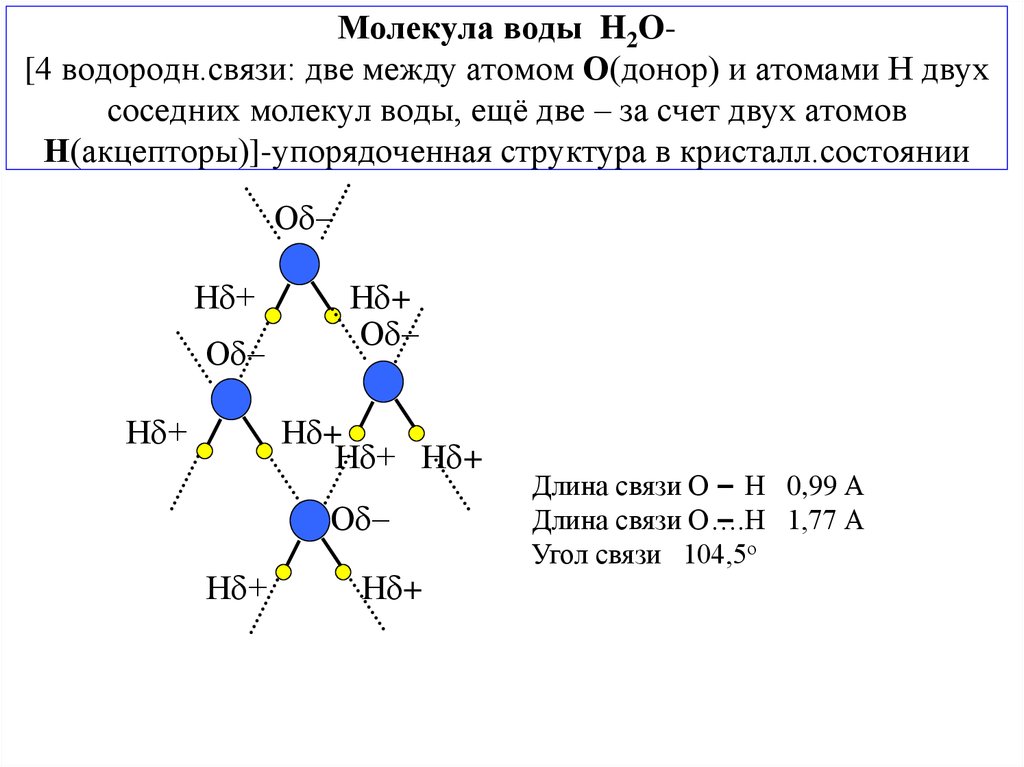
8. Молекула воды H2O- [4 водородн.связи: две между атомом О(донор) и атомами Н двух соседних молекул воды, ещё две – за счет двух атомов Н(акцептор
Молекула воды H2O[4 водородн.связи: две между атомом О(донор) и атомами Н двухсоседних молекул воды, ещё две – за счет двух атомов
Н(акцепторы)]-упорядоченная структура в кристалл.состоянии
О
Н +
О
Н +
Н +
О
Н +
Н + Н +
О
Н +
Н +
Длина связи О Н 0,99 А
Длина связи О….Н 1,77 А
Угол связи 104,5о
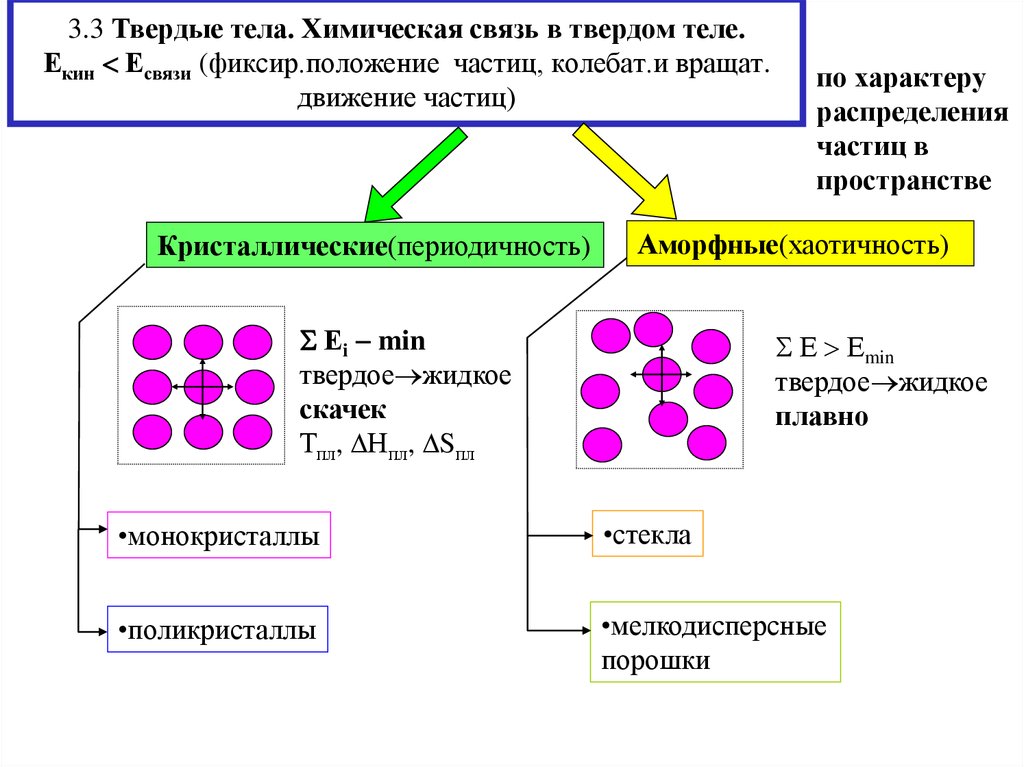
9. 3.3 Твердые тела. Химическая связь в твердом теле. Екин Есвязи (фиксир.положение частиц, колебат.и вращат. движение частиц)
3.3 Твердые тела. Химическая связь в твердом теле.Екин Есвязи (фиксир.положение частиц, колебат.и вращат.
движение частиц)
Кристаллические(периодичность)
по характеру
распределения
частиц в
пространстве
Аморфные(хаотичность)
Еi min
твердое жидкое
скачек
Тпл, Нпл, Sпл
Е Еmin
твердое жидкое
плавно
•монокристаллы
•стекла
•поликристаллы
•мелкодисперсные
порошки
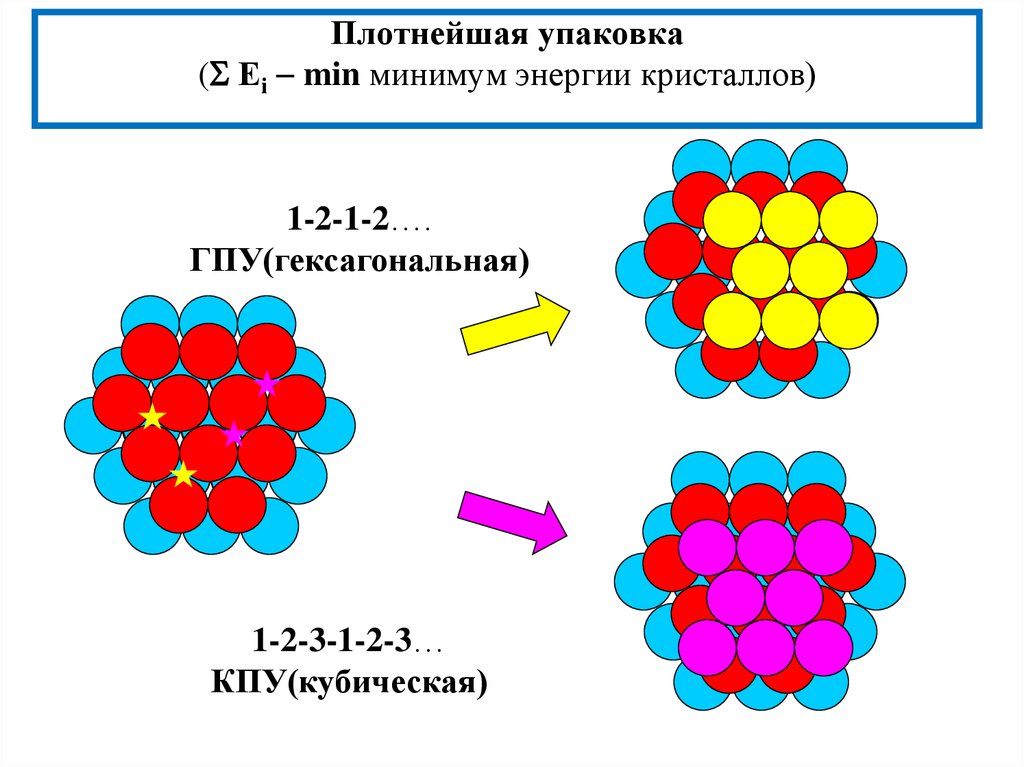
10. Плотнейшая упаковка ( Еi min минимум энергии кристаллов)
Плотнейшая упаковка( Еi min минимум энергии кристаллов)
1-2-1-2….
ГПУ(гексагональная)
1-2-3-1-2-3…
КПУ(кубическая)
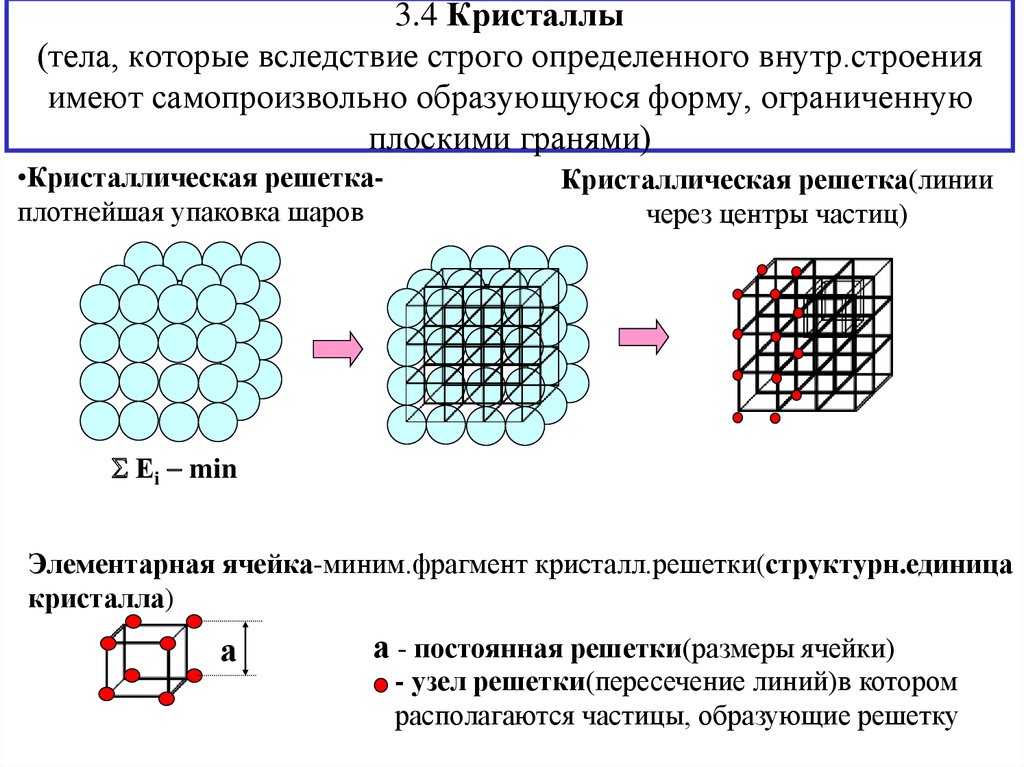
11. 3.4 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоски
3.4 Кристаллы(тела, которые вследствие строго определенного внутр.строения
имеют самопроизвольно образующуюся форму, ограниченную
плоскими гранями)
•Кристаллическая решеткаплотнейшая упаковка шаров
Кристаллическая решетка(линии
через центры частиц)
Еi min
Элементарная ячейка-миним.фрагмент кристалл.решетки(структурн.единица
кристалла)
а
а - постоянная решетки(размеры ячейки)
- узел решетки(пересечение линий)в котором
располагаются частицы, образующие решетку
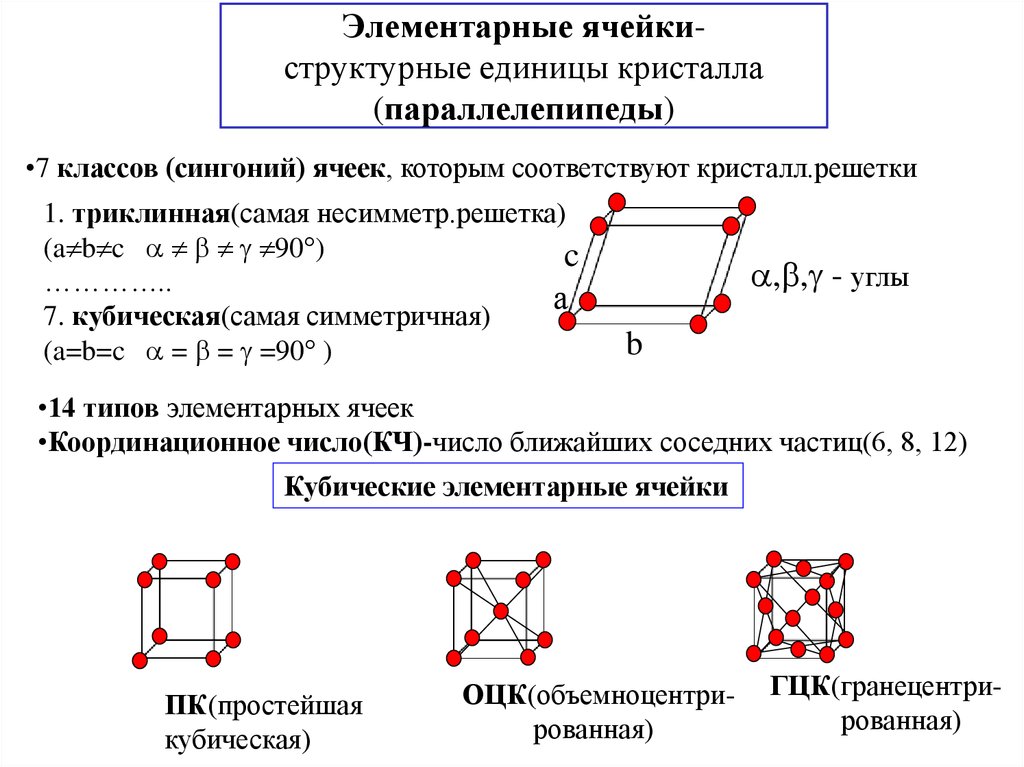
12. Элементарные ячейки- структурные единицы кристалла (параллелепипеды)
Элементарные ячейкиструктурные единицы кристалла(параллелепипеды)
•7 классов (сингоний) ячеек, которым соответствуют кристалл.решетки
1. триклинная(самая несимметр.решетка)
(a b c 90°)
c
…………..
а
7. кубическая(самая симметричная)
(a=b=c = = =90° )
, , - углы
b
•14 типов элементарных ячеек
•Координационное число(КЧ)-число ближайших соседних частиц(6, 8, 12)
Кубические элементарные ячейки
ПК(простейшая
кубическая)
ОЦК(объемноцентрированная)
ГЦК(гранецентрированная)
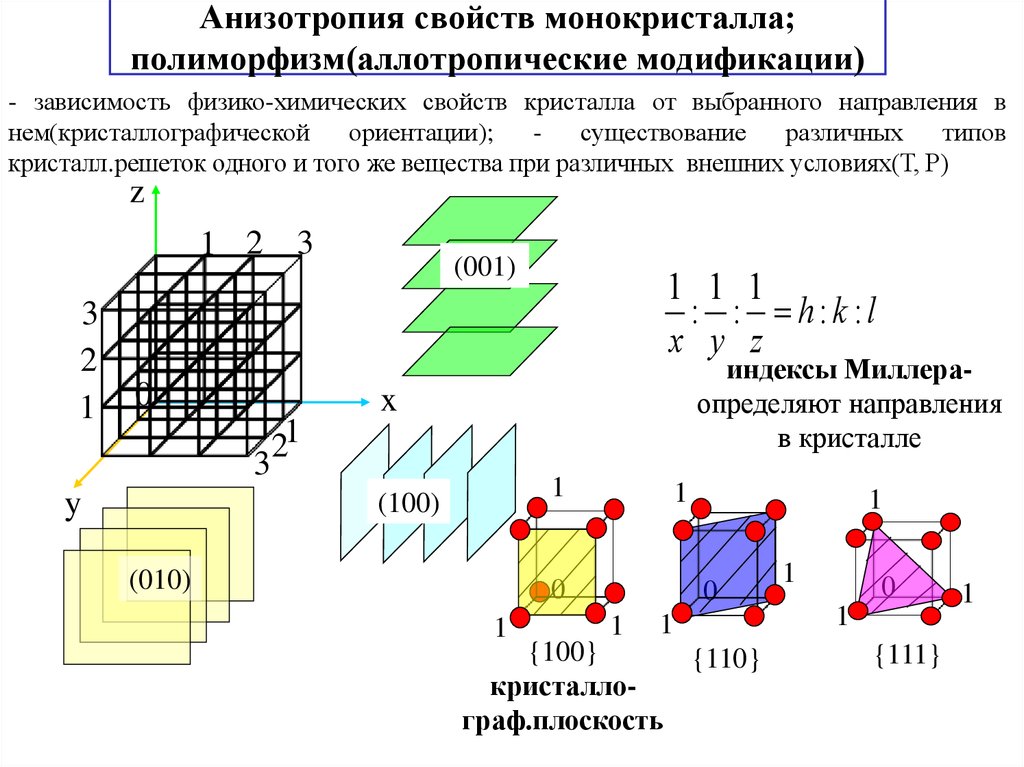
13. Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации)
- зависимость физико-химических свойств кристалла от выбранного направления внем(кристаллографической
ориентации);
существование
различных
типов
кристалл.решеток одного и того же вещества при различных внешних условиях(Т, Р)
z
1 2 3
3
2
1
0
1 1 1
: : h:k :l
x y z
индексы Миллераопределяют направления
в кристалле
x
3
y
(001)
21
1
(100)
(010)
1
0
1
1
0
1
1
{100}
{110}
кристаллограф.плоскость
1
0
1
{111}
1
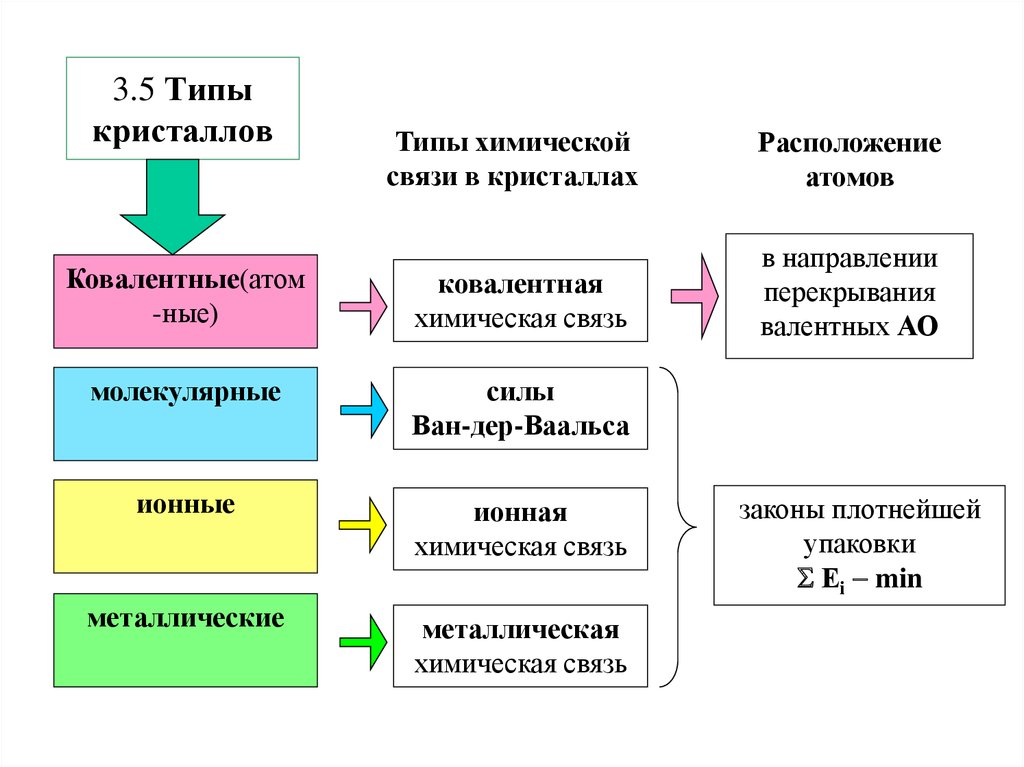
14. 3.5 Типы кристаллов
Типы химическойсвязи в кристаллах
Расположение
атомов
Ковалентные(атом
-ные)
ковалентная
химическая связь
в направлении
перекрывания
валентных АО
молекулярные
силы
Ван-дер-Ваальса
ионные
ионная
химическая связь
металлические
металлическая
химическая связь
законы плотнейшей
упаковки
Еi min
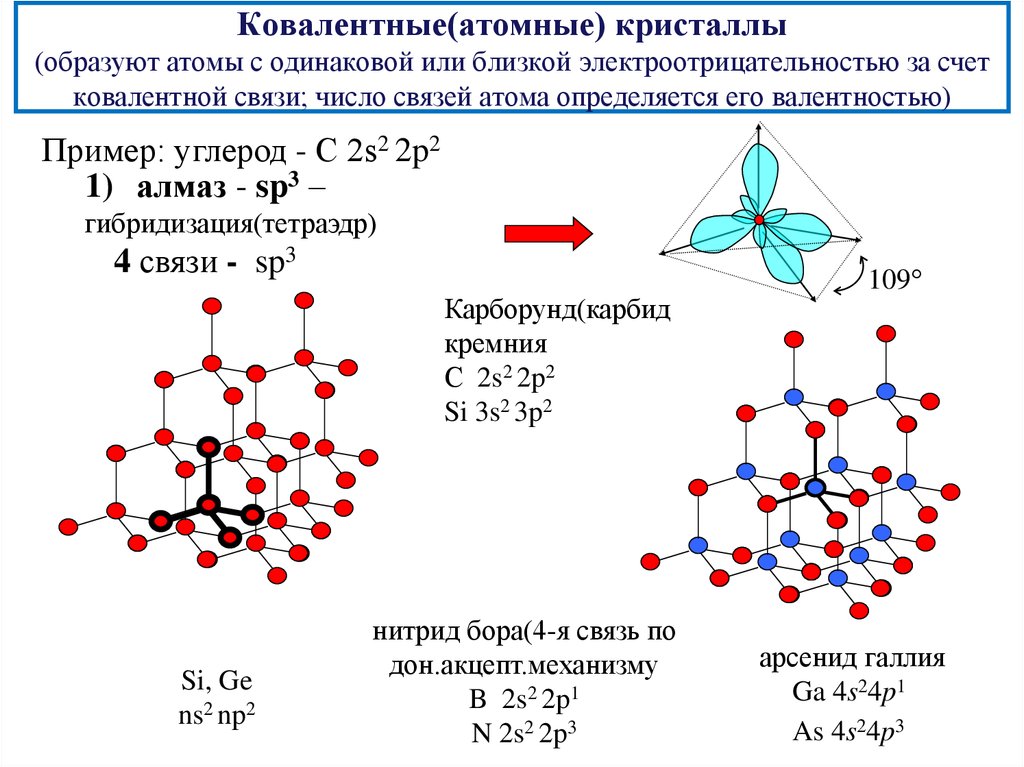
15. Ковалентные(атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью за счет ковалентной связи; число связей а
Ковалентные(атомные) кристаллы(образуют атомы с одинаковой или близкой электроотрицательностью за счет
ковалентной связи; число связей атома определяется его валентностью)
Пример: углерод - С 2s2 2p2
1) алмаз - sp3 –
гибридизация(тетраэдр)
4 связи - sp3
Карборунд(карбид
кремния
С 2s2 2p2
Si 3s2 3p2
Si, Ge
ns2 np2
нитрид бора(4-я связь по
дон.акцепт.механизму
B 2s2 2p1
N 2s2 2p3
109
арсенид галлия
Ga 4s24p1
As 4s24p3
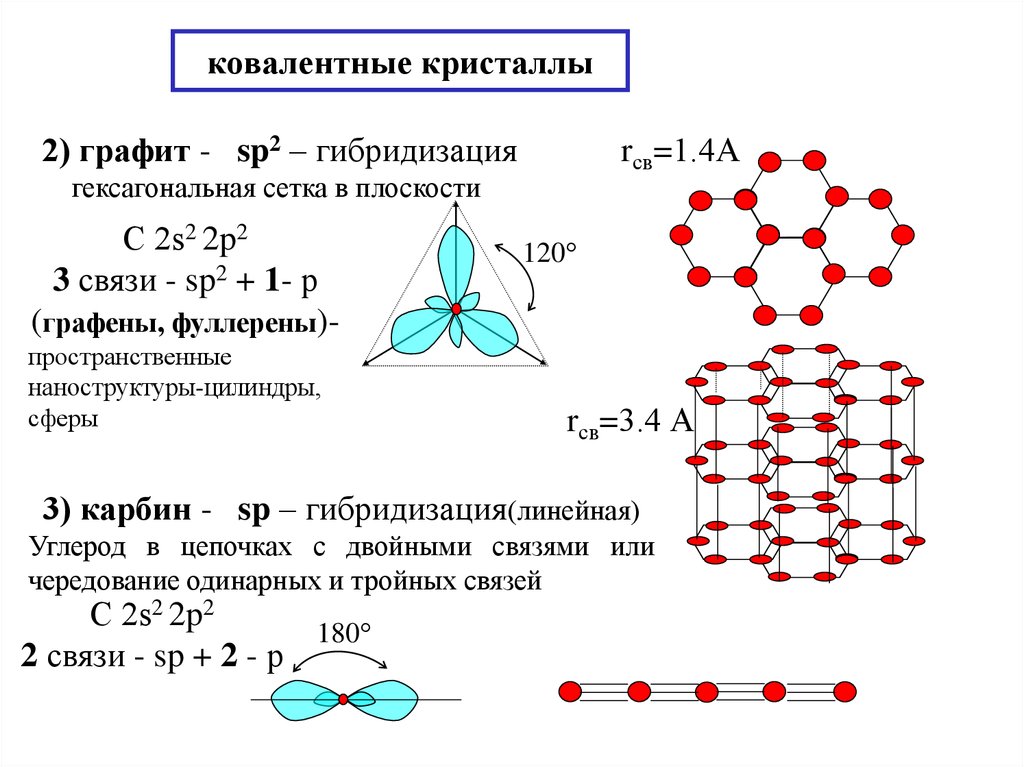
16. ковалентные кристаллы
2) графит - sp2 – гибридизацияrсв=1.4А
гексагональная сетка в плоскости
С 2s2 2p2
3 связи - sp2 + 1- р
(графены, фуллерены)пространственные
наноструктуры-цилиндры,
сферы
120
rсв=3.4 А
3) карбин - sp – гибридизация(линейная)
Углерод в цепочках с двойными связями или
чередование одинарных и тройных связей
С 2s2 2p2
180
2 связи - sp + 2 - р
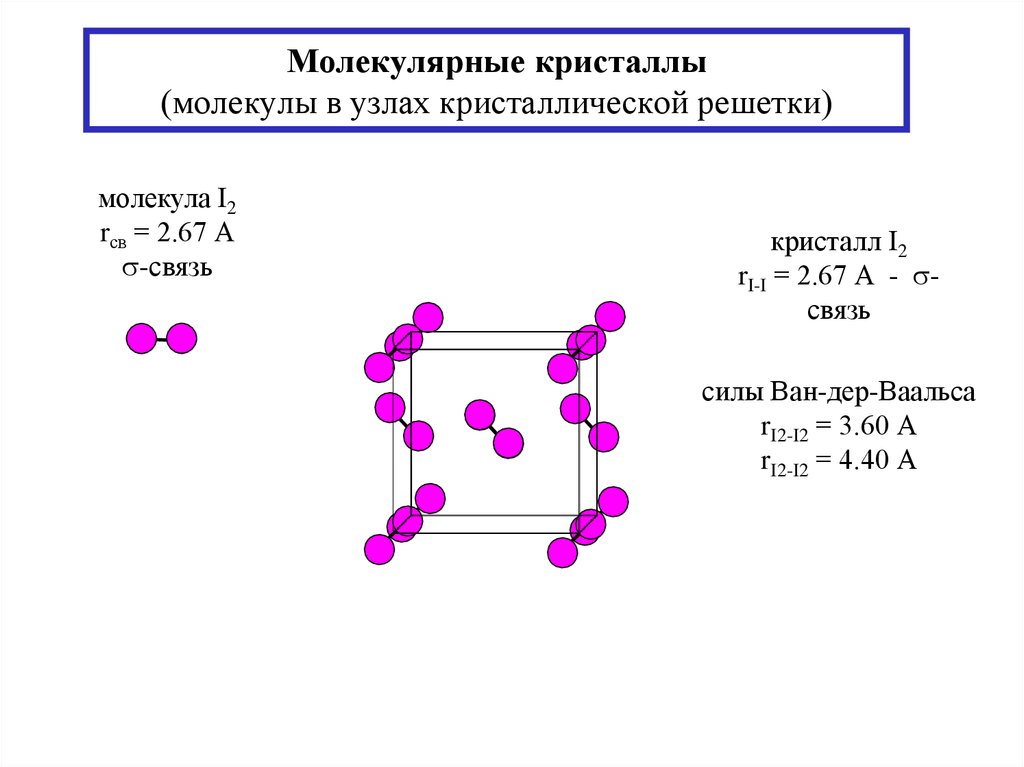
17. Молекулярные кристаллы (молекулы в узлах кристаллической решетки)
молекула I2rсв = 2.67 А
-связь
кристалл I2
rI-I = 2.67 А - связь
силы Ван-дер-Ваальса
rI2-I2 = 3.60 А
rI2-I2 = 4.40 А
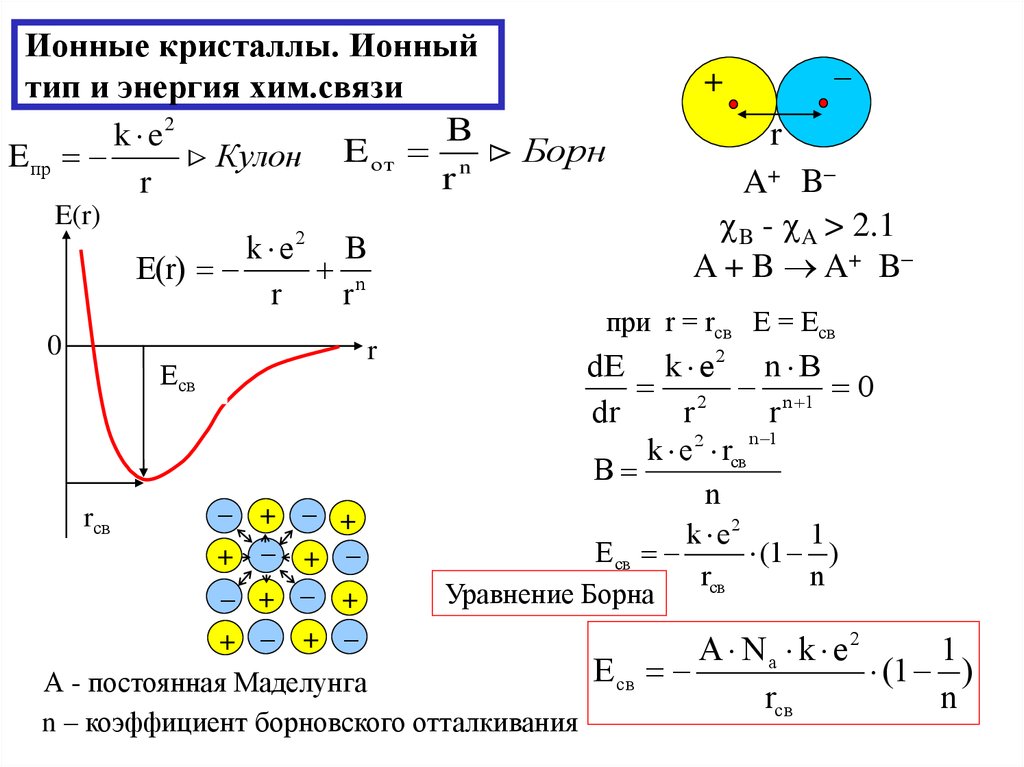
18. Ионные кристаллы. Ионный тип и энергия хим.связи
Bk e2
E пр
Кулон E от n Борн
r
r
E(r)
0
k e2 B
E(r)
n
r
r
rсв
+
+ +
+
+ +
+
+
r
+ B
AАВ
B - A > 2.1
A + B A+ B
при r = rсв Е = Есв
r
Есв
+
dE k e 2 n B
2 n 1 0
dr
r
r
n 1
k e 2 rсв
B
n
k e2
1
E св
(1 )
rсв
n
Уравнение Борна
А - постоянная Маделунга
n – коэффициент борновского отталкивания
A Na k e2
1
E св
(1 )
rсв
n
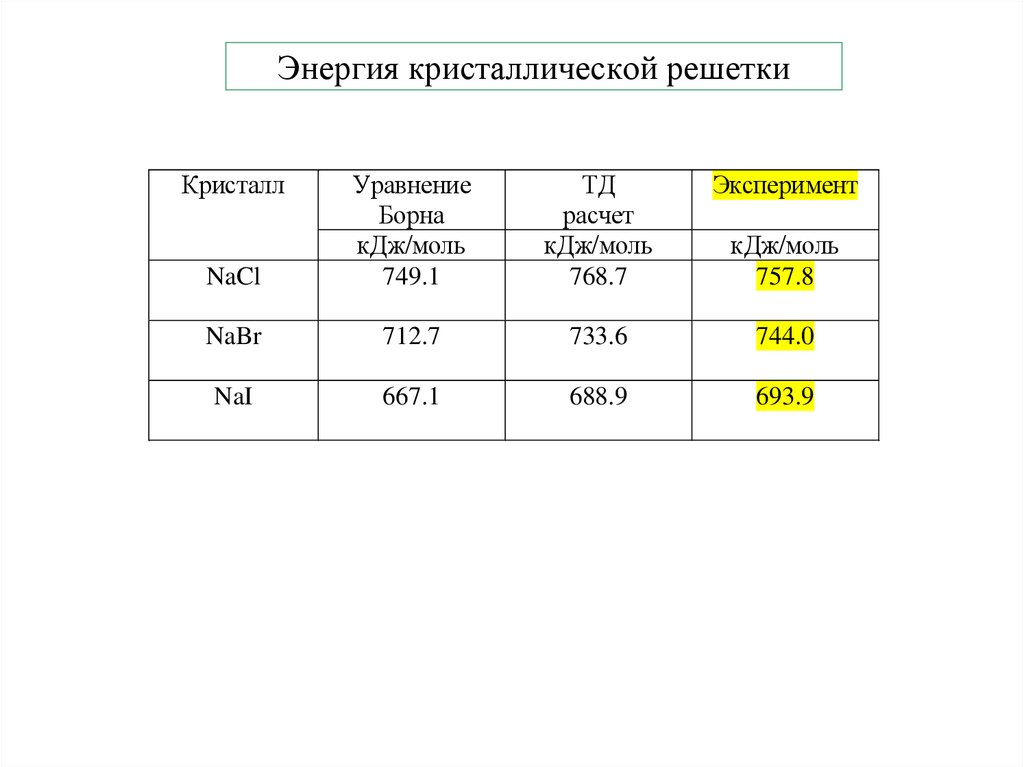
19. Энергия кристаллической решетки
КристаллТД
расчет
кДж/моль
768.7
Эксперимент
NaCl
Уравнение
Борна
кДж/моль
749.1
NaBr
712.7
733.6
744.0
NaI
667.1
688.9
693.9
кДж/моль
757.8
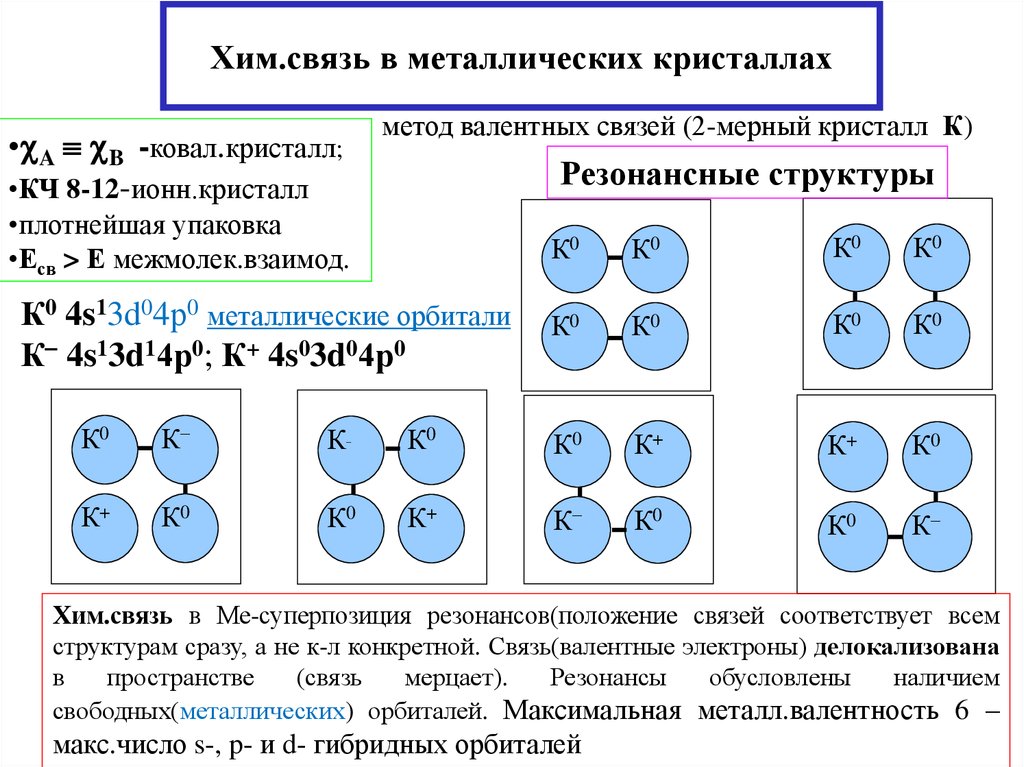
20. Хим.связь в металлических кристаллах
метод валентных связей (2-мерный кристалл К)• A B -ковал.кристалл;
•КЧ 8-12-ионн.кристалл
Резонансные структуры
•плотнейшая упаковка
•Есв > Е межмолек.взаимод.
К0 4s13d04р0 металлические орбитали
К 4s13d14р0; К+ 4s03d04р0
К0
К0
К0
К0
К0
К0
К0
К0
К0
К
К
К0
К0
К+
К+
К0
К+
К0
К0
К+
К
К0
К0
К
Хим.связь в Ме-суперпозиция резонансов(положение связей соответствует всем
структурам сразу, а не к-л конкретной. Связь(валентные электроны) делокализована
в
пространстве
(связь
мерцает).
Резонансы
обусловлены
наличием
свободных(металлических) орбиталей. Максимальная металл.валентность 6 –
макс.число s-, p- и d- гибридных орбиталей
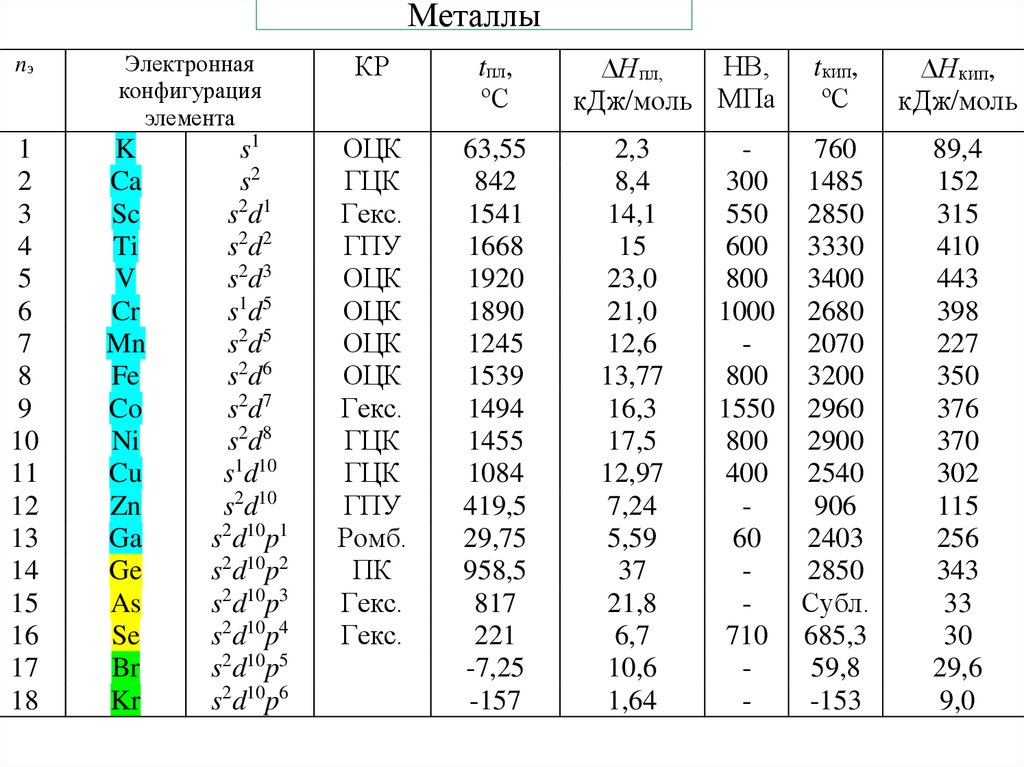
21. Металлы
nэ1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Электронная
конфигурация
элемента
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
s1
s2
s2d1
s2d2
s2d3
s1d5
s2d5
s2d6
s2d7
s2d8
s1d10
s2d10
s2d10p1
s2d10p2
s2d10p3
s2d10p4
s2d10p5
s2d10p6
КР
tпл,
о
С
ОЦК
ГЦК
Гекс.
ГПУ
ОЦК
ОЦК
ОЦК
ОЦК
Гекс.
ГЦК
ГЦК
ГПУ
Ромб.
ПК
Гекс.
Гекс.
63,55
842
1541
1668
1920
1890
1245
1539
1494
1455
1084
419,5
29,75
958,5
817
221
-7,25
-157
НВ,
Нпл,
кДж/моль МПа
2,3
8,4
14,1
15
23,0
21,0
12,6
13,77
16,3
17,5
12,97
7,24
5,59
37
21,8
6,7
10,6
1,64
tкип,
о
С
760
300 1485
550 2850
600 3330
800 3400
1000 2680
2070
800 3200
1550 2960
800 2900
400 2540
906
60
2403
2850
Cубл.
710 685,3
59,8
-153
Нкип,
кДж/моль
89,4
152
315
410
443
398
227
350
376
370
302
115
256
343
33
30
29,6
9,0
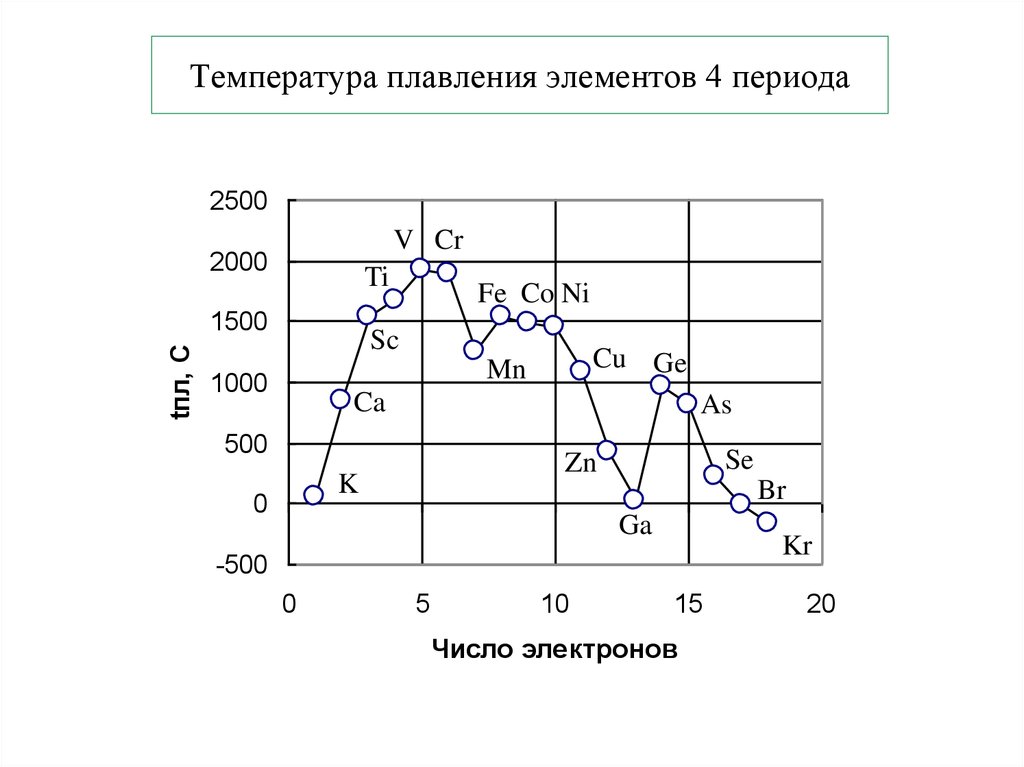
22. Температура плавления элементов 4 периода
2500V Cr
2000
Ti
tпл, С
1500
Fe Co Ni
Sc
Cu Ge
Mn
1000
Ca
As
500
K
0
Se
Zn
Br
Ga
Kr
-500
0
5
10
15
Число электронов
20
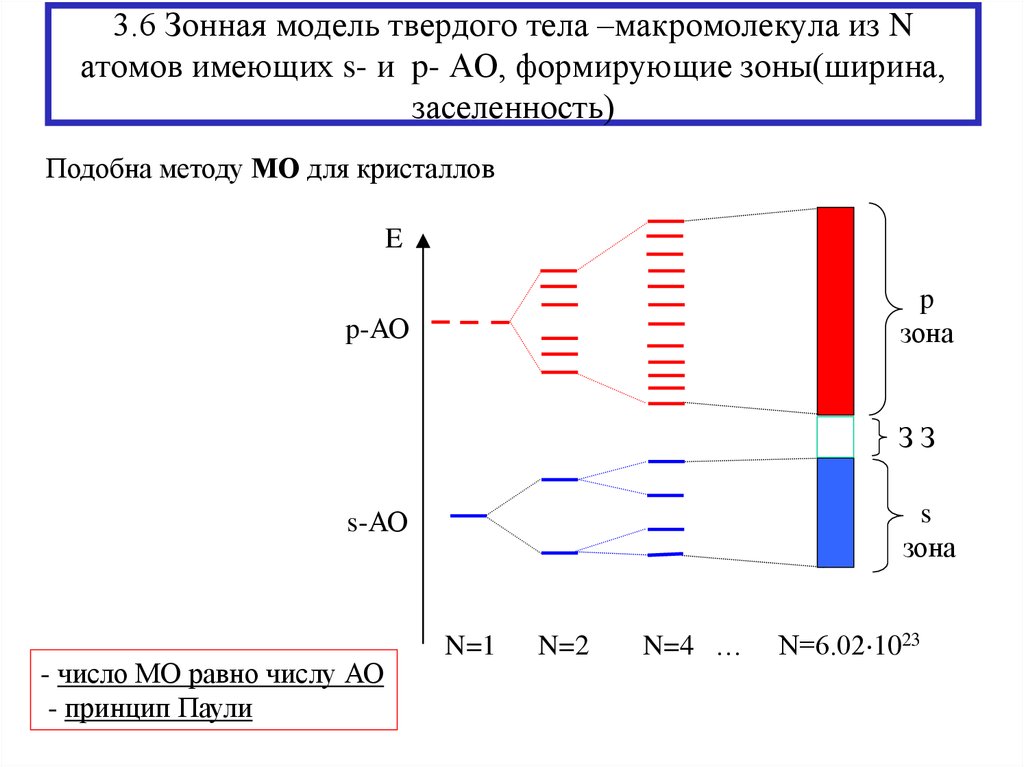
23. 3.6 Зонная модель твердого тела –макромолекула из N атомов имеющих s- и p- АО, формирующие зоны(ширина, заселенность)
Подобна методу МО для кристалловE
p
зона
p-АО
ЗЗ
s
зона
s-АО
- число МО равно числу АО
- принцип Паули
N=1
N=2
N=4 …
N=6.02 1023
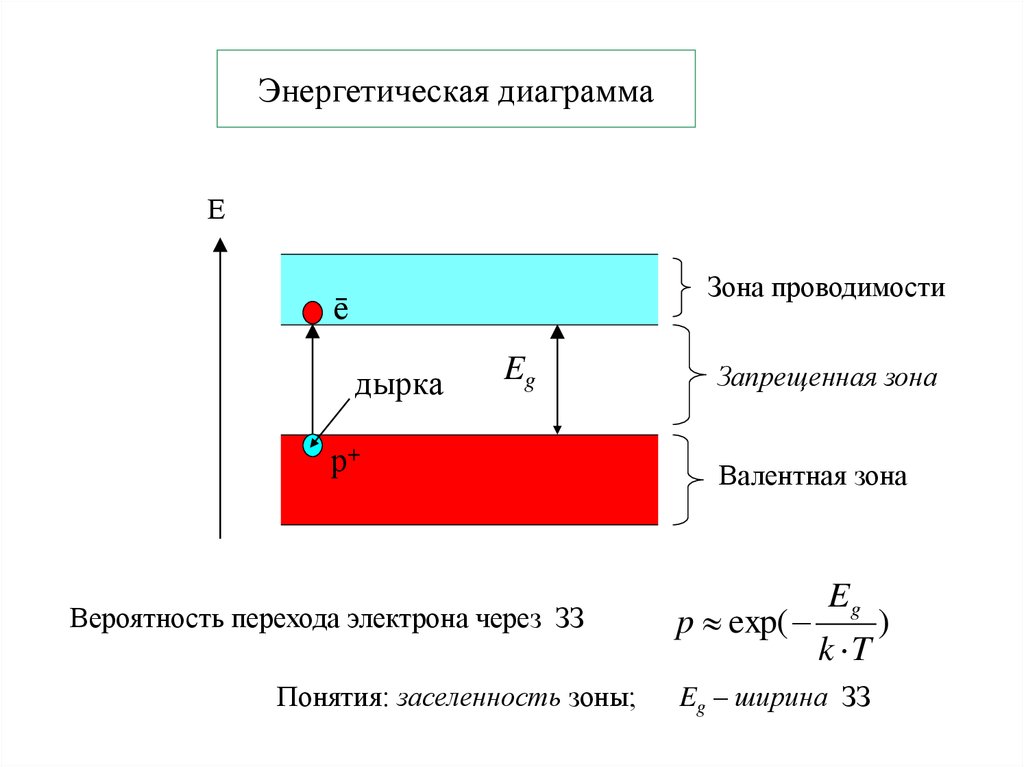
24. Энергетическая диаграмма
ЕЗона проводимости
ē
дырка
Eg
р+
Вероятность перехода электрона через ЗЗ
Понятия: заселенность зоны;
Запрещенная зона
Валентная зона
p exp(
Eg
k T
Eg – ширина ЗЗ
)
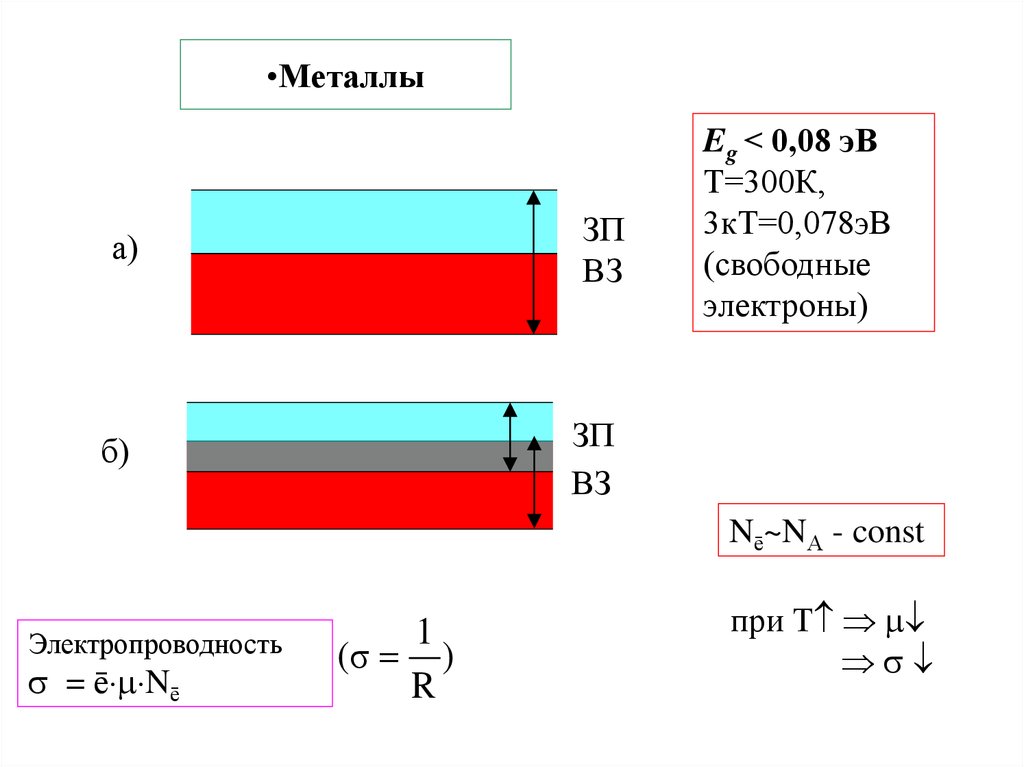
25. Металлы
•МеталлыЗП
ВЗ
а)
Eg < 0,08 эВ
Т=300К,
3кТ=0,078эВ
(свободные
электроны)
ЗП
ВЗ
б)
Nē~NА - const
Электропроводность
= ē Nē
1
(σ )
R
при Т
26. Диэлектрики
• ДиэлектрикиEg > > 3 эВ > > кТ-энергии тепловых колебаний
Eg
Nē = 0
=0
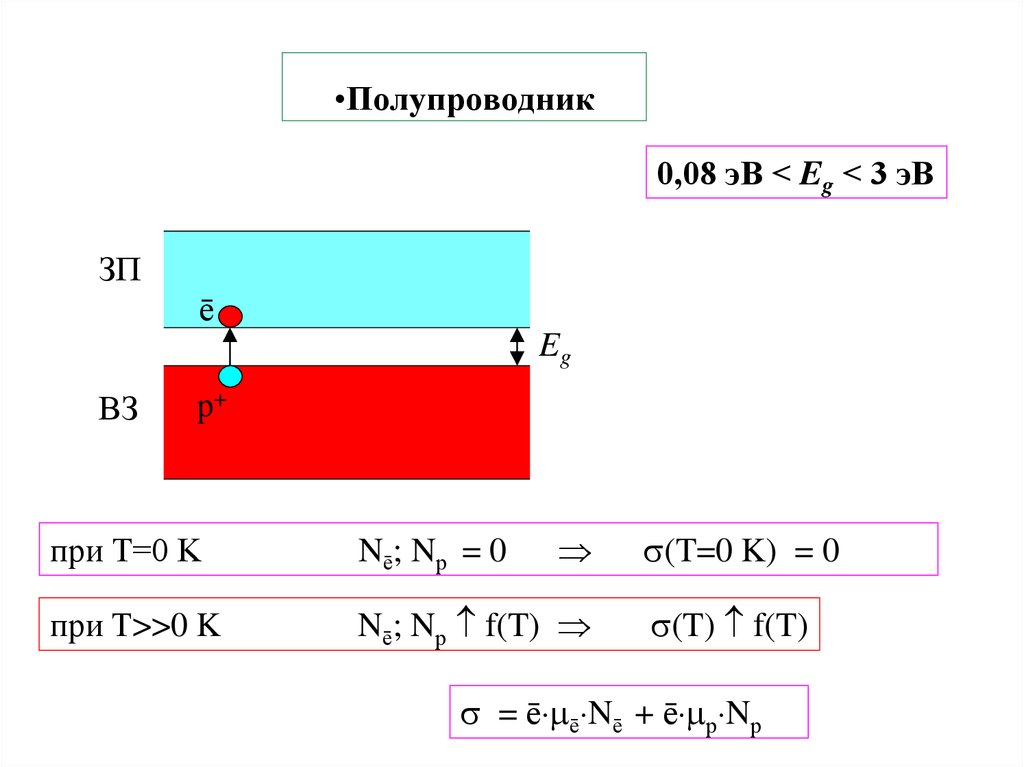
27. Полупроводник
•Полупроводник0,08 эВ < Eg < 3 эВ
ЗП
ē
Eg
ВЗ
р+
при T=0 K
Nē; Nр = 0
при T>>0 K
Nē; Nр f(T)
(T=0 K) = 0
(T) f(T)
= ē ē Nē + ē р Nр
28. 3.7 Кристаллические материалы
•Дефекты кристаллической решеткиЭлектронные(электронно-дырочная пара, несимм.разрыв хим.св.) ē-р(А - А+);
Экситоны(без разрыва хим.связи) ex0 (А*) - 2 простейших точечных дефекта
Точечные дефекты(нарушение регулярности):
собственные:
вакансии(отсутствие частицы в узле
решетки; межузельные атомы или ионы
AG
A*
V
A
A+
A- i
примесные (случайные или спец.вводятся)
Линейные дефекты(дислокации)-линии вдоль которых нарушено
правильное чередование атомных плоскостей(краевые, винтовые)
Двумерные(поверхности, границы кристаллических зерен)
Объемные(пузыри)
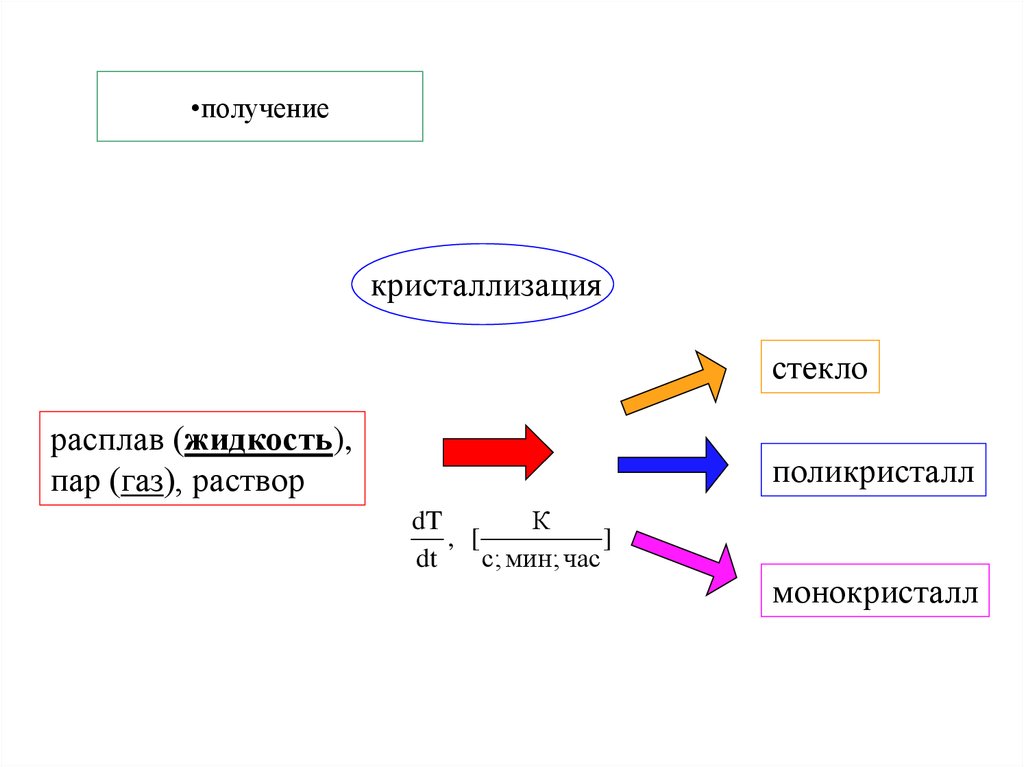
29. получение
•получениекристаллизация
стекло
расплав (жидкость),
пар (газ), раствор
поликристалл
dT
К
, [
]
dt
с; мин; час
монокристалл
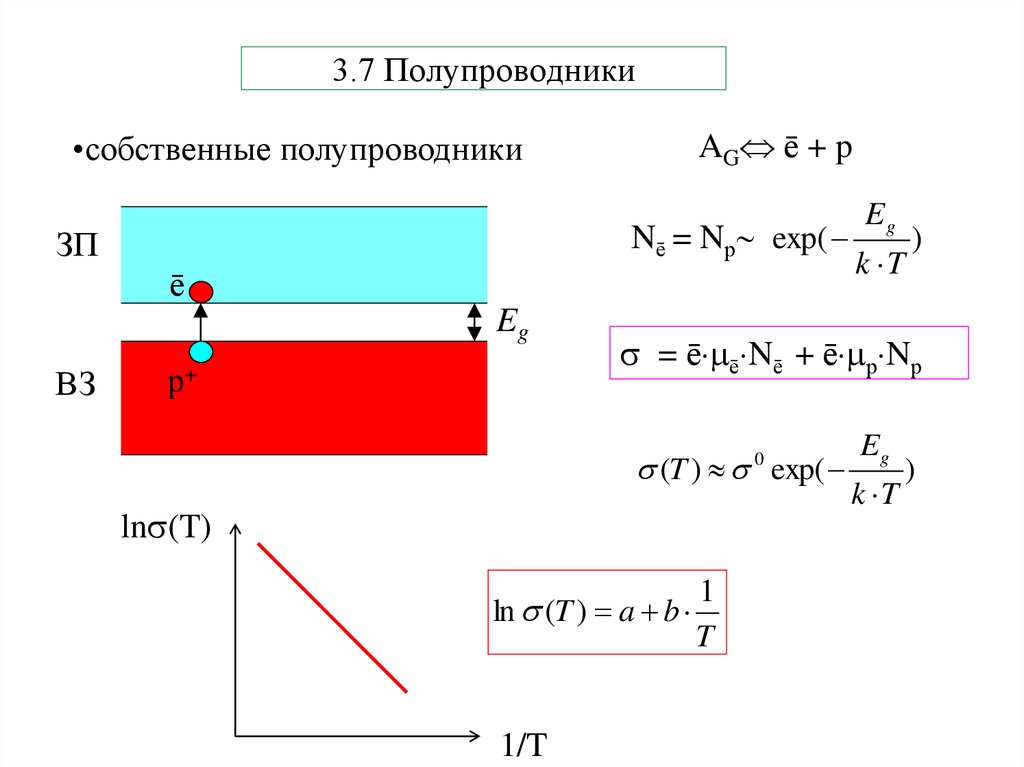
30. 3.7 Полупроводники
•собственные полупроводникиAG ē + p
Nē = Nр exp(
ЗП
ē
Eg
ВЗ
р+
k T
)
= ē ē Nē + ē р Nр
(T ) exp(
0
ln (T)
1
ln (T ) a b
T
1/T
Eg
Eg
k T
)
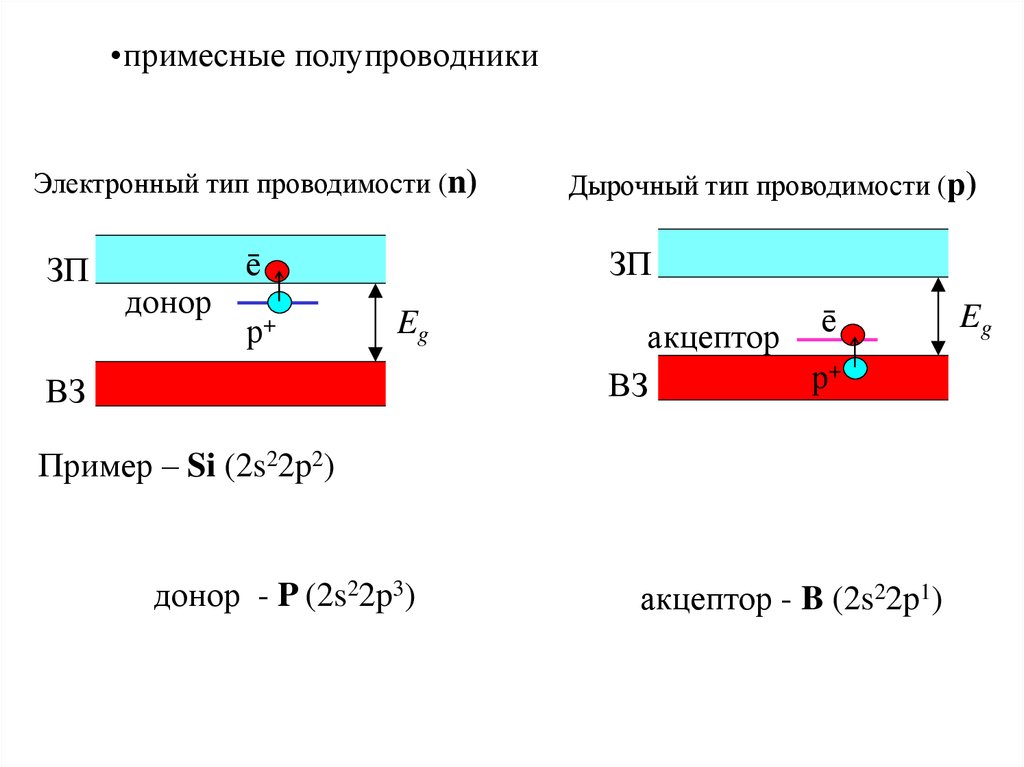
31. примесные полупроводники
•примесные полупроводникиЭлектронный тип проводимости (n)
ЗП
донор
ē
р+
Дырочный тип проводимости (р)
ЗП
Eg
ВЗ
ē
акцептор
р+
ВЗ
Пример – Si (2s22p2)
донор - P (2s22p3)
акцептор - B (2s22p1)
Eg
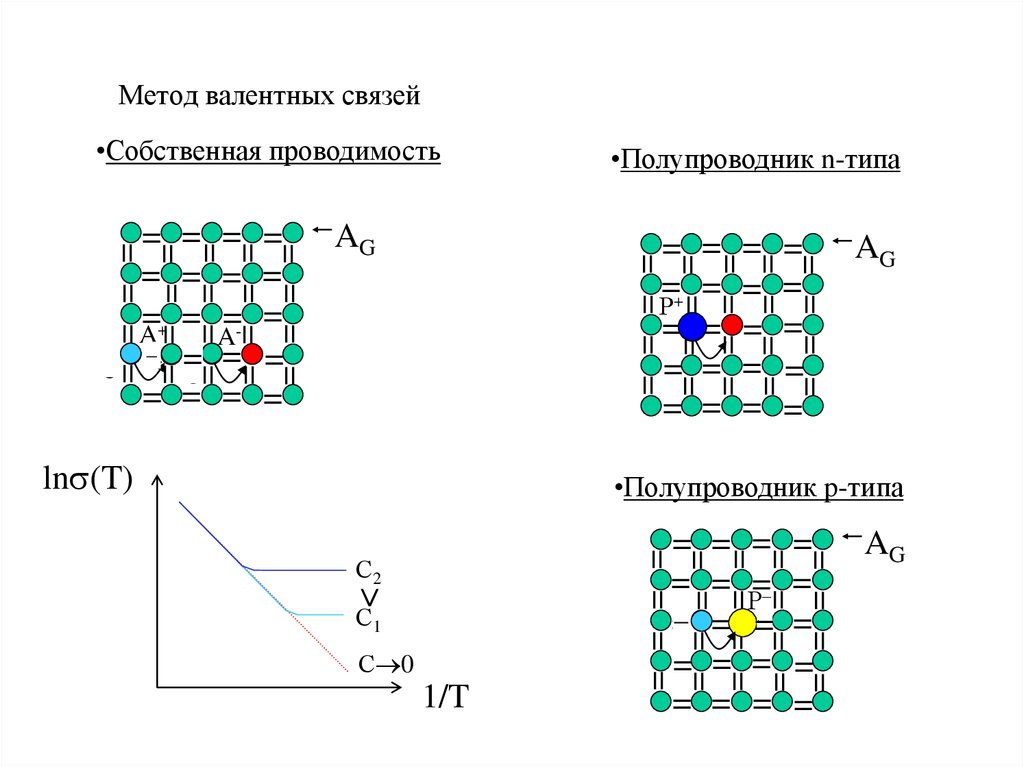
32. Метод валентных связей
•Собственная проводимость=
=
=
A=
=
=
=
=
=
=
AG
=
=
Р+
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
ē
=
=
=
=
=
=
=
=
=
A+
ē =
=
•Полупроводник n-типа
AG
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
ln (T)
•Полупроводник p-типа
=
=
=
=
=
=
=
Р
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
=
<
С2
=
=
=
=
=
С1
1/T
=
=
=
=
=
С 0
AG

![Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей] Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей]](https://cf.ppt-online.org/files/slide/j/jwrTCiHyvASfMxelLGWQRZbIdo69BmuOqNYEF1/slide-4.jpg)



 Химия
Химия








