Похожие презентации:
Экзаменационные вопросы. Химическая связь в твердых телах
1.
Экзаменационные вопросы2. Химическая связь в твердых телах
1. Агрегатные состояния вещества. Среднее расстояние (размеры пространства) между частицами в
зависимости от агрегатного состояния.
2. Полярность связи и дипольный момент молекулы. Межмолекулярное взаимодействие (силы Вандер-Ваальса). Типы взаимодействия диполей.
3. Водородная связь.
4. Твердые тела. Химическая связь в твердом теле. Кристаллическое состояние вещества.
Плотнейшая упаковка. Кристаллическая решетка. Элементарные ячейки. Кубические простейшие
элементарные ячейки. Типы кристаллов.
5. Ковалентные (атомные) кристаллы. Молекулярные кристаллы
6. Ионные кристаллы. Ионный тип и энергия химической связи. Химическая связь в металлических
кристаллах.
7. Зонная модель кристаллического тела: металлы, полупроводники и диэлектрики.
8. Кристаллические материалы. Дефекты кристаллической решетки.
9. Химическая связь в аморфных твердых телах и жидкостях.
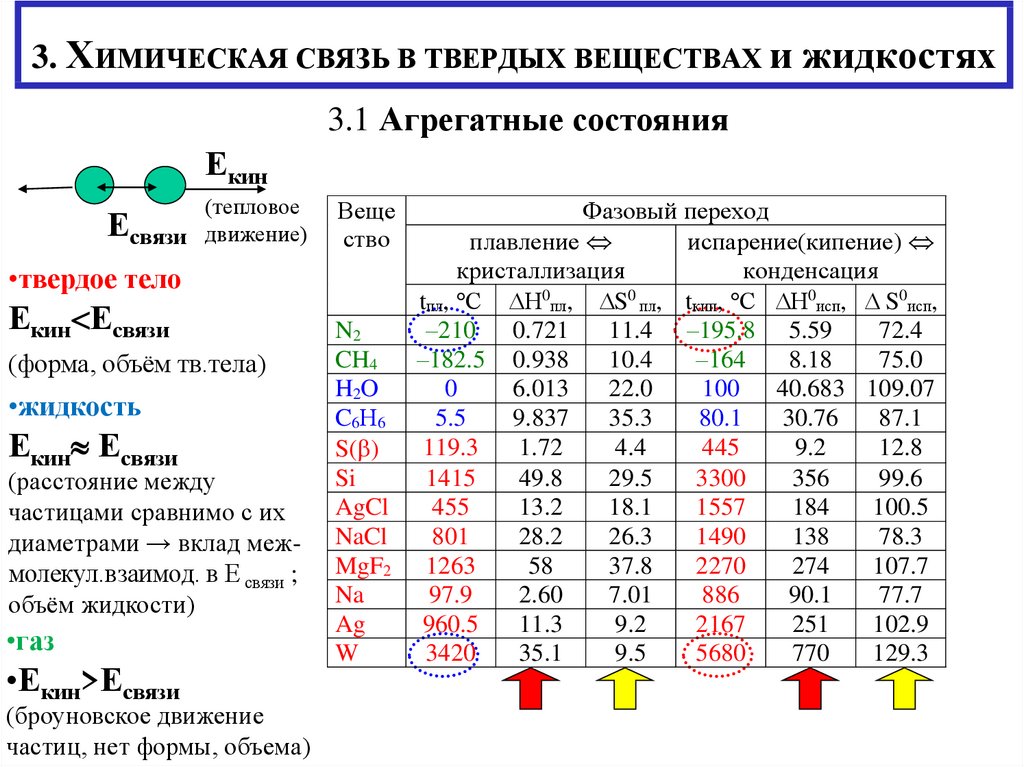
2. 3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях
3.1 Агрегатные состоянияЕкин
(тепловое
Есвязи движение)
Веще
ство
•твердое тело
Екин Есвязи
(форма, объём тв.тела)
•жидкость
Екин Есвязи
(расстояние между
частицами сравнимо с их
диаметрами → вклад межмолекул.взаимод. в Е связи ;
объём жидкости)
•газ
•Екин>Есвязи
(броуновское движение
частиц, нет формы, объема)
N2
CH4
H2O
C6Н6
S( )
Si
AgCl
NaCl
MgF2
Na
Ag
W
Фазовый переход
плавление
испарение(кипение)
кристаллизация
конденсация
0
0
tпл, С Н пл, S пл, tкип, С Н0исп, S0исп,
–210
0.721
11.4 –195.8 5.59
72.4
–182.5 0.938
10.4
–164
8.18
75.0
0
6.013
22.0
100 40.683 109.07
5.5
9.837
35.3
80.1
30.76
87.1
119.3
1.72
4.4
445
9.2
12.8
1415
49.8
29.5
3300
356
99.6
455
13.2
18.1
1557
184
100.5
801
28.2
26.3
1490
138
78.3
1263
58
37.8
2270
274
107.7
97.9
2.60
7.01
886
90.1
77.7
960.5
11.3
9.2
2167
251
102.9
3420
35.1
9.5
5680
770
129.3
3. Среднее расстояние (размеры пространства) между частицами
1 моль NA = 6.02 1023 частицГаз
0
для
одной
частицы
V = 22.4 л a V 33 А, ребро
V = V / NA куба
серебро Vν
0
a
a
d N2 3 А
M
108
10.3 cм 3
ρ 10.50
0
0
a 2.6 А d Ag 2.68 А
d
a
Кристалл(твёрдое в-во)
d
a
Жидкость - бром (Br2)
M 160
Vν
51.2 cм 3
ρ 3.12
0
a 4.4 А
d Br2 4.5 А
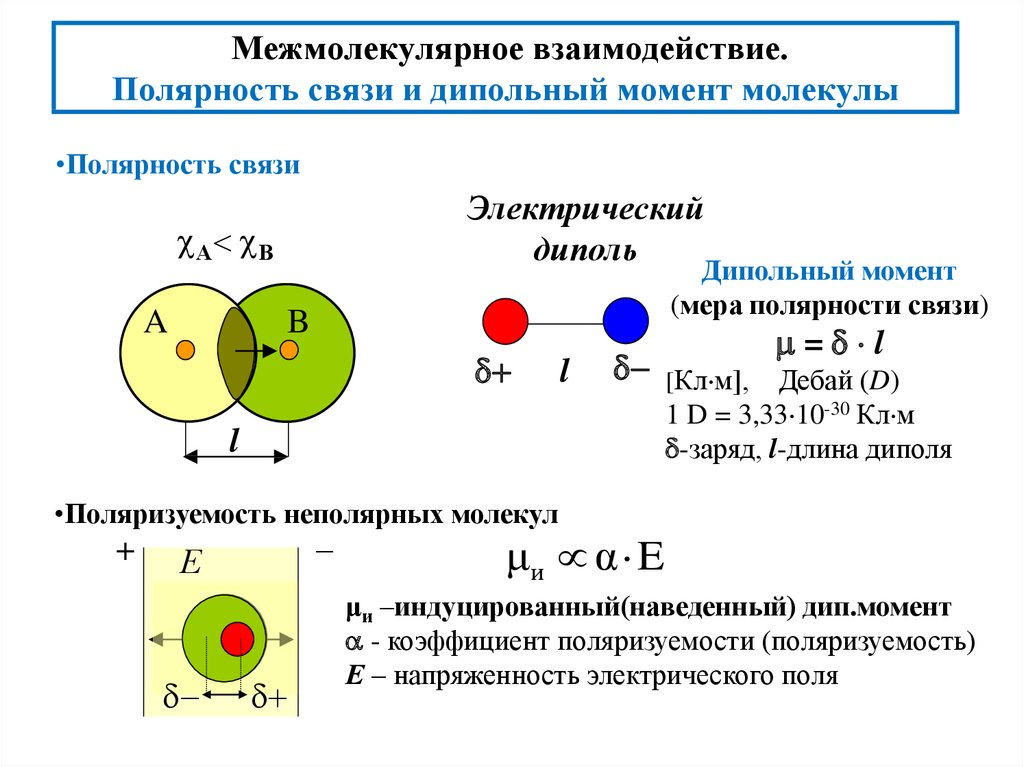
4. Межмолекулярное взаимодействие. Полярность связи и дипольный момент молекулы
•Полярность связиЭлектрический
диполь
А В
A
Дипольный момент
(мера полярности связи)
B
l
= l
[Кл м], Дебай (D)
1 D = 3,33 10-30 Кл м
-заряд, l-длина диполя
l
•Поляризуемость неполярных молекул
+
–
Е
μи α E
μи –индуцированный(наведенный) дип.момент
- коэффициент поляризуемости (поляризуемость)
Е – напряженность электрического поля
5. Дипольный момент молекул (зависит от их симметрии молекул)
МолекулаДипольный Дипольный
момент
момент
связи, D
молекулы, D
Строение
молекулы
О
O3
H2O
CO2
0
1,5
2,7
0
1,84
0
О
О
Н +
+
О
Н
+
O
С O
6. Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)]
1. Ориентационный эффект (Кьезома) [взаимодействие(электростатическоепритяжение) пост.диполь – пост.диполь] [полярные молекулы]
+
1
+
2
+
+
E ор
1. 2
r 6T
2. Индукционный эффект (Дебая ) [взаимодействие постоянный диполь –
наведенный(индуцированный) диполь][полярная – неполярная молекулы]
- +
E инд
μ2 α
6
r
3. Дисперсионный эффект (Лондона) [взаимодействие мгновенных диполей,
за счет неравномерности электронн.плотности, колебания ядер] [неполярные
молекулы]
1
2
α1 α 2
E
дис
r6
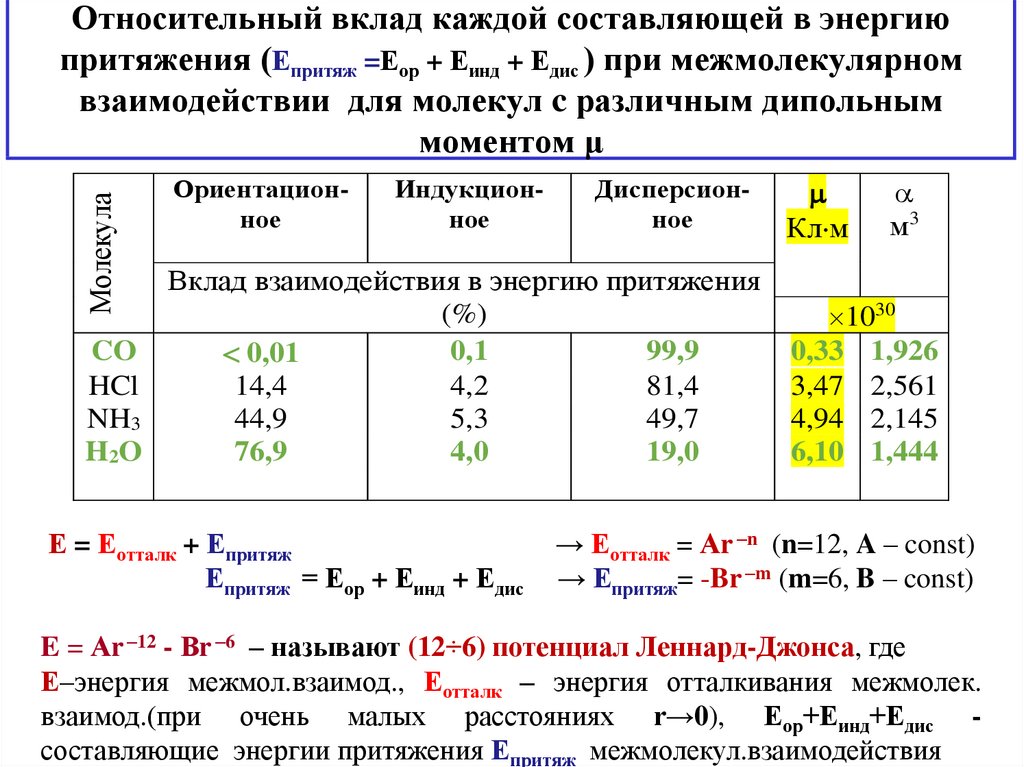
7. Относительный вклад каждой составляющей в энергию притяжения (Епритяж =Еор + Еинд + Едис ) при межмолекулярном взаимодействии
МолекулаОтносительный вклад каждой составляющей в энергию
притяжения (Епритяж =Еор + Еинд + Едис ) при межмолекулярном
взаимодействии для молекул c различным дипольным
моментом μ
Ориентационное
Индукционное
Дисперсионное
Вклад взаимодействия в энергию притяжения
(%)
CO
0,1
99,9
0,01
HCl
14,4
4,2
81,4
NH3
44,9
5,3
49,7
H2 O
76,9
4,0
19,0
Е = Еотталк + Епритяж
Епритяж = Еор + Еинд + Едис
Кл м
м3
1030
0,33 1,926
3,47 2,561
4,94 2,145
6,10 1,444
→ Еотталк = Аr –n (n=12, A – const)
→ Епритяж= -Br –m (m=6, B – const)
E = Аr –12 - Вr –6 – называют (12÷6) потенциал Леннард-Джонса, где
Е–энергия межмол.взаимод., Еотталк – энергия отталкивания межмолек.
взаимод.(при очень малых расстояниях r→0), Еор+Еинд+Едис составляющие энергии притяжения Епритяж межмолекул.взаимодействия
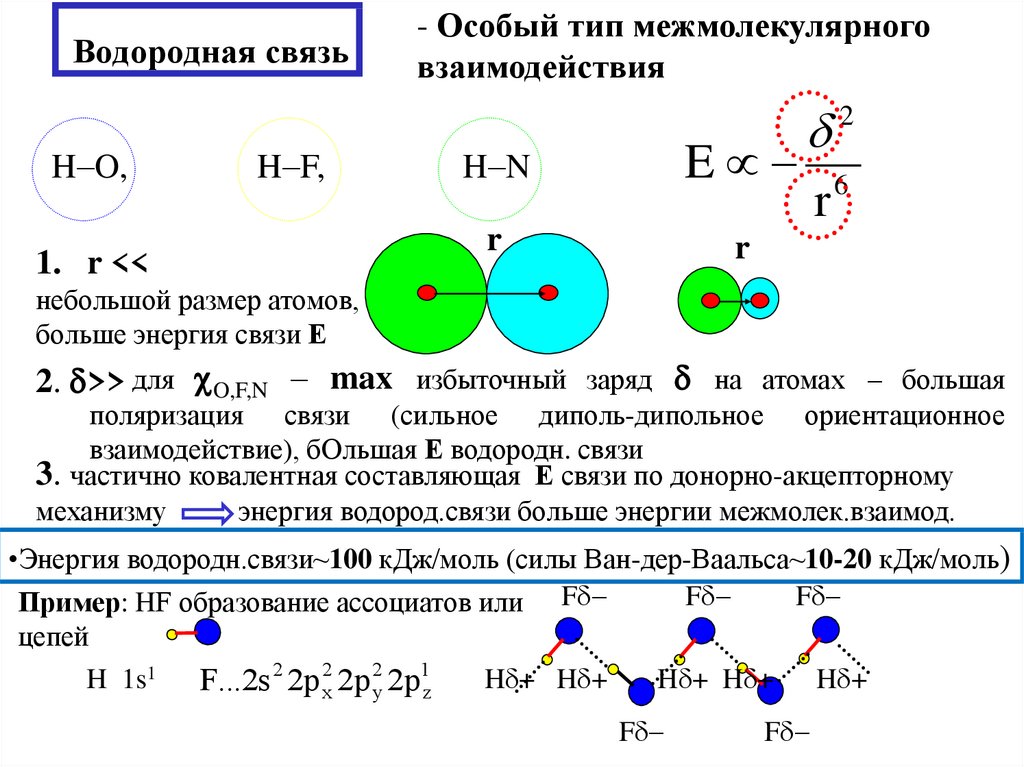
8. Водородная связь
H O,H F,
1. r <<
- Особый тип межмолекулярного
взаимодействия
H N
E
r
r
2
r
6
небольшой размер атомов,
больше энергия связи Е
2. >> для O,F,N – max избыточный заряд на атомах – большая
поляризация связи (сильное диполь-дипольное ориентационное
взаимодействие), бОльшая Е водородн. связи
3. частично ковалентная составляющая Е связи по донорно-акцепторному
механизму
энергия водород.связи больше энергии межмолек.взаимод.
•Энергия водородн.связи~100 кДж/моль (силы Ван-дер-Ваальса~10-20 кДж/моль)
F
F
Пример: HF образование ассоциатов или F
цепей
H 1s1
H + H +
H + H + H +
F...2s 2 2p 2x 2p 2y 2p1z
F
F
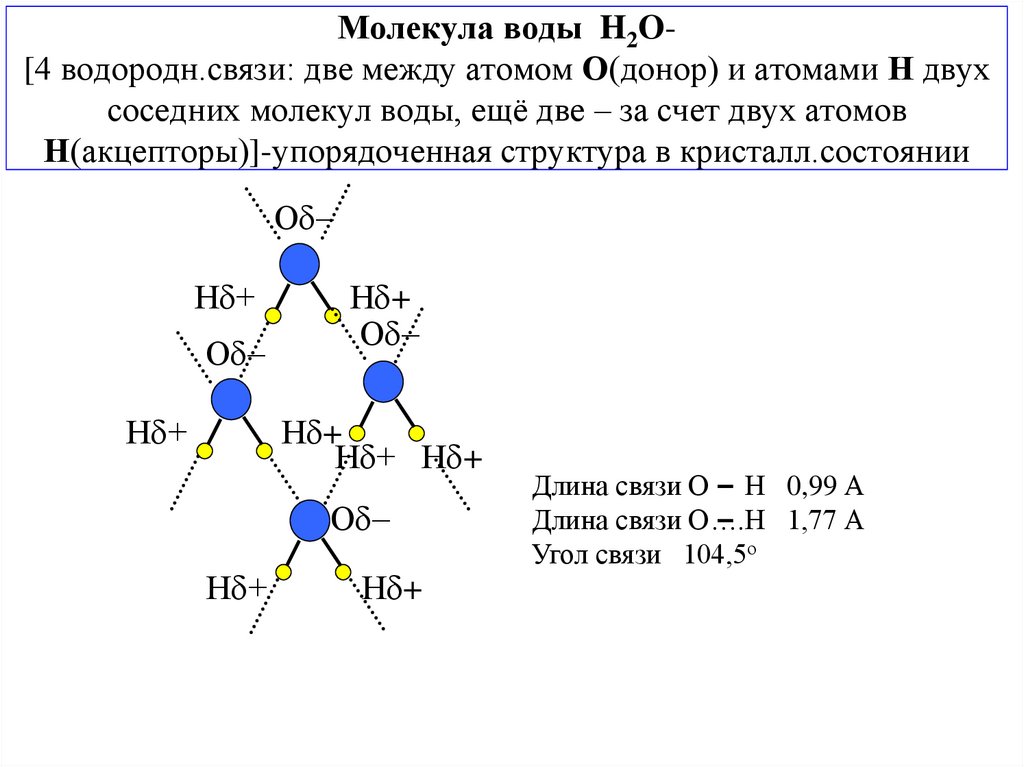
9. Молекула воды H2O- [4 водородн.связи: две между атомом О(донор) и атомами Н двух соседних молекул воды, ещё две – за счет двух
Молекула воды H2O[4 водородн.связи: две между атомом О(донор) и атомами Н двухсоседних молекул воды, ещё две – за счет двух атомов
Н(акцепторы)]-упорядоченная структура в кристалл.состоянии
О
Н +
О
Н +
Н +
О
Н +
Н + Н +
О
Н +
Н +
Длина связи О Н 0,99 А
Длина связи О….Н 1,77 А
Угол связи 104,5о
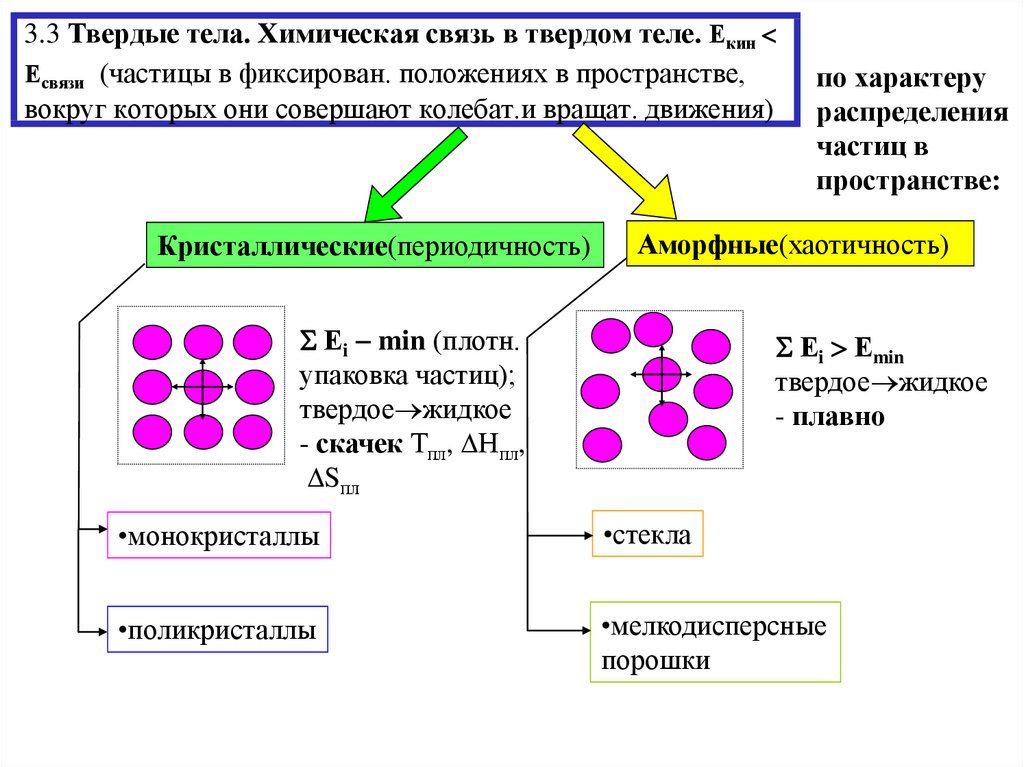
10. 3.3 Твердые тела. Химическая связь в твердом теле. Екин Есвязи (частицы в фиксирован. положениях в пространстве, вокруг
3.3 Твердые тела. Химическая связь в твердом теле. ЕкинЕсвязи (частицы в фиксирован. положениях в пространстве,
вокруг которых они совершают колебат.и вращат. движения)
Кристаллические(периодичность)
по характеру
распределения
частиц в
пространстве:
Аморфные(хаотичность)
Еi min (плотн.
упаковка частиц);
твердое жидкое
- скачек Тпл, Нпл,
Sпл
Еi Еmin
твердое жидкое
- плавно
•монокристаллы
•стекла
•поликристаллы
•мелкодисперсные
порошки
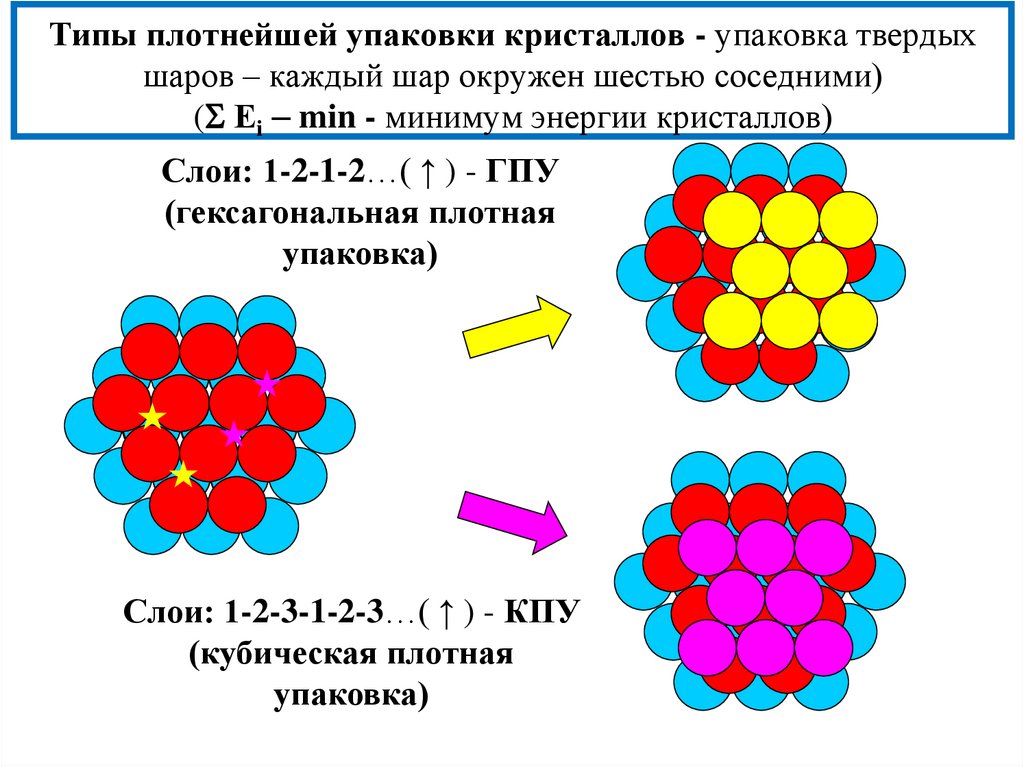
11. Типы плотнейшей упаковки кристаллов - упаковка твердых шаров – каждый шар окружен шестью соседними) ( Еi min - минимум
Типы плотнейшей упаковки кристаллов - упаковка твердыхшаров – каждый шар окружен шестью соседними)
( Еi min - минимум энергии кристаллов)
Слои: 1-2-1-2…( ↑ ) - ГПУ
(гексагональная плотная
упаковка)
Слои: 1-2-3-1-2-3…( ↑ ) - КПУ
(кубическая плотная
упаковка)
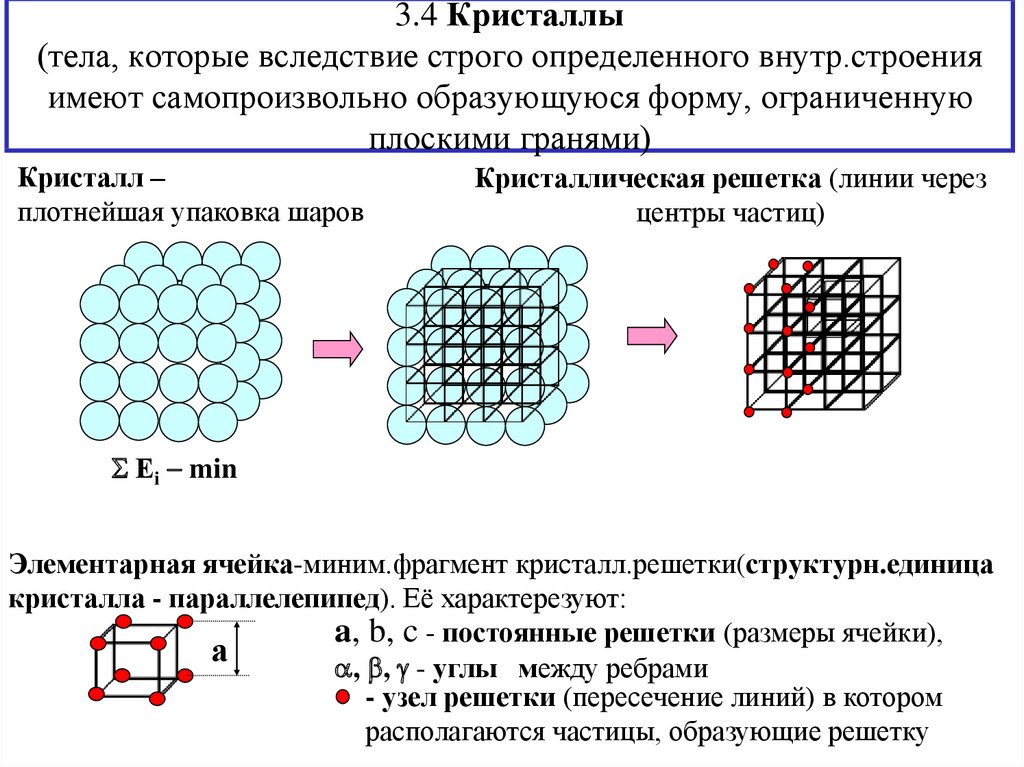
12. 3.4 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму,
ограниченнуюплоскими гранями)
Кристалл –
плотнейшая упаковка шаров
Кристаллическая решетка (линии через
центры частиц)
Еi min
Элементарная ячейка-миним.фрагмент кристалл.решетки(структурн.единица
кристалла - параллелепипед). Её характерезуют:
a, b, c - постоянные решетки (размеры ячейки),
а
, , - углы между ребрами
- узел решетки (пересечение линий) в котором
располагаются частицы, образующие решетку
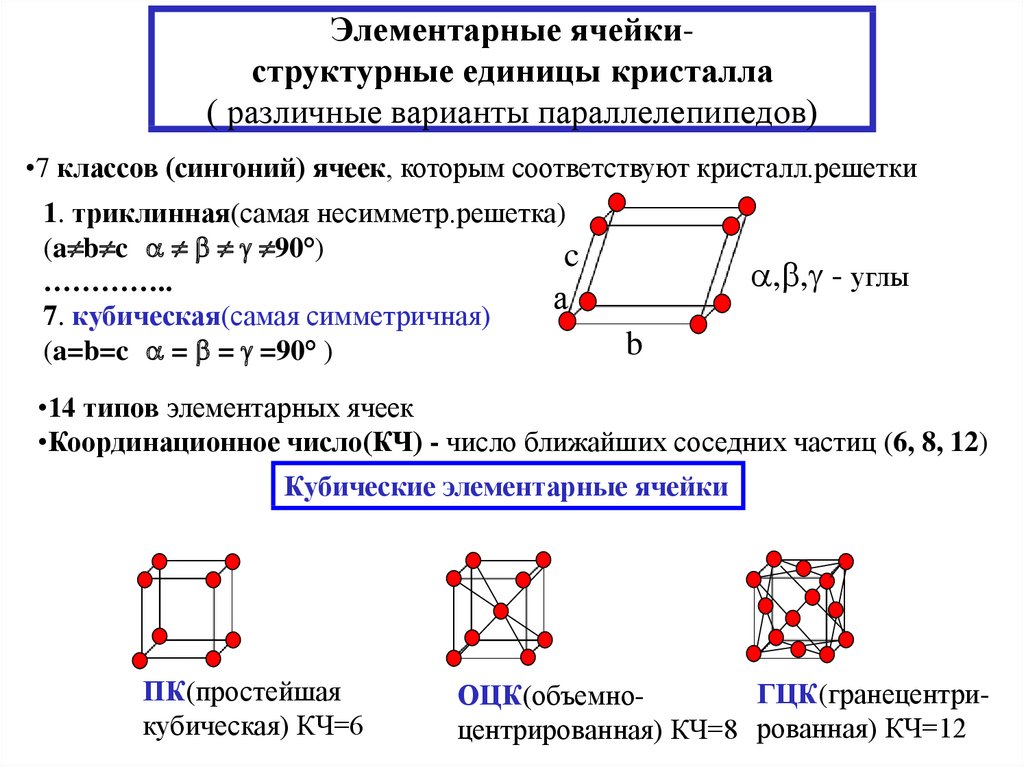
13. Элементарные ячейки- структурные единицы кристалла ( различные варианты параллелепипедов)
Элементарные ячейкиструктурные единицы кристалла( различные варианты параллелепипедов)
•7 классов (сингоний) ячеек, которым соответствуют кристалл.решетки
1. триклинная(самая несимметр.решетка)
(a b c 90°)
c
…………..
а
7. кубическая(самая симметричная)
(a=b=c = = =90° )
, , - углы
b
•14 типов элементарных ячеек
•Координационное число(КЧ) - число ближайших соседних частиц (6, 8, 12)
Кубические элементарные ячейки
ПК(простейшая
кубическая) КЧ=6
ГЦК(гранецентриОЦК(объемноцентрированная) КЧ=8 рованная) КЧ=12
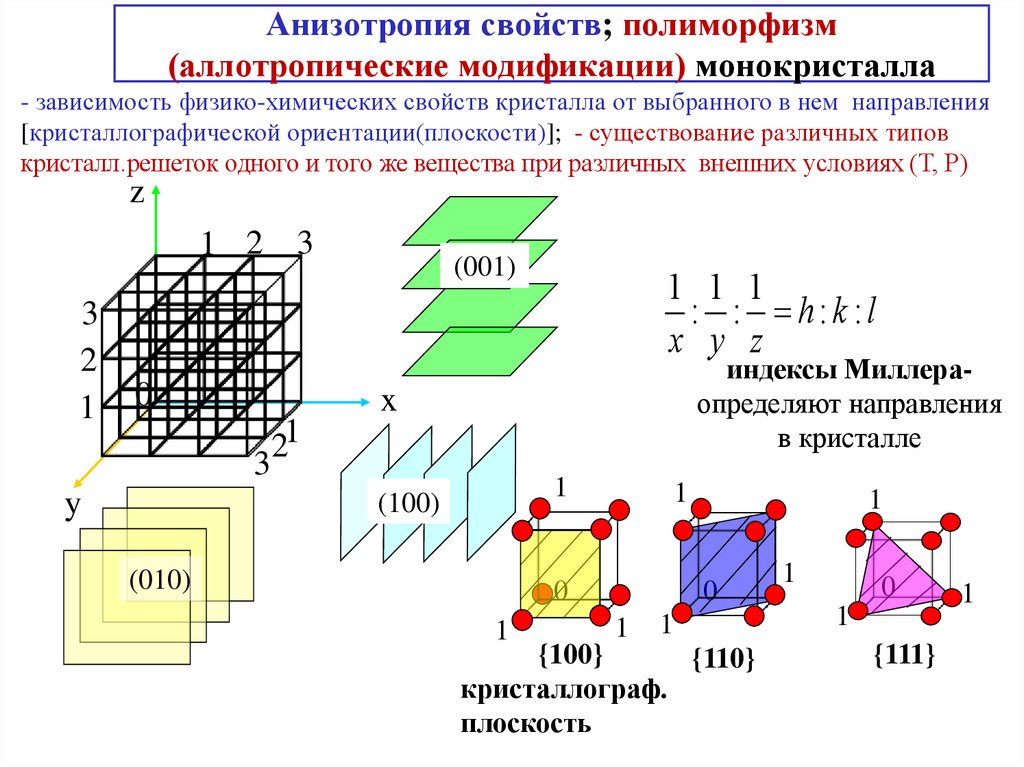
14. Анизотропия свойств; полиморфизм (аллотропические модификации) монокристалла
- зависимость физико-химических свойств кристалла от выбранного в нем направления[кристаллографической ориентации(плоскости)]; - существование различных типов
кристалл.решеток одного и того же вещества при различных внешних условиях (Т, Р)
z
1 2 3
3
2
1
0
1 1 1
: : h:k :l
x y z
индексы Миллераопределяют направления
в кристалле
x
3
y
(001)
21
1
(100)
(010)
1
0
0
1
1
1
1
{100}
{110}
кристаллограф.
плоскость
1
0
1
{111}
1
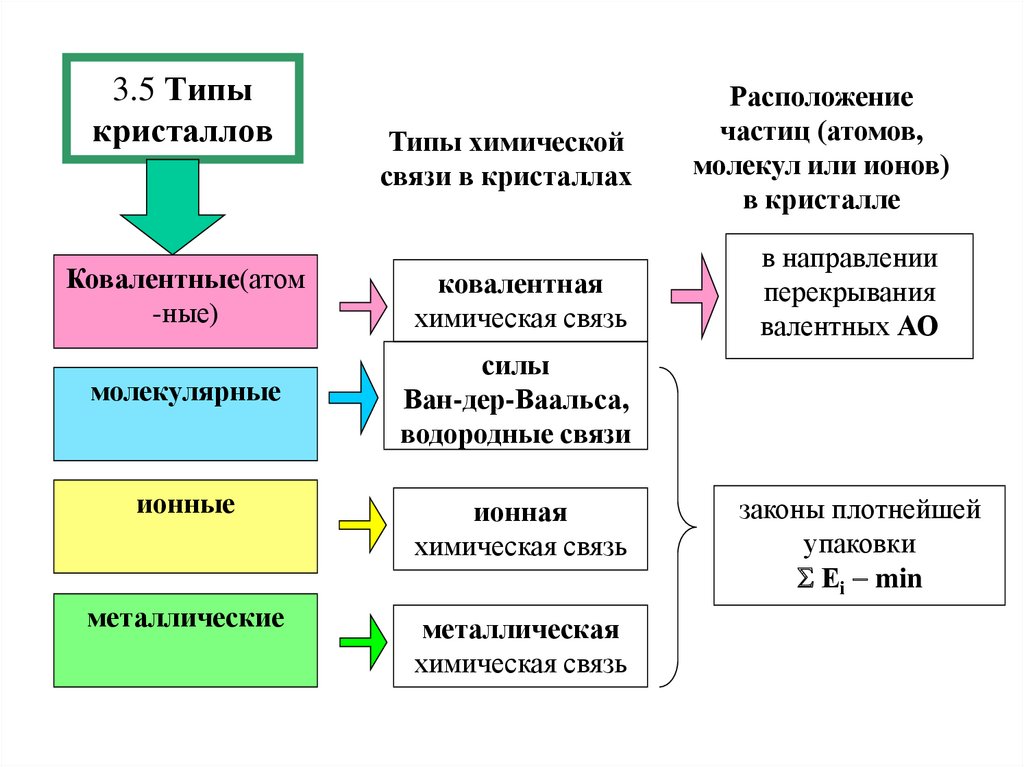
15. 3.5 Типы кристаллов
Типы химическойсвязи в кристаллах
Ковалентные(атом
-ные)
ковалентная
химическая связь
молекулярные
силы
Ван-дер-Ваальса,
водородные связи
ионные
ионная
химическая связь
металлические
металлическая
химическая связь
Расположение
частиц (атомов,
молекул или ионов)
в кристалле
в направлении
перекрывания
валентных АО
законы плотнейшей
упаковки
Еi min
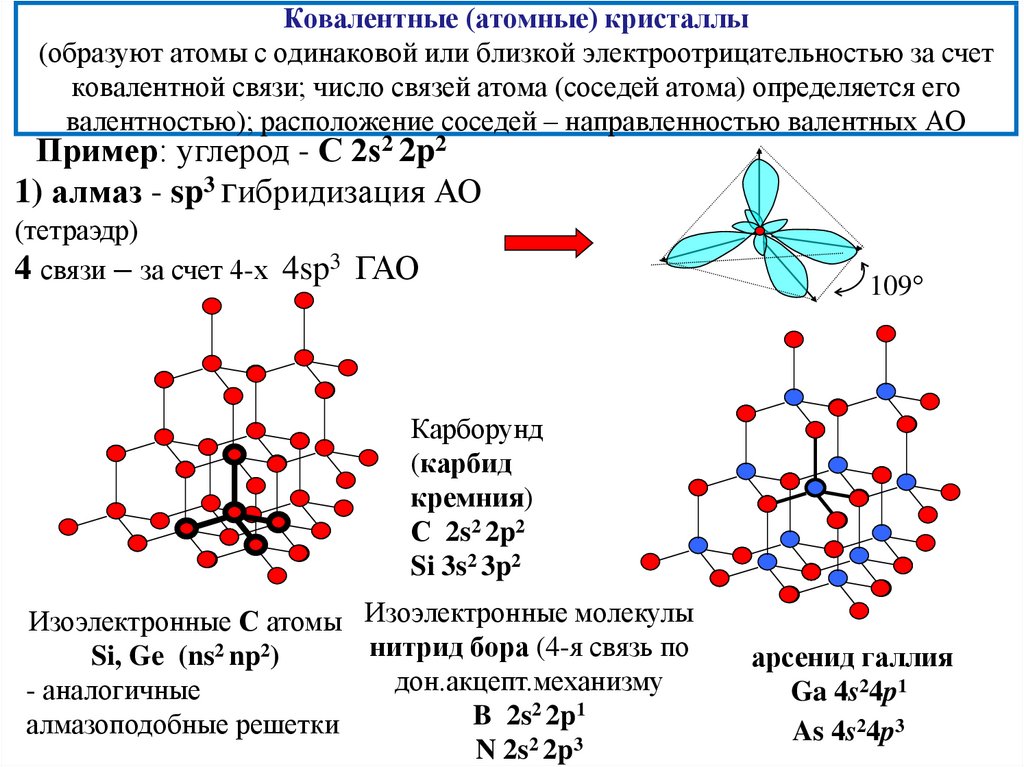
16. Ковалентные (атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью за счет ковалентной связи;
число связей атома (соседей атома) определяется еговалентностью); расположение соседей – направленностью валентных АО
Пример: углерод - С 2s2 2p2
1) алмаз - sp3 гибридизация АО
(тетраэдр)
4 связи – за счет 4-х 4sp3 ГАО
109
Карборунд
(карбид
кремния)
С 2s2 2p2
Si 3s2 3p2
Изоэлектронные С атомы Изоэлектронные молекулы
нитрид бора (4-я связь по
Si, Ge (ns2 np2)
дон.акцепт.механизму
- аналогичные
B 2s2 2p1
алмазоподобные решетки
N 2s2 2p3
арсенид галлия
Ga 4s24p1
As 4s24p3
17. ковалентные кристаллы
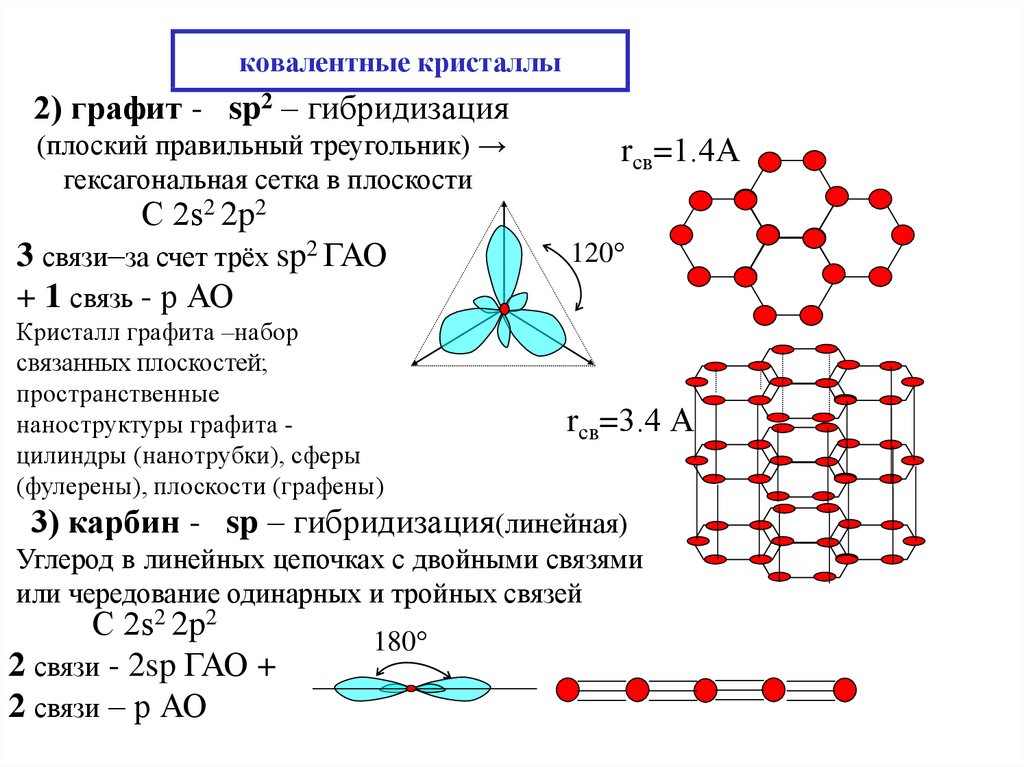
2) графит - sp2 – гибридизация(плоский правильный треугольник) →
гексагональная сетка в плоскости
rсв=1.4А
С 2s2 2p2
3 связи–за счет трёх sp2 ГАО
+ 1 связь - р АО
Кристалл графита –набор
связанных плоскостей;
пространственные
наноструктуры графита цилиндры (нанотрубки), сферы
(фулерены), плоскости (графены)
120
rсв=3.4 А
3) карбин - sp – гибридизация(линейная)
Углерод в линейных цепочках с двойными связями
или чередование одинарных и тройных связей
С 2s2 2p2
2 связи - 2sp ГАО +
2 связи – р АО
180
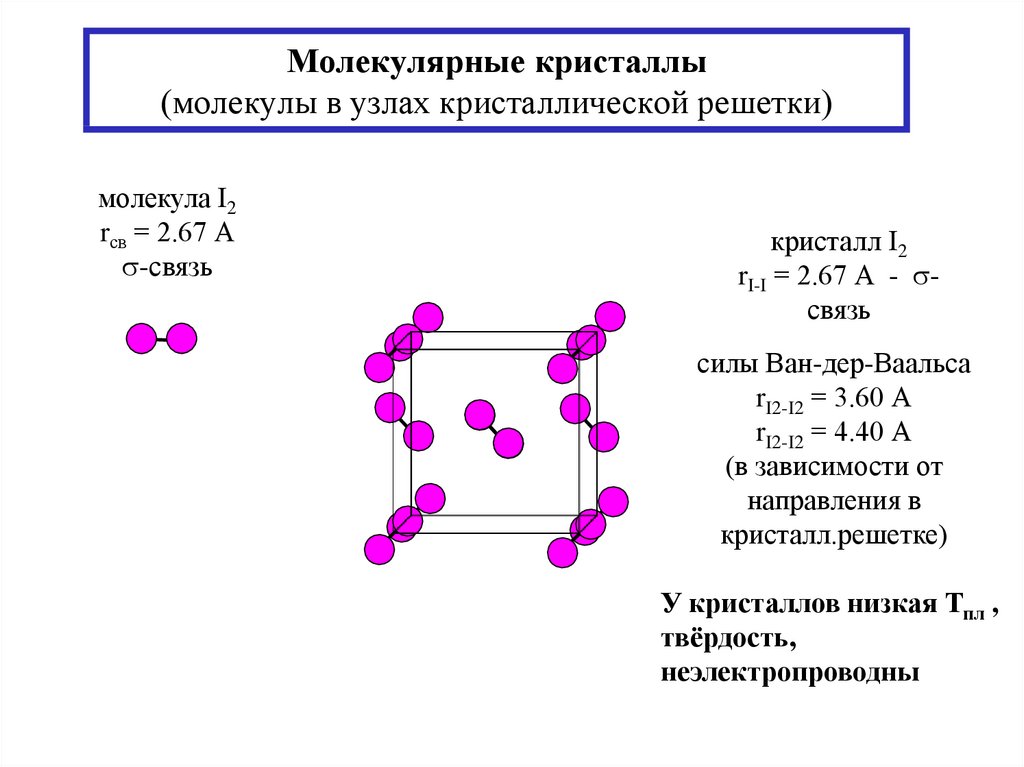
18. Молекулярные кристаллы (молекулы в узлах кристаллической решетки)
молекула I2rсв = 2.67 А
-связь
кристалл I2
rI-I = 2.67 А - связь
силы Ван-дер-Ваальса
rI2-I2 = 3.60 А
rI2-I2 = 4.40 А
(в зависимости от
направления в
кристалл.решетке)
У кристаллов низкая Тпл ,
твёрдость,
неэлектропроводны
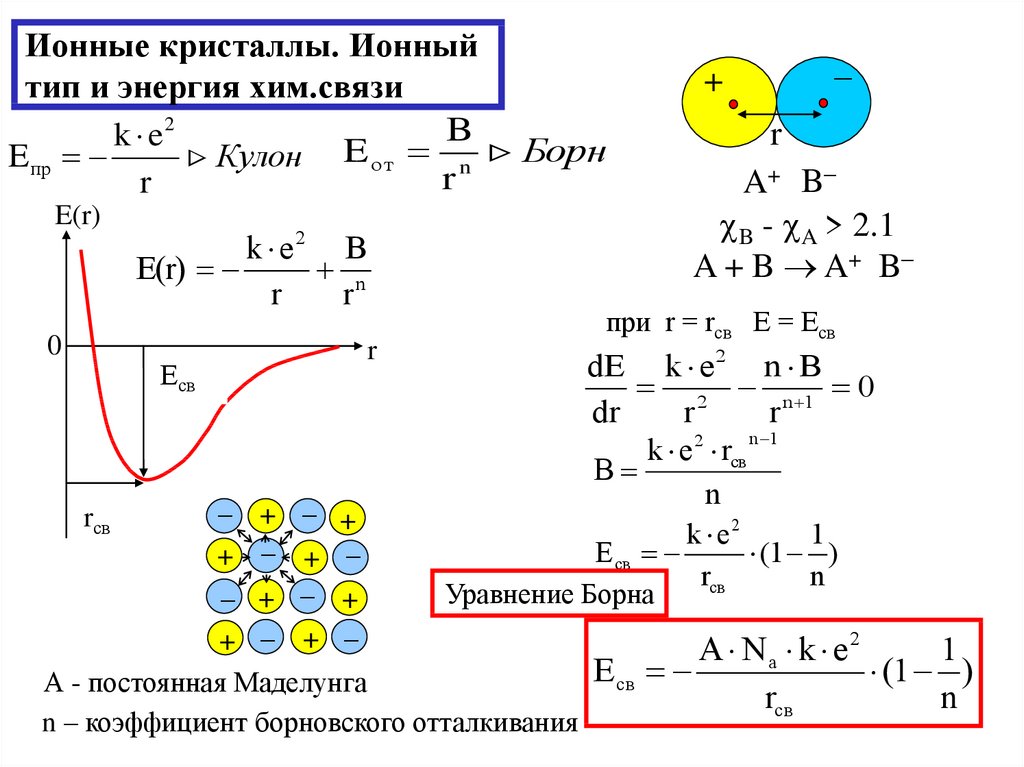
19. Ионные кристаллы. Ионный тип и энергия хим.связи
Bk e2
E пр
Кулон E от n Борн
r
r
E(r)
0
k e2 B
E(r)
n
r
r
rсв
+
+ +
+
+ +
+
+
r
+ B
AАВ
B - A > 2.1
A + B A+ B
при r = rсв Е = Есв
r
Есв
+
dE k e 2 n B
2 n 1 0
dr
r
r
n 1
k e 2 rсв
B
n
k e2
1
E св
(1 )
rсв
n
Уравнение Борна
А - постоянная Маделунга
n – коэффициент борновского отталкивания
A Na k e2
1
E св
(1 )
rсв
n
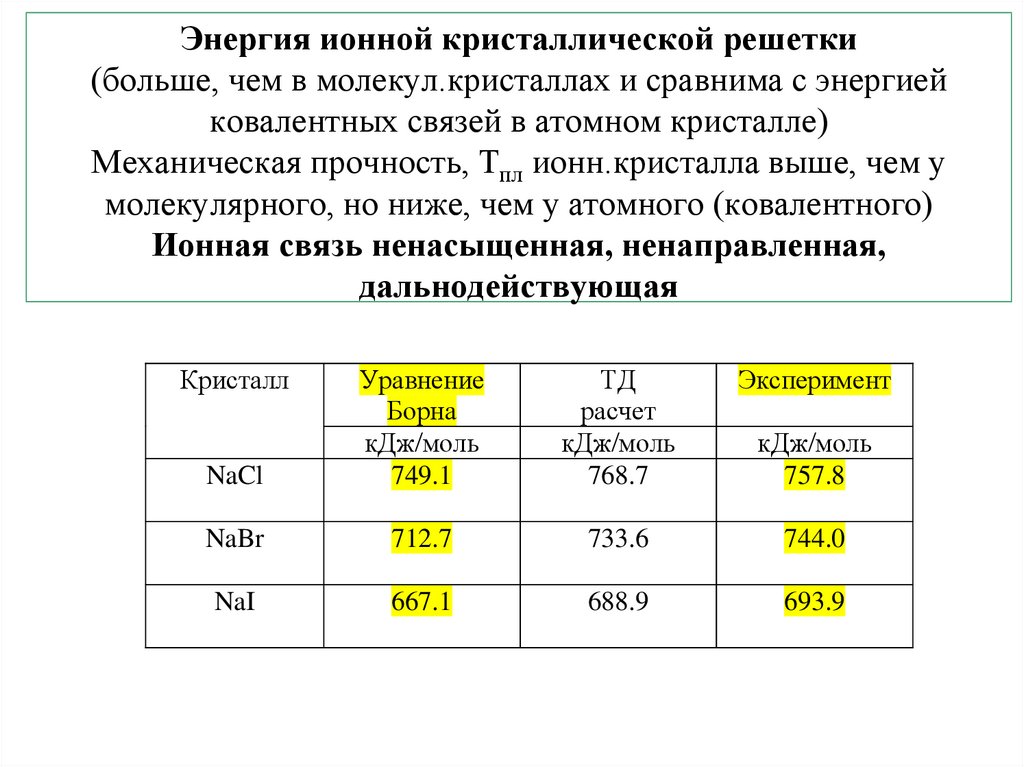
20. Энергия ионной кристаллической решетки (больше, чем в молекул.кристаллах и сравнима с энергией ковалентных связей в атомном
кристалле)Механическая прочность, Тпл ионн.кристалла выше, чем у
молекулярного, но ниже, чем у атомного (ковалентного)
Ионная связь ненасыщенная, ненаправленная,
дальнодействующая
Кристалл
ТД
расчет
кДж/моль
768.7
Эксперимент
NaCl
Уравнение
Борна
кДж/моль
749.1
NaBr
712.7
733.6
744.0
NaI
667.1
688.9
693.9
кДж/моль
757.8
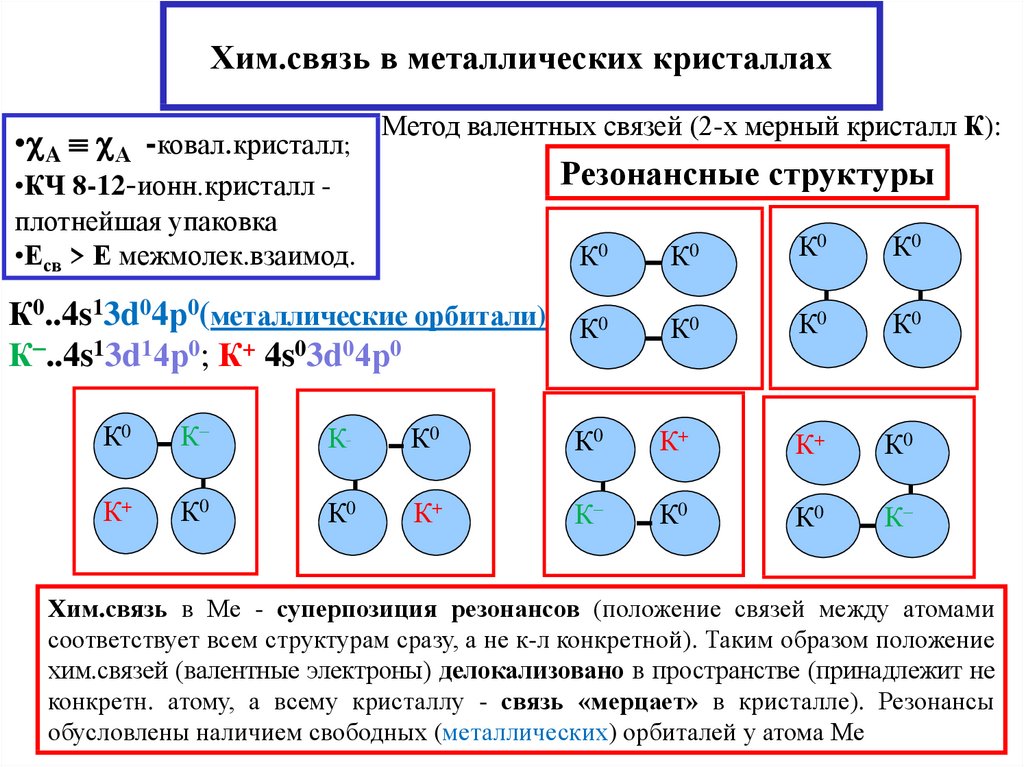
21. Хим.связь в металлических кристаллах
• A А -ковал.кристалл;•КЧ 8-12-ионн.кристалл -
Метод валентных связей (2-х мерный кристалл К):
Резонансные структуры
плотнейшая упаковка
•Есв > Е межмолек.взаимод.
К0
К0
К0
К0
К0..4s13d04р0(металлические орбитали) К0
К ..4s13d14р0; К+ 4s03d04р0
К0
К0
К0
К0
К
К
К0
К0
К+
К+
К0
К+
К0
К0
К+
К
К0
К0
К
Хим.связь в Ме - суперпозиция резонансов (положение связей между атомами
соответствует всем структурам сразу, а не к-л конкретной). Таким образом положение
хим.связей (валентные электроны) делокализовано в пространстве (принадлежит не
конкретн. атому, а всему кристаллу - связь «мерцает» в кристалле). Резонансы
обусловлены наличием свободных (металлических) орбиталей у атома Ме
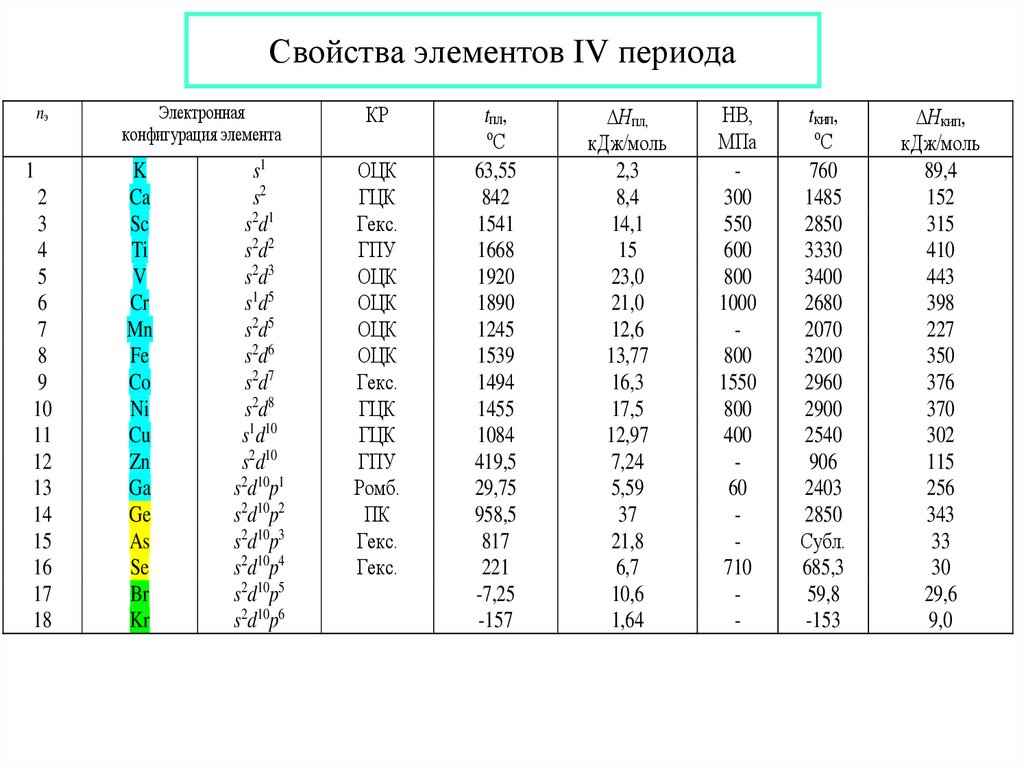
22. Свойства элементов IV периода
nэ1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Электронная
конфигурация элемента
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
s1
s2
s2d1
s2d2
s2d3
s1d5
s2d5
s2d6
s2d7
s2d8
s1d10
s2d10
s2d10p1
s2d10p2
s2d10p3
s2d10p4
s2d10p5
s2d10p6
КР
ОЦК
ГЦК
Гекс.
ГПУ
ОЦК
ОЦК
ОЦК
ОЦК
Гекс.
ГЦК
ГЦК
ГПУ
Ромб.
ПК
Гекс.
Гекс.
tпл,
о
С
63,55
842
1541
1668
1920
1890
1245
1539
1494
1455
1084
419,5
29,75
958,5
817
221
-7,25
-157
Нпл,
кДж/моль
2,3
8,4
14,1
15
23,0
21,0
12,6
13,77
16,3
17,5
12,97
7,24
5,59
37
21,8
6,7
10,6
1,64
НВ,
МПа
300
550
600
800
1000
800
1550
800
400
60
710
-
tкип,
о
С
760
1485
2850
3330
3400
2680
2070
3200
2960
2900
2540
906
2403
2850
Cубл.
685,3
59,8
-153
Нкип,
кДж/моль
89,4
152
315
410
443
398
227
350
376
370
302
115
256
343
33
30
29,6
9,0
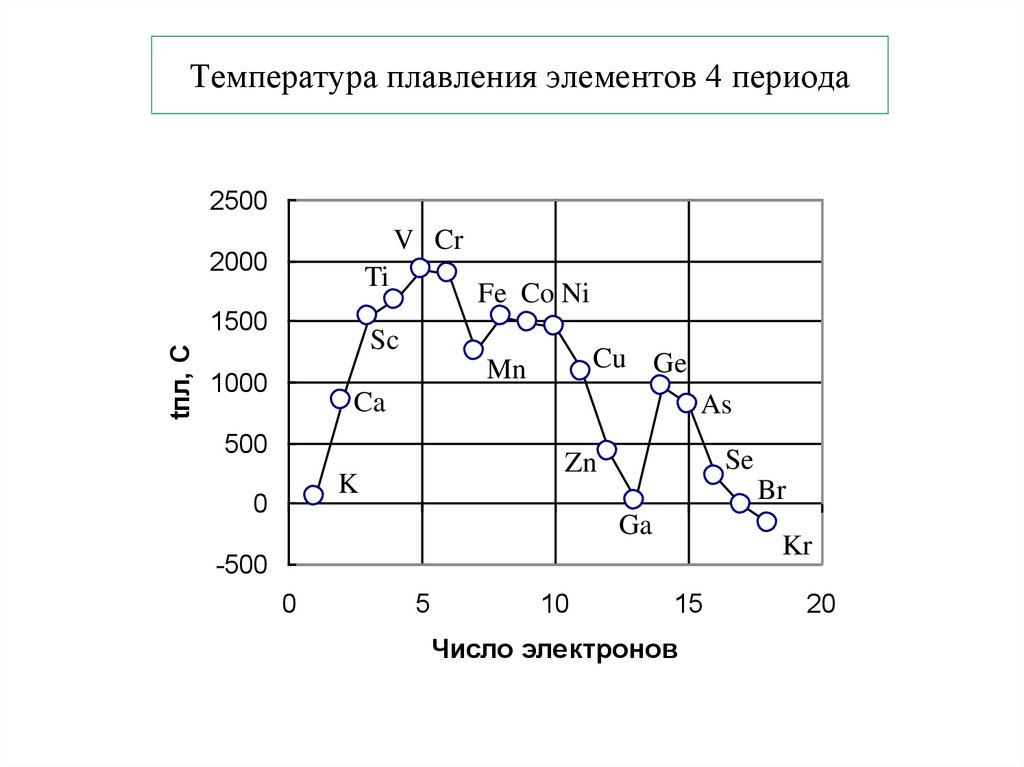
23. Температура плавления элементов 4 периода
2500V Cr
2000
Ti
tпл, С
1500
Fe Co Ni
Sc
Cu Ge
Mn
1000
Ca
As
500
K
0
Se
Zn
Br
Ga
Kr
-500
0
5
10
15
Число электронов
20
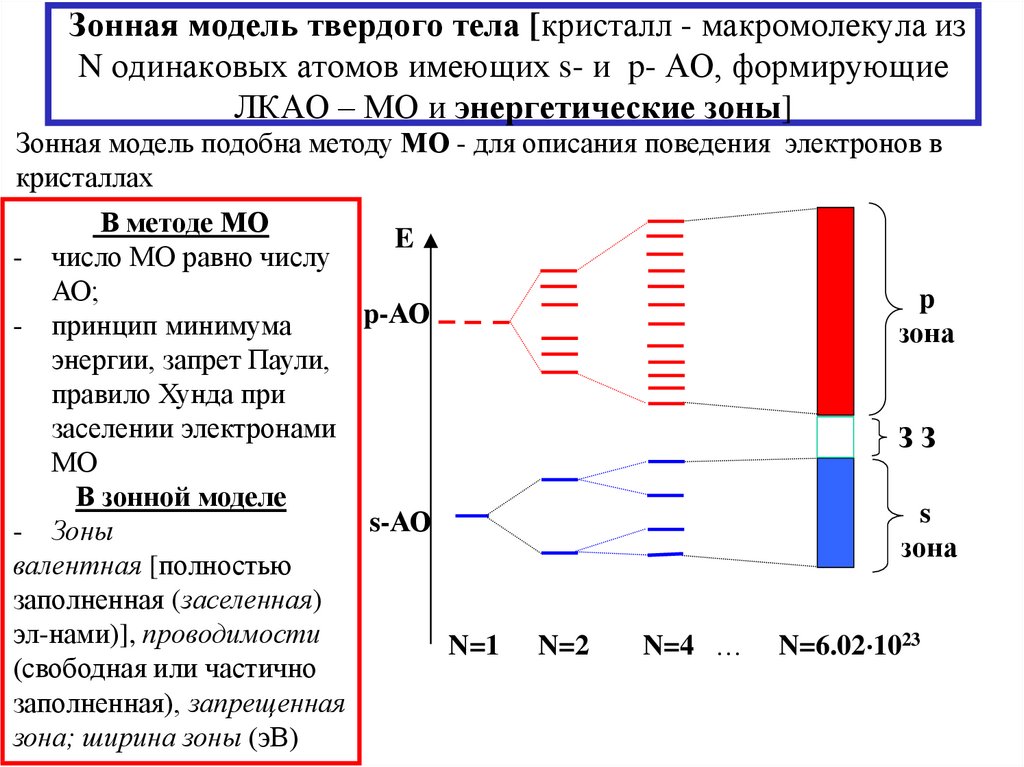
24. Зонная модель твердого тела [кристалл - макромолекула из N одинаковых атомов имеющих s- и p- АО, формирующие ЛКАО – МО и
энергетические зоны]Зонная модель подобна методу МО - для описания поведения электронов в
кристаллах
В методе МО
E
- число МО равно числу
АО;
p-АО
- принцип минимума
энергии, запрет Паули,
правило Хунда при
заселении электронами
МО
В зонной моделе
s-АО
- Зоны
валентная [полностью
заполненная (заселенная)
эл-нами)], проводимости
N=1
(свободная или частично
заполненная), запрещенная
зона; ширина зоны (эВ)
p
зона
ЗЗ
s
зона
N=2
N=4 …
N=6.02 1023
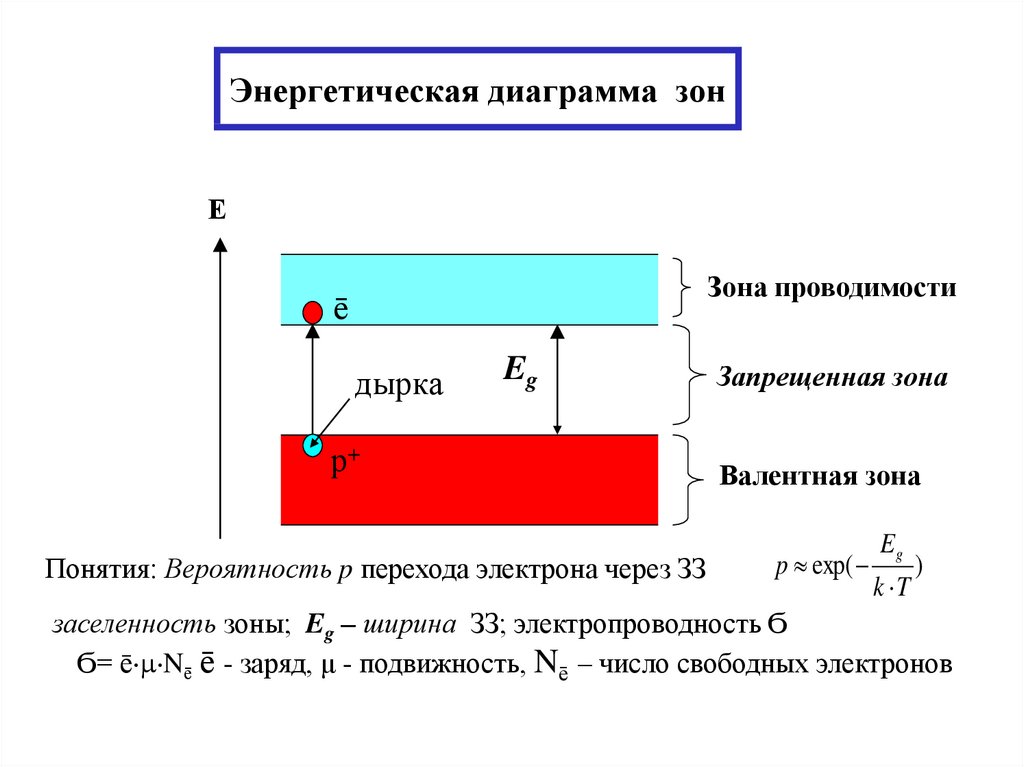
25. Энергетическая диаграмма зон
ЕЗона проводимости
ē
дырка
Eg
р+
Понятия: Вероятность p перехода электрона через ЗЗ
Запрещенная зона
Валентная зона
p exp(
Eg
k T
)
заселенность зоны; Eg – ширина ЗЗ; электропроводность Ϭ
Ϭ= ē Nē ē - заряд, μ - подвижность, Nē – число свободных электронов
26. Металлы
Eg= 0 или Eg < 0,08 эВПри Т=300К, 3кТ=0,078эВ
ширина ЗЗ Eg меньше
ЗП энергии тепловых
колебаний
ВЗ кристалл.решетки
а)
ЗП
ВЗ
б)
Электропроводность σ
Nē~NА - const
1
(σ )
= ē Nē
R
ē - заряд, μ - подвижность,
Nē – число свободных электронов
при Т
27. Диэлектрики
Eg > > 3 эВ > > кТсущественно больше энергиитепловых колебаний кристалл.
решетки [не возможен переход
эл-на из ВЗ (валентн.зона) в ЗП
(зона проводимости)]
Диэлектрики
Eg
Nē = 0 = ē Nē = 0
Концентрация
свободных эл-нов Nē
и электропроводность
равны нулю
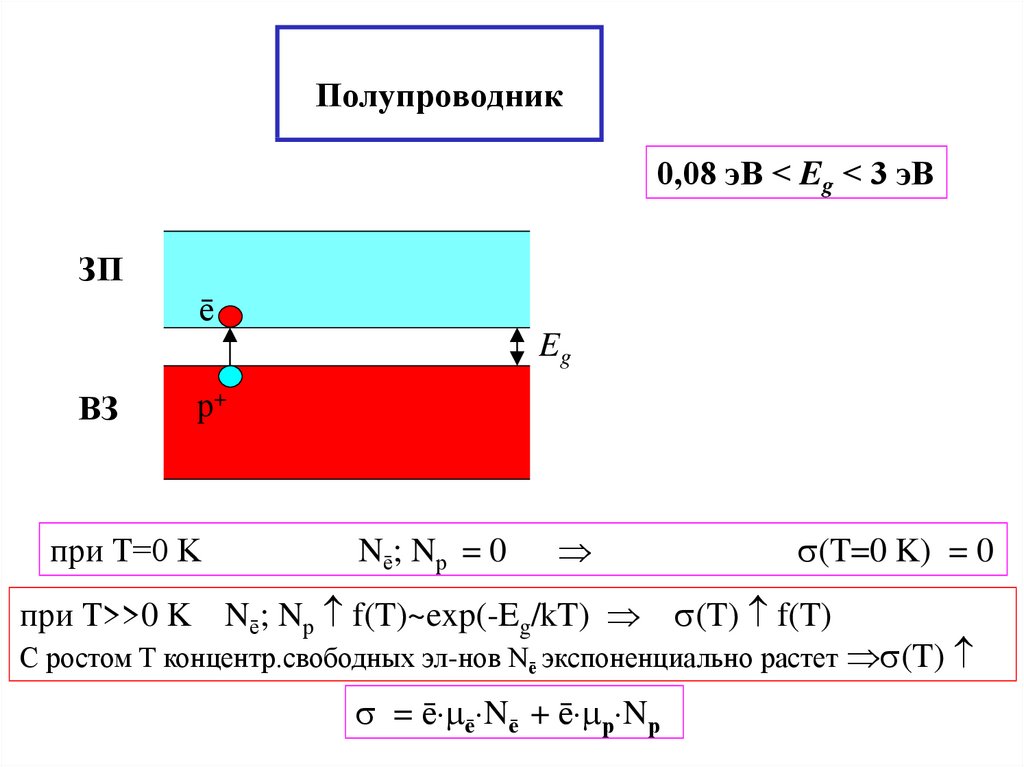
28. Полупроводник
0,08 эВ < Eg < 3 эВЗП
ē
Eg
ВЗ
р+
при T=0 K
Nē; Nр = 0
(T=0 K) = 0
при T>>0 K Nē; Nр f(T)~exp(-Eg/kT) (T) f(T)
С ростом Т концентр.свободных эл-нов Nē экспоненциально растет (T)
= ē ē Nē + ē р Nр
29. Кристаллические материалы
•Дефекты кристаллической решеткиЭлектронные(электронно-дырочная пара, несимм.разрыв хим.св.) ē-р(А - А+);
Экситоны(без разрыва хим.связи) ex0 (А*) - 2 простейших точечных дефекта
Точечные дефекты(нарушение регулярности):
собственные:
вакансии(отсутствие частицы в узле
решетки; межузельные атомы или ионы
AG
A*
V
A
A+
A- i
примесные (случайные или спец.вводятся)
Линейные дефекты(дислокации)-линии вдоль которых нарушено
правильное чередование атомных плоскостей(краевые, винтовые)
Двумерные(поверхности, границы кристаллических зерен)
Объемные(пузыри)



![Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)] Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)]](https://cf2.ppt-online.org/files2/slide/k/knQSKG5fJjXz16ivD0yOacR83e2NhPATprBlos/slide-5.jpg)



 Химия
Химия








