Похожие презентации:
Вакцинопрофилактика менингококковой инфекции у детей и перспективы ее включения
1. Вакцинопрофилактика менингококковой инфекции у детей и перспективы ее включения в Национальный Календарь профилактических
прививок.Профессор А.М. Федоров
Зав. кафедрой педиатрии ИПК ФМБА
России
1
2. Вацинопрофилактика менингококковой инфекции – наиболее эффективный способ борьбы с ней
• Трудности ранней клинической диагностики,бурное течение и, как следствие, высокая
летальность
• Высокий процент тяжелых неврологических
осложнений у выживших после менингита
• Перидически возникающие эпидемические
подъемы заболеваемости
2
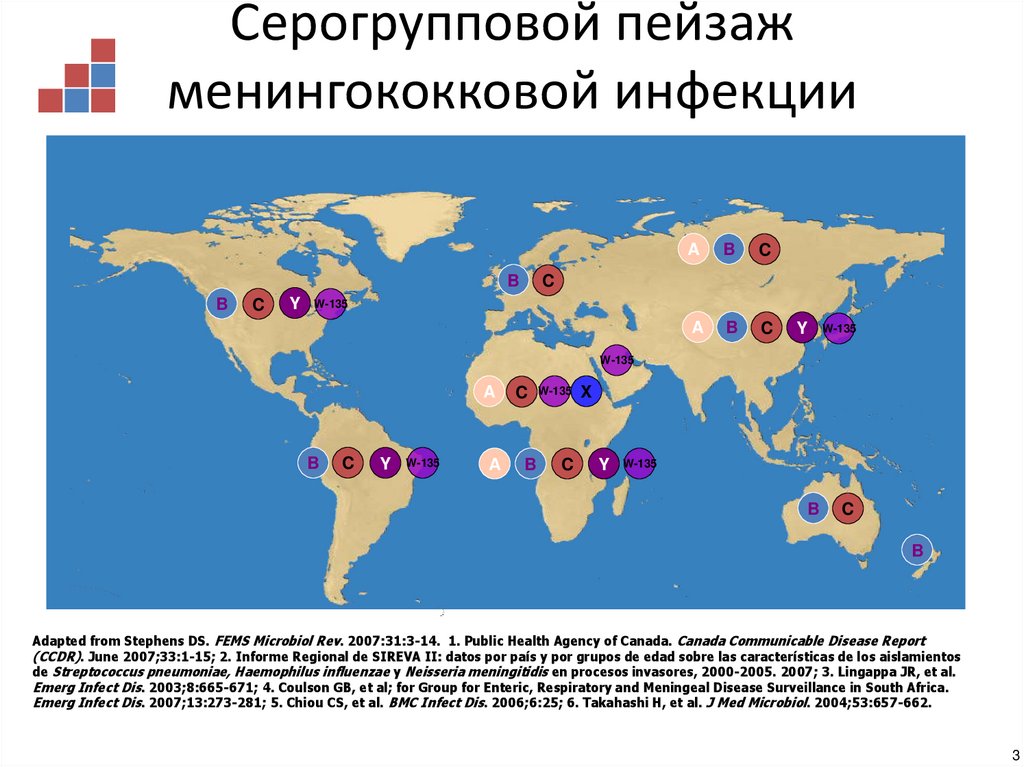
3. Серогрупповой пейзаж менингококковой инфекции
BB
C
Y
A
B
C
A
B
C
C
W-135
Y
W-135
W-135
A
B
C
Y
W-135
A
C
B
W-135
C
X
Y
W-135
B
C
B
Adapted from Stephens DS. FEMS Microbiol Rev. 2007:31:3-14. 1. Public Health Agency of Canada. Canada Communicable Disease Report
(CCDR). June 2007;33:1-15; 2. Informe Regional de SIREVA II: datos por país y por grupos de edad sobre las características de los aislamientos
de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasores, 2000-2005. 2007; 3. Lingappa JR, et al.
Emerg Infect Dis. 2003;8:665-671; 4. Coulson GB, et al; for Group for Enteric, Respiratory and Meningeal Disease Surveillance in South Africa.
Emerg Infect Dis. 2007;13:273-281; 5. Chiou CS, et al. BMC Infect Dis. 2006;6:25; 6. Takahashi H, et al. J Med Microbiol. 2004;53:657-662.
3
4. Компоненты клеточной мембраны Neisseria meningitidis
Цитоплазматическая мембранаОколоплазматическое пространство
Наружная мембрана
Протеины
цитоплазматической
мембраны
Липоолигосахариды
Фимбрии
Капсульные
полисахариды
(серогрупповые)
Фосфолипиды
Протеины наружной
мембраны
(серотип/серосубтип)
Modified from Rosenstein NE, et al. N Engl J Med. 2001;344:1378-1388.
4
5. Классификация менингококковых вакцин
• Полисахаридные вакцины– Капсульные полисахариды Neisseria meningitidis
• Конъюгированные вакцины
– Капсульные полисахариды связанные с высоко
иммуногенными белками
• Наружно мембранные везикулярные (OMV)
вакцины
– Некапсулированный подход
5
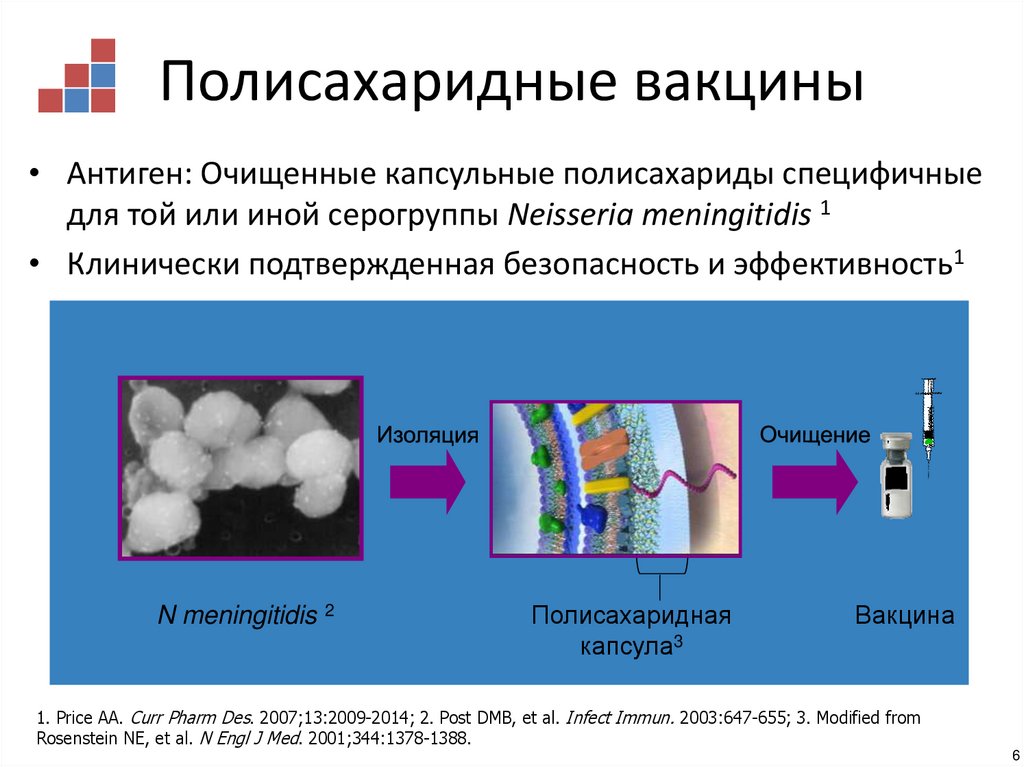
6. Полисахаридные вакцины
• Антиген: Очищенные капсульные полисахариды специфичныедля той или иной серогруппы Neisseria meningitidis 1
• Клинически подтвержденная безопасность и эффективность1
N meningitidis
2
Полисахаридная
капсула3
Вакцина
1. Price AA. Curr Pharm Des. 2007;13:2009-2014; 2. Post DMB, et al. Infect Immun. 2003:647-655; 3. Modified from
Rosenstein NE, et al. N Engl J Med. 2001;344:1378-1388.
6
7. Полисахаридные вакцины
• Вакцина менингококковая А, Россия• Менинго А+С, санофи пастер Франция
• Менцевакс ACWY, ГлаксоСмитКляйн, Бельгия
7
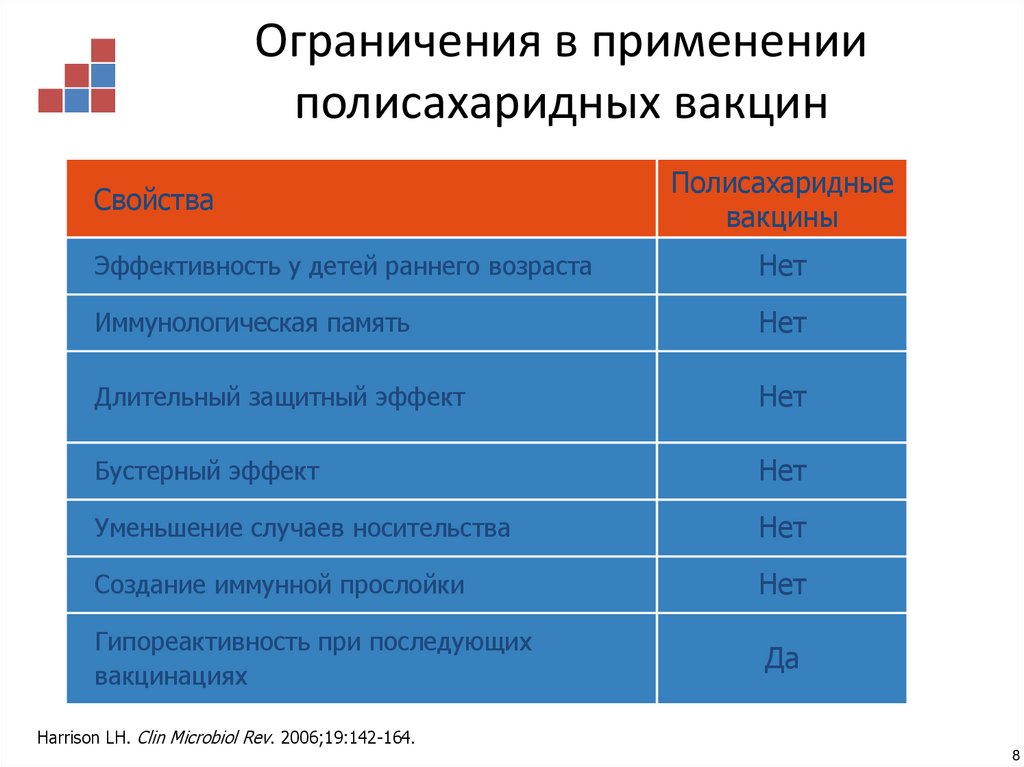
8. Ограничения в применении полисахаридных вакцин
СвойстваПолисахаридные
вакцины
Эффективность у детей раннего возраста
Нет
Иммунологическая память
Нет
Длительный защитный эффект
Нет
Бустерный эффект
Нет
Уменьшение случаев носительства
Нет
Создание иммунной прослойки
Нет
Гипореактивность при последующих
вакцинациях
Да
Harrison LH. Clin Microbiol Rev. 2006;19:142-164.
8
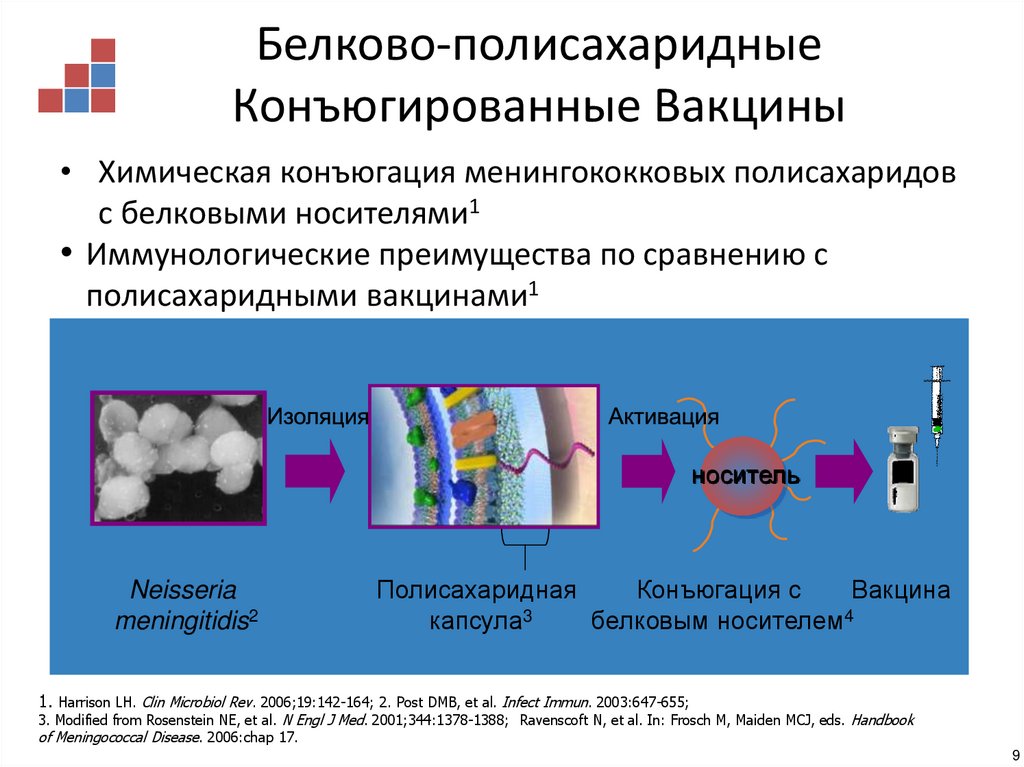
9. Белково-полисахаридные Конъюгированные Вакцины
• Химическая конъюгация менингококковых полисахаридовс белковыми носителями1
• Иммунологические преимущества по сравнению с
полисахаридными вакцинами1
носитель
Neisseria
meningitidis2
Полисахаридная
Конъюгация с
Вакцина
капсула3
белковым носителем4
1. Harrison LH. Clin Microbiol Rev. 2006;19:142-164; 2. Post DMB, et al. Infect Immun. 2003:647-655;
3. Modified from Rosenstein NE, et al. N Engl J Med. 2001;344:1378-1388; Ravenscoft N, et al. In: Frosch M, Maiden MCJ, eds. Handbook
of Meningococcal Disease. 2006:chap 17.
9
10. Белково-полисахаридные Конъюгированные Вакцины
• Менюгейт (Мен С), Новартис, Германия• Менвео* (Мен АСWY), Новартис, Германия
• Менактра** (Мен АСWY), санофи пастер
Франция
• МенАСWY,** санофи пастер Франция
* - готовится к регистрации
** применяется преимущественно в США
10
11. Примеры использования белковых носителей
• Белковые носители содержат антигенные детерминанты(эпитопы)для распознавания CD4+ T -хелперами1
• Наиболее часто используются в качестве белковых
носителей2:
– Дифтерийный анатоксин
– Столбнячный анатоксин
– Измененный дифтерийный токсин (CRM197)
• CRM197
– Модифицированный дифтерийный токсин 3
– Ферментативно неактивен и нетоксичен3
– Не требует инактивации формальдегидом и поэтому не
реагирует перекрестно с антигенами-соучастниками3
– При соединении с бактериальными полисахаридами, CRM197
усиливает их иммуногенность4
1. Baraldo K, et al. Infect Immun. 2005;73:5835-5841; 2. Sáfadi MA, et al. J Pediatr (Rio J). 2006;82(3 suppl): S35-44;
3. Lavelle EC, et al. In: Hackett CJ, Harn DA Jr, eds. Vaccine Adjuvants. 2006:chap 7; 4. Rappuoli R, et al. Appl Environ
Microbiol. 1983;46:560-564.
11
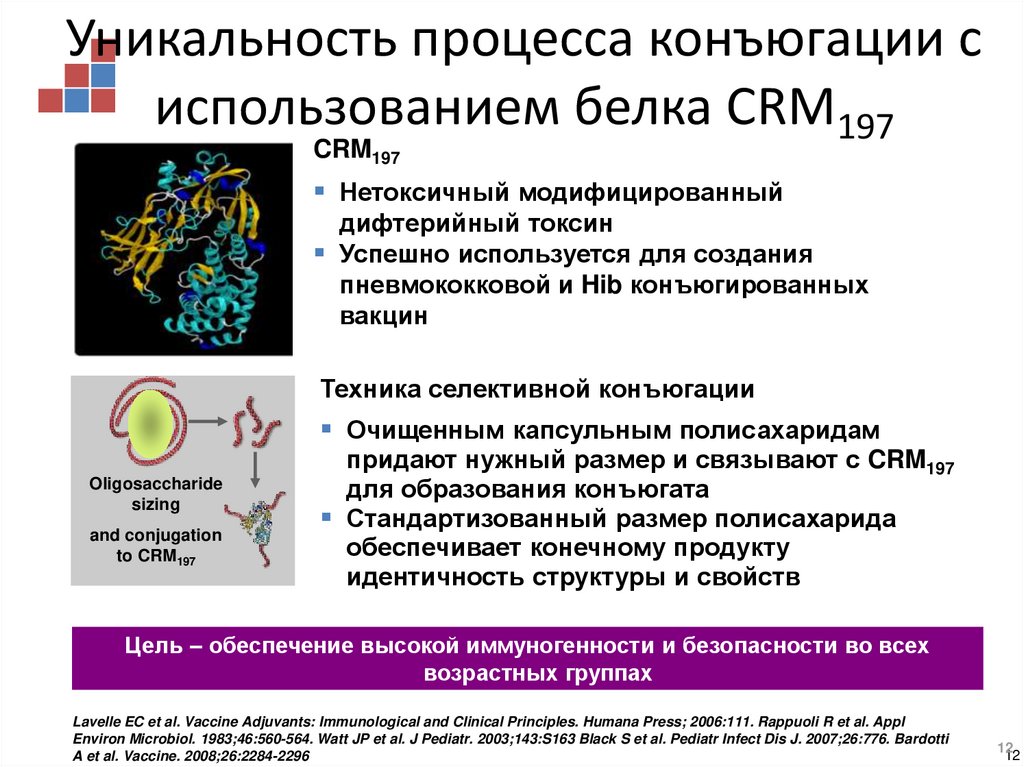
12. Уникальность процесса конъюгации с использованием белка CRM197
CRM197Нетоксичный модифицированный
дифтерийный токсин
Успешно используется для создания
пневмококковой и Hib конъюгированных
вакцин
Техника селективной конъюгации
Очищенным капсульным полисахаридам
Oligosaccharide
sizing
and conjugation
to CRM197
придают нужный размер и связывают с CRM197
для образования конъюгата
Стандартизованный размер полисахарида
обеспечивает конечному продукту
идентичность структуры и свойств
Цель – обеспечение высокой иммуногенности и безопасности во всех
возрастных группах
Lavelle EC et al. Vaccine Adjuvants: Immunological and Clinical Principles. Humana Press; 2006:111. Rappuoli R et al. Appl
Environ Microbiol. 1983;46:560-564. Watt JP et al. J Pediatr. 2003;143:S163 Black S et al. Pediatr Infect Dis J. 2007;26:776. Bardotti
A et al. Vaccine. 2008;26:2284-2296
12
12
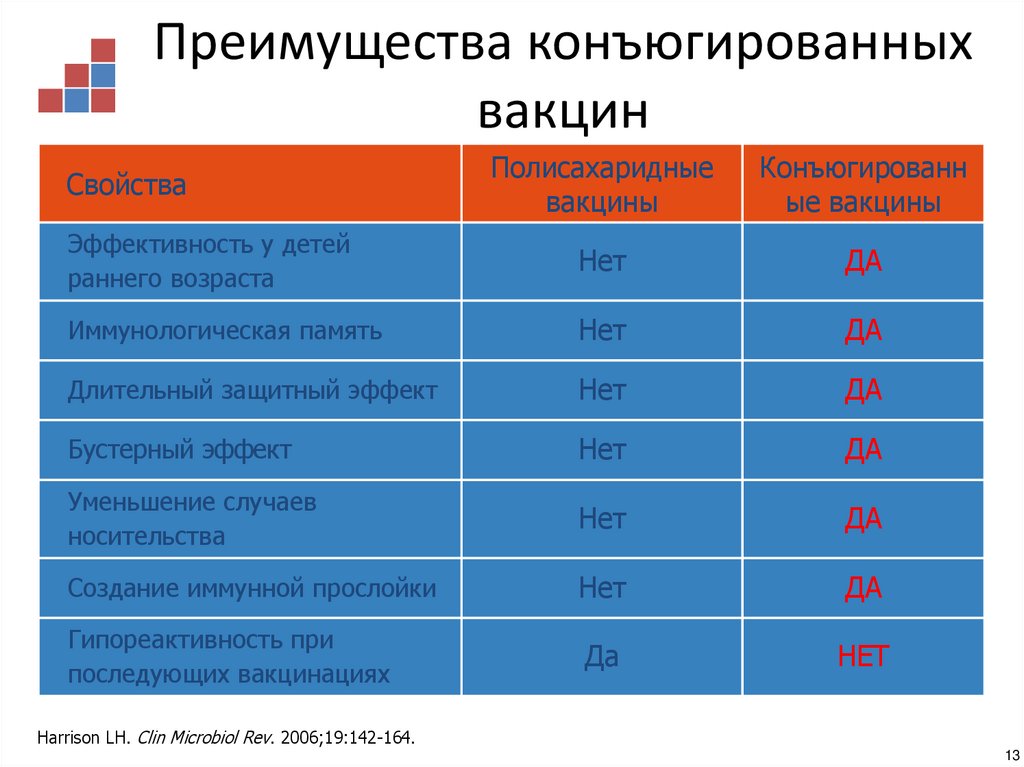
13. Преимущества конъюгированных вакцин
Полисахаридныевакцины
Конъюгированн
ые вакцины
Эффективность у детей
раннего возраста
Нет
ДА
Иммунологическая память
Нет
ДА
Длительный защитный эффект
Нет
ДА
Бустерный эффект
Нет
ДА
Уменьшение случаев
носительства
Нет
ДА
Создание иммунной прослойки
Нет
ДА
Гипореактивность при
последующих вакцинациях
Да
НЕТ
Свойства
Harrison LH. Clin Microbiol Rev. 2006;19:142-164.
13
14.
МЕНЮГЕЙТ – ПЕРВАЯКОНЪЮГИРОВАННАЯ ВАКЦИНА ДЛЯ
ПРОФИЛАКТИКИ МЕНИНГОКОККОВОЙ
ИНФЕКЦИИ ТИПА С У ДЕТЕЙ С 2МЕСЯЧНОГО ВОЗРАСТА
Обладает высокой иммуногенностью
Обеспечивает стойкий защитный
иммунный ответ у детей, начиная с 2
месяцев, подростков и взрослых
Эффективно препятствует
распространению возбудителя в очаге
инфекции
Эффективна при вспышках
заболевания
14
15. Эффективность конъюгированной менингококковой вакцины типа С
Эффективность (95% CI)Исследование
(год*)
Возрастные
группы
Общая
1 год**
≥4 лет**
Quebec1
(2001–2002)
2 mos–20 yrs
97% (75–100)
97% (75–100)
—
—
—
—
-∞% (-∞–96)
85% (-495–100)
92% (82–97)
Quebec2
(2001–2006)
<1 yr†
1 yr
≥2 yrs
89%
(75–95)§
England3
(2000–2004)
2 mos–4 mos†
5 mos–11 mos†
1–2 yrs
3–4 yrs
4–6 yrs
7–10 yrs
11–16 yrs
17–18 yrs
66% (6–86)
85% (46–96)
83% (60–93)
98% (91–100)
100% (71–100)
88% (38–98)
96% (90–98)
93% (82–98)
93% (67–99)
87% (11–99)
88% (65–96)
98% (90–100)
—
—
96% (89–99)
—
-81% (-7430–71)
82% (-8–97)
61% (-327–94)
93% (78–98)
—
—
90% (77–96)
—
Spain4
(2001–2004)
2, 4, 6 mos†
7 mos–5 yrs
95% (91–97)
98% (96–99)
98% (96–99)
100% (98–100)
78% (3–95)
94% (71–99)
*Год оценки эффективности; **Время, прошедшее после вакцинации; †без бустерной дозы на 2-м году жизни; §Общая
эффективность через 5 лет.
1. De Wals P, et al. JAMA. 2004;292:2491-2494; 2. De Wals P, et al. 45th annual meeting of IDSA, October 4–7, 2007; San
Diego, CA: Abstract #869:202; 3. Trotter CL, et al. Lancet. 2004;364:365-367; 4. Larrauri A, et al. Vaccine. 2005;23:4097-4100.
15
16. Уменьшение частоты носительства менингококка серогруппы С после вакцинации менингококковой конъюгированной вакциной типа С
United KingdomИзоляция менингококка, %
(пропорционально)
Соотношение
2001:1999
P
1999
n=14,057
2000
n=16,482
2001
n=17,770
16.7% (2348)
17.7% (2931)
18.7% (3320)
1.08
Серогруппа C
2.51%
(59)
0.72% (21)
0.48% (16)
0.19
<0.
001
Серогруппа B
23.00%
(540)
22.76%
(667)
24.10%
(800)
1.05
0.3
4
Серогруппа W-135
6.30% (148)
7.51% (220)
7.14% (237)
1.13
0.22
Серогруппа Y
5.58% (131)
5.53% (162)
5.39% (179)
0.97
0.76
Всего выделено
n = number of swab samples collected in 15- to 19-year-olds.
Maiden MC, et al. J Infect Dis. 2008;197:737-743.
16
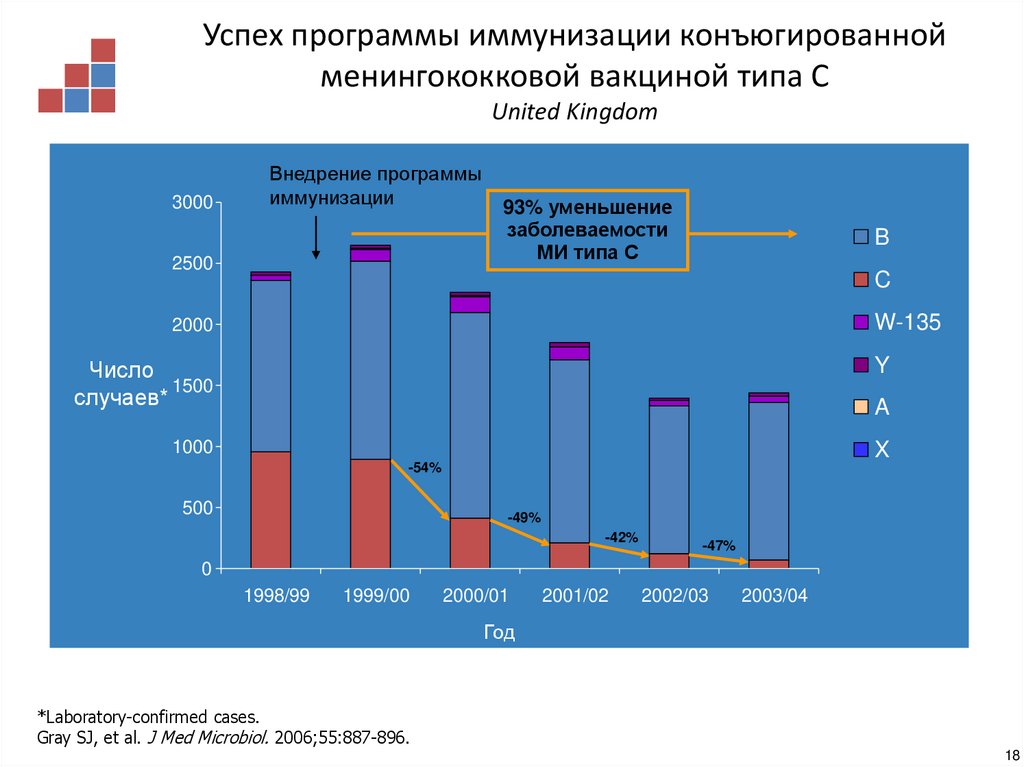
17. Формирование популяционного иммунитета после иммунизации конъюгированной менингококковой вакциной типа С у пациентов <18 лет
Успех программы иммунизации конъюгированнойменингококковой вакциной типа С
United Kingdom
3000
Внедрение программы
иммунизации
2500
93% уменьшение
заболеваемости
МИ типа С
B
C
W-135
2000
Y
Число
1500
случаев*
A
1000
X
-54%
500
-49%
-42%
-47%
0
1998/99
1999/00
2000/01
2001/02
2002/03
2003/04
Год
*Laboratory-confirmed cases.
Gray SJ, et al. J Med Microbiol. 2006;55:887-896.
18
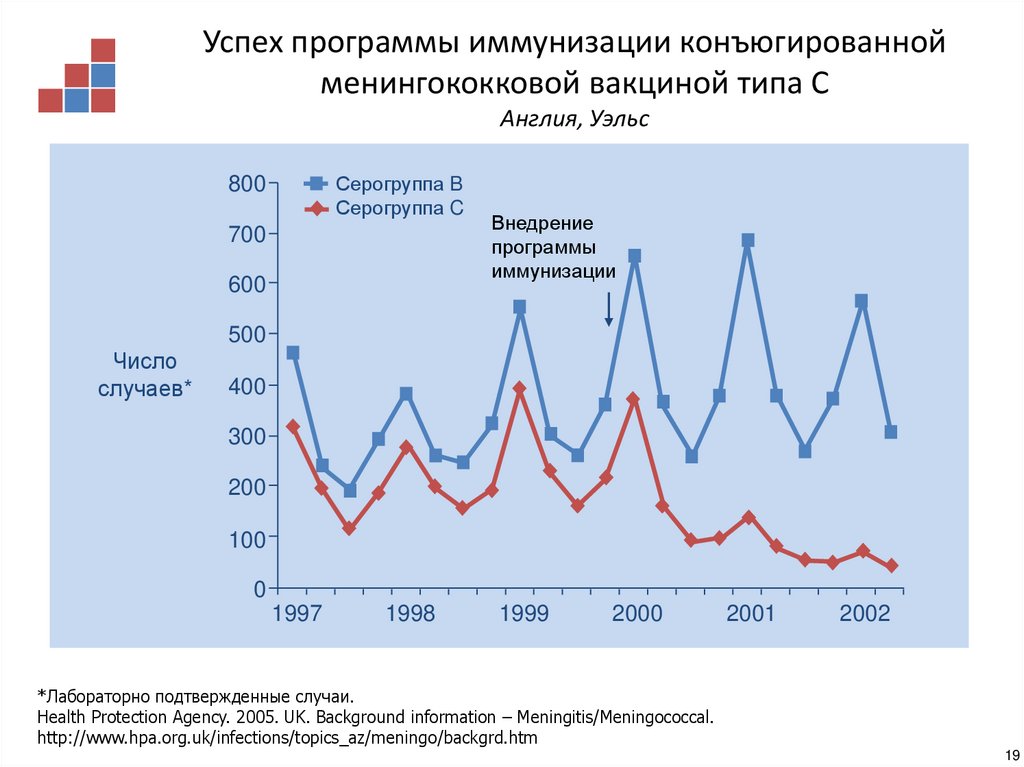
18. Успех программы иммунизации конъюгированной менингококковой вакциной типа С United Kingdom
Успех программы иммунизации конъюгированнойменингококковой вакциной типа С
Англия, Уэльс
Серогруппа B
Серогруппа C
800
700
600
Внедрение
программы
иммунизации
500
Число
случаев*
400
300
200
100
0
1997
1998
1999
2000
2001
2002
*Лабораторно подтвержденные случаи.
Health Protection Agency. 2005. UK. Background information – Meningitis/Meningococcal.
http://www.hpa.org.uk/infections/topics_az/meningo/backgrd.htm
19
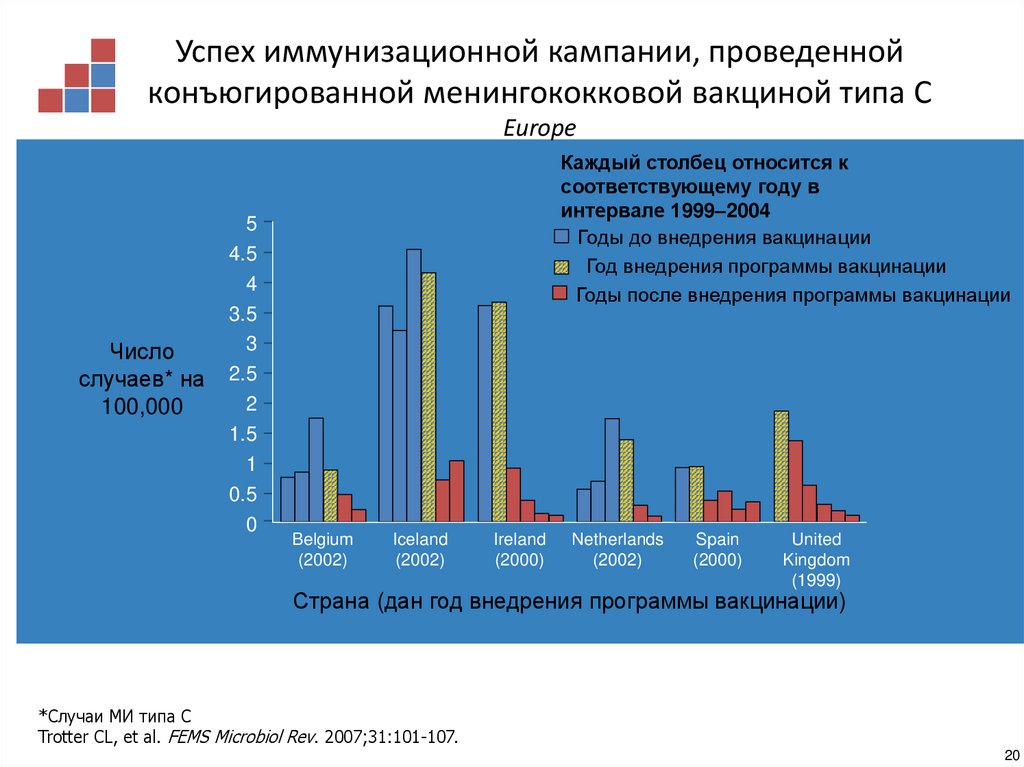
19.
Успех иммунизационной кампании, проведеннойконъюгированной менингококковой вакциной типа С
Europe
Каждый столбец относится к
соответствующему году в
интервале 1999–2004
Годы до внедрения вакцинации
Год внедрения программы вакцинации
Годы после внедрения программы вакцинации
5
4.5
4
Число
случаев* на
100,000
3.5
3
2.5
2
1.5
1
0.5
0
Belgium
(2002)
Iceland
(2002)
Ireland
(2000)
Netherlands
(2002)
Spain
(2000)
United
Kingdom
(1999)
Страна (дан год внедрения программы вакцинации)
*Случаи МИ типа С
Trotter CL, et al. FEMS Microbiol Rev. 2007;31:101-107.
20
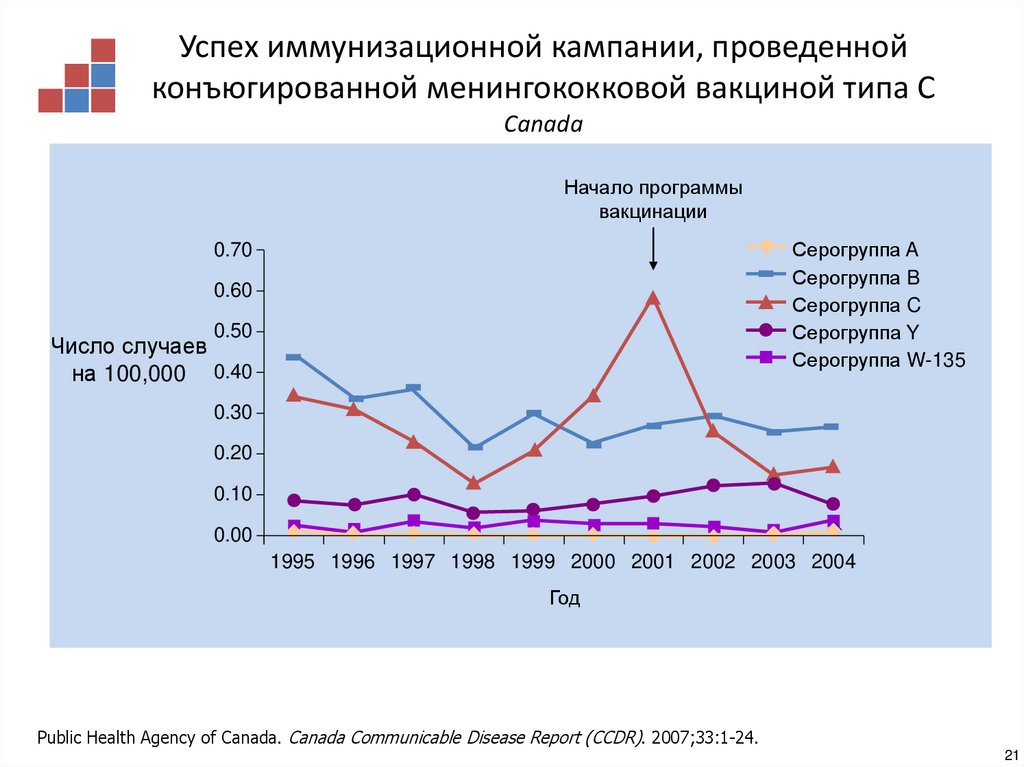
20. Успех иммунизационной кампании, проведенной конъюгированной менингококковой вакциной типа С Europe
Успех иммунизационной кампании, проведеннойконъюгированной менингококковой вакциной типа С
Canada
Начало программы
вакцинации
Серогруппа A
Серогруппа B
Серогруппа C
Серогруппа Y
Серогруппа W-135
0.70
0.60
0.50
Число случаев
на 100,000 0.40
0.30
0.20
0.10
0.00
1995 1996 1997 1998 1999 2000 2001 2002 2003 2004
Год
Public Health Agency of Canada. Canada Communicable Disease Report (CCDR). 2007;33:1-24.
21
21. Успех иммунизационной кампании, проведенной конъюгированной менингококковой вакциной типа С Canada
Характеристика вакцины Менвео• В состав входят
10 мкг Men A, 5 мкг Men C, 5 мкг Men W,
5 мкг Men Y, конъюгированные с CRM 197
• Не содержит консервантов
• Высокая иммуногенность у подростков и
взрослых, у детей до 2 лет, у пожилых
• Доказанный благоприятный профиль
переносимости во всех возрастных группах
22
22. Характеристика вакцины Менвео
Параллельно с успехами в борьбе сМенингококком группы С и др.
становится все более актуальным
создание эффективных вакцин
против Мен В
23
23. Параллельно с успехами в борьбе с Менингококком группы С и др. становится все более актуальным создание эффективных вакцин
Ограничения традиционного подхода к созданиюменингококковых вакцин типа В
• Капсулярный подход
– Простые полисахаридные
вакцины1,2
• Структурно идентична
полисиаловой кислоте
нервной ткани ребенка2
• Низкая иммуногенность
• Теоретический риск развития
аутоиммунных реакций
• Не-капсулярный подход
– OMV вакцины4,5
• большое разнообразие
антигенов
• Защита в отношении только
гомологичных штаммов
– Все известные поверхностные
антигены, изученные
традиционными методами в
течение последних 30 лет,
имели ограничения по
антигенной вариабельности
или степени иммунного
ответа4,6
1. Häyrinen J, et al. J Infect Dis. 1995;171:1481-1490; 2. Finne J, et al. J Immunol. 1987;138:4402-4407; 3. Bruge J, et
al. Vaccine. 2004;22:1087-1096; 4. Pizza M, et al. Science. 2000;287:1816-1820; 5. Zimmer SM, et al. Curr Opin Investig
Drugs. 2007;7:733-739; 6. Martin D, et al. J Exp Med. 1997;185:1173-1183.
24
24. Ограничения традиционного подхода к созданию менингококковых вакцин типа В
Наружно мембранные везикулярные (OMV) вакциныАнтиген: Везикулы наружной мембраны (OMV) или пузырьки
–
OMV это пузырьки наружной мембраны, содержащие основные мембранные белки, пурины,
фосфолипиды, и lлипополисахариды
Наружная мембрана2
Вакцина
«Пузырьки» наружной мембраны
у Neisseria meningitidis3
Ограничения: Антигенные различия4
– Продуцирует защитные антитела только в отношении гомологичных штаммов
1. Perrett KP, et al. Expert Opin Ther. 2005;5:1611-1625; 2. Modified from Rosenstein NE, et al. N Engl J Med. 2001;
344:1378-1388; 3. Devoe IW, et al. J Exp Med. 1973;138:1156-1167; 4. Pizza M, et al. Science. 2000;287:1816-1820.
25
25. Наружно мембранные везикулярные (OMV) вакцины
Эффективность OMV менингококковых вакцин типа Впротив гомологичных штаммов возбудителя
Основные
штаммы
Возрастная
группа
Эффективность (95% CI)
Cuba1
(1987–1989)
B:4:P1.15
11–16 yrs
81% (44,93)
Iquique, Chile2
(1987–1989)
B:15:P1.3
1–4 yrs
5–21 yrs
No efficacy
70% (3,93)
B:15:P1.7,16
14–16 yrs
14–16 yrs
87% (62,100)*
57% (28,79)**
São Paolo, Brazil5
(1990–1991)
B:4:P1.15
3–23 mos
24–47 mos
48–83 mos
-37% (≤100,73)
47% (-72,84)
74% (16,92)
Rio de Janeiro, Brazil6
(1990–1991)
B:4:P1.15
6 mos–9 yrs
≥48 mos
54% (20,74)
71% (34,87)
B:4:P1.7b,4
All ages
73% (52,85)
Страна (год)
Эффективность
Norway3,4
(1988–1991)
Эффективность
New Zealand7
(2001–2006)
*10 месяцев, **29 месяцев.
1. Sierra GVG, et al. NIPH Ann. 1991;14:195–207; 2. Boslego J, et al. Vaccine. 1995;13:821-829; 3. Holst J, et al. Vaccine.
2003;21:734-737; 4. Bjune G, et al. Lancet. 1991;338:1093-1096; 5. de Moraes JC, et al. Lancet. 1992;340:1074-1078;
6. Noronha CP, et al. Int J Epidemiol. 1995;24:1050-1057; 7. Kelly C, et al. Am J Epidemiol. 2007;166:817-823.
26
26. Эффективность OMV менингококковых вакцин типа В против гомологичных штаммов возбудителя
Успех иммунизационной кампании, проведенной OMVвакциной типа B
40
90%
35
80%
Start of
vaccination
campaign
Число случаев
30
25
20
15
70%
60%
50%
83%
50%
охват 3охват 3кратной
40%
кратной
вакцинацией
вакцинацией
30%
10
20%
10%
0
0%
Jan
Feb
Mar
Apr
May
Jun
Jul
Aug
Sep
Oct
Nov
Dec
Jan
Feb
Mar
Apr
May
Jun
Jul
Aug
Sep
Oct
Nov
Dec
Jan
Feb
Mar
Apr
May
Jun
Jul
Aug
Sep
Oct
Nov
Dec
Jan
Feb
Mar
Apr
May
Jun
Jul
Aug
Sep
Oct
Nov
Dec
Jan
Feb
Mar
Apr
May
Jun
Jul
Aug
Sep
Oct
Nov
Dec
5
2002
0, 1, или 2 дозы
2003
2004
3 и более доз
2005
% охвата 3-кратной вакцинацией
New Zealand
2006
% охвата 3-кратной
вакцинацией
Martin D, et al. The Epidemiology of Meningococcal Disease in New Zealand in 2006. Report prepared for the Ministry of
Health by the Institute of Environmental Science and Research Limited (ESR). Wellington: Ministry of
Health.http://www.moh.govt.nz/moh.nsf/pagesmh/6647/$File/epidemiology-of-meningococcal-disease-2006.pdf.
28
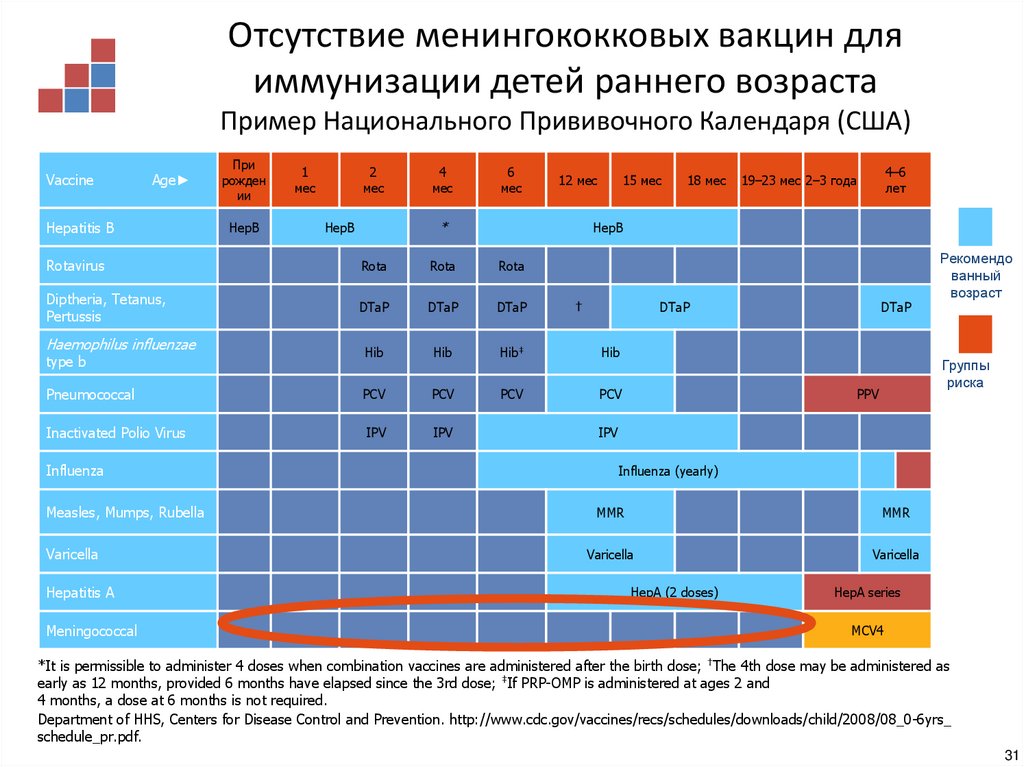
27. Отсутствие эффекта менингококковой вакцины типа В в отношении гетерологичных штаммов возбудителя
Отсутствие менингококковых вакцин дляиммунизации детей раннего возраста
Пример Национального Прививочного Календаря (США)
Vaccine
Age
Hepatitis B
При
рожден
ии
HepB
1
мес
2
мес
4
мес
6
мес
12 мес
*
HepB
15 мес
Rota
Rota
Rota
Diptheria, Tetanus,
Pertussis
DTaP
DTaP
DTaP
Hib
Hib
Hib‡
Hib
Pneumococcal
PCV
PCV
PCV
PCV
Inactivated Polio Virus
IPV
IPV
type b
Influenza
Measles, Mumps, Rubella
Varicella
Hepatitis A
Meningococcal
4–6
лет
19–23 мес 2–3 года
HepB
Rotavirus
Haemophilus influenzae
18 мес
†
DTaP
DTaP
Рекомендо
ванный
возраст
Группы
риска
PPV
IPV
Influenza (yearly)
MMR
MMR
Varicella
Varicella
HepA (2 doses)
HepA series
MCV4
*It is permissible to administer 4 doses when combination vaccines are administered after the birth dose; †The 4th dose may be administered as
early as 12 months, provided 6 months have elapsed since the 3rd dose; ‡If PRP-OMP is administered at ages 2 and
4 months, a dose at 6 months is not required.
Department of HHS, Centers for Disease Control and Prevention. http://www.cdc.gov/vaccines/recs/schedules/downloads/child/2008/08_0-6yrs_
schedule_pr.pdf.
31
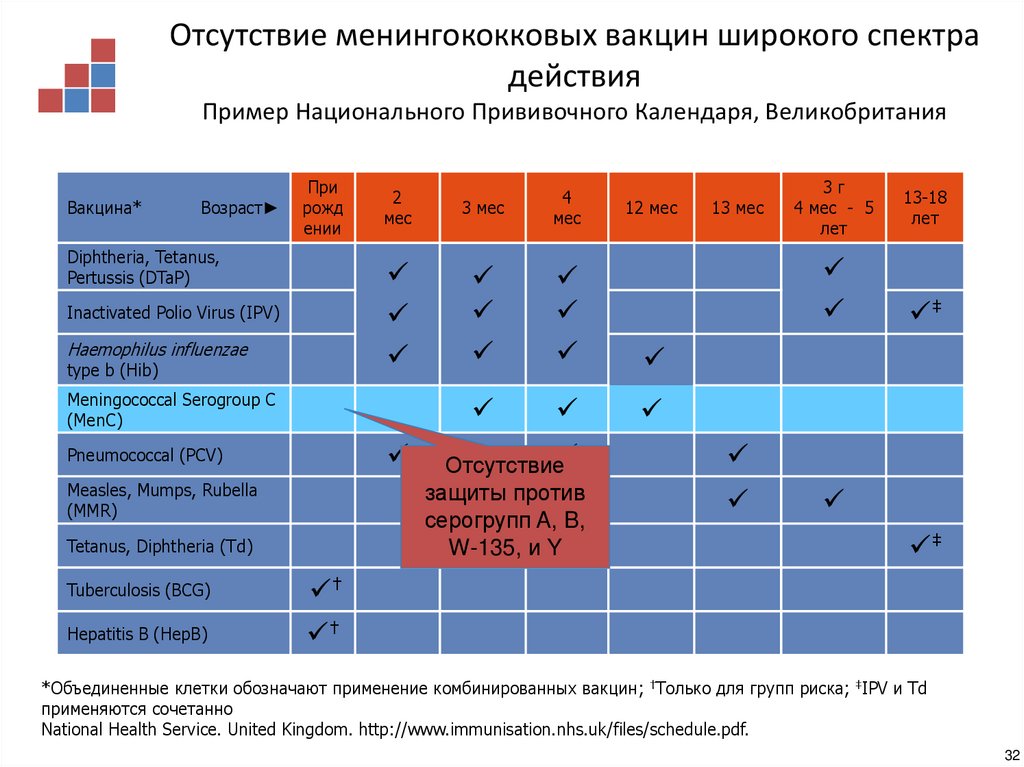
28. Успех иммунизационной кампании, проведенной OMV вакциной типа B New Zealand
Отсутствие менингококковых вакцин широкого спектрадействия
Пример Национального Прививочного Календаря, Великобритания
Вакцина*
Возраст
При
рожд
ении
Diphtheria, Tetanus,
Pertussis (DTaP)
Inactivated Polio Virus (IPV)
Haemophilus influenzae
type b (Hib)
2
мес
3 мес
4
мес
Meningococcal Serogroup C
(MenC)
Pneumococcal (PCV)
Measles, Mumps, Rubella
(MMR)
Tetanus, Diphtheria (Td)
Tuberculosis (BCG)
†
Hepatitis B (HepB)
†
Отсутствие
защиты против
серогрупп A, B,
W-135, и Y
12 мес
13 мес
3г
4 мес - 5
лет
13-18
лет
‡
‡
*Объединенные клетки обозначают применение комбинированных вакцин; †Только для групп риска; ‡IPV и Td
применяются сочетанно
National Health Service. United Kingdom. http://www.immunisation.nhs.uk/files/schedule.pdf.
32
29. Метод Реверсивной вакцинологии
Оптимальную защиту от менингококковойинфекции обеспечивают вакцины широкого
спектра действия
• Специфическая иммунизация помогает снизить
заболеваемость и летальность от менингококковой
инфекции
• Существующие менингококковые вакцины
достаточно эффективны, однако, имеют
ограничения в применении
• Новые конъюгированные и искусственно
синтезированные менингококковые вакцины,
находящиеся на этапе разработки, призваны
защитить всех пациентов из возрастных групп риска
от наиболее значимых серотипов возбудителя МИ
(A, B, C, W-135, и Y)
33
30. Необходимость создания менингококковых вакцин широкого спектра действия
Включение в Календарь перспективы радужные, но …• Нужна конъюгированная поливалентная
вакцина
• Необходимо изменение мировоззрения
чиновников от медицины, что, в свою
очередь, поможет решить
• Проблему финансирования
34


















 Медицина
Медицина








