Похожие презентации:
Физические и химические свойства алкенов
1.
Непредельные углеводородысодержат одну или несколько
углеродных связей.
Простейший представитель —
этилен или этен.
2.
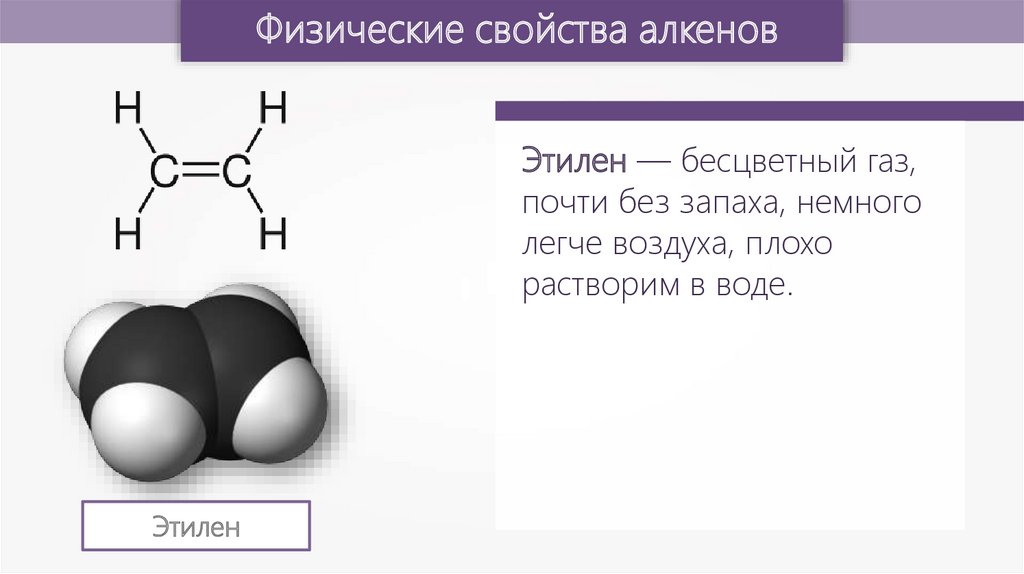
Физические свойства алкеновЭтилен — бесцветный газ,
почти без запаха, немного
легче воздуха, плохо
растворим в воде.
Этилен
3.
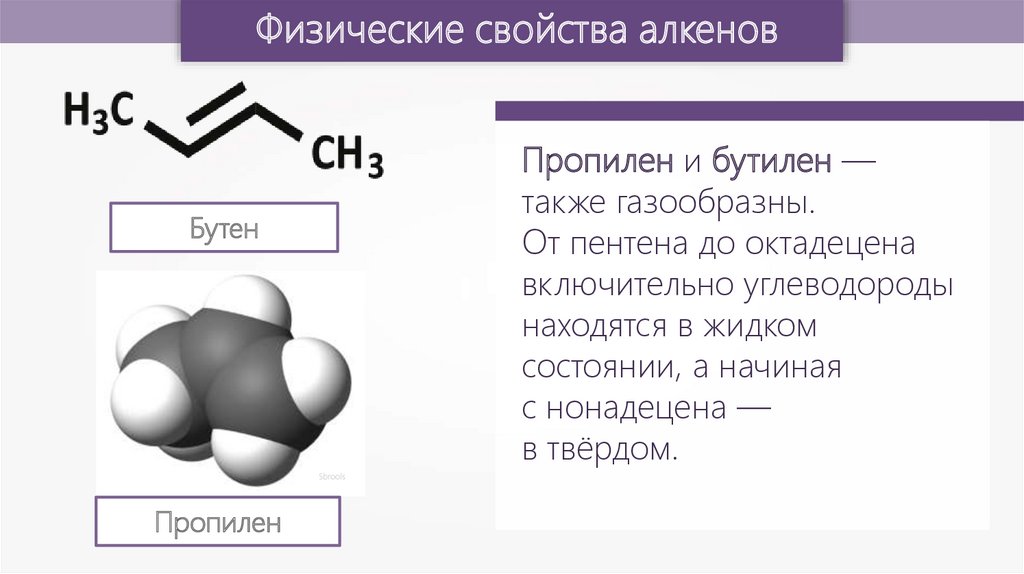
Физические свойства алкеновПропилен и бутилен —
также газообразны.
От пентена до октадецена
включительно углеводороды
находятся в жидком
состоянии, а начиная
с нонадецена —
в твёрдом.
Бутен
Sbrools
Пропилен
4.
Физические свойства алкеновАлкены плохо растворимы
в воде, но хорошо —
в органических
растворителях. Этилен и
пропилен горят коптящим
пламенем.
5.
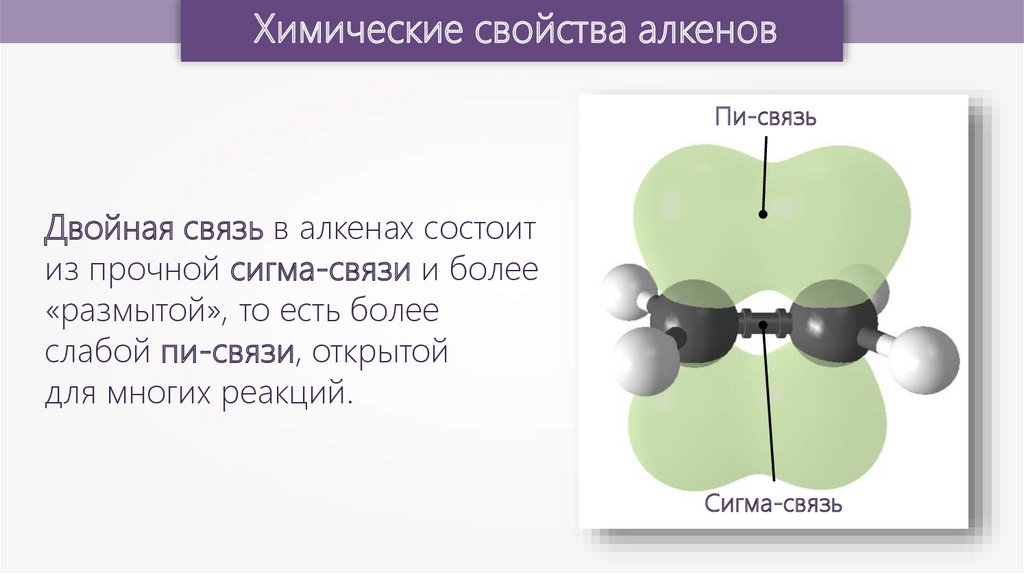
Химические свойства алкеновПи-связь
Двойная связь в алкенах состоит
из прочной сигма-связи и более
«размытой», то есть более
слабой пи-связи, открытой
для многих реакций.
Сигма-связь
6.
Кратная связь представляетсобой область повышенной
электронной плотности,
которая доступна для частиц
с полным или частичным
положительным зарядом —
электрофилов.
7.
Реакции присоединенияt, Ni
CnH2n + H2 → CnH2n+2
Реакция гидрирования (гидрогенизация) —
это реакция взаимодействия с водородом,
которая происходит в присутствии
катализатора никеля и при повышенной
температуре.
8.
Реакции присоединенияCnH2n + Г2 → CnH2nГ2
Алкены вступают в реакцию
галогенирования — это реакция
взаимодействия с галогенами.
9.
Периодическая система химических элементов Дмитрия Ивановича Менделеева10.
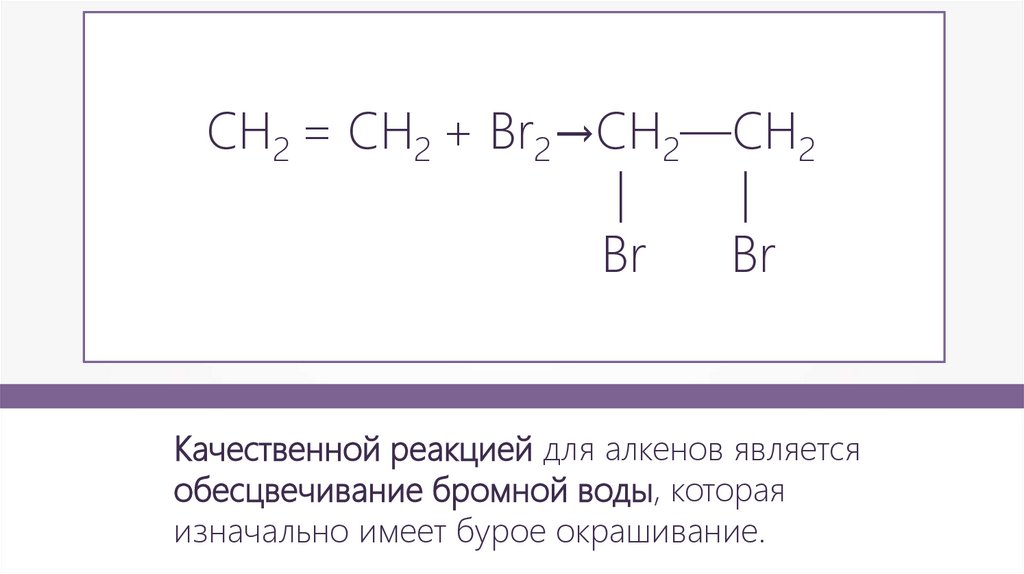
СH2 = CH2 + Br2→CH2—CH2|
|
Br
Br
Качественной реакцией для алкенов является
обесцвечивание бромной воды, которая
изначально имеет бурое окрашивание.
11.
Реакции присоединенияR—CH = CH2 + НГ → R—CH—CH3
|
Г
Реакция гидрогалогенирование —
это реакция взаимодействия
с галогенводородами.
12.
t,H3PO4R—СH = CH2 + H—OH → R—CH—CH3
|
OH
t,H3PO4
CH2 = CH2 + H2O → CH3—CH2—OH
Гидратация — реакция присоединения молекул
воды так же является характерной для алкенов.
13.
Присоединениегалогенводородов и воды
к несимметричным алкенам
происходит по правилу
Марковникова Владимира
Васильевича.
Марковников
Владимир Васильевич
1803–1873 гг.
14.
Ещё одной характернойреакцией для алкенов и
для всех органических
соединений является
реакция окисления.
15.
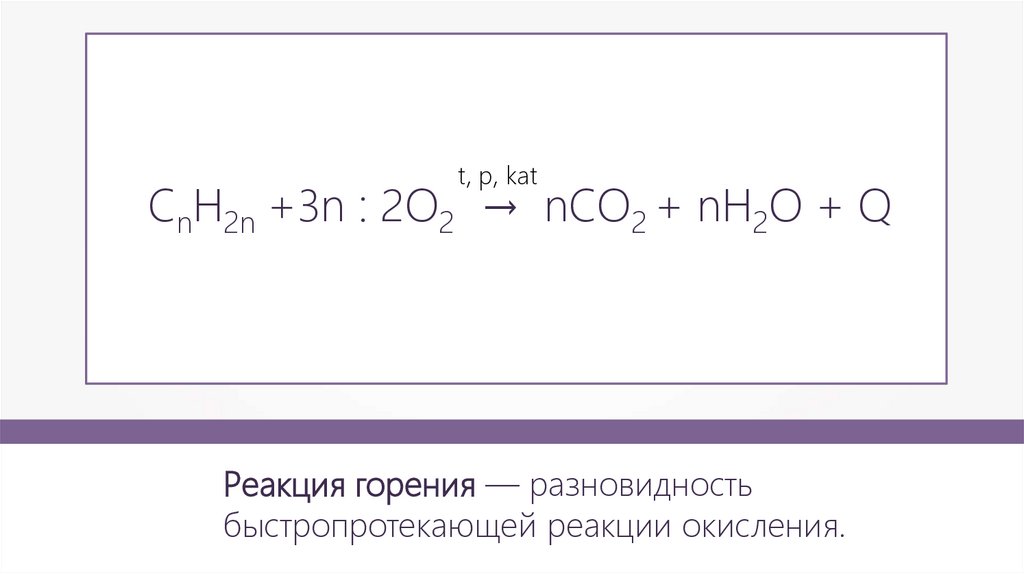
t, p, katCnH2n +3n : 2O2 → nCO2 + nH2O + Q
Реакция горения — разновидность
быстропротекающей реакции окисления.
16.
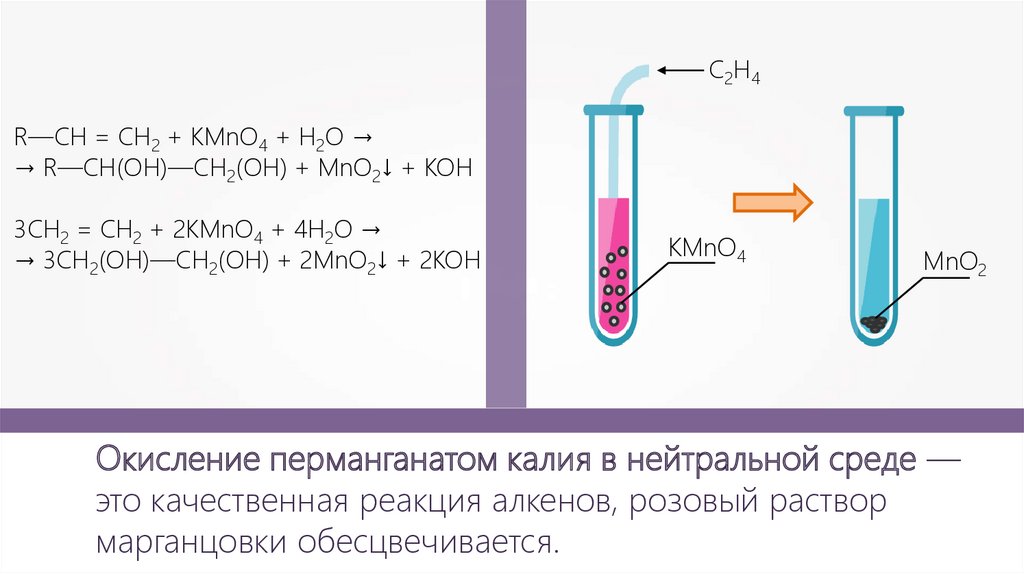
C2H4R—CH = CH2 + KMnO4 + H2O →
→ R—CH(ОН)—CH2(ОН) + MnO2↓ + KOH
3CH2 = CH2 + 2KMnO4 + 4H2O →
→ 3CH2(ОН)—CH2(ОН) + 2MnO2↓ + 2KOH
KMnO4
MnO2
Окисление перманганатом калия в нейтральной среде —
это качественная реакция алкенов, розовый раствор
марганцовки обесцвечивается.
17.
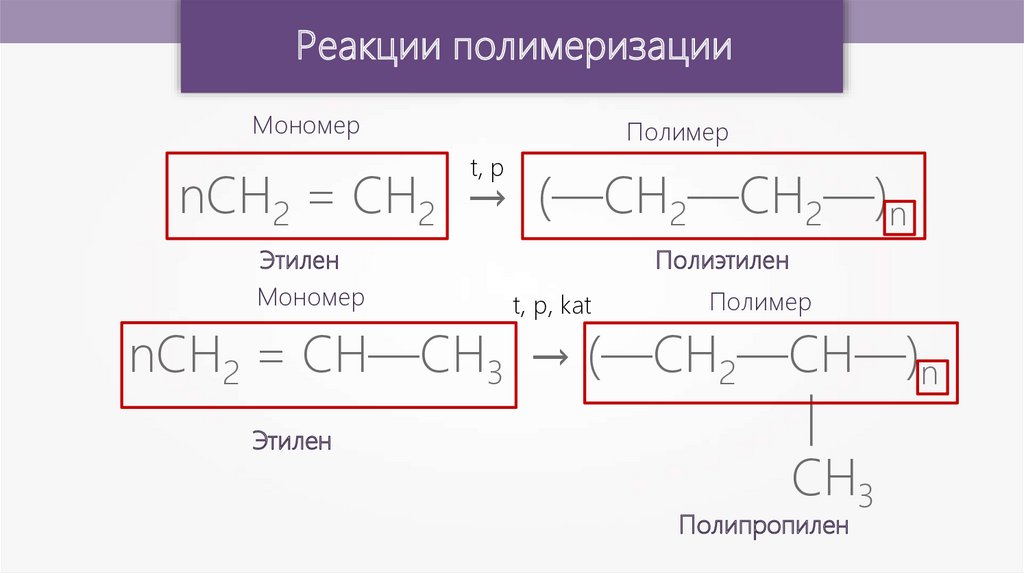
Реакции полимеризацииМономер
Полимер
t, p
nCH2 = CH2 → (—CH2—CH2—)n
Этилен
Мономер
Полиэтилен
t, p, kat
Полимер
nCH2 = CH—CH3 → (—CH2—CH—)n
|
Этилен
CH3
Полипропилен
18.
Реакция полимеризации — процесспоследовательного соединения
одинаковых молекул в большие
по размерам молекулы.
19.
Этиленовые углеводородыс воздухом образуют
небезопасные взрывные
смеси, про это надо помнить
во время работы с ними.
20.
Для этиленовыхуглеводородов
характерны реакции:
– присоединения;
– окисления;
– полимеризации.











 Химия
Химия








