Похожие презентации:
Алкены. Строение, номенклатура, изомерия, физические и химические свойства алкенов
1.
«Уча, учимся».Сенека
2.
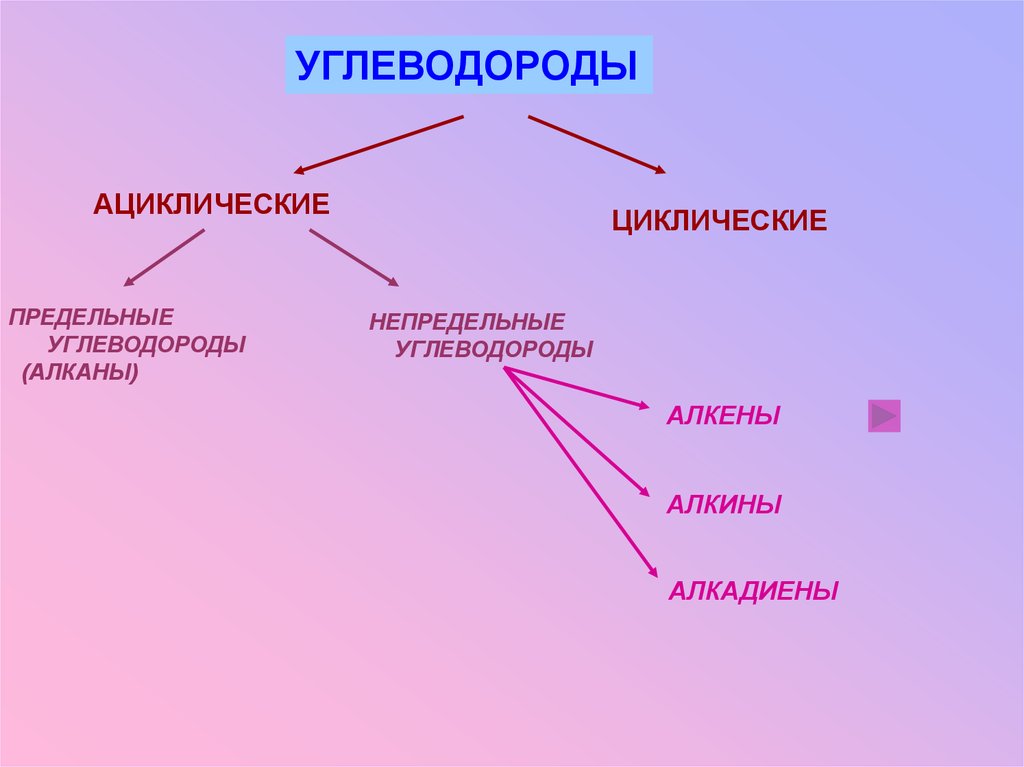
УГЛЕВОДОРОДЫАЦИКЛИЧЕСКИЕ
ПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
(АЛКАНЫ)
ЦИКЛИЧЕСКИЕ
НЕПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
АЛКЕНЫ
АЛКИНЫ
АЛКАДИЕНЫ
3.
ТЕМА УРОКА :АЛКЕНЫ-
АЛКЕНЫ. СТРОЕНИЕ,
НОМЕНКЛАТУРА,ИЗОМЕРИЯ,
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
СВОЙСТВА АЛКЕНОВ.
ЭТО УГЛЕВОДОРОДЫ НЕЦИКЛИЧЕСКОГО
СТРОЕНИЯ, В МОЛЕКУЛАХ КОТОРЫХ
МЕЖДУ АТОМАМИ УГЛЕРОДА ОБРАЗУЕТСЯ
ОДНА ДВОЙНАЯ СВЯЗЬ.
Общая формула
CnH2n (n>1)
далее
4.
Гомологический ряд этилена1
CH2
1
2
CH2
эт ан
ен
2
3
CH2
CH
1
2
CH2
1
CH2
CH
2
CH
CH3
3
CH2
3
CH2
Названия алкенов по системати(этилен)
ческой номенклатуре образуются
от названий соответствующих
алканов (с тем же числом
атомов
углерода) путём замены
пропан
ен
(пропилен)
суффикса -ан на –ен.
4
CH3
4
CH2
бутан
ен-1
(бутилен)
5
CH3
пент ан
ен-1
Некоторые простейшие алкены имеют тривиальные названия
далее
5.
Алгоритм составления названия разветвлённого алкена2
CH2
C
СH3
1 CH
2
3
CH
СH3
4
СH3
3-метил-2-этил бутен -1
Выбираем главную
цепь,
она обязатель41Записываем
названиеуглеродную
предельного
углеводорода,
53
ВВ
конце
названии
названия
указываем
ставим
местоположение
цифру,цепь,
показывающую
и название
после
но
должна
содержать
двойную
связь
(может
не
содержащего
такое
же
количество
атомов
углерода,
2
Нумеруем
главную
углеродную
начиная
сбыть
того
какого
всех
заместителей.
углерода
стоит
двойная
самой
длинной)
как
в главной
цепи,
заменив
суффикс
-ансвязь.
на -ен
края
катома
которому
ближе
двойная
связь.
далее
6.
Строение этиленаCH2
p
s
CH2
В молекуле этилена между атомами углерода образуется двойная связ
которая является сочетанием s- и p-связей. s-связь возникает при
осевом перекрывании гибридных орбиталей, а для образования
p-связи необходимы «чистые» р-орбитали. Поэтому атомы углерода,
связанные двойной связью находятся в sp2 -гибридном состоянии.
далее
7.
Атом углерода в sp2-гибридном состояниидалее
8.
Образование молекулы этиленадалее
9.
Особенности s- и p-связейp-Связи образуются между атомами, уже соединенными s-связью.
Эта связь слабее s-связи из-за менее полного перекрывания р-орбитале
Различное строение s- и p-молекулярных орбиталей определяет
характерные особенности s- и p-связей.
1. s-Связь прочнее p-связи. Это обусловлено более эффективным
перекрыванием атомных орбиталей при образовании s-связи и
нахождением s-электронов между ядрами.
2. По s-связям возможно внутримолекулярное вращение атомов
без разрыва связи. Вращение по p-связи невозможно без ее разрыва!
3. Электроны p-связи, находясь вне межъядерного пространства,
обладают большей подвижностью по сравнению с s-электронами
далее
10.
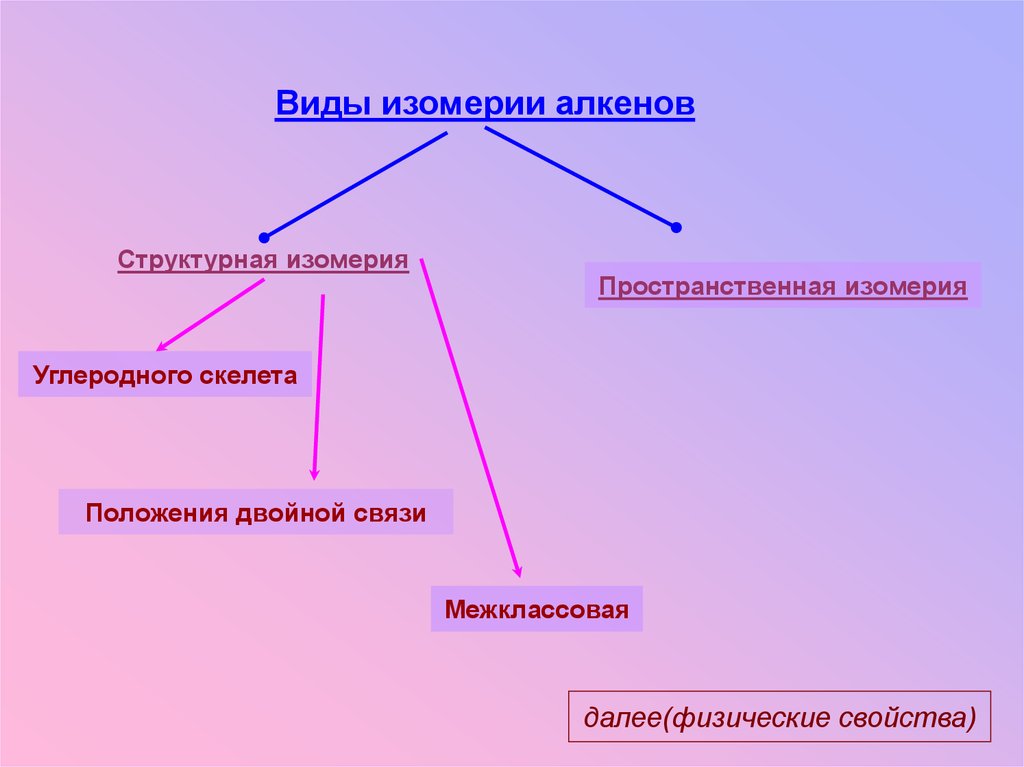
Виды изомерии алкеновСтруктурная изомерия
Пространственная изомерия
Углеродного скелета
Положения двойной связи
Межклассовая
далее(физические свойства)
11.
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТАC4H8
1
2
CH2
1
CH2
3
CH
2
C
CH2
4
CH3
БУТЕН-1
3
C H3
2-МЕТИЛПРОПЕН
CH3
далее
12.
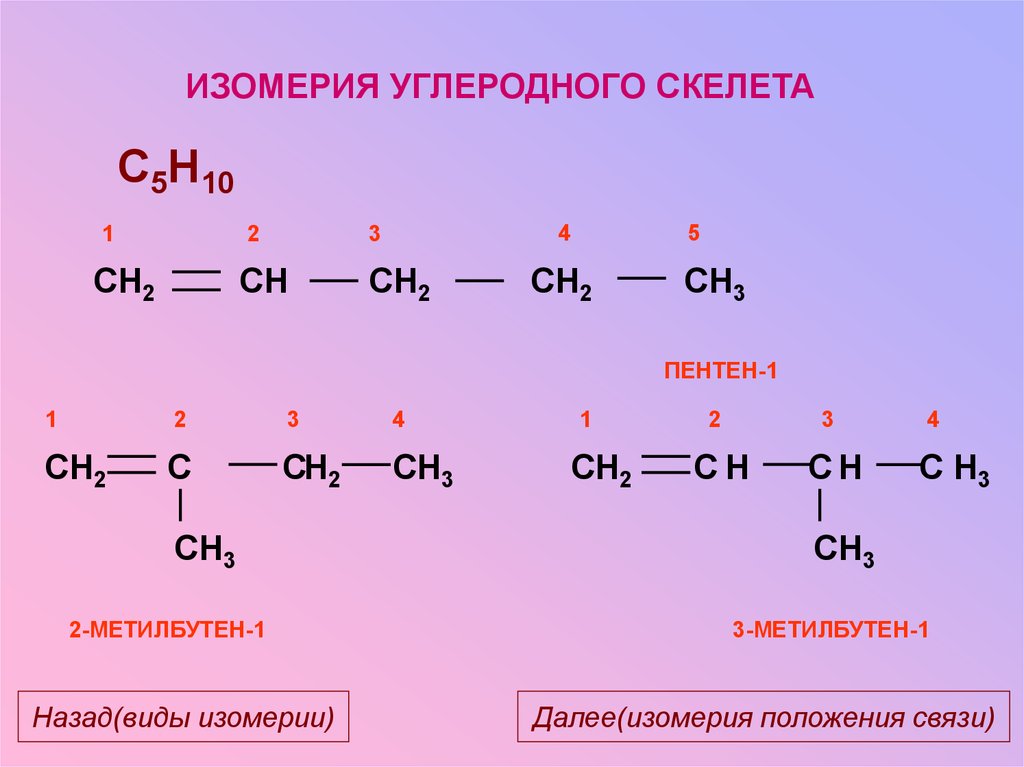
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТАC5H10
1
2
CH2
4
3
CH
CH2
5
CH2
CH3
ПЕНТЕН-1
1
2
3
4
CH2
C
CH2
CH3
CH3
2-МЕТИЛБУТЕН-1
Назад(виды изомерии)
1
CH2
2
3
CH
CH
4
C H3
CH3
3-МЕТИЛБУТЕН-1
Далее(изомерия положения связи)
13.
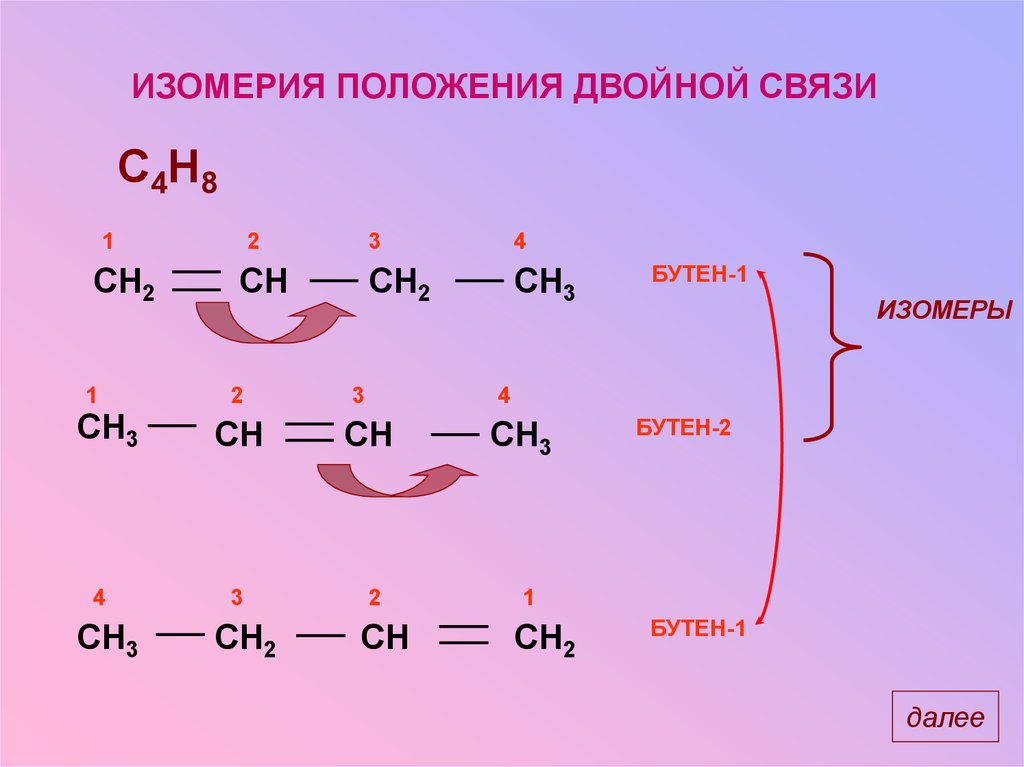
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИC4H8
1
CH2
1
CH3
4
CH3
2
CH
2
3
4
CH2
CH3
3
ИЗОМЕРЫ
4
CH
CH
3
2
CH2
БУТЕН-1
CH
CH3
БУТЕН-2
1
CH2
БУТЕН-1
далее
14.
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИC5H10
1
2
CH2
CH
1
5
CH2
2
CH3
5
4
CH
CH
3 3
CH
CH2 2
Назад(виды изомерии)
CH
CH2
ПЕНТЕН-1
5
CH2
2
3
CH3
4
CH
3
5
CH2
3
CH
4
4
3
CH3
ПЕНТЕН-2
1
2
1
CH
CH
CH
CH3 2
ПЕНТЕН-2
ПЕНТЕН-1
Далее(межклассовая изомерия)
15.
МЕЖКЛАССОВАЯ ИЗОМЕРИЯCnH2n
циклоалканы
алкены
C4H8
CH2
CH
БУТЕН-1
CH2
CH3
H2C
CH2
H2C
CH2
ЦИКЛОБУТАН
далее
16.
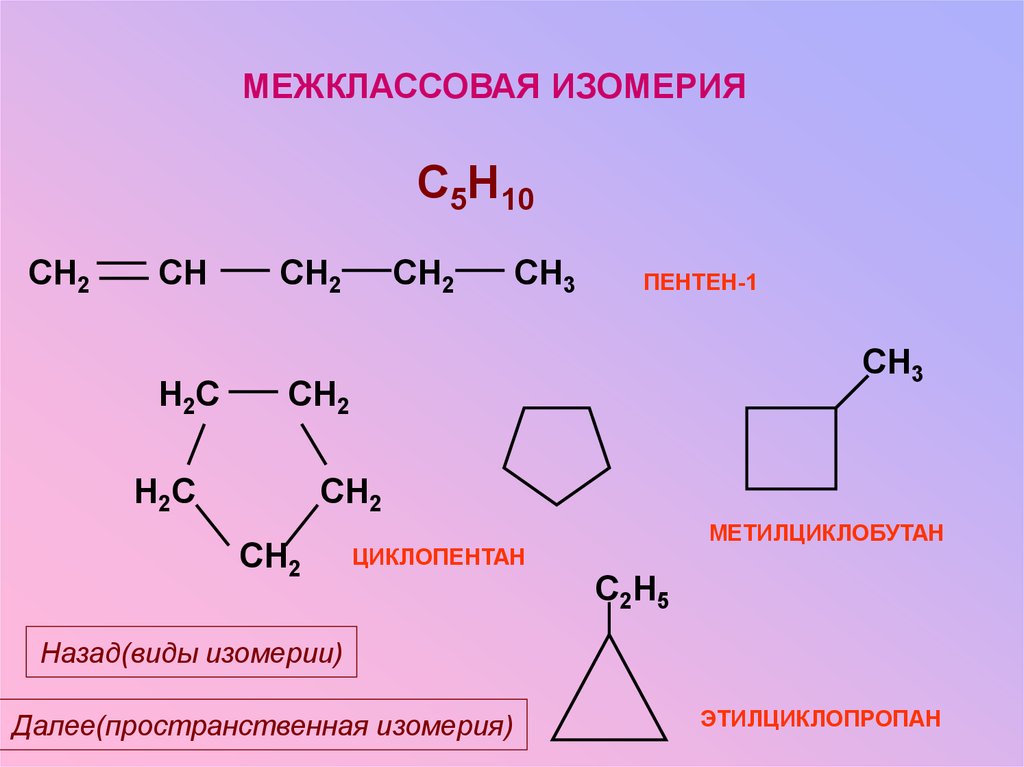
МЕЖКЛАССОВАЯ ИЗОМЕРИЯC5H10
CH2
CH
H2C
CH2
CH2
CH3
ПЕНТЕН-1
CH3
CH2
H2C
CH2
CH2
МЕТИЛЦИКЛОБУТАН
ЦИКЛОПЕНТАН
C2H5
Назад(виды изомерии)
Далее(пространственная изомерия)
ЭТИЛЦИКЛОПРОПАН
17.
НОМЕНКЛАТУРААЛКЕНОВ изомерия
Пространственная
Назад(виды изомерии)
далее(физические свойства)
18.
Физические свойства алкеновФизические свойства алкенов закономерно изменяются в
гомологическом ряду: от С2Н4 до С4Н8 – газы,
начиная с С5Н10 – жидкости,
с С18Н36 – твердые вещества.
Алкены практически нерастворимы в воде, но хорошо
растворяются в органических растворителях.
далее
19.
Химические свойства алкеновХимические свойства алкенов определяются строением и
свойствами двойной связи С=С, которая значительно активнее
других связей в молекулах этих соединений.
Алкены химически более активны, чем алканы.
Для алкенов наиболее характерны реакции, протекающие
за счет раскрытия менее прочной p-связи. При этом p –связь
(в исходном алкене) преобразуется в s -связь в продукте реакции.
Исходное ненасыщенное соединение превращается в насыщенное
без образования других продуктов, т.е. происходит
реакция присоединения.
далее
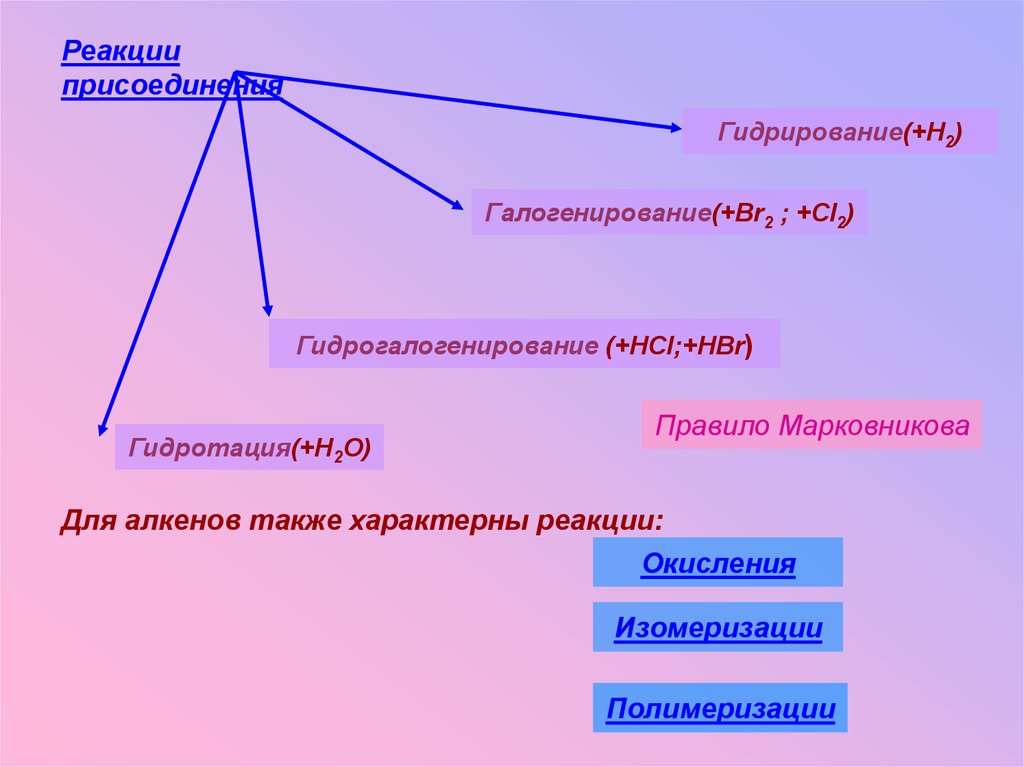
20.
Реакцииприсоединения
Гидрирование(+H2)
Галогенирование(+Br2 ; +Cl2)
Гидрогалогенирование (+HCl;+HBr)
Гидротация(+H2O)
Правило Марковникова
Для алкенов также характерны реакции:
Окисления
Изомеризации
Полимеризации
21.
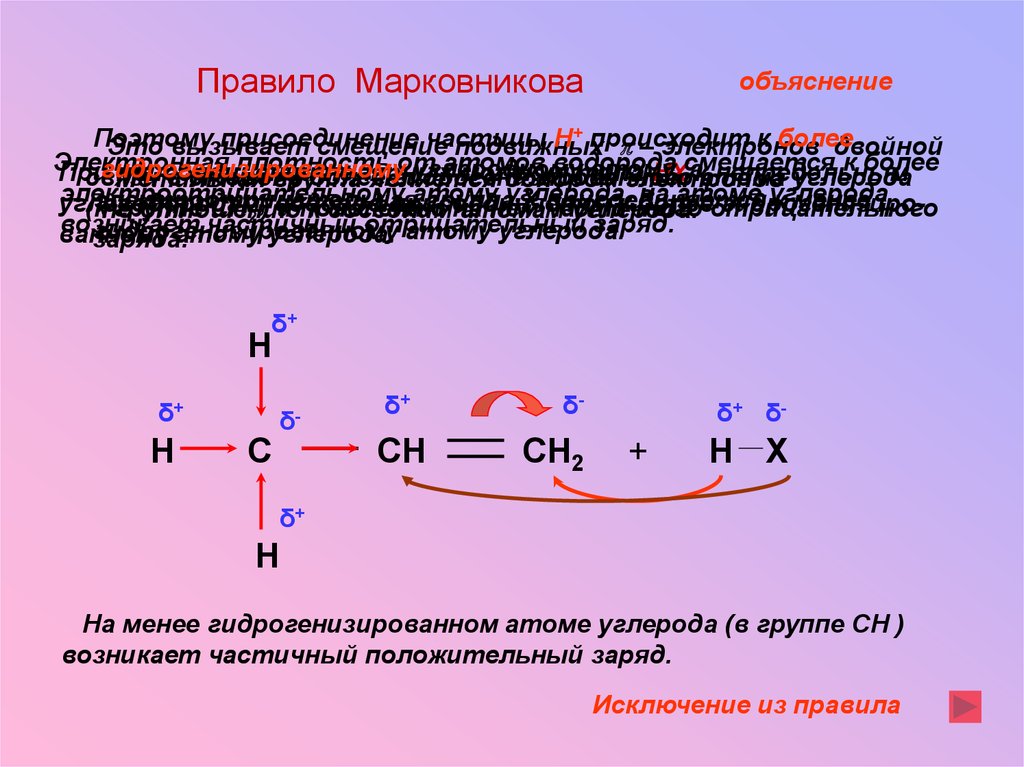
Правило Марковниковаобъяснение
Поэтому
присоединение
частицы
Н+ происходит
к более
Это вызывает
смещение
подвижных
p – электронов
двойной
Электронная
плотность
от
атомов
водорода
смещается
к более
гидрогенизированному
углеродному
атому,
При
присоединении
полярных
молекул
типа
НХ акатома
непредельным
связи
в сторону
более
гидрогенизированного
углерода
Метильная
группа
является
донором
электронов
электроотрицательному
атому
углерода,
на атоме
углерода
электроотрицательная
группа
Х частичного
присоединяется
к менее
углеводородам,
присоединяется
к более
гидрогенизиро(к
группе
СН2 ) водород
и появлению
на
нём
отрицательного
по
отношению
к соседним
атомам
углерода.
возникает
частичный
отрицательный
заряд.
гидрогенизированному
атому углерода.
ванному
атому
углерода.
заряда.
δ+
H
δ+
H
δ-
C
δ+
CH
δ-
CH2
δ+ δ-
+
Н Х
δ+
H
На менее гидрогенизированном атоме углерода (в группе СН )
возникает частичный положительный заряд.
Исключение из правила
22.
Введение в радикал электроотрицательного элементаприводит к изменению направления реакции присоединения.
H
δ-
Cl
δ+
C
H
выбор свойства
δ-
CH
δ+
CH2
δ+ δ-
+
Н Х
23.
Реакции окисленияСтроение продуктов окисления алкенов зависит
от условий реакции и природы окислителя.
Полное окисление. Горение.
CnH2n +
CH2
далее
CH2
3n
O2
2
+ 3 O2
n CO2 + n H2O
2 CO2 + 2 H2O
24.
Реакции окисленияМягкое окисление алкенов водным раствором перманганата
калия приводит к образованию двухатомных спиртов
(реакция Вагнера):
KMnO4
CH2
CH2
+
O
+
H2O
CH2
CH2
этиленгликоль
OH
OH
Промышленное значение имеет частичное окисление алкенов
с образованием циклических оксидов, которые широко
используются в органическом синтезе:
2 CH2
CH2
+
выбор свойства
O2
150-3500 С
катализато
р
2 CH2
CH2
этиленоксид
O
далее
25.
Реакция Вагнера (качественная реакция)алке
н
раствор KMnO4
до реакции
выбор свойства
раствор KMnO4
после реакции
далее(гидрирование)
26.
Гидрирование (присоединение водорода)Алкены взаимодействуют с водородом при нагревании в
присутствии металлов Pt, Pd или Ni:
CH23
CH23
этилен
выбор свойства
+
H2
этан
далее(галогенирование)
27.
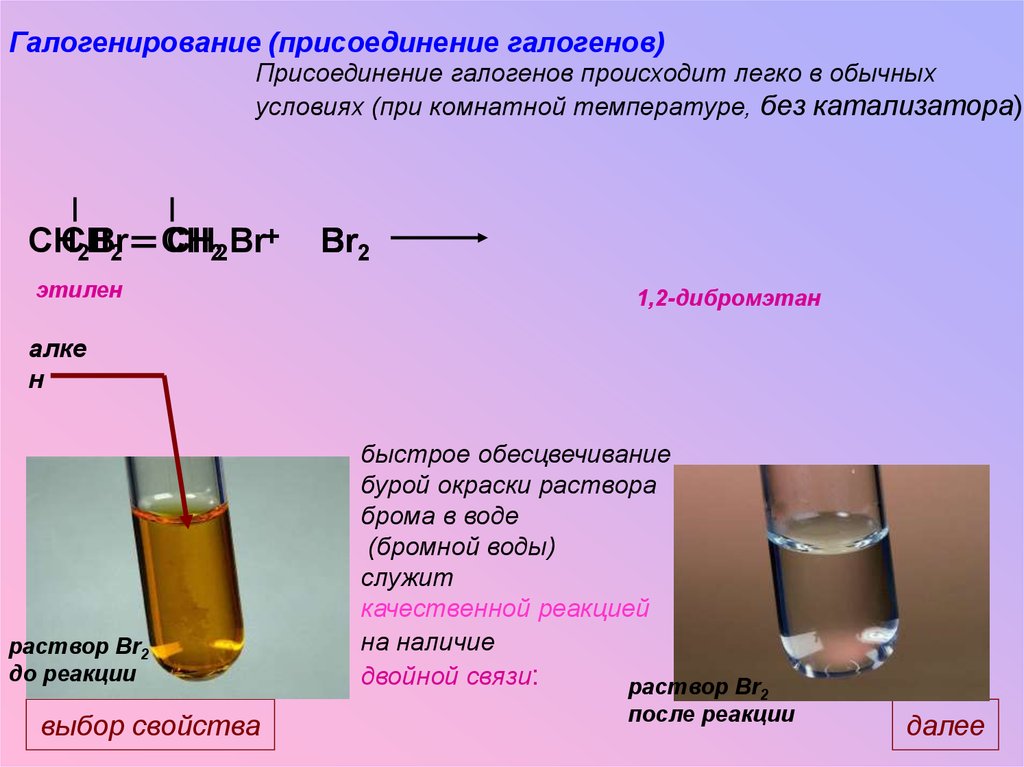
Галогенирование (присоединение галогенов)Присоединение галогенов происходит легко в обычных
условиях (при комнатной температуре, без катализатора).
CHCH
CH
CH22Br+
2Br
2
этилен
Br2
1,2-дибромэтан
алке
н
раствор Br2
до реакции
выбор свойства
быстрое обесцвечивание
бурой окраски раствора
брома в воде
(бромной воды)
служит
качественной реакцией
на наличие
двойной связи:
раствор Br
2
после реакции
далее
28.
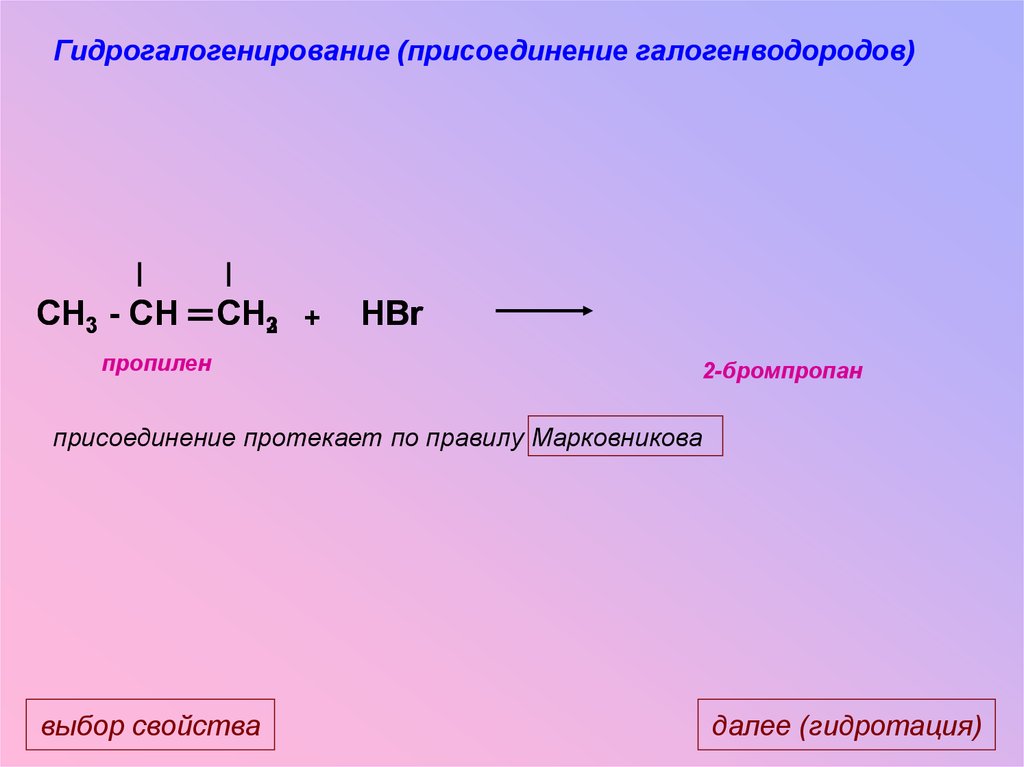
Гидрогалогенирование (присоединение галогенводородов)CH3 - CH
CH32 +
пропилен
HBr
2-бромпропан
присоединение протекает по правилу Марковникова
выбор свойства
далее (гидротация)
29.
Гидротация (присоединение воды)Гидратация происходит в присутствии минеральных кислот
CH3 - CH
CH32 +
H2OH
O
присоединение протекает по правилу Марковникова
выбор свойства
далее (изомеризация)
30.
Реакции изомеризацииАлкены вступают в реакцию изомеризации при нагревании в
присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению p–связи:
или к перестройке углеродного скелета:
выбор свойства
далее (полимеризация)
31.
Реакции полимеризацииПолимеризация – реакция образования высокомолекулярного
соединения (полимера) путем последовательного присоединения
молекул низкомолекулярного вещества (мономера) по схеме:
Число n называется степенью полимеризации.
Реакции полимеризации алкенов идут в результате присоединения по
кратным связям:
выбор свойства
32.
Слайд №1. Классификация углеводородов….………………………………2
Содежание 2. Тема урока……………….……………………………………...….3
3. Гомологический ряд этилена….………………………………..4
4. Номенклатура алкенов….….……………………………..….….5
5. Строение этилена ………..………………………………..........6
sp2- гибридизация………………….……………………...7-8
особенности сигма- и пи- связей…………….…..…..….9
6. Виды изомерии алкенов…….……………………………..…..….10
изомерия углеродного скелета (С4Н10 ;С5Н12)……11-12
изомерия положения двойной связи (С4Н10 ;С5Н12)…13-14
межклассовая изомерия (С4Н10 ;С5Н12).…………..…..15-16
пространственная изомерия...…..…….…………..…17
7. Физические свойства алкенов……….…..…..……….…………18
8. Химические свойства алкенов……..….……..……….…………19
типы реакций………….……..…………..………..…….….20
правило Марковникова………..………………….….….21-22
реакции окисления……………..………………..………23-25
реакция гидрирования …………………………..…………26
реакция галогенирования………………………...…..…….27
реакция гидррогалогенирования …………………….…..28
реакция гидротации………………………………………..29
реакции изомеризации…………..……………….…......….30
реакции полимеризации………..………………..….…......31
9. Содержание….…………………………..…………..……….…...….32























 Химия
Химия








