Похожие презентации:
Окислительно-восстановительные реакции
1. « Кто-то теряет, а кто-то находит.»
2. Тема урока : "Окислительно-восстановительные реакции"
3.
Ca0 +20 ) ) ) )Ca 2+
2 8 8 2
атом
S0 +16 ) ) )
S22 8 6
атом
Ca2+ +20 ) ) )
Ca0 - 2 e =>
2 8 8
ион
S2- +16 ) ) )
2 8 8
ион
Ca0 + S0 => Ca+2S-2
S0 + 2e =
4.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1 -1
+1 -2 +1
+1
-1
+1 -2
HCl + NaOH = NaCl + H2O
+1
-1
0
+2
-1
0
Окислительновосстановительная
2
реакция
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
5.
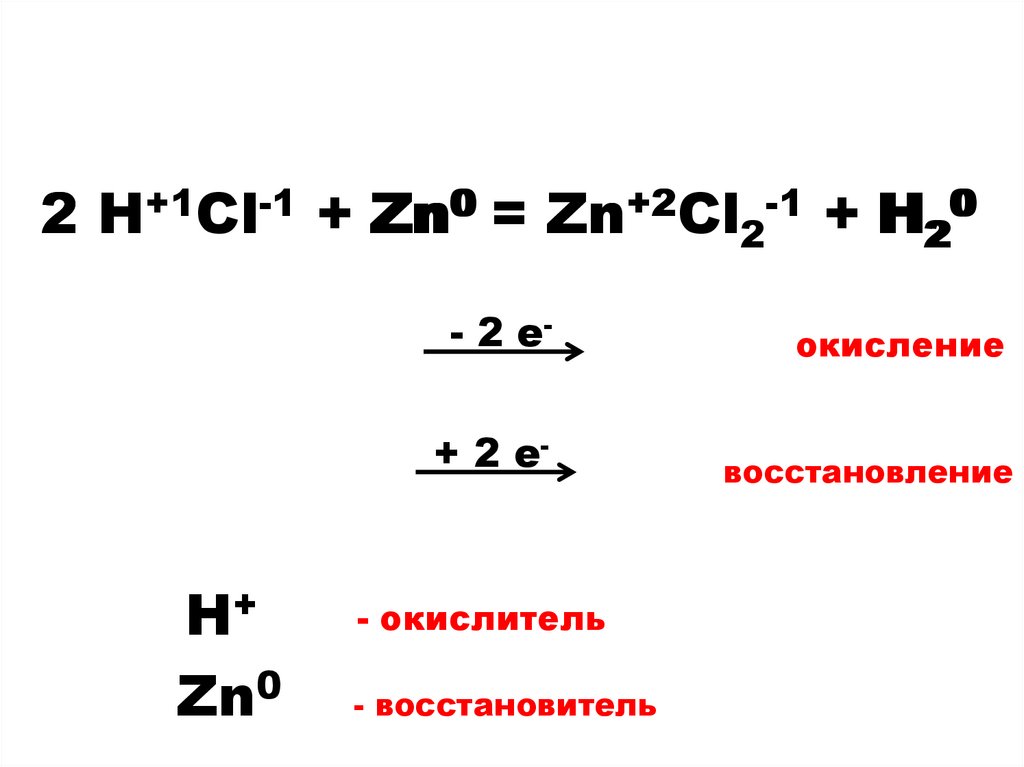
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200H+
Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
6.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
7.
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
8.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
2Cl-1
+5 e- 2 e-
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
5
окисление
10
9.
Расставьте коэффициентыметодом электронного баланса.
Al + MnO2 = Al2O3 + Mn
Fe2O3 + Zn = ZnO + Fe
10. Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель
• Li0 + O20 => Li2O• C0 + O20 => CO2
• H02 + O20 => H2O
11. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР
• СаСО3 => СаО + СО2• KMnO4 => K2 MnО4 + MnО2 + О2
• CuS + О2 => СuО + SО2
12. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР Определите окислитель, восстановитель
• 1)С-4Н4+1 + 2О20 => C+4О2-2 + 2H2+1О-2-8e
• С-4 C+4 - восстановитель -(окисляется )
+4e
• О20 2О-2 - окислитель -(восстанавливается )
4|1
8 |2
13. Домашнее задание:
Параграф 44 , упр 1 с.268.












 Химия
Химия








