Похожие презентации:
Обмен аминокислот
1.
2.
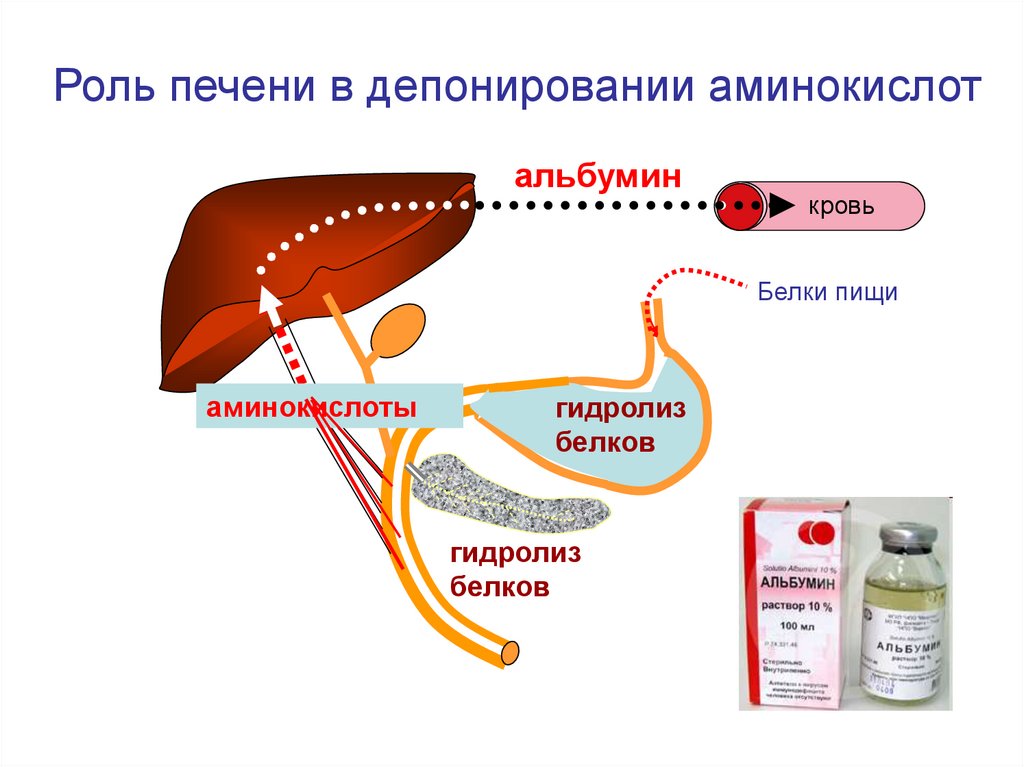
Роль печени в депонировании аминокислотальбумин
кровь
Белки пищи
аминокислоты
гидролиз
белков
гидролиз
белков
3.
Превращенияаминокислот
в клетке
4.
Все превращения аминокислот можносуммировать в виде следующей таблицы:
1.Реакции поликонденсации
(биосинтез белков)
2.Реакции трансаминирования
3.Реакции декарбоксилирования
4.Реакции окислительного
дезаминирования
5.
Биосинтезбелка
6.
Стадии синтеза белка1.Образование инициирующего
комплекса;
2.Элонгация (удлинение
полипептидной цепи);
3.Терминация (завершение синтеза);
4.Процессинг (окончательное
достраивание молекулы белка).
7.
Для синтеза белка нужна и-РНКкодон
кодон
кодон
кодон кодон
-А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г - и-РНК
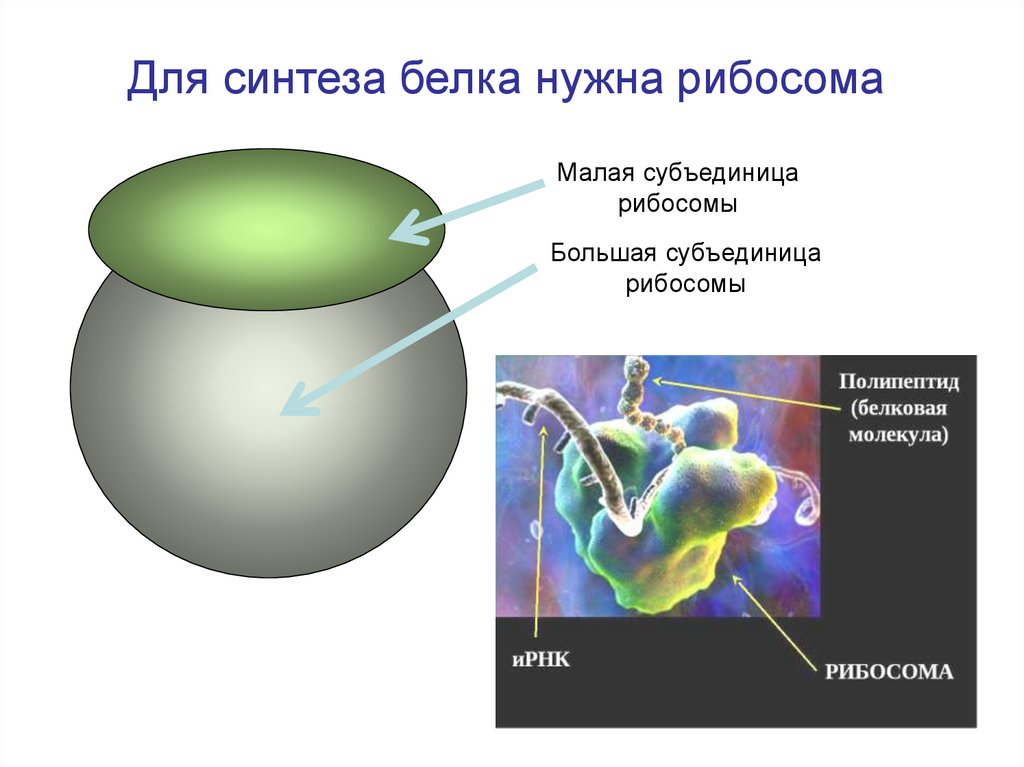
8.
Для синтеза белка нужна рибосомаМалая субъединица
рибосомы
Большая субъединица
рибосомы
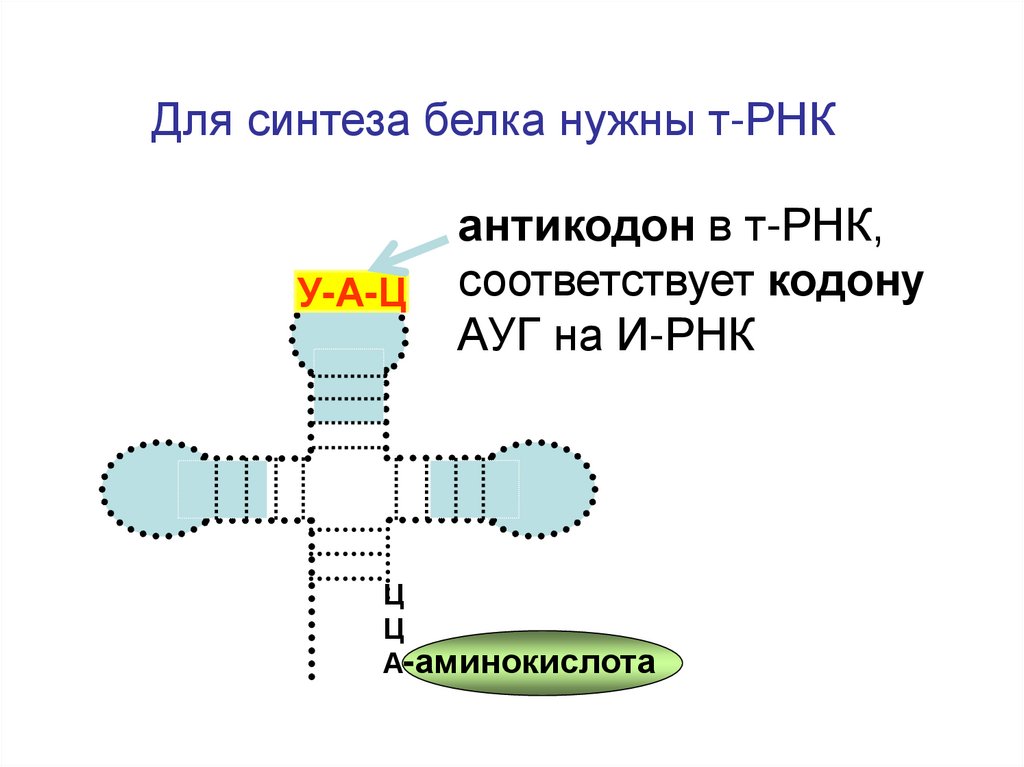
9.
Для синтеза белка нужны т-РНКУ-А-Ц
антикодон в т-РНК,
соответствует кодону
АУГ на И-РНК
Ц
Ц
А-аминокислота
10.
Все аминокислоты кодируются в видетроек нуклеотидов (кодонов или
триплетов). Одна аминокислота может
кодироваться одним триплетом (например,
аминокислота метионин), двумя разными
триплетами (например, фенилаланин,
лейцин и др.), а также четырьмя
триплетами (серин, пролин и др.).
Таблица аминокислотного кода
представлена на следующем рисунке.
11.
РНК - аминокислотный кодФен
УУУ
УУЦ
Лей
УУА
УУГ
Тир
УАУ
УАЦ
Цис
УГУ
УГЦ
Мет
АУГ
Иле
ЦУА
ЦУЦ
Гис
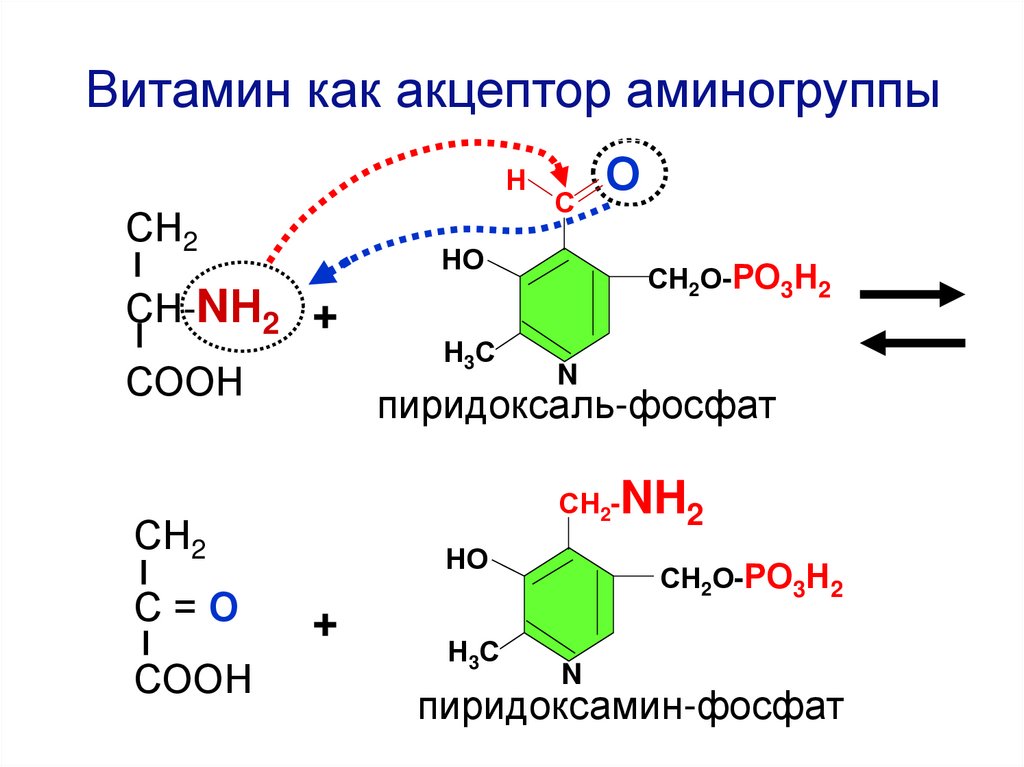
ЦАУ
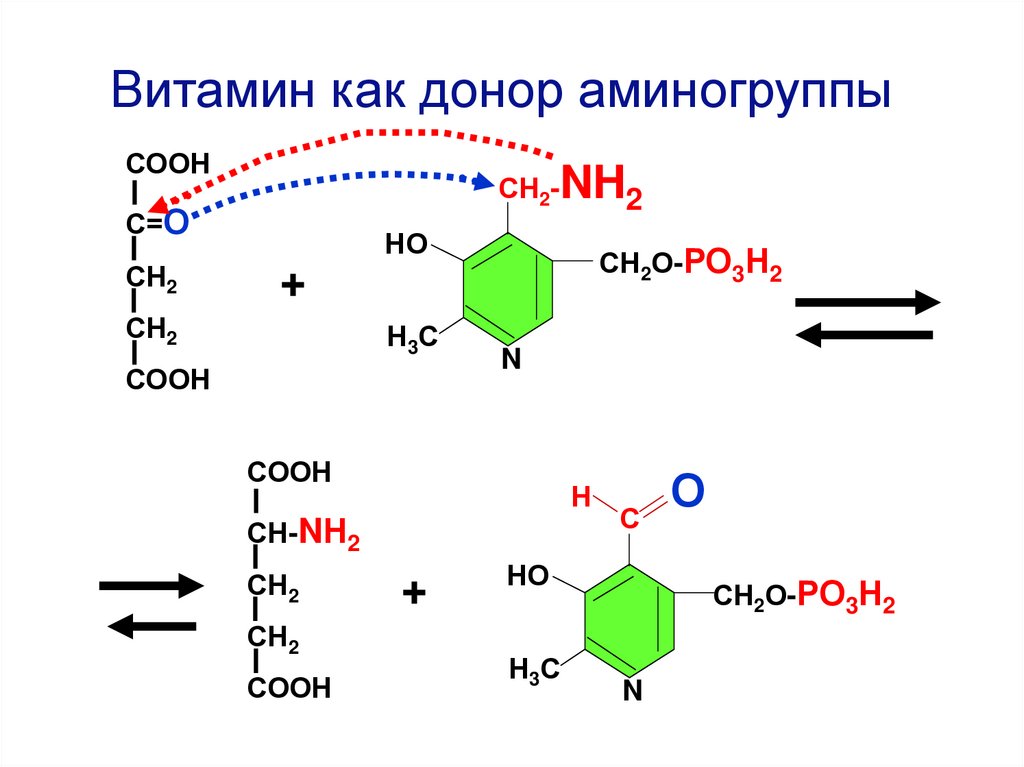
ЦАЦ
Глн
ЦАА
ЦАГ
Асн
ААУ
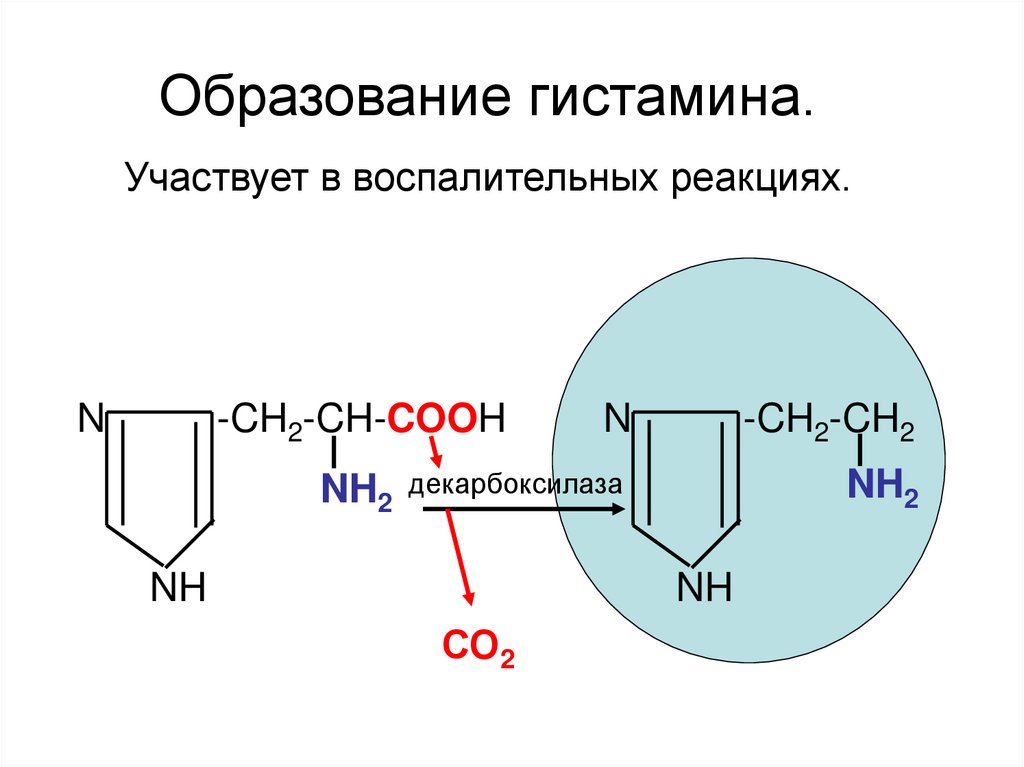
ААЦ
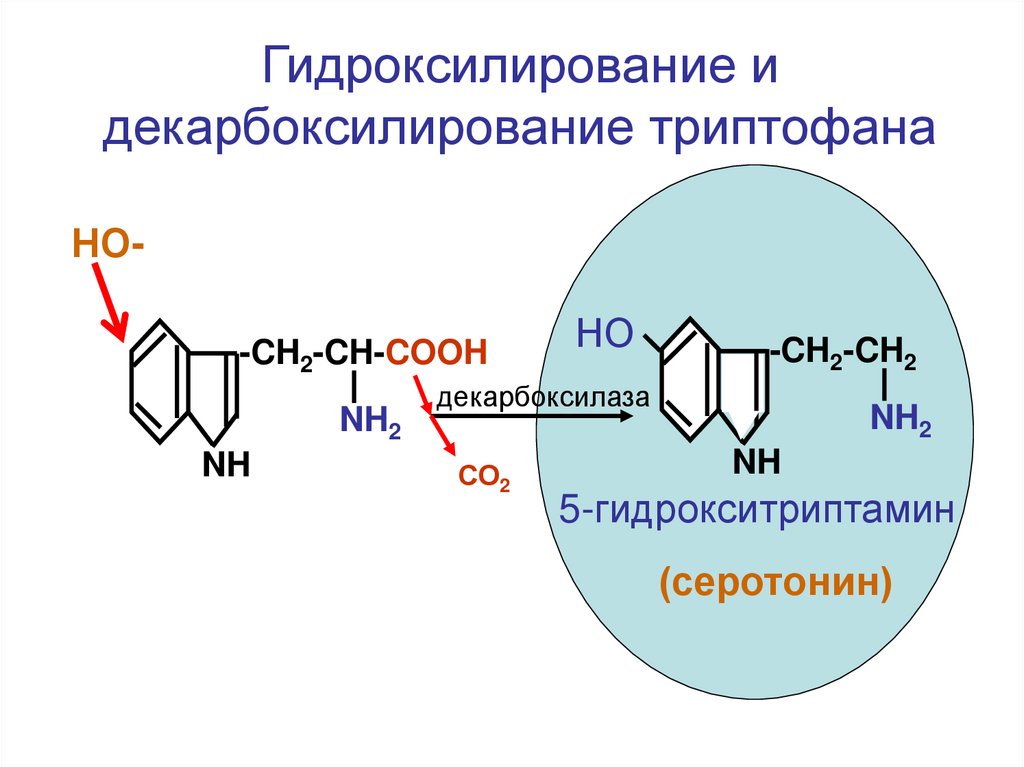
Лиз
ААА
ААГ
Сер
АГУ
АГЦ
Арг
АГА
АГГ
Асп
ГАУ
ГАЦ
Три
УГГ
Терм
УАА
УАГ
Сер
УЦУ УЦЦ
УЦА УЦГ
Про
ЦЦУ ЦЦЦ
ЦЦА ЦЦГ
Арг
ЦГУ ЦГЦ
ЦГА ЦГГ
Тре
АЦУ АЦЦ
АЦА АЦГ
Терм
УГА
Ала
ГЦУ ГЦЦ
ГЦА ГЦГ
Глу
ГГУ ГГЦ
ГГА ГГГ
Лей
ЦУУ ЦУА
ЦУЦ ЦУГ
Вал
ГУУ ГУЦ
ГУА ГУГ
Стоп
ГАА
ГАГ
12.
Активация аминокислотПроцесс соединения аминокислот со своими т-РНК, которые
содержат антикодоны, комплементарные коду каждой
аминокислоты, имеет сложный характер.
Вначале аминокислота активируется с помощью АТФ.
Образуется комплекс: аминокислота-АМФ под названием
аминоациладенилат.
АТФ
+ НООС-СН-NН2
R
O
АМФ - C - CH - NH
2
R
аминоациладенилат
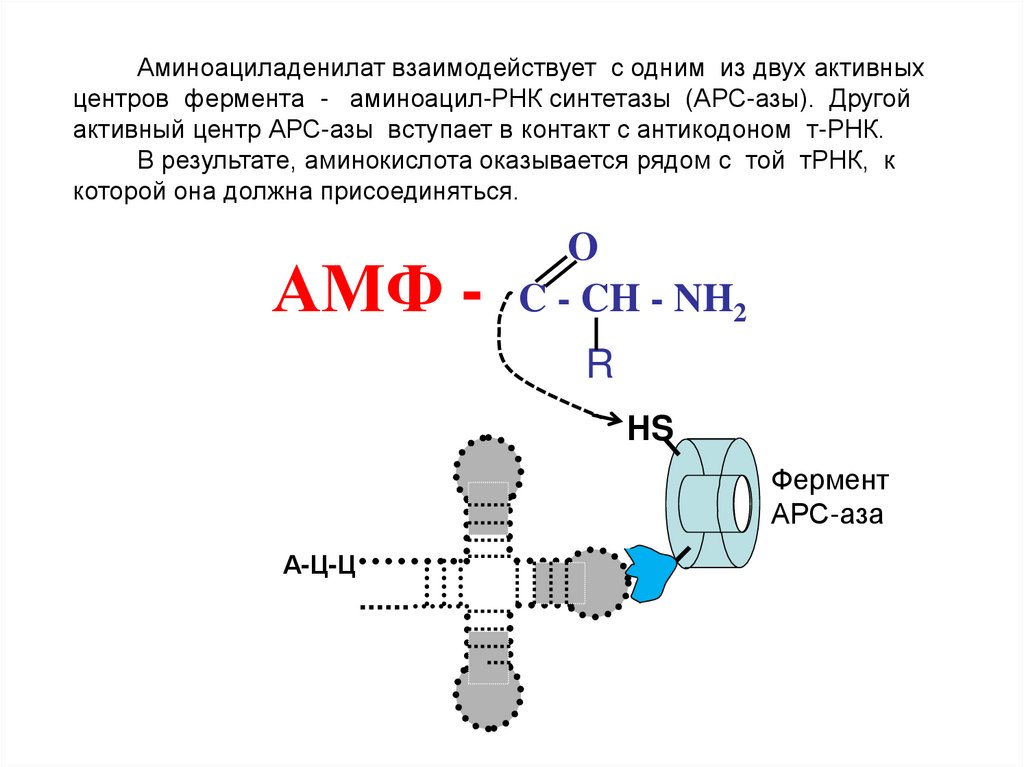
13.
Аминоациладенилат взаимодействует с одним из двух активныхцентров фермента - аминоацил-РНК синтетазы (АРС-азы). Другой
активный центр АРС-азы вступает в контакт с антикодоном т-РНК.
В результате, аминокислота оказывается рядом с той тРНК, к
которой она должна присоединяться.
АМФ -
O
C - CH - NH2
R
НS
Фермент
АРС-аза
А-Ц-Ц
14.
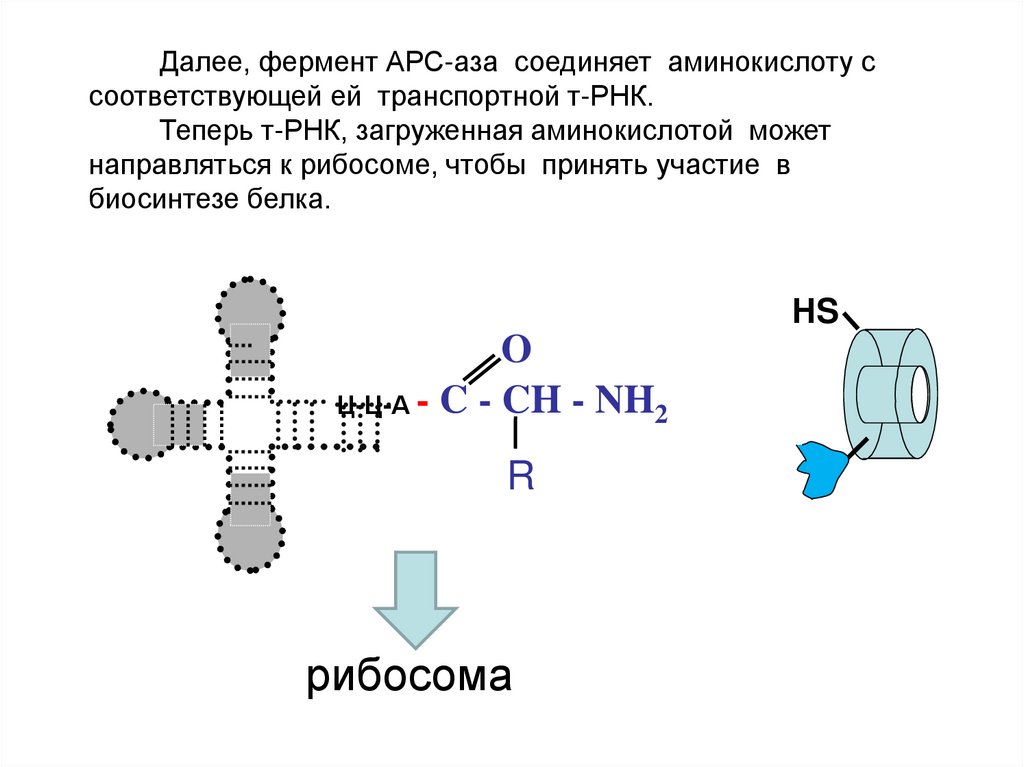
Далее, фермент АРС-аза соединяет аминокислоту ссоответствующей ей транспортной т-РНК.
Теперь т-РНК, загруженная аминокислотой может
направляться к рибосоме, чтобы принять участие в
биосинтезе белка.
НS
O
Ц-Ц-А - C - CH - NH2
R
рибосома
15.
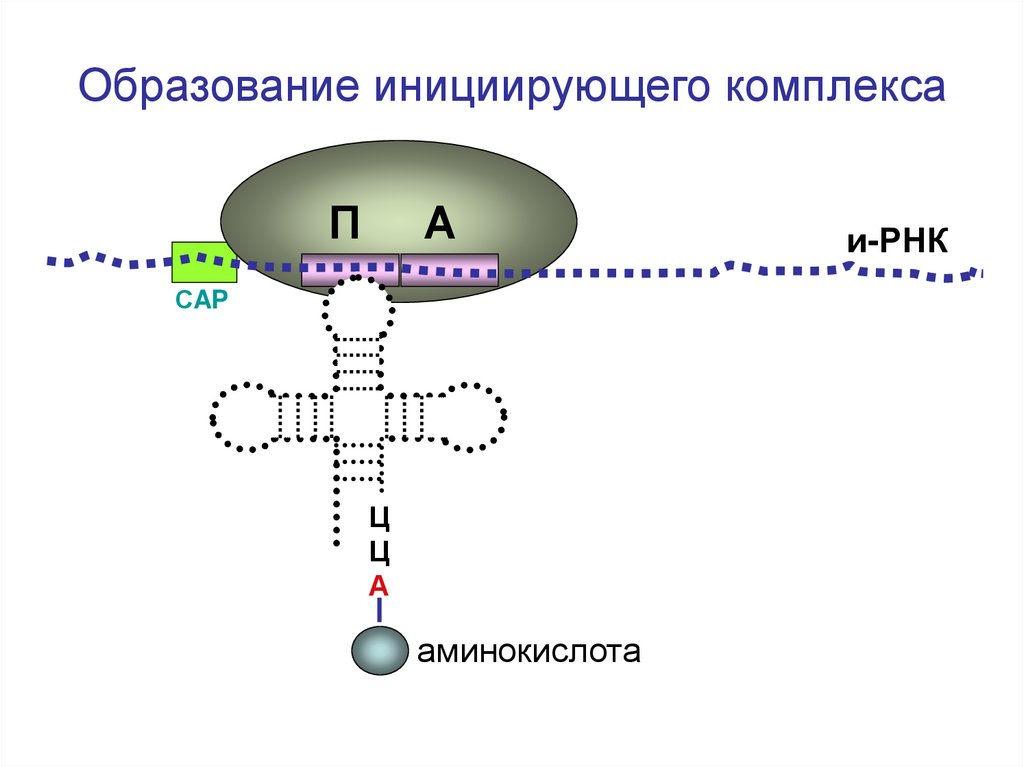
Образованиеинициирующего
комплекса.
16.
Инициирующий комплекс состоит из рибосомы, и-РНК и первойт-РНК. Своим антикодоном т-РНК взаимодействует с
комплементарным для него кодоном на и-РНК. Комплекс
служит сигналом для начала синтеза белка.
кодон
кодон
кодон
кодон кодон
-А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г - и-РНК
У-А-Ц
т-РНК
Ц
Ц
А-аминокислота
17.
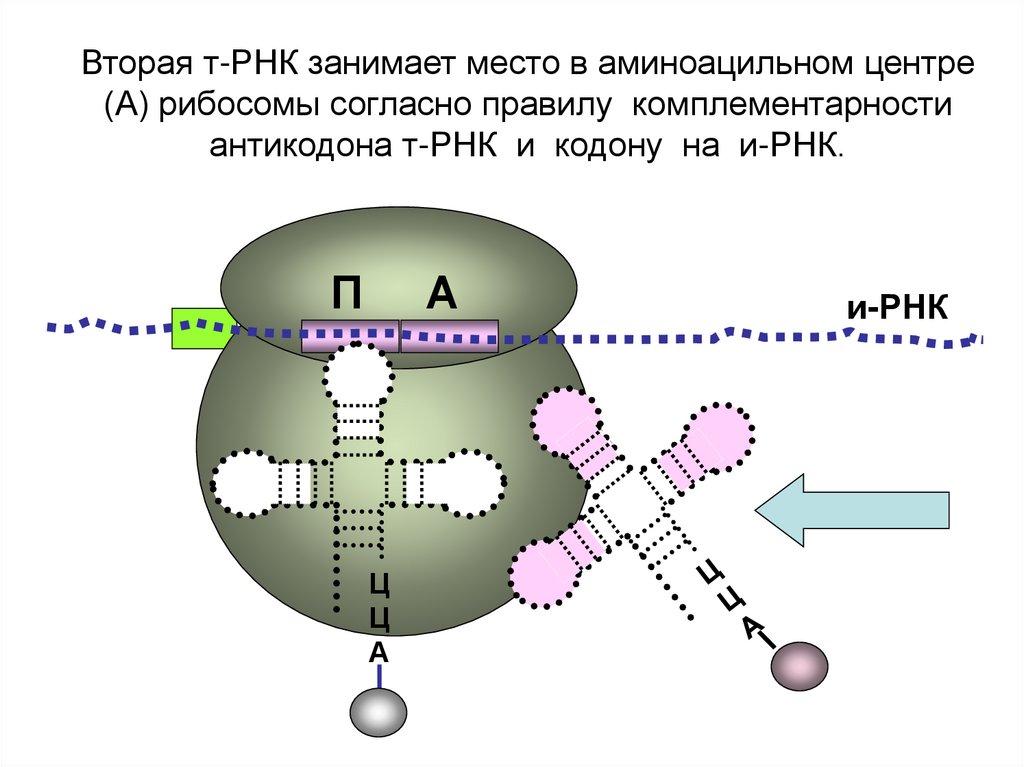
Вторая т-РНК занимает место в аминоацильном центре(А) рибосомы согласно правилу комплементарности
антикодона т-РНК и кодону на и-РНК.
П
А
Ц
Ц
А
и-РНК
18.
Оказавшись рядом с первой т-РНК, вторая т-РНК переносит ксвоей аминокислоте аминокислоту первой т-РНК. При этом
фермент пептидилтрансфераза образует пептидную связь
между двумя аминокислотами.
П
А
Ц
Ц
А
и-РНК
Ц
Ц
А
19.
После этого рибосома передвигается на один кодон в сторону. Приэтом в аминоацильном центре (А) появляется следующий, третий
кодон. Первая т-РНК, оказавшись за пределами рибосомы,
удаляется.
П
А
и-РНК
СAP
Перемещение на 1
кодон
Ц
Ц
А
20.
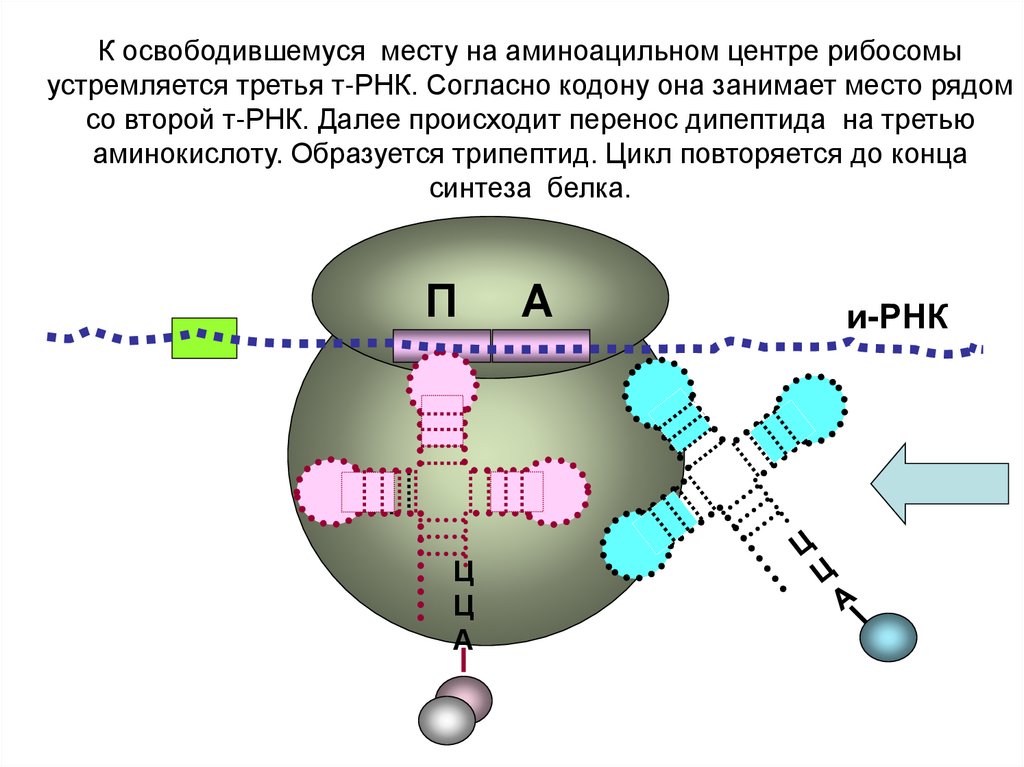
К освободившемуся месту на аминоацильном центре рибосомыустремляется третья т-РНК. Согласно кодону она занимает место рядом
со второй т-РНК. Далее происходит перенос дипептида на третью
аминокислоту. Образуется трипептид. Цикл повторяется до конца
синтеза белка.
П
Ц
Ц
А
А
и-РНК
21.
Синтез белка продолжается до техпор, пока в аминоацильный центр не
заходит особый кодон и-РНК,
сигнализирующий о завершении синтеза.
Такими стоп-кодонами являются,
например, УАА, УГА, УАГ.
В этом случае с кодоном, вместо
т-РНК, взаимодействует белок – фактор
терминации. К нему присоединяется еще
один белок, который отрывает цепь белка
от последней т-РНК.
22.
Остановка синтеза белка фактором терминации,при попадании в А-центр стоп-кодона.
П
Ц
Ц
А
и-РНК
А
УАА
стоп-кодон
фактор
терминации
БЕЛОК
23.
Биосинтезбелка
(мультик)
24.
Образование инициирующего комплексаП
А
СAP
Ц
Ц
А
аминокислота
и-РНК
25.
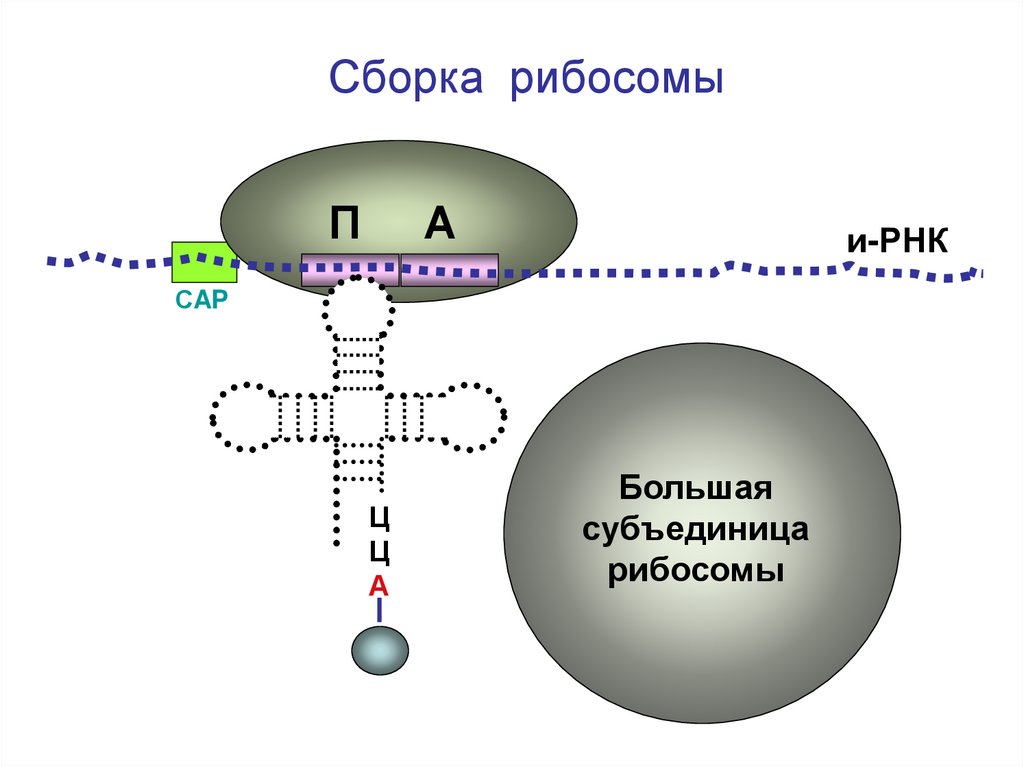
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
26.
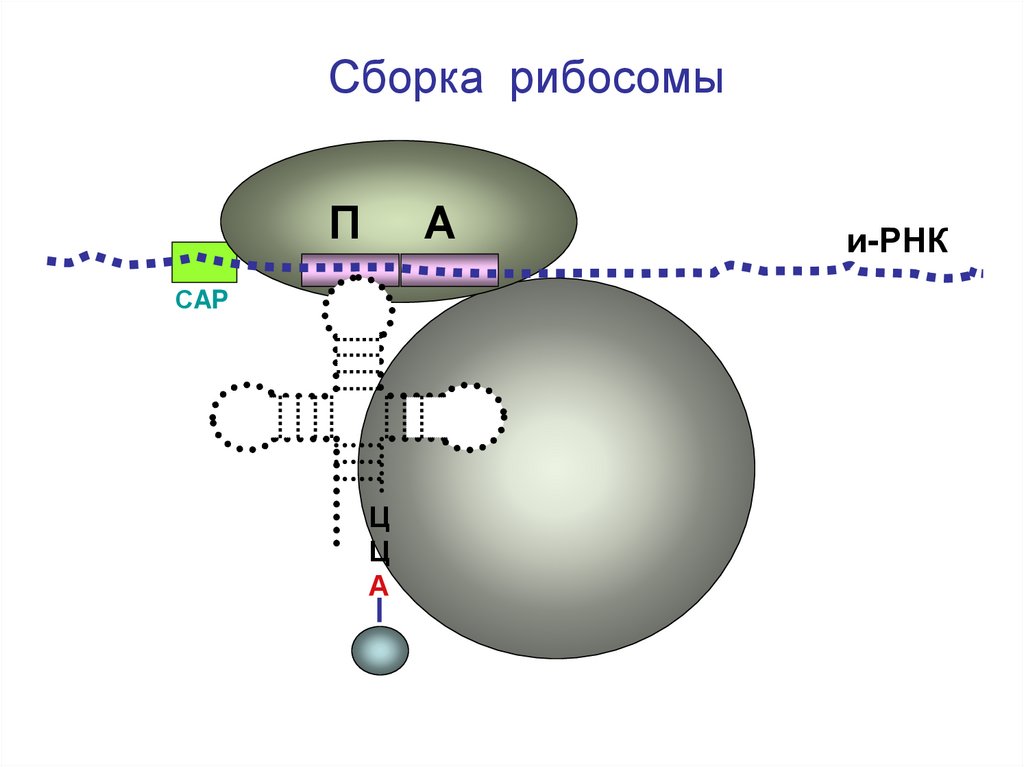
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
27.
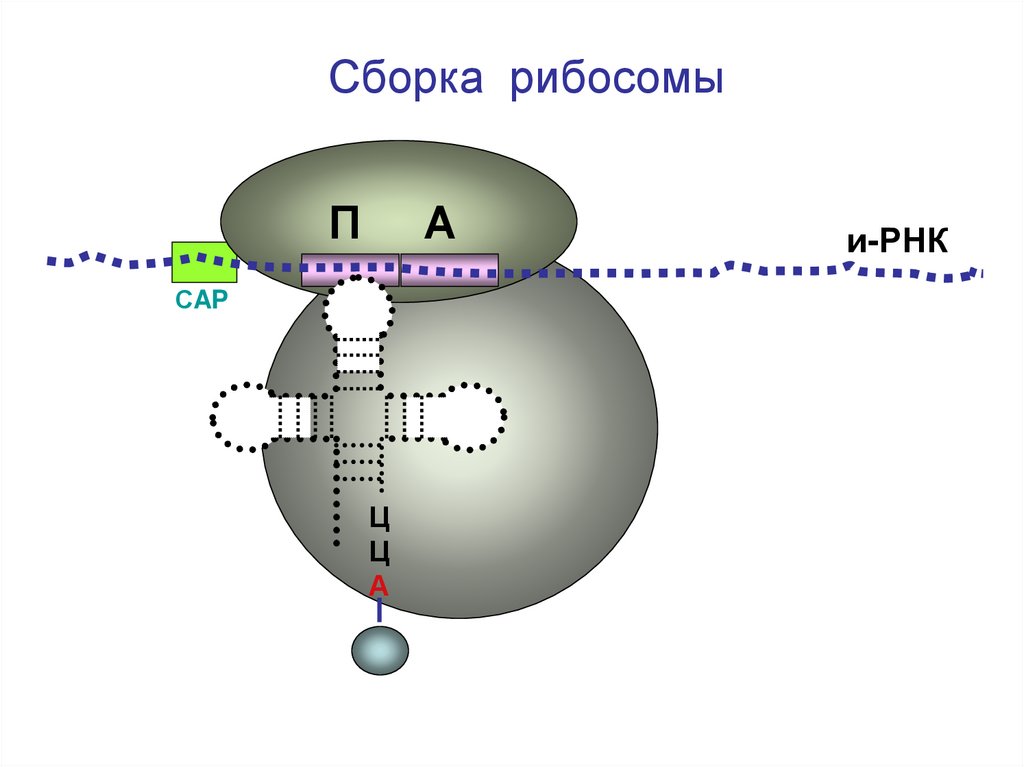
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
28.
Сборка рибосомыП
А
СAP
Ц
Ц
А
и-РНК
29.
Сборка рибосомыП
А
СAP
Ц
Ц
А
и-РНК
30.
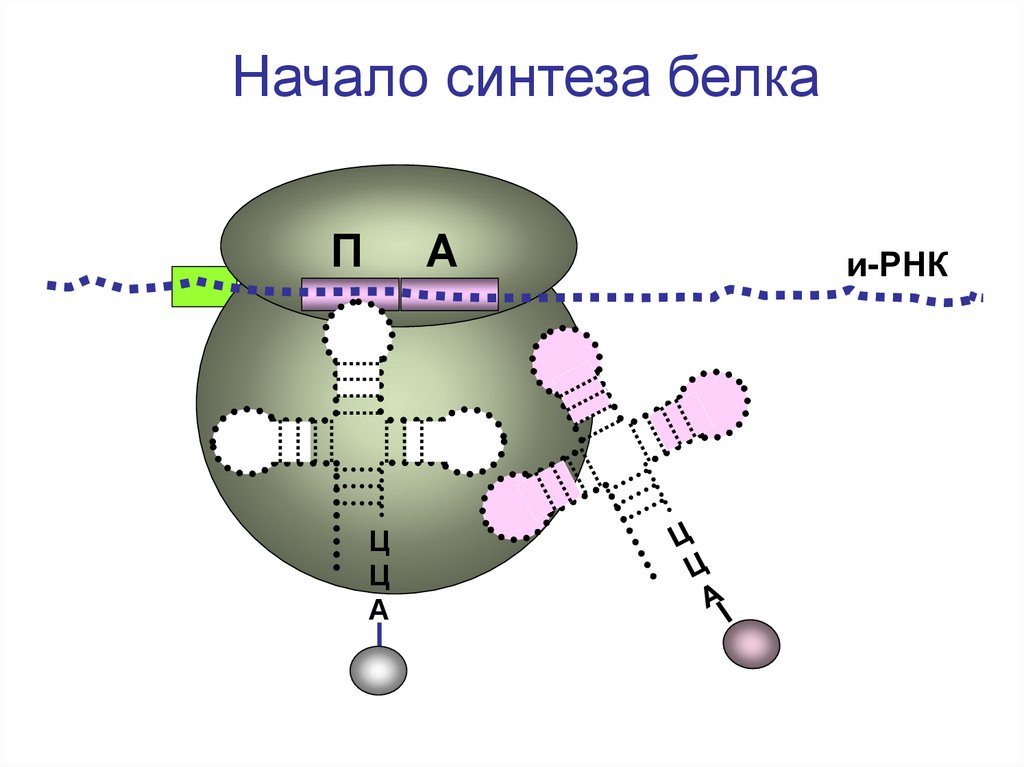
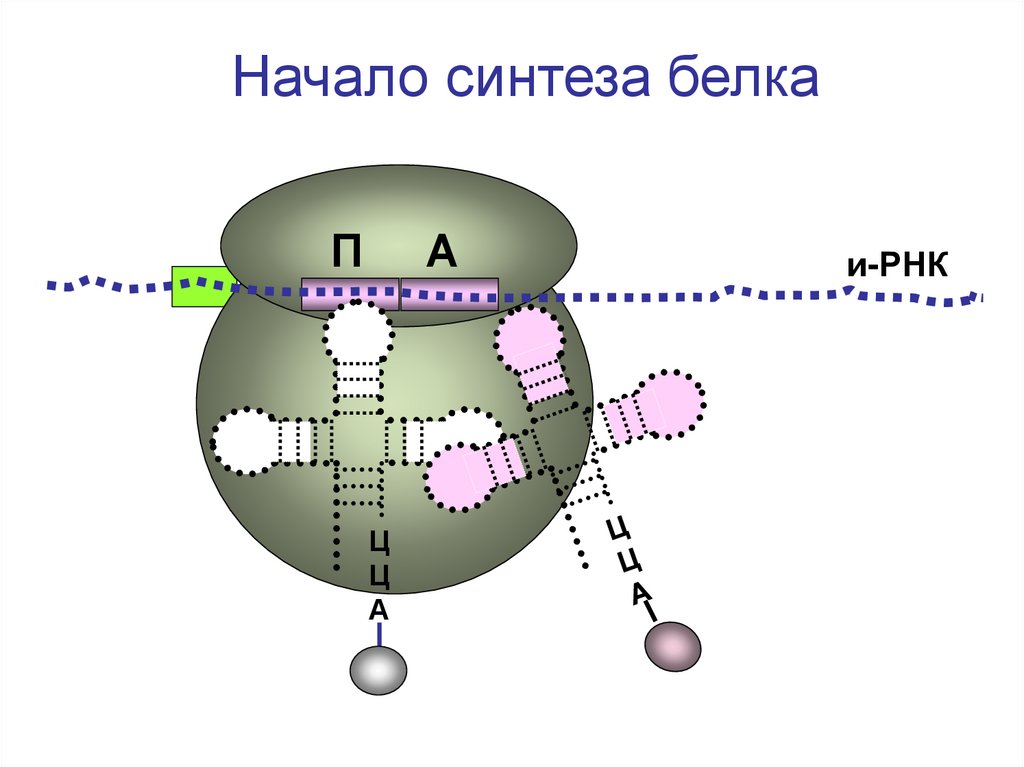
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
31.
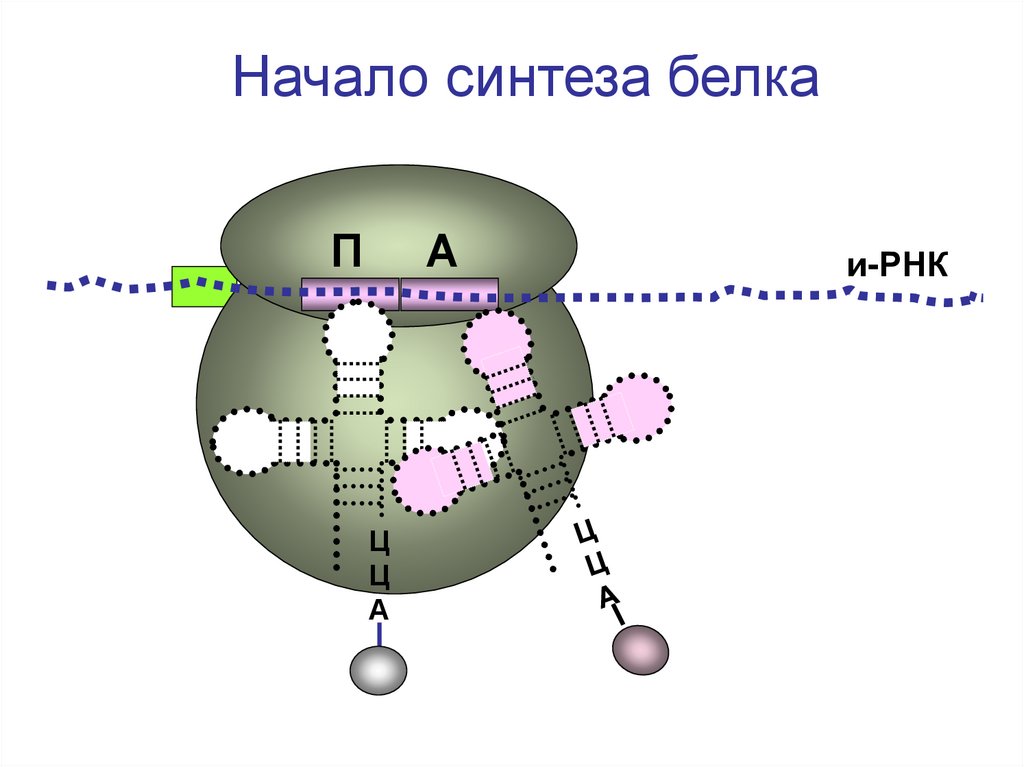
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
32.
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
33.
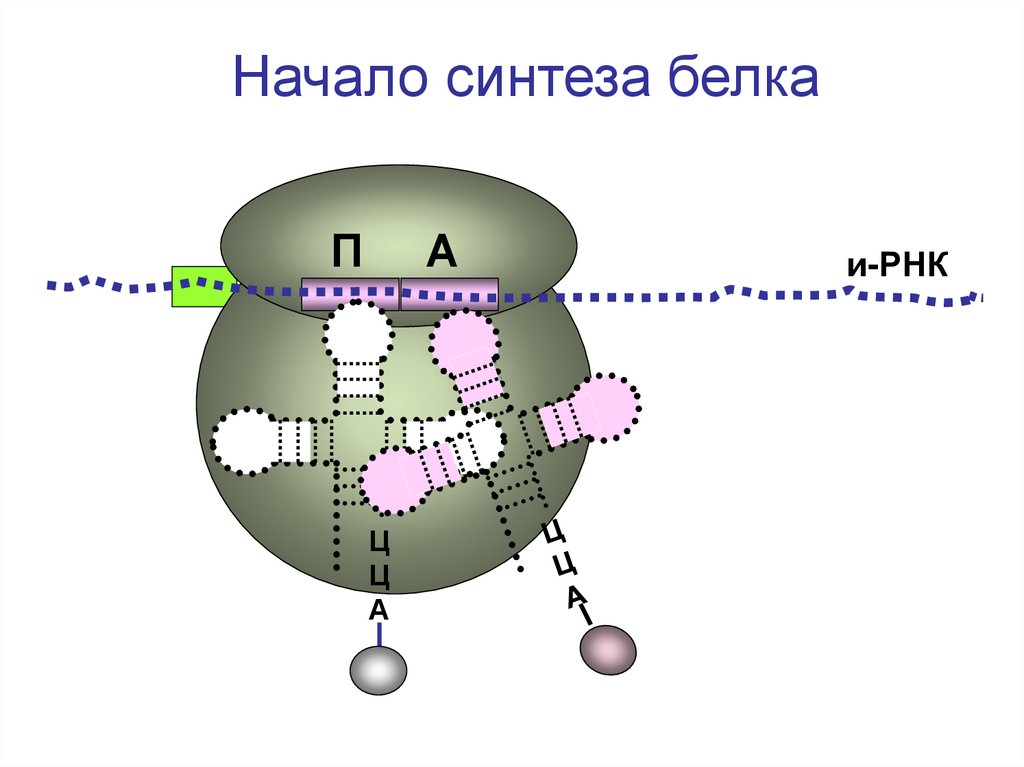
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
34.
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
35.
Перенос первой аминокислоты на вторуюП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
36.
Перенос первой аминокислоты на вторуюП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
37.
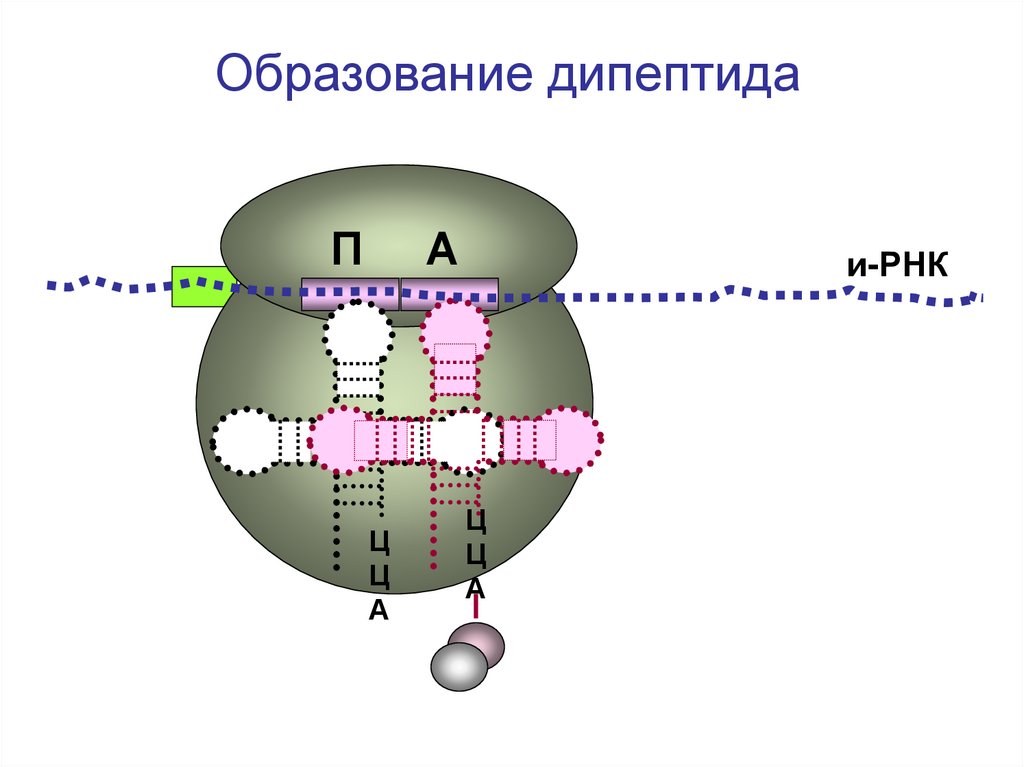
Образование дипептидаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
38.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
Ц
Ц
А
и-РНК
39.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
Ц
Ц
А
и-РНК
40.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
Ц
Ц
А
и-РНК
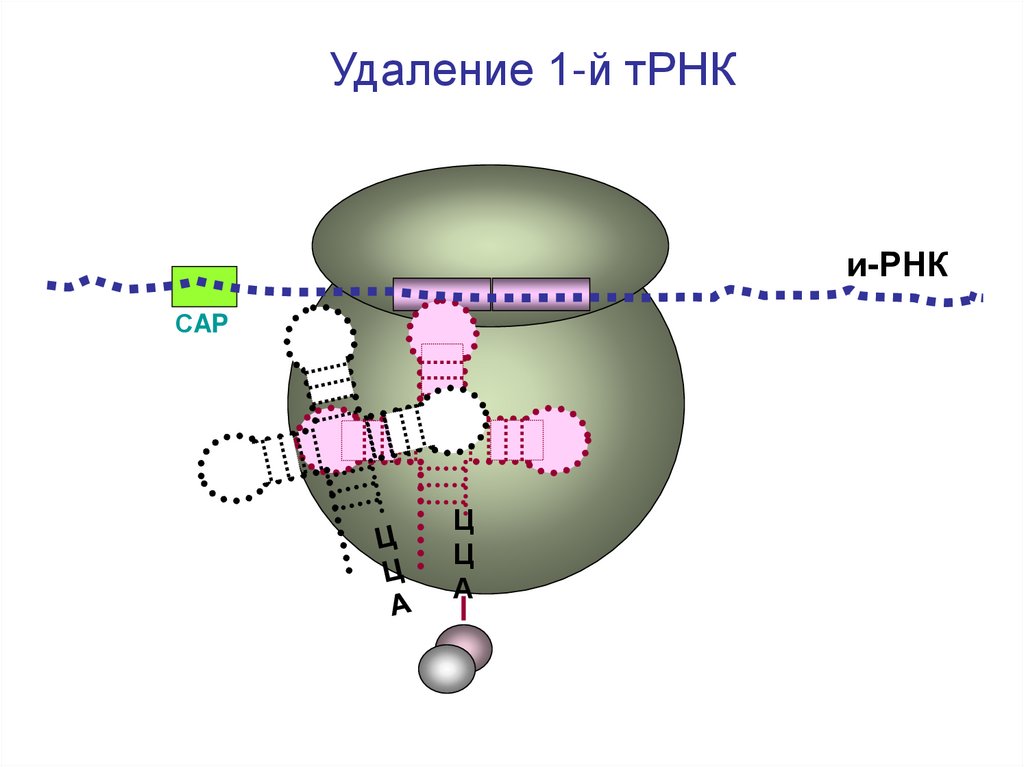
41.
Удаление 1-й тРНКи-РНК
СAP
Ц
Ц
А
42.
Удаление 1-й тРНКи-РНК
СAP
Ц
Ц
А
43.
Удаление 1-й тРНКи-РНК
СAP
Ц
Ц
А
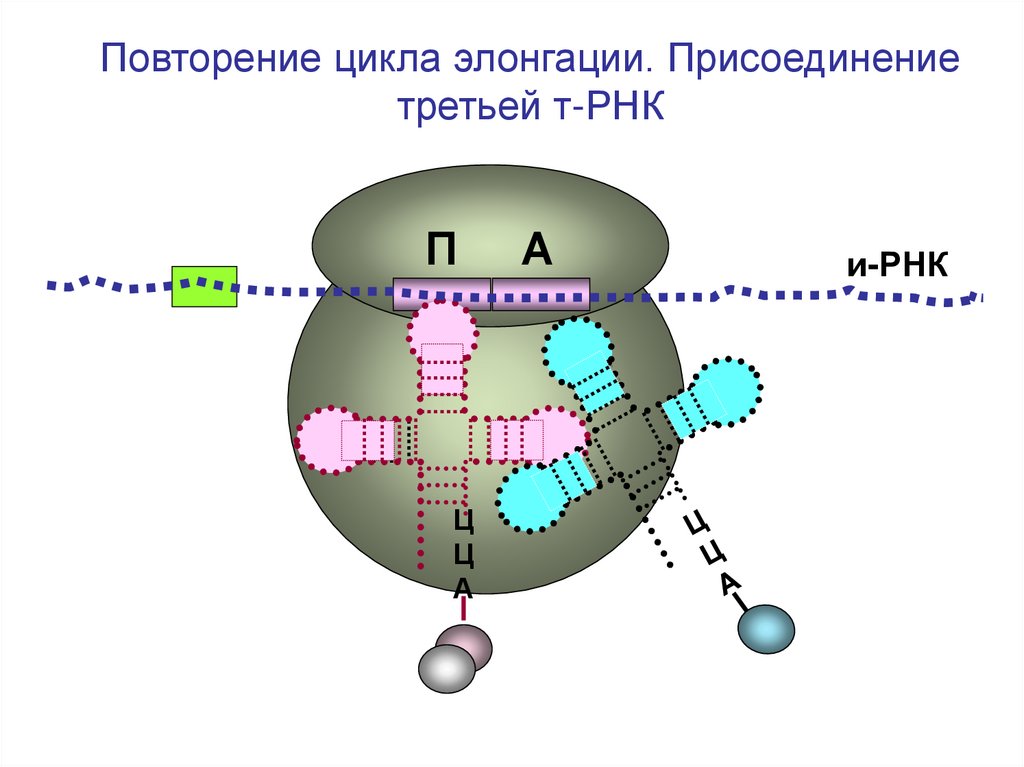
44.
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
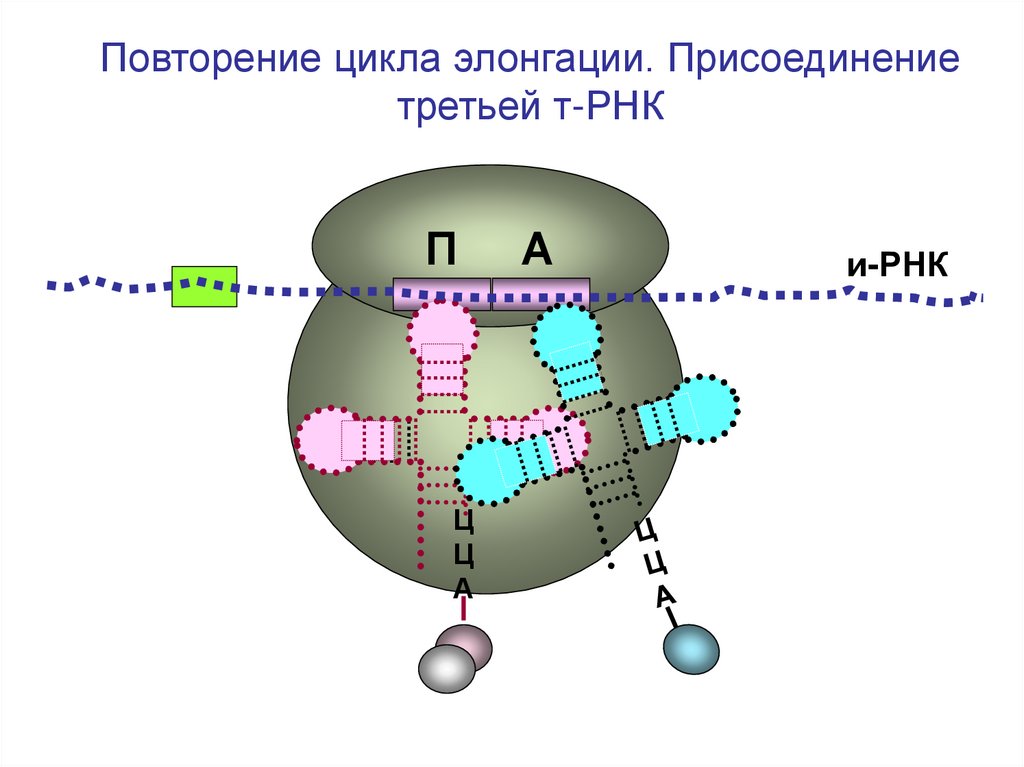
45.
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
46.
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
47.
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
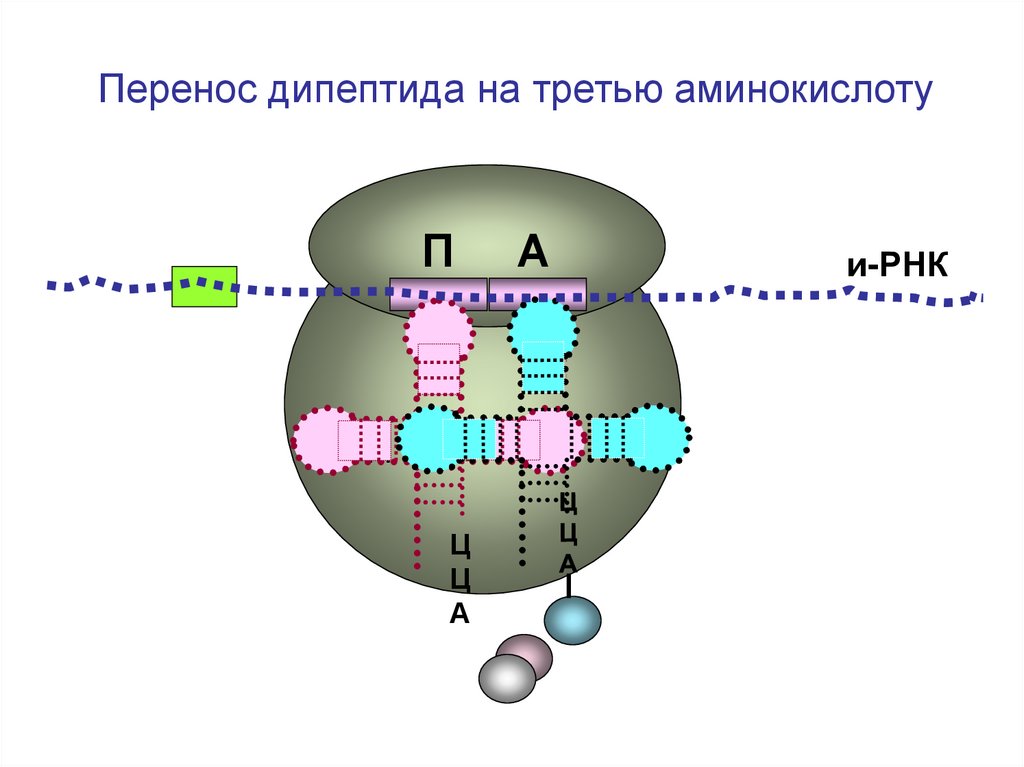
48.
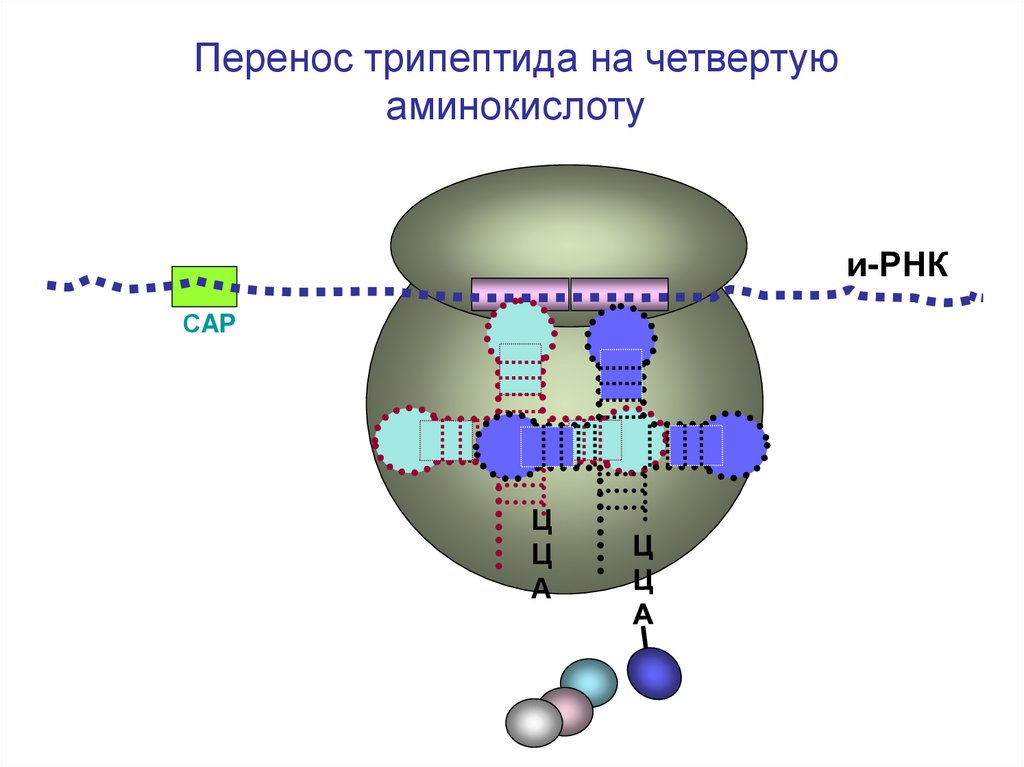
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
49.
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
50.
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
51.
Образование трипептидаП
Ц
Ц
А
А
и-РНК
52.
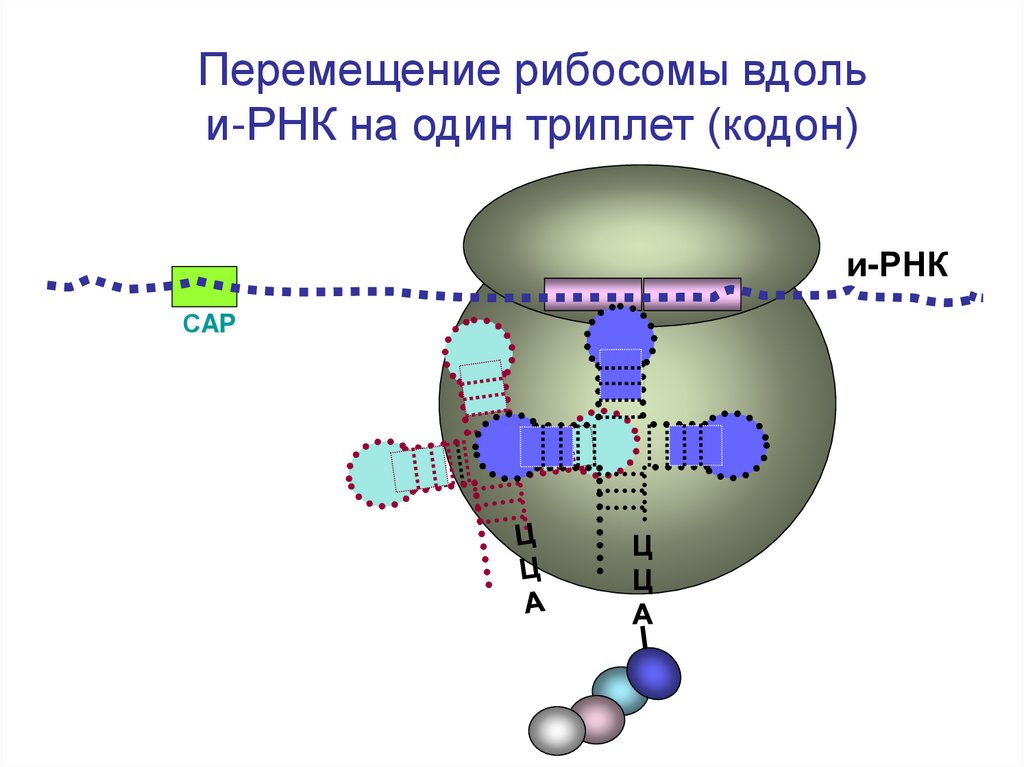
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
и-РНК
53.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
и-РНК
54.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
П
Ц
Ц
А
А
и-РНК
55.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
56.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
57.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
58.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
59.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
60.
Повторение цикла элонгации. Присоединениечетвертой т-РНК
и-РНК
СAP
Ц
Ц
А
61.
Перенос трипептида на четвертуюаминокислоту
и-РНК
СAP
Ц
Ц
А
62.
Перенос трипептида на четвертуюаминокислоту
и-РНК
СAP
Ц
Ц
А
63.
Перенос трипептида на четвертуюаминокислоту
и-РНК
СAP
Ц
Ц
А
64.
Перенос трипептида на четвертуюаминокислоту
и-РНК
СAP
Ц
Ц
А
65.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
66.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
67.
Повторение цикла элонгации. Присоединениепятой т-РНК и т. д.
и-РНК
СAP
68.
Стадиятерминации
69.
Образовавшийся белок, потокомжидкости в эндоплазматическом ретикулуме
(состоящим из трубочек), направляется в
Аппарат Гольджи. В этом месте белки
превращаются в сложные формы белков,
путем присоединения к ним небелковых
компонентов - коферментов, углеводов,
нуклеотидов, фосфатов и т.д.
После этого белки становятся
функционально активными молекулами
клетки.
70.
Многие белки требуютдостраивания.
В аппарат
Гольджи
71.
Образование функционально-активныхмолекул белков
Удаление “лишних”
аминокислот или
участков белка
Присоединение
коферментов
Присоединение
углеводов
Образование четвертичной структуры
Обьединение с
металлами
Фосфорилирование
72.
Регуляцияобмена
белков
73.
Гормональная регуляция скоростисинтеза белка
1. Соматотропин, половые гормоны (индукторы
транскрипции и биосинтеза белка);
2. Тироксин (активатор транскрипции ферментов,
осуществляющих липолиз и протеолиз);
3. Инсулин (активатор транскрипции ферментов,
участвующих в углеводном обмене);
4. Глюкокортикоиды (репрессоры транскрипции
генов, контролирующих синтез белков и липидов.
Индукторы транскрипции и биосинтеза ферментов
глюконеогенеза).
74.
Влияние некоторых факторов наконцентрацию и состав белков организма
1. Доступность в белковой диете;
2. Наличие полноценных белков в продуктах;
3. Заболевания органов пищеварения;
5. Заболевания почек, печени, поджелудочной
железы;
6. Гиповитаминоз (В6; фолиевой кислоты, В12).
7. Длительное применение антибиотиков.
75.
Влияние антибиотиков на биосинтез белковПуромицин
Связывается с аминоацильным центром.
Актиномицин Д
Доксорубицин
Внедряются между парами оснований ДНК и
нарушают репликацию и транскрипцию
Тетрациклин
связывается с малой субъединицей
рибосомы и блокирует А-центр
Левомицетин
ингибитор пептидилтрансферазы в большой
субъединице рибосомы
Эритромицин
ингибитор транслокации
Стрептомицин
ингибитор стадии инициации
Пенициллин
нарушает образование поперечных связей в
белках бактерий
76.
Трансаминированиеаминокислот
77.
Поступающий с пищей набор аминокислот, редко соответствует ихтребуемому соотношению для использования клетками. Часто одних
аминокислот больше чем нужно, а других меньше необходимого уровня.
Для исправления этого неправильного соотношения аминокислот в
клетках функционирует особый механизм, позволяющий поддерживать
наиболее полное соответствие количества аминокислот с потребностями
организма.
Таким механизмом является реакция трансаминирования. Особое
значение этот процесс имеет в период роста детей, а также после
оперативных вмешательств при заживлении ран.
Смысл этих биохимических реакций состоит в том, что из
аминокислот, которых больше, синтезируется те, которых меньше.
Следует заметить, что речь идет только о синтезе заменимых аминокислот.
Например, из аминокислоты аланин, с помощью кетоглутаровой
кислоты, которая образуется из глюкозы в цикле Кребса, может
образовываться глутаминовая кислота. При этом аланин превращается в
пировиноградную кислоту, которая используется для выработки энергии.
В реакции участвует активная форма витамина В6 фосфопиридоксаль. Фермент, который катализирует превращение
аланина в глутаминовую кислоту, называется аланин-аиино-трансфераза
(АЛТ или АлАТ). Фермент, который превращает аспарагиновую кислоту в
глутаминовую, называется аспартатаминотрансфераза (АСТ или АсАТ).
78.
Участие фосфопиридоксаля (В6)в реакции трансаминирования
СН3
СООН
СН3
СНNH2 + C=О ФП-аль С=О +
СООН
СН2
СООН
СН2
СООН
аланин оксоглутарат
пируват
СООН
СНNH2
СН2
СН2
СООН
глутаминовая
кислота
79.
Витамин В6(неактивная форма витамина)
Н
С
НО
Н 3С
О
СН2ОН
N
пиридоксаль
80.
Фосфопиридоксаль(активная форма витамина)
Н
С
НО
Н 3С
О
СН2О-
N
РО3Н2
81.
Витамин как акцептор аминогруппыН
СН2
НО
СН-NН2 +
СООН
СООН
Н 3С
СН2О-РО3Н2
N
пиридоксаль-фосфат
СН2-NH2
СН2
С=О
О
С
НО
+
Н 3С
СН2О-РО3Н2
N
пиридоксамин-фосфат
82.
Витамин как донор аминогруппыСООН
СН2-NH2
С=О
СН2
НО
СН2О-РО3Н2
+
СН2
Н 3С
СООН
N
СООН
Н
СН-NН2
СН2
СН2
СООН
+
С
НО
Н 3С
О
СН2О-РО3Н2
N
83.
В клинической практике активность АлАТ или АсАТчасто измеряют в сыворотке крови для обнаружения
цитолиза клеток при патологических процессах.
Например, при воспалительных явлениях, в
результате активации пероксидного окисления липидов
(ПОЛ), происходит разрушение клеточных мембран в
очаге патологии.
Поскольку данные ферменты сосредоточены в
цитоплазме клеток, то при разрушении клеточной
оболочки, ферменты выходят из клеток в кровяное
русло.
Количество разрушенных клеток, коррелирует с
размерами поврежденной ткани и соответствует
количеству ферментов попадающих при этом в кровь.
Таким образом, можно количественно оценить
интенсивность поражения патологическим процессом в
различных органах.
84.
Динамика повышения активности АсАТ иАлАТ крови при гепатите
Активность
ферментов
АлАТ
АсАТ
1 2
3 4 5
6 7 8 9 10 11 12 13 14 15 16 17 18
Дни болезни
85.
Декарбоксилированиеаминокислот
(образование
биологическиактивных аминов)
86.
Часть аминокислот используется организмом дляполучения биологически активных молекул, которые
участвуют в регуляции обменных процессов. Путем
удаления карбоксильной группы (декарбоксилирования)
из аминокислот образуются амины (поскольку
аминогруппа при этом сохраняется).
Ниже приводятся примеры таких реакций, в которых
получаются хорошо известные в физиологии нервной
деятельности, фармакологии и при лечении
эндокринных заболеваний биологически активные амины.
Срок “жизни” таких молекул недолгий, они очень
быстро разрушаются особыми ферментами моноаминооксидазами.
Поэтому, биологически активные амины быстро
образуются, интенсивно действуют на различные
биохимические процессы и очень быстро прекращают
свое действие, благодаря своевременному разрушению.
87.
Схема декарбоксилированияаминокислот
H2N – CН – CООН
R
H2N – CН2 + СО2
R
Биологически
активные
амины
88.
Образование гистамина.Участвует в воспалительных реакциях.
N
-CH2-CH-COOH
N
-CH2-CH2
NH2 декарбоксилаза
NH2
NH
NH
СО2
89.
Гидроксилирование идекарбоксилирование триптофана
НО-CH2-CH-COOH
NH2
NH
НО
-CH2-CH2
декарбоксилаза
СО2
NH2
NH
5-гидрокситриптамин
(серотонин)
90.
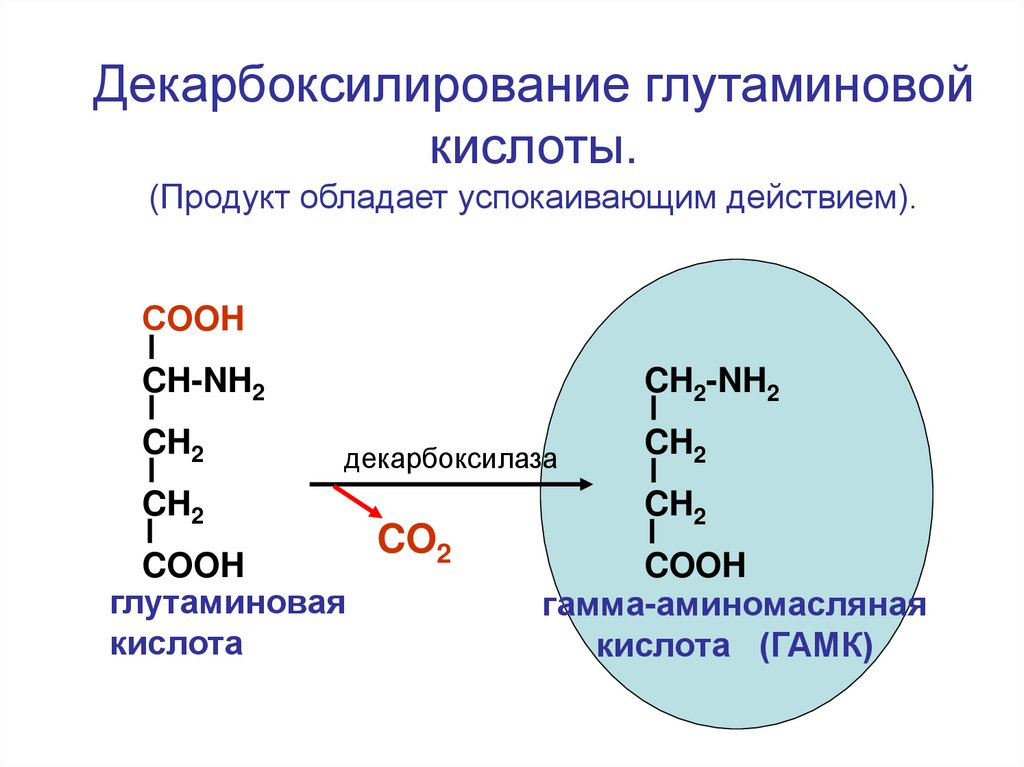
Декарбоксилирование глутаминовойкислоты.
(Продукт обладает успокаивающим действием).
СOOH
CH-NH2
CH2
CH2-NH2
декарбоксилаза
CH2
COOH
глутаминовая
кислота
CO2
CH2
CH2
COOH
гамма-аминомасляная
кислота (ГАМК)
91.
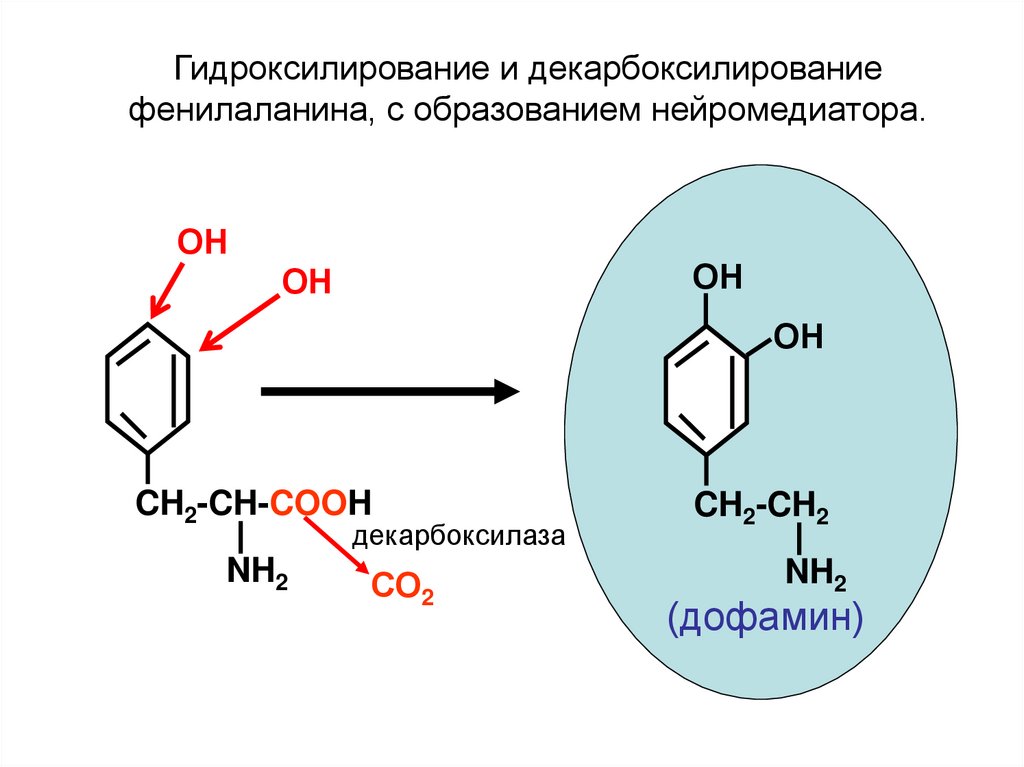
Гидроксилирование и декарбоксилированиефенилаланина, с образованием нейромедиатора.
ОН
ОН
ОН
ОН
CH2-CH-COOH
декарбоксилаза
NH2
СО2
CH2-CH2
NH2
(дофамин)
92.
Синтез норадреналина из дофамина.ОН
ОН
ОН
гидроксилаза
НАДФН2; О2;
ОН
р450
CH2-CH2
CH-CH2
NH2
ОН NH2
норадреналин
93.
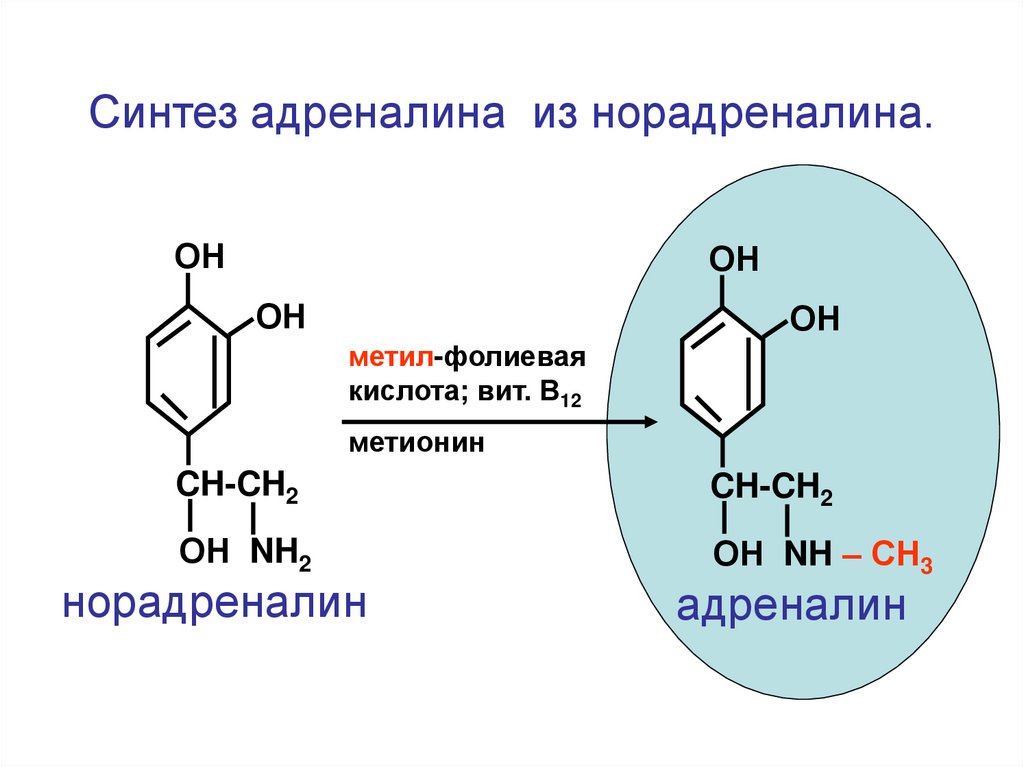
Синтез адреналина из норадреналина.ОН
ОН
ОН
ОН
метил-фолиевая
кислота; вит. В12
метионин
CH-CH2
CH-CH2
ОН NH2
ОН NH – СН3
норадреналин
адреналин
94.
Биологически активные амины, используемыекак лекарственные средства.
1. Гистамин
2. Триптамин
3. Серотонин
4. Гамма-аминомасляная кислота
(ГАМК)
5. Дофамин
6. Норадреналин
7. Адреналин
95.
Использование аминокислотв качестве исходных
субстратов для выработки
энергии с помощью
окислительного
дезаминирования.
96.
Иногда в клетках возникает необходимость в болееинтенсивном образовании энергии. При этом, кроме
углеводов и липидов, в качестве исходного источника
энергии могут служить некоторые аминокислоты.
При этом из них удаляется аминогруппа (путем
дезаминирования) и одновременно происходит реакция
дегидрирования (отрываются атомы водорода для
использования их в дыхательной цепи митохондрий
(см. раздел: Биологическое окисление).
Поэтому эти две реакции обозначаются таким
понятием как: окислительное дезаминирование
аминокислот.
97.
Реакция окислительногодезаминирования глутаминовой кислоты
СООН
СООН
СН2
СН2
CH-NH2
COOH
HАД
HАДН2
СН2
СООН
+Н2О
СН2
СН2
СН2
C = NH
C=О
COOH
COOH
митохондрии
3 АТФ
+ NH3
98.
В результате окислительного дезаминированияглутаминовой, или аспарагиновой кислот образуется
одна молекула НАДН2 , которая используется
митохондриями для синтеза 3-х молекул АТФ.
Однако, судя приведенной выше реакции, наблюдается
образование аммиака (NH3), обладающего ярко
выраженным токсичным влиянием на организм человека.
В клетках происходят также ряд других реакций
дезаминирования, в которых образуется аммиак,
например, дезаминирование нуклеотидов,
аминопроизводных сахаров и др.
Поэтому очень важными реакциями в клетках
являются те, которые обеспечивают обезвреживание
аммиака с помощью превращения его в мочевину или
присоединения аммиака к глутаминовой кислоте.
99.
метаболические источники аммиака в организмедезаминирование аминокислот
окисление
аминов
NH3
дезаминирование нуклеотидов
дезаминирование
аминосахаров
100.
синтезмочевины
101.
Местом обезвреживания аммиака в организме( 20 г в сутки) является печень
102.
В первой реакции аммиак с помощью угольнойкислоты и энергии АТФ преобразуется в
карбамоилфосфат.
глутаминовая
кислота
NH3 + CO2 + 2 АТФ
α-кетоглутаровая к-та
карбамоил
-фосфат
синтетаза
O
OH
NH2-C-O~P=O
OH
2АДФ H3PO4
карбамоилфосфат
103.
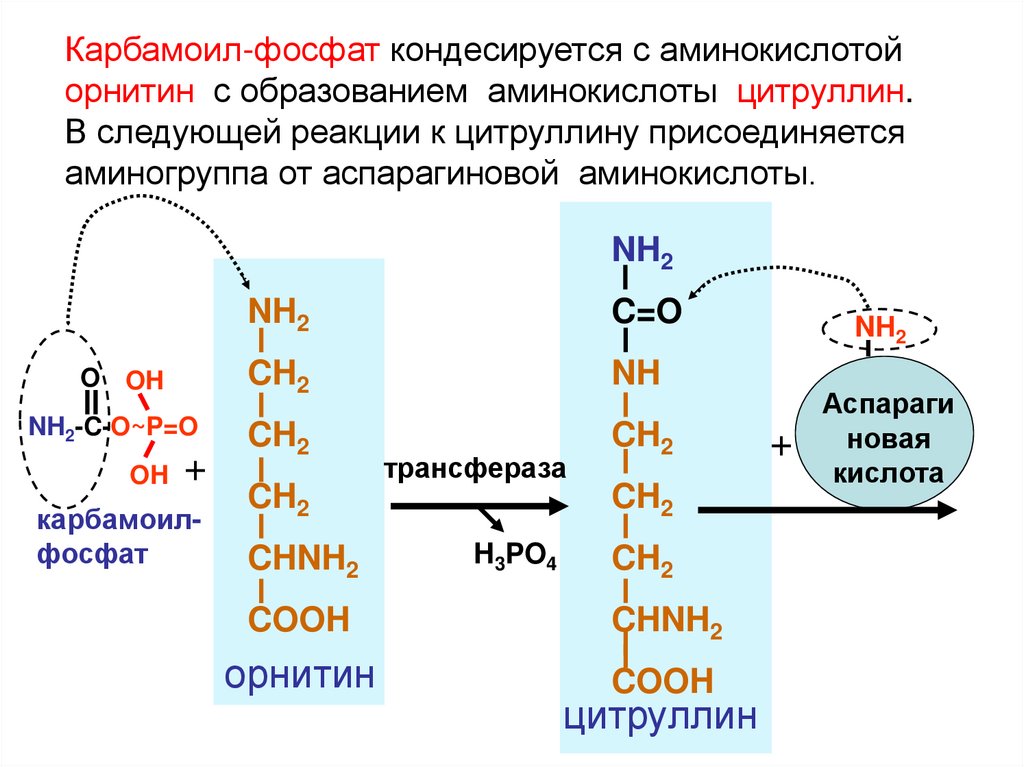
Карбамоил-фосфат кондесируется с аминокислотойорнитин с образованием аминокислоты цитруллин.
В следующей реакции к цитруллину присоединяется
аминогруппа от аспарагиновой аминокислоты.
NH2
NH2
C=O
O OH
CH2
NH
NH2-C-O~P=O
CH2
CH2
OH +
карбамоилфосфат
CH2
CHNH2
трансфераза
H3PO4
CH2
CH2
COOH
CHNH2
орнитин
COOH
цитруллин
NН2
+
Аспараги
новая
кислота
104.
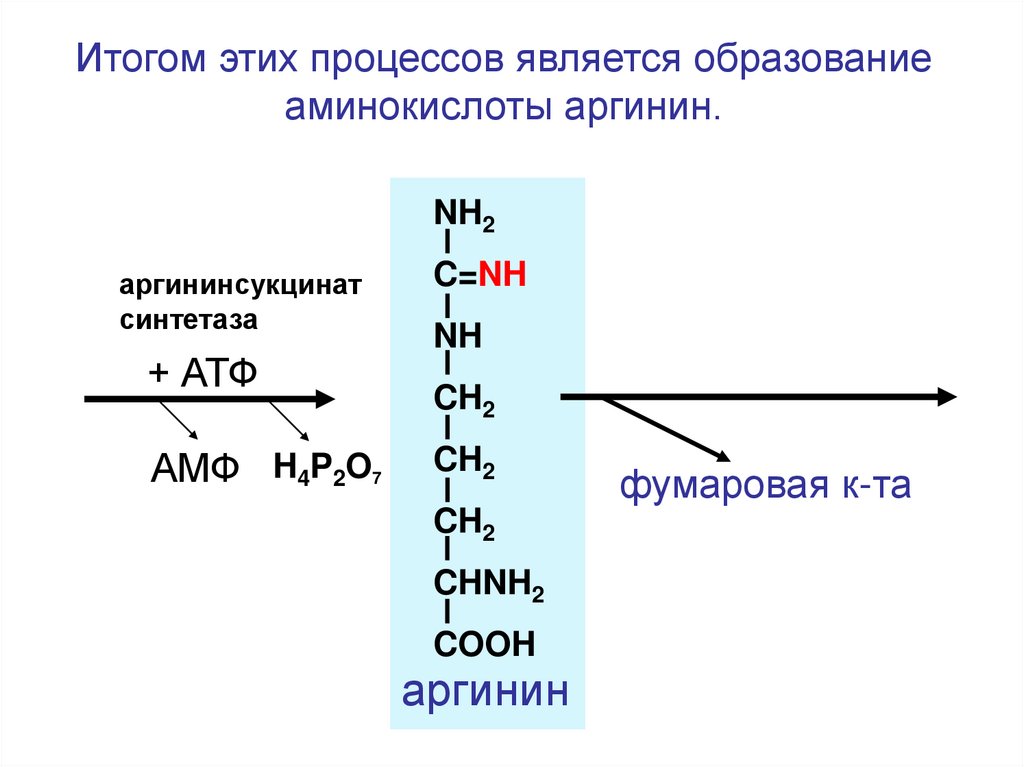
Итогом этих процессов является образованиеаминокислоты аргинин.
NH2
аргининсукцинат
синтетаза
+ АТФ
АМФ H4P2O7
C=NH
NH
CH2
CH2
CH2
CHNH2
COOH
аргинин
фумаровая к-та
105.
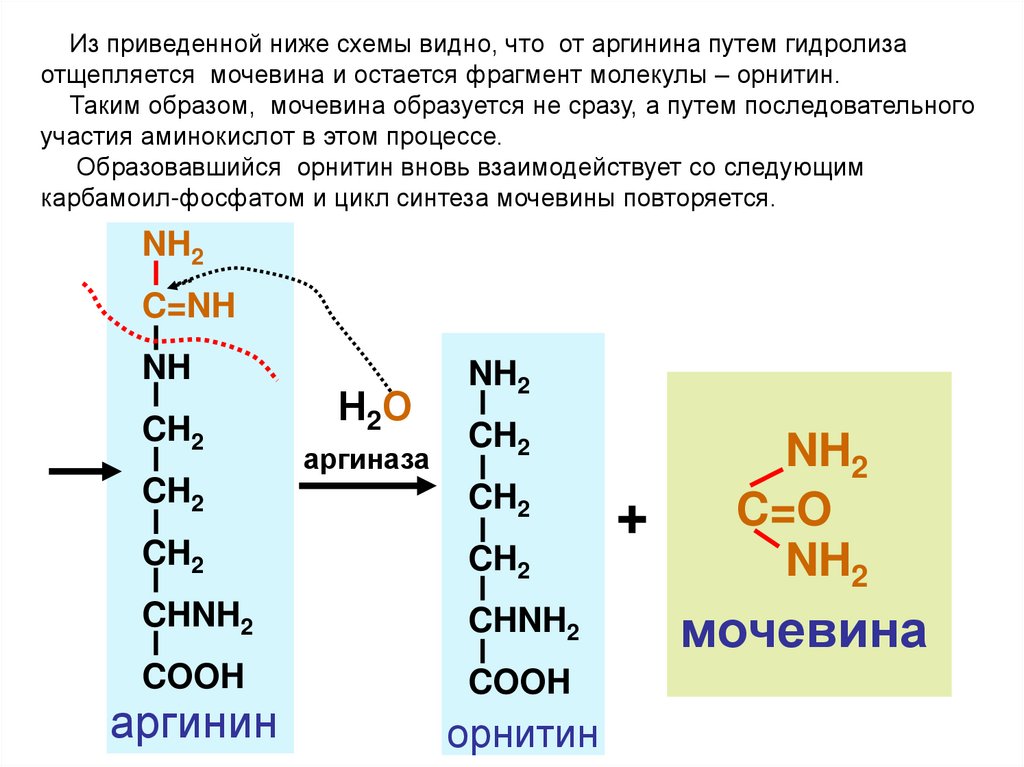
Из приведенной ниже схемы видно, что от аргинина путем гидролизаотщепляется мочевина и остается фрагмент молекулы – орнитин.
Таким образом, мочевина образуется не сразу, а путем последовательного
участия аминокислот в этом процессе.
Образовавшийся орнитин вновь взаимодействует со следующим
карбамоил-фосфатом и цикл синтеза мочевины повторяется.
NH2
C=NH
NH
CH2
Н2О
аргиназа
NH2
CH2
CH2
CH2
CH2
CH2
CHNH2
CHNH2
COOH
COOH
аргинин
орнитин
+
NH2
C=O
NH2
мочевина
106.
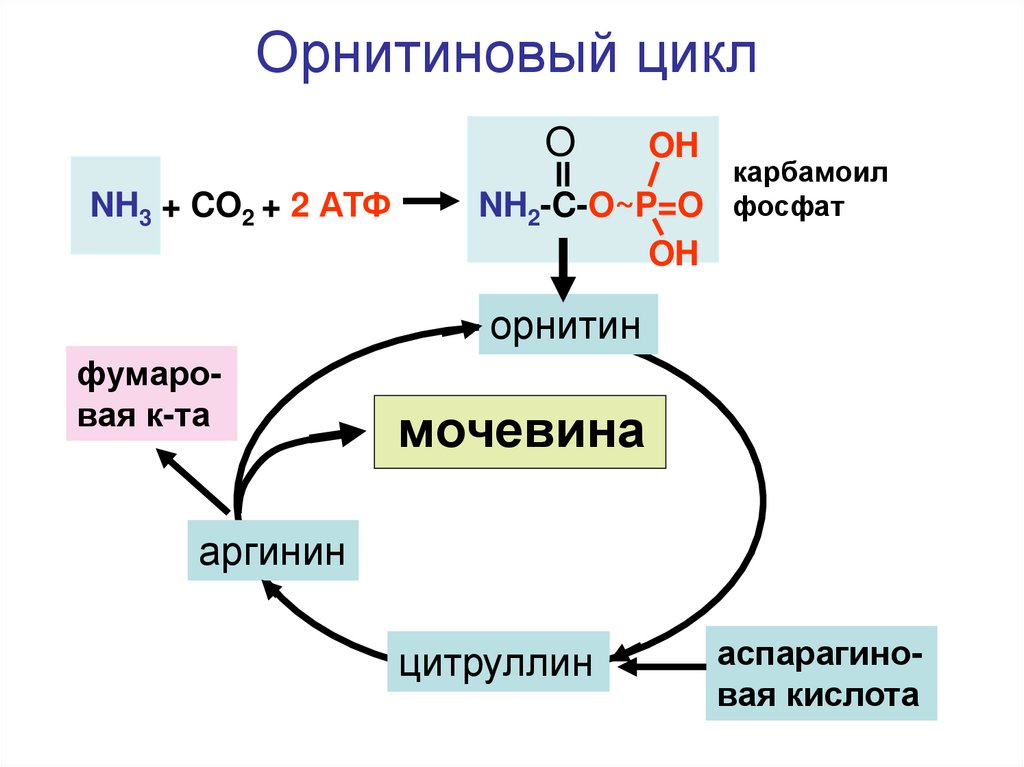
Орнитиновый циклO
NH3 + CO2 + 2 АТФ
OH
NH2-C-O~P=O
OH
карбамоил
фосфат
орнитин
фумаровая к-та
мочевина
аргинин
цитруллин
аспарагиновая кислота
107.
Содержаниемочевины в крови
2,5 – 8,3 ммоль/л
сыворотки
108.
Диагностическая значимость определенияконцентрации мочевины в крови.
Понижение ниже нормы наблюдается при:
- тяжелом заболевании печени;
- длительном голодании;
- беременности.
Повышение уровня мочевины в крови
наблюдается при:
- заболеваниях почек;
- избыточной белковой пищи;
-- ожогах и травмах.
109.
Вспомогательный,быстрый механизм
связывания
аммиака внутри
клеток
110.
Этот пример удаления аммиака в клеткахпроисходит в тех органах, где мочевина не
может синтезироваться. Например, в мышцах
или нервных клетках цикл синтеза мочевины
не происходит.
В этом случае, инактивация аммиака
происходит с помощью глутаминовой кислоты.
Фермент глутаматсинтетаза встраивает
аминогруппу в карбоксильный фрагмент
глутаминовой кислоты. При этом образуется
амид глутаминовой кислоты - глутамин. Эта
аминокислота уже не обладает токсичностью.
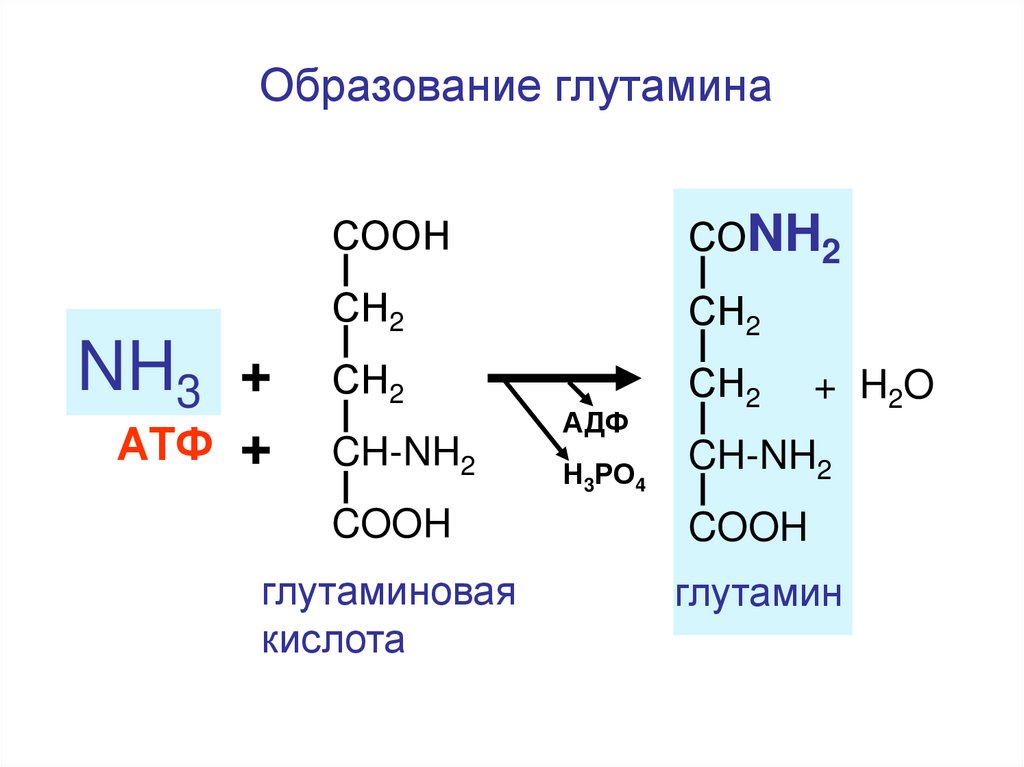
111.
Образование глутаминаNH3 +
АТФ +
СООН
СОNH2
СН2
СН2
СН2
СН2
CH-NH2
АДФ
Н3РО4
+ H2 O
CH-NH2
COOH
COOH
глутаминовая
кислота
глутамин
112.
С током крови глутамин поступает впечень или в почки. В печени
происходит гидролиз глутамина,
образуется аммиак и глутаминовая
кислота. Аммиак в печени превращается
в мочевину.
В почках глутамин после гидролиза
переходит в глутаминовую кислоту и
возвращается в ткани за следующей
порцией аммиака. Аммиак в почках
выделяется с мочой в виде солей
аммония.
113.
Ресинтез глутаминовой кислотыв почках
возвращение в кровь
СОNH2
в почки
СООН
СН2
глутаминаза СН
СН2
СН2
+ H2 O
2
CH-NH2
CH-NH2
COOH
глутамин
COOH
глутаминовая кислота
NH3
моча
114.
органыглу
NH3
глутамин
кровь
NH2
моча NH4CI
глутаминовая
кислота














































































 Биология
Биология








